Botanical Research
Vol.
09
No.
04
(
2020
), Article ID:
36580
,
13
pages
10.12677/BR.2020.94042
Morphological Classification and Molecular Identification of Germplasm Resources in Momordica charantia L.
Guoli Wang
School of Life Science, Huizhou University, Huizhou Guangdong
Received: Jun. 28th, 2020; accepted: Jul. 13th, 2020; published: Jul. 20th, 2020

ABSTRACT
Combined with morphological markers and molecular markers, a solution is provided for comprehensive analysis of genetic diversity of Dading bitter gourd resources. According to the morphological description standard of Momordica charantia, the variation and cluster analysis of the morphological indexes of Dading bitter gourd were carried out. And the cluster analysis was carried out based on SRAP and SSR molecular marker technology. The results showed that, among the 33 morphological indexes, the variation coefficient of leaf shape is the largest, followed by the seed skin color. The variation coefficients of melon habit, leaf color, leaf shape, single melon weight, number of seeds per melon and longitudinal diameter of commercial melon were more than 25%. However, the coefficient of variation of six indexes, such as lobes count, sexual type, hide subtending leaf of flower stalk, melon surface gloss, end face shape of proximal melon pedicel and species melon skin color, was 0. At the threshold of genetic distance of 18, all bitter gourd materials were divided into three groups. A total of 282 polymorphic bands were amplified by 25 pairs of SRAP primers, and the tested materials could be divided into 4 groups at the threshold of genetic similarity coefficient of about 0.66. A total of 58 polymorphic bands were amplified by 20 pairs of SSR primers, and at the threshold of 0.64, the tested materials of Dading bitter gourd could be divided into four groups. The similarity of the clustering results of the two markers was 92.86%, and the comprehensive clustering result based on the two markers was basically the same as those of SSR markers. The clustering similarity between morphological markers and molecular markers reached 78.57%. It is more reliable in analysing the genetic diversity of Dading bitter gourd germplasm resources than the analysis with single methodology, and the results of the two molecular markers were highly consistent with each other. The geographical distribution of germplasm and the first female flower node are very important for the classification of Dading bitter gourd germplasm, as well as melon shape, single melon weight, seed coat color and leaf shape are very important.
Keywords:Dading Bitter Gourd (Momordica charantia L.), Germplasm Resouces, Morphological Classification, Molecular Marker

大顶苦瓜种质资源的形态分类及分子鉴定
王国莉
惠州学院生命科学学院,广东 惠州

收稿日期:2020年6月28日;录用日期:2020年7月13日;发布日期:2020年7月20日

摘 要
结合形态学标记和分子标记技术,为综合分析大顶苦瓜种质资源遗传多样性提供解决方案。根据苦瓜形态学描述规范对供试大顶苦瓜进行形态学指标的变异和聚类分析,并采用SRAP和SSR分子标记技术进行聚类分析。结果发现,33个形态学指标中叶形的变异系数最大,其次是种皮色。结瓜习性、叶色、瓜形、单瓜重、单瓜种子数、商品瓜纵径的变异系数均大于25%,而裂片数、花柄遁形苞叶、性型、瓜面光泽、近瓜蒂端面形状和种瓜皮色等6个指标的变异系数为0,在遗传距离为18处,所有苦瓜材料被分为3大组群。采用25对SRAP引物扩增共获得282条多态性条带,在遗传相似系数阈值约0.66处可将供试材料分为4个类群;20对SSR引物扩增共获得多态性条带有58条,在遗传相似系数阈值0.64处可将大顶苦瓜供试材料分为4个类群。两种分子标记的聚类结果相似性达到92.86%,综合两种分子标记的聚类结果与SSR标记基本相同。形态标记和分子标记的聚类相似度达到78.57%。采用形态学标记结合分子标记技术综合分析大顶苦瓜种质资源的遗传多样性可靠度较高,两种分子标记的分析结果一致度非度高。种质的地理分布和第一雌花节位是大顶苦瓜种质分类中非常重要的依据,瓜形、单瓜重、种皮色、叶形等性状也很重要。
关键词 :大顶苦瓜,种质资源,形态分类,分子标记

Copyright © 2020 by author(s) and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY 4.0).
http://creativecommons.org/licenses/by/4.0/


1. 引言
苦瓜(Momordica charantia L.)是葫芦科一年生草本攀缘植物,起源于印度,在我国栽培历史悠久,南北各地均有分布,以华南及长江流域栽培居多 [1] [2]。经过长期的驯化、自然杂交和人工选择,苦瓜形成了丰富的品种和类型 [3] [4]。大顶苦瓜药食兼用,瓜形肥大,肉厚色绿,质地细密,顶平粒粗,味道微苦但甘甜,口感爽脆无渣 [5],种植的经济价值极高。收集并规范性分析和系统整理大顶苦瓜种质,是对大顶苦瓜种质资源有效利用和选育工作的基础 [6]。苦瓜的遗传变异基础广泛,如果根据形态标记对苦瓜进行分类 [7] [8],需要鉴定者经验丰富,不仅耗时费力,还容易受外界环境、生育期及基因显隐性的影响 [9]。DNA分子标记现已被应用于苦瓜亲缘关系分析 [10] [11]、种质资源的遗传多样性分析 [12] [13]、苦瓜抗病性 [14] 和性别分化研究 [15] [16]、品种鉴定 [17] 等多个方面。SSR (simple sequence repeat) [18] 和SRAP (Sequence-Related Amplified Polymorphism) [19] 是研究群体遗传变异的两种有效分子标记。王国莉等 [11] [16] [17] 综合利用两种分子标记技术,成功对苦瓜育种新组合22份材料进行了亲缘关系的分析,对育种新品种进行了分子鉴定,并对不同性型苦瓜雌雄花芽的分化展开研究。李光光 [12] 等利用16对SSR引物对50份不同来源的苦瓜材料进行多态性扩增,参试苦瓜遗传信息丰富、具有较大的遗传多样性,杂交实验发现,相同母本杂交后代经自交选育后产生了较大的遗传距离。米军红 [14] 等建立了苦瓜抗白粉病SRAP标记的优化体系,为获得苦瓜抗白粉病的SRAP分子标记、加快苦瓜抗白粉病新品种的选育提供参考依据。赵秀娟等 [20] 采用SRAP标记分析了苦瓜种质资源的遗传进化关系。综合运用形态学标记和分子标记技术专门分析经济价值高、种质珍贵的大顶苦瓜亲缘关系的研究并不多。本研究以课题组收集的14份大顶苦瓜种质为材料,尝试采用形态标记规范描述,结合SSR和SRAP分子标记,综合分析大顶苦瓜种质的遗传多样性,以期为准确了解大顶苦瓜种质间的亲缘关系,实现分子标记辅助大顶苦瓜育种提供理论基础和方法参考。
2. 材料与方法
2.1. 材料
2017~2018年,自国内外收集大顶苦瓜种质14份,种质特性见表1。2019年春将苦瓜种子催芽,幼苗长至2叶1心期时定植于温室,温度26℃~28℃,湿度60%~80%,每品种各20株。于生长旺盛期内采取苦瓜嫩叶,液氮速冻后置于−80℃冰箱保存,用于提取苦瓜基因组DNA。
Table 1. Characteristics of 14 Dading Germplasms of bitter gourd
表1. 14个大顶苦瓜种质特性
2.2. 方法
2.2.1. 种质资源的规范性描述
每个品种选取生长旺盛、长势一致的单株10株,根据苦瓜种质资源描述规范和数据标准 [21],结合向长萍等的方法 [22],田间观察并记录所有种质的形态学数据,数据按照茎叶性状、花果性状和果实性状分别进行归类。茎叶性状包括主蔓色、蔓长、主蔓粗、节间长、叶形、叶色、叶缘、叶裂刻、裂片数、叶片长、叶片宽、叶柄长12个。花果性状包括第一雌花节位、性型、花柄遁形苞叶、结瓜习性、瓜形、商品瓜皮色、瓜瘤类型、棱瘤稀密、瓜瘤大小、瓜面光泽、近瓜蒂端面形状11个。果实性状包括瓜顶形状、商品瓜纵径、商品瓜横径、商品瓜肉厚、商品瓜肉色、单瓜重、商品瓜成熟天数、种瓜皮色、单瓜种子数、种皮色10个。
2.2.2. SSR和SRAP-PCR扩增
采用改良CTAB法提取14份大顶苦瓜材料的基因组DNA。SSR和SRAP引物序列、引物筛选和反应体系参考王国莉等 [11] [16] [17] 的方法。聚丙烯酰胺凝胶电泳分离PCR产物,银染后拍照。
2.2.3. 数据处理
参考王国莉等 [11] [16] [17] 方法,读取电泳图上的位点长度,以不同顺序记录等位基因,对其进行赋值,用“1”来表示电泳图谱上清晰出现的条带,同一位置无条带的记为“0”,获得矩阵。用NTSYS PC 2.10e计算待测样品之间的遗传距离及遗传相似系数,并采用UPGMA方法进行聚类分析。
3. 结果与分析
3.1. 形态学标记的变异和聚类分析
3.1.1. 种质资源的形态学指标变异分析
14份大顶苦瓜种质的33个形态学性状的多样性分析见表2。从表2可以看出,所有形态学指标中叶形的变异系数最大,其次是种皮色。结瓜习性、叶色、瓜形、单瓜重、单瓜种子数、商品瓜纵径的变异系数均大于25%。而叶裂刻、性型、瓜面光泽等6个指标的变异系数为0。
Table 2. Diversity analysis of 14 bitter gourd germplasms
表2. 14份大顶苦瓜种质的多样性分析
在所有茎叶性状中,叶形变异系数达到41.32%,种质中心脏形叶片居多,其次是掌形,最少的是近圆形。叶片深裂居多,叶裂数均为7,变异系数为0。从变异系数来看,叶形变异度大,可以作为大顶苦瓜种质鉴定分类的一个主要形态指标,叶色、节间长和主蔓直径等指标的变异系数也较大,也具有一定的参考价值。
在所有花果性状中,结瓜习性的变异系数最大,瓜形、瓜瘤类型和第一雌花节位的变异系数也较大。大顶苦瓜种质一般雌性强、早熟,所以性型的变异系数为0。但第一雌花节位是衡量苦瓜品种熟性的重要指标,跟经济产量密切相关,第一雌花节位低,属早熟类型,节位高,属晚熟类型。这个性状的变异系数19.60%,其中翠鼎苦瓜的第一雌花节位最低,在第7节,翠绿3号和富优1号的第一雌花节位最高,在第16节。
果实的形态特征是苦瓜种质多样性的最重要特征,包括果形、果色、瓜瘤形状大小、瓜瘤的稀密程度、单果重等。其中差异较大的是商品瓜纵径,其变异系数为29.05%,最大值为26 cm,而最小值仅为10.5 cm;其次是商品瓜的重量,变异系数28.61%,最重的是翠娘珍珠,最重达756.2 g,最轻的是国优大顶,重量为278.9 g;商品瓜的瓜棱大小、瓜皮颜色、果肉厚等性状的变异系数都不高,在10%至15%之间。
种子的形态特征同样是苦瓜分类的重要数据,种皮色在不同品种之间差异较大,变异系数为38.77%,单瓜种子数的变异系数为27.78%,金顶2号的单瓜种子数最多,为61粒,翠绿厚肉特优最少仅有19粒。
3.1.2. 基于形态学标记的聚类分析
以14份大顶苦瓜种质的33组形态学标记数据为原始矩阵,进行系统聚类,聚类结果见图1。图1显示,以遗传距离18为阈值,所有苦瓜材料被分为3大组群。组1包括富优1号(9)、翠绿3号(14)、丰秀大顶(10)、国优大顶(11)、玉和(8)和翠鼎大顶(13)。这组种质叶形以掌形居多,品种多为中早熟,种皮以棕色和深棕色居多。
组2包括江门大顶(5)、绿顶1号(7)、翠绿厚肉(1)、金菠萝(4)、金科3号(12)、金顶2号(2)和翠绿厚肉特优(6),本组都属于早熟种,雌花多,座果力强,叶形多为心脏形和圆形,种皮以黑色居多。
组3只有翠娘珍珠(3) 1个种质,主蔓结瓜,瓜形较长呈长纺锤形,皮绿色,珠瘤肥大,钝尖,肉厚,成熟天数大约23 d,单瓜瓜重平均可达756.2 g,种皮深棕色。与其它3组的亲缘关系较远,可能还与其产自甘肃、地理区域跨度大有关,而其它种质都产自广东或接近广东。
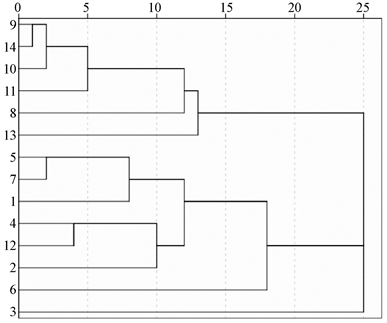
Figure 1. Cluster analysis of 14 Dading bitter gourd germplasms based on morphological markers
图1. 基于形态学标记的14个大顶苦瓜种质的聚类分析
3.2. 基于分子标记的的种质多样性和聚类分析
3.2.1. SSR和SRAP分子标记反应体系及引物
图2是部分大顶苦瓜种质的DNA提取和分子标记体系扩增结果。从图2(a)可知,提取的大顶苦瓜基因组DNA完整度高,杂质污染少,可以满足SSR与SRAP分子标记中PCR反应的需要。选择扩增结果清晰、条带数量多、多态性丰富的20对SSR多态性引物和25对SRAP多态性引物,以用于种质资源的遗传多样性分析(图2(b),图2(c)),引物多态性分析结果见表3。表3中,20对SSR引物平均扩增出4.5条清晰条带,所有条带的分子量主要分布在200~1000 bp之间。多态性条带58条,引物组合的多态性比率介于40%~100%之间,平均64.4%。N6F + N6R组合的扩增条带最多(图2(b)),其次是S13F/S13R、S33F/S33R、N9F/N9R、N5F/N5R、S15F/S15R、N1F/N1R等。25对SRAP引物平均扩增条带数18.1条,片段大小介于100~2000 bp之间。扩增总共获得452个条带,其中多态性位点282个,平均多态性比率为62.5%。这说明两种标记扩增时所用引物的多态性比率差异不大。
 (a)
(a)
 (b)
(b)
 (c)
(c)
Figure 2. Optimized PCR amplification system of SSR and SRAP markers in Dading Momordica charantia L. (a) Genomic DNA Electrophoresis Map of Dading bitter gourd germplasms; (b) Optimized SSR amplification result with N6F and N6R as primers; (c) Optimized SRAP amplification result with Me8 and Em4 as primers.
图2. 大顶苦瓜SSR和SRAP PCR扩增体系。(a) 大顶苦瓜供试种质的基因组DNA电泳图;(b) SSR扩增体系和筛选引物后的扩增结果,所用引物合为N6F + N6R;(c) SRAP扩增体系和筛选引物后的扩增结果,所用引物组合为Me8 + Em4
Table 3. Polymorphism of SSR and SRAP marker primers
表3. SSR和SRAP分子标记引物的多态性
3.2.2. 基于SSR标记的聚类分析
基于SSR标记的14份大顶苦瓜种质的聚类分析结果见图3。由图3可以看出,14份供试大顶苦瓜种质的遗传相似度比较大,翠绿厚肉和富优1号的亲缘关系最远,其次是丰秀大顶和富优1号,金菠萝和江门大顶的遗传相似系数0.900,亲缘关系最近。绿顶1号和江门大顶次之。在遗传相似系数0.64处,供试14份大顶苦瓜材料可划分为4大类群。
第1大类群包含翠绿厚肉、丰秀大顶、翠娘珍珠、玉和和翠绿3号。这一类苦瓜为早熟或中早熟,组中5个种质除玉和外,瓜顶形状多为钝尖,瓜型圆锥形,种皮多为棕色和深棕色,珠瘤肥大,肉厚。在遗传相似系数0.71处,又可分为两个亚类,翠绿厚肉和丰秀聚为第I亚类,相似系数为0.789;第II亚类有翠娘珍珠、玉和和翠绿3号,而翠绿3号又与其它两个种质的亲缘关系较远。
第2大类群包含金菠萝、江门大顶、绿顶1号、金顶2号和翠绿厚肉特优5个种质,其中金菠萝和江门大顶遗传相似系数高达0.9,两个种质的雌性、瓜型、瓜皮色泽和珠瘤性状相似度甚高。此组5个种质早熟,叶形为近圆形和心脏形,瓜形多呈短纺锤型;座果力强,瓜瘤粗直,聚类可能与雌性、瓜形、瓜瘤、叶形等性状相关。
第3大类群包含金科3号、国优大顶和翠鼎大顶。国优大顶和翠鼎大顶在相似性系数0.822处聚为一类,两个种质叶缘波状,瓜顶近圆,棱瘤密,瓜短圆锥,种皮黑色,早熟。金科3号与其它两个品种的相似性系数都为0.667;此组种质雌性较强,叶形掌形多,瘤条粗直,肉厚。聚类可能与叶形、瓜形、瓜瘤和种皮色等性状相关。
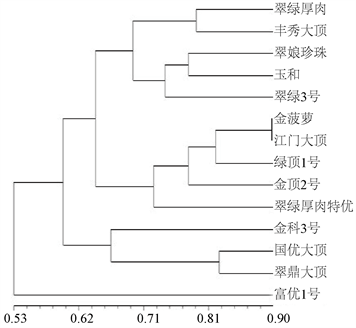
Figure 3. Cluster analysis of 14 Dading bitter gourd germplasms based on SSR markers
图3. 14份大顶苦瓜种质的SSR聚类分析
富优1号独立成为第4类,此种质第一雌花节位高达16.5节,雌性最低,瓜顶钝尖,瓜形为短圆锥,种皮深棕。叶形为掌形。单独分类与第一雌花节位高低关系密切。
3.2.3. 基于SRAP标记的聚类分析
基于SRAP标记的14份大顶苦瓜种质的聚类分析结果见图4。由图4可以看出,基于SRAP标记分析的所有种质的遗传相似系数跨度较大,翠绿厚肉与富优1号的亲缘关系最远,丰秀大顶和翠绿3号的亲缘关系最近。在遗传相似系数约为0.66时,可将14份大顶苦瓜材料分为4大类群。

Figure 4. Cluster analysis of 14 Dading bitter gourd germplasms based on SRAP markers
图4. 14份大顶苦瓜种质的SRAP聚类分析
第1大类群包括翠绿厚肉、翠娘珍珠、玉和、丰秀大顶和翠绿3号大顶苦瓜,此组分类结果与SSR标记的分类相同。不同的是丰秀大顶和翠绿3号两个种质高度聚合。
第2大类群包括金顶2号、翠绿厚肉特优、绿顶1号、金菠萝、江门大顶、金科3号,与SSR标记聚类相比,这组多了金科3号,绿顶1号、金顶2号、翠绿厚肉特优3个种质又可以聚为一个亚类,金菠萝、金科3号和江门大顶3个种质聚为1个亚类,组内每个种质的遗传相似度与SSR标记的聚类结果差异较大。从聚类结果来看,与第一雌花节位、瓜形、瓜瘤、叶形等性状相关度极高。
第3大类群则包括国优大顶苦瓜、翠鼎大顶苦瓜,在相似系数约为0.79时单独归为一个类群。这个聚类结果与SSR标记相同。
第4大类群仅有富优1号,这与SSR标记完全相同。
3.2.4. 基于SSR和SRAP两种标记的综合聚类分析
综合SSR和SRAP 两种标记所有数据,我们对14份大顶苦瓜种质再次进行了聚类分析,结果见图5。从图5可以看出,在遗传相似系数约为0.70处,可将14份大顶苦瓜材料分为4大类群,每组中的种质分类结果跟SSR标记的分类结果一致性非常高。不同的是,综合分类结果中第1大类群的翠娘珍珠和翠绿3号的亲缘关系最近,第2大类群中翠绿厚肉特优和绿顶1号的亲缘关系最近。两个聚类结果中,金菠萝和江门大顶都直接聚类,与SRAP不同。

Figure 5. Cluster analysis of 14 Dading bitter gourd germplasms based on SSR和SRAP markers
图5. 基于SSR和SRAP标记的14份大顶苦瓜种质的聚类分析
4. 结论与讨论
4.1. 大顶苦瓜种质的形态学分类
一般来说,依据形态学特征可对大顶苦瓜种质资源进行分析归类,且形态学的标记方法简单及直观,观察记录也简易,但是材料的形态较容易受生态环境的变化、基因的显隐性表达以及生育期等的影响,因此很难客观地去估计和评价其遗传变异性 [7] [8] [9]。我们通过观察记录发现,在茎、叶、花相关性状中,裂片数,性型,花柄遁形苞叶这三个性状在14个种质中相同,而叶形的差异最大。在瓜、种的相关性状中,瓜面光泽,近瓜蒂端面,种瓜皮色这3个性状在14个种质中相同,而结瓜习性在这14个种质中差异最大。所有种质中商品瓜横径的差异不大,主要差异在纵径上。从形态学聚类结果来看,由于瓜形差异,长纺锤形瓜的翠娘珍珠单独分为一类。第一组多是短纺锤形;第二组以短圆锥形居多。此外,种质的第一雌花节位也是分类的重要依据。第一组多为中早熟品种,第二组则多为早熟品种。
分类结果中,组3只有翠娘珍珠,与其它两组的亲缘关系较远,因其来源甘肃,说明地理起源和选择方向对种质的影响也是比较大的。陈禅友 [23] 利用ISSR分子标记对30个苦瓜品种进行遗传多样性聚类分析,认为其亲缘关系与种质地理的分布和植物学性状特征等存在一定的联系。
4.2. 大顶苦瓜种质遗传多样性的分子鉴定
目前,苦瓜的遗传研究主要集中在多个性状的聚类分析 [22],利用分子标记可以较为精确地揭示基因组DNA变异。高山等 [24] 利用RAPD和ISSR分子标记技术,对38份苦瓜种质进行遗传多样性分析和聚类,发现RAPD的分类群与形态学依据苦瓜瓜瘤表型的分类较为相近,ISSR的分类群则与形态学依据颜色表型的分类较为相近;赵秀娟等 [20] 应用SRAP分子标记对43份苦瓜种质遗传多样性的分析结果显示,SRAP分类群的结果与苦瓜刺瘤的有无、瘤的性状、瓜色以及棱条的粗细等密切相关。本研究中,2种标记以及二者综合后的分析结果高度一致,都可以将14份材料分为4大类,SSR和SRAP的分类相似度达到92.86%,两种标记综合分析的结果与SSR的分类结果完全一致,这与我们之前研究中发现的、两种标记综合分析结果与SRAP标记的分析结果较为接近的结论并不一致 [11] [16] [17],可能与引物选用和分析的种质不同有关。
所有分类结果中,富优1号单独归为一类,可能与其第一雌花节位最高有关;第一大类基本属于早熟种,第二大类为中早熟。这说明在大顶苦瓜种质分类中,第一雌花节位高低非常重要。此外,叶形、瓜形、瓜瘤类型以及种皮色都是分类的重要依据。
SSR分子标记技术对植物种质资源的鉴定是非常灵敏和有效的,可以检测并分辨出品种间很小的种质遗传的差异,也可以从分子水平上更加准确地开展种质资源遗传多样性分析 [25]。由于SSR扩增一般需要采用专门开发的特异性引物,从成本上分析会受到一定程度的限制。本研究采用20对SSR引物共扩增出90条清晰条带,各引物产生等位基因的范围是1~21条,平均为4.5条,这一结果比李光光 [12] 等利用SSR标记分析苦瓜材料的扩增结果要优异很多,说明针对大顶苦瓜种质资源的分析可以采用文中推荐的引物组合。
SRAP分子标记技术现已被广泛地运用于种质资源的鉴定评价、遗传图谱的构建、遗传多样性分析、重要性状的标记乃至基因分离克隆、杂种优势预测等方面。米军红等 [14] 建立并验证了苦瓜抗白粉病SRAP标记的优化体系,为获得苦瓜抗白粉病的SRAP分子标记、加快苦瓜抗白粉病新品种的选育提供参考依据。赵秀娟等 [20] 采用SRAP标记分析了苦瓜种质资源的遗传多样性。本研究选用多态性率较高的25对SRAP引物对14个大顶苦瓜供试材料进行扩增,总共获得452个条带,每对引物扩增的条带数介于3~20之间,平均11.3条,多态性比率为62.4%。这充分说明我们优化的SRAP分子标记扩增体系稳定、筛选引物的多态性比率比较高。
4.3. 大顶苦瓜种质资源遗传多样性的综合分析
利用形态学标记和分子标记,14份大顶苦瓜的种质都可以根据其特征进行分类,但每一类包含的种质却不相同。从分类结果看,有11份种质可以产生相同的聚类,说明两种标记的聚类相似度达到78.57%。14份种质之间的遗传差异不大,但基于两种分子标记基础上的分子聚类结果非常接近,说明分子标记的聚类可能更为可靠。
但形态学标记分类中将地理分布差异较大的翠娘珍珠单独归为一类,而分子标记却将第一雌花节位高的富优1号单独归为一类,这说明在大顶苦瓜的种质分类中,地理分布和第一雌花节位都是非常重要的分类依据。除此之外,瓜形、单果重、瓜瘤形状、种皮色、叶形等性状也是重要的分类依据。前人也研究发现苦瓜的果形、果色、单果重、瓜瘤的大小,单瓜的种子数在品种(系)之间差别较大 [24],并认为其亲缘关系与种质地理的分布和植物学性状特征等存在一定的联系。
值得一提的是,翠绿3号是广东省农科院蔬菜研究所以优良自交系江门大顶A11为母本,优良自交系南海大顶D12-3-1为父本而育成的,但在我们的分类结果中,翠绿3号与江门大顶这两个种质都没有聚在一起,原因需要进一步对亲本类型和后代的选育方向深入分析,因为李光光 [12] 等研究就发现,即使有相同母本杂交的后代经自交选育后会出现较大的遗传距离,采用定向连续性选育对苦瓜性状的累积具有重要影响。
基金项目
广东省科技计划项目(2012A020602068);惠州市科技计划项目(2015B010002003;2015B010002006;2015ZX063)资助;惠州学院青年创新团队项目(hzu201711)。
文章引用
王国莉. 大顶苦瓜种质资源的形态分类及分子鉴定
Morphological Classification and Molecular Identification of Germplasm Resources in Momordica charantia L.[J]. 植物学研究, 2020, 09(04): 341-353. https://doi.org/10.12677/BR.2020.94042
参考文献
- 1. 浙江农业大学. 蔬菜栽培学各论(南方本) [M]. 北京: 中国农业出版社, 1985.
- 2. Lucas, E.A., Dumancas, G.G. and Smith, B.J. (2010) Health Benefits of Bitter Melon (Momordica charantia). Bioactive Foods in Promoting Health, 35, 525-549. https://doi.org/10.1016/B978-0-12-374628-3.00035-9
- 3. 万新建, 李作善, 缪南生, 等. 苦瓜种质资源的研究与利用[J]. 现代园艺, 2009(8): 29-31.
- 4. 徐润生, 吕业成, 孔国添, 等. 地方特色谭边大顶苦瓜[J]. 蔬菜, 2006(5): 10-11.
- 5. 郭文场, 于艳, 张亚兰, 等. 苦瓜的利用价值[J]. 特种经济动植物, 2001(3): 38.
- 6. 张长远, 罗少波, 胡开林, 等. 长身苦瓜品种资源聚类分析[J]. 广东农业科学, 2003(4): 20-21, 26.
- 7. 李志勇, 谢华锋, 张力, 等. DNA分子标记技术在农作物品种鉴定上的应用[J]. 种子科技, 2010(10): 19-20.
- 8. 文方德, 李卓杰, 傅家瑞. 种子纯度鉴定技术进展及其评论[J]. 种子, 1995(5): 36-38.
- 9. 方宣钧, 吴为人, 唐纪良. 作物DNA标记辅助育种[M]. 北京: 科学出版社, 2001: 1-84.
- 10. 张长远, 孙妮, 胡开林. 苦瓜品种亲缘关系的RAPD分析[J]. 分子植物育种, 2005(4): 515-519.
- 11. 王国莉, 黄梅花. 应用SSR和SRAP分析苦瓜育种新组合的亲缘关系[J]. 分子植物育种, 2015, 13(9): 1993-2000.
- 12. 李光光, 郑岩松, 李向阳, 等. 利用SSR分子标记研究苦瓜资源的遗传多样性[J]. 南方农业学报, 2013, 44(1): 6-11.
- 13. 张景云, 黄月琴, 万新建, 等. 基于SSR和SRAP标记苦瓜种质遗传多样性分析[J]. 上海交通大学学报: 农业科学版, 2017, 35(3): 90-94.
- 14. 米军红, 尚小红, 周生茂, 等. 苦瓜抗白粉病SRAP标记筛选的PCR体系优化与验证[J]. 南方农业学报, 2013, 44(6): 898-902.
- 15. 邓俭英, 王绪, 方锋学, 等. 不同性别类型苦瓜基因组DNA提取及RAPD标记初步研究[J]. 广西农业科学; 2007, 2(3): 223-226.
- 16. 王国莉, 陈勇智, 冉梦莲, 等. 苦瓜性别相关SSR和SRAP分子标记的筛选及分析[J]. 分子植物育种, 2016, 14(7): 1764-1771.
- 17. 王国莉, 徐毓璇, 黄梅花. 基于SSR和SRAP标记的苦瓜品种鉴定及亲缘关系分析[J]. 分子植物育种, 2016, 14(2): 501-510.
- 18. Wang, S.Z. (2010) Development and Characterization of Polymorphic Microsatellite Markers in Momordica Chrantia. American Journal of Botany, 97, e75-e78. https://doi.org/10.3732/ajb.1000153
- 19. Li, G. and Quiros, C.F. (2001) Sequence-Related Amplifiled Polymorphism (SRAP), a New Marker System Based on a Simple PCR Reaction its Application to Mapping and Gene Tagging Brassiea. Theoretical and Applied Genetics, 103, 55-61. https://doi.org/10.1007/s001220100570
- 20. 赵秀娟, 宋建文, 胡开林. 苦瓜遗传多样性的SRAP标记分析[J]. 植物遗传资源学报, 2013, 14(1): 78-84.
- 21. 沈镝, 李锡香. 苦瓜种质资源描述规范和数据标准[M]. 北京: 中国农业出版社, 2008.
- 22. 向长萍, 谢军, 聂启军, 等. 23个苦瓜品种(系)农艺性状的主成分分析[J]. 华中农业大学学报, 2001, 20(4): 378-381.
- 23. 陈禅友, 兰红, 李亚木, 等. 苦瓜种质资源ISSR遗传多态性分析[J]. 长江蔬菜, 2012(12): 19-22.
- 24. 高山, 林碧英, 许端祥, 等. 苦瓜种质遗传多样性的RAPD和ISSR分析[J]. 植物遗传资源学报, 2010, 11(1): 78-83.
- 25. 王燕龙, 姜言生, 曲志才, 等. SSR分子标记在作物种质资源鉴定中的应用[J]. 山东农业科学, 2012, 44(10): 11-18.
