Advances in Clinical Medicine
Vol.
12
No.
05
(
2022
), Article ID:
51460
,
8
pages
10.12677/ACM.2022.125628
应用时间分辨荧光免疫层析技术建立HBP定量检测的方法
郭金双1,2*,赵玉川3,刘凤林1,夏文龙1
1山东省食品药品审评查验中心,山东 济南
2中国科学院福建物质结构研究所结构化学国家重点实验室,福建 福州
3山东省环科院环境检测有限公司,山东 济南
收稿日期:2022年4月18日;录用日期:2022年5月13日;发布日期:2022年5月20日

摘要
本文建立了一种肝素结合蛋白(Heparin-binding protein, HBP)的定量检测方法,并检验该方法的性能。主要通过以时间分辨荧光纳米微球作为荧光标记物,结合双抗体夹心法原理和免疫层析技术,实现HBP的定量检测。本检测方法在5~1000 ng/mL线性范围内线性关系良好,方程为y = 0.0324x − 0.0971,R2 = 0.9975。本试剂的批内精密度CV ≤ 5.21%,批间精密度CV ≤ 7.06%。本试剂与中翰盛泰生物技术股份有限公司的肝素结合蛋白测定试剂盒(免疫荧光干式定量法)相关性较好,二者的阳性符合率与阴性符合率分别为96.23%和95.0%,本试剂的假阳性率和假阴性率分别为5.0%和3.77%,诊断符合率为94.52%。本研究建立了HBP定量检测方法,并且该方法具有操作简单、检测快速、结果准确的优点。
关键词
肝素结合蛋白,时间分辨荧光纳米微球,免疫层析法,双抗体夹心法

Using Time Resolved Fluorescence Immunochromatography to Establish a Quantitative Detection Method for HBP
Jinshuang Guo1,2*, Yuchuan Zhao3, Fenglin Liu1, Wenlong Xia1
1Shandong Center for Food and Drug Evaluation and Inspection, Jinan Shandong
2State Key Laboratory of Structural Chemistry, Fujian Institute of Research on the Structure of Matter, Chinese Academy of Sciences, Fuzhou Fujian
3Shandong Academy of Environmental Sciences Environmental Testing Co., Ltd., Jinan Shandong
Received: Apr. 18th, 2022; accepted: May 13th, 2022; published: May 20th, 2022

ABSTRACT
In this paper, a quantitative detection method for Heparin Binding Protein (HBP) was established and its performance was tested. The quantitative detection of HBP was achieved by using time-resolved fluorescent nanospheres as fluorescent markers, combined with the principle of double antibody sandwich method and immunochromatography technology. The linearity of the detection method was good in the linear range of 5~1000 ng/mL, and the equation was y = 0.0324x − 0.0971, R2 = 0.9975, intra-batch precision CV ≤ 5.21%, inter-batch precision CV ≤ 7.06%. The reagent has a good correlation with Heparin Binding Protein (HBP) Detection Kit (fluorescence immunochromatography) developed by Zhonghanshengtai Biotechnology Limited Co., Ltd. The positive coincidence rate and negative coincidence rate were 96.23% and 95.0%, respectively. The false positive rate and false negative rate of this method were 5.0% and 3.77%, respectively, and the diagnostic coincidence rate was 94.52%. This study established a quantitative HBP detection method, and the method has the advantages of simple operation, rapid detection and accurate results.
Keywords:Heparin-Binding Protein, Time-Resolved Fluorescent Nano-Microspheres, Immunochromatography, Double Antibody Sandwich Methods

Copyright © 2022 by author(s) and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY 4.0).
http://creativecommons.org/licenses/by/4.0/


1. 引言
肝素结合蛋白(Heparin-Binding Protein, HBP),是机体内出现炎症反应后最早被释放的炎症因子,因此HBP成为多种临床感染性疾病的诊断指标 [1] [2]。HBP由Shafer教授等 [3] 于1984年首次分离成功。肝素结合蛋白是预先储存于中性粒细胞中,当机体内出现炎症或病变时由迁移的中性粒细胞释放,并通过激活巨噬、单核细胞,调节机体炎症反应的发生 [4] [5]。HBP在检测细菌感染方面具有良好的预后和区分性,具有很高的敏感性和特异性。HBP可通过促进细胞因子的释放及提高吞噬细菌能力的作用,从而使得入侵机体的微生物细菌被更有效地清除 [6] [7]。除了感染性疾病HBP也可作为其他疾病的临床诊断的指标,如Zhou等 [8] 研究发现在慢性阻塞性肺疾病发展过程中伴随HBP水平的升高,并证实肝素结合蛋白对慢性阻塞性肺疾病急性加重有诊断和预测价值。HBP作为一种有价值的诊断标记物,在疾病早期其含量检测在临床上具有重要意义。
目前HBP的检测方法主要有酶联免疫吸附法、化学发光法、免疫层析法等。但酶联免疫吸附法酶活性易受到反应体系中各种因素影响,导致该方法重复性较差,灵敏度不高等问题 [9];化学发光法则成本较高,需要购买大型仪器设备而且需配备专业人员操作,不利于普及;免疫层析法中有胶体金 [10]、上转换发光 [11] [12]、荧光胶乳微球 [13] [14] 等均可作为标记物被制作成HBP检测检测卡,但这些方法都分别存在不同缺陷,如:线性范围较窄,灵敏度不够等。时间分辨荧光免疫层析技术是用含有镧系稀土元素物作为荧光物质的高分子材料作为标记物,偶联蛋白抗体后形成抗体结合物,结合双抗体夹心法原理和免疫层析技术,可对目标抗原进行定量检测。由于镧系元素独特的荧光特性,结合时间延迟和光谱分辨等技术,使得该方法具有低背景、高特异性、高灵敏度等特点 [15] [16]。
本研究通过应用铕离子时间分辨荧光纳米微球作为标记物的方法,获得一种操作简单、价格低廉、检测快速、结果准确的HBP定量检测试剂。
2. 材料和方法
2.1. 材料与试剂
本HBP重组抗原、HBP鼠源抗体HBP-2H6、HBP鼠源抗体HBP-1E2 (珠海博美生物科技有限公司);羊抗鼠IgG抗体(购自奥创生物技术有限公司);铕离子时间分辨荧光纳米微球(苏州为度生物技术有限公司);硝酸纤维素膜(德国Sartorius公司);PVC板、玻璃纤维、吸水纸(上海金标生物科技有限公司);N-羟基琥珀酰亚胺(N-hydroxysuccinimide, NHS)(上海晶纯生化科技股份有限公司);1-乙基-(3-二甲基氨丙基)碳二亚胺(EDC) (德国sigma公司);其余化学试剂(分析纯,国药集团化学试剂有限公司)。临床样本来自山东省立医院的儿科门诊、呼吸内科门诊及住院患者,临床诊断为炎症、肺炎。
2.2. 仪器设备
划膜喷金仪(HGS510)、可编程切条机(HGS201)、HGS802型压壳机(杭州峰航科技有限公司);CTS300型数控裁条机(上海金标生物科技有限公司);电热鼓风干燥箱(上海一恒科学仪器有限公司);JS1000型荧光免疫分析仪(中翰盛泰生物技术股份有限公司)。
2.3. HBP标准品
将HBP重组抗原稀释为5、10、100、250、500、1000 ng/mL浓度的标准品。
2.4. 检测卡制备与使用方法
2.4.1. 荧光微球与HBP抗体(HBP-2H6)偶联
取100 μL荧光微球,加入900 μL标记缓冲液(50 mM MES, Ph = 6.0)进行稀释,取10 μL的NHS (20 mg/mL),快速混匀,然后加入5 μL EDC (20 mg/mL)快速混匀,室温孵育20 min。17,000 rpm,离心20 min,去掉上清,沉淀用100 μL标记缓冲液(20 mmol/L MES溶液,pH 6.5)重悬,加入0.1 mg HBP-2H6抗体,快速混匀,室温孵育2 h。加入100 μL 20% BSA室温封闭1 h。离心后,去除上清液,沉淀用1mL结合物稀释液(50 mmol/L Tris,10%蔗糖,2.5%海藻糖,0.5%酪蛋白,0.5% PVP10,pH 8.0)重悬,获得荧光微球HBP-2H6结合物备用。
2.4.2. HBP检测卡制备
分别用样品垫预处理液(10 mmol/L Tris溶液,1% PVP-10,0.4%酪蛋白,0.5% NaCl,0.2% TWEEN20,0.05% Proclin300,pH8.0)和结合垫预处理液(10 mmol/L四硼酸钠溶液,0.2% PEG2000,0.5% PVP-10,0.5% 酪蛋白钠盐,0.5% S9,0.05% Proclin300,10%蔗糖,pH 8.0)处理样品垫和结合垫。以浸泡的方式处理30 min,并置于37℃干燥箱中干燥6 h。
在PVC板上贴上NC膜,并将羊抗鼠抗体稀释至1 mg/mL,划在NC膜上作为C线(质控线),鼠源HBP-1E2抗体稀释至1.5 mg/mL,划在NC膜上作为T线(检测线),划膜量设定为1 μL/cm,然后置于45℃干燥箱中干燥1 h后备用。
在结合垫上喷涂荧光微球HBP-2H6结合物,喷量设定为3 μL/cm,45℃干燥箱中干燥1 h;在25%湿度环境中将结合垫、样品垫和吸水纸贴到PVC板对应的位置上,将组装完成的试纸板切成宽为4 mm的试纸条,装入塑料卡壳中。将组装完成的检测卡和干燥剂放入铝箔袋中密封,并于室温保存。
2.4.3. 标准曲线的拟合
使用本检测卡检测5、10、100、250、500、1000 ng/mL六个浓度标准品。使用Logistic P4参数方法将信号值和浓度值拟合成标准曲线,并将曲线信息录入ID卡中。
2.4.4. 检测卡的使用
从铝箔袋中拿出检测卡,吸取稀释十倍的样本或标准品100 μL,垂直滴加至检测卡加样孔处,层析一段时间后,通过荧光免疫分析仪读得检测卡的T/C值,再根据对应ID卡中的标准曲线,计算出HBP的浓度。
2.5. 检测卡条件优化
2.5.1. T线包被浓度优化
计划1:T线浓度为0.5 mg/mL;计划2:T线浓度为1.0 mg/mL;计划3:T线浓度为1.5 mg/mL;计划4:T线浓度为2.0 mg/mL;以此确定合适的T线包被浓度。
2.5.2. 结合垫喷膜浓度优化
对HBP抗体结合物分别进行5、6、7倍稀释,以此确定合适的喷膜浓度。
2.5.3. 检测时间的选取
选取HBP浓度为10、100、250 ng/mL的标准品,分别在加入样本后的5、7、10、12、15、17、20、22、25 min对检测卡进行检测,以此确定合适的检测时间。
2.6. 检测卡性能评估
2.6.1. 线性测试
用浓度为5、10、100、250、500、1000 ng/mL的HBP标准品检测线性关系。该方法的线性方程为y = 0.0324x − 0.0971,相关系数R2 = 0.9975。
2.6.2. 精密度测试
选取浓度为10、100、250 ng/mL的HBP标准品进行批内和批间精密度测定。批内精密度要求1天内完成一个批次的检测卡检测,3个浓度的HBP标准品分别做5次重复测试。批间精密度要求为分别取三个批次的检测卡进行检测,3个浓度的HBP标准品分别做5次重复测试。计算检测结果的平均值、标准差和变异系数。
2.6.3. 对比实验
选取不同浓度HBP的73例临床标本做对比,样本均由中翰盛泰生物技术股份有限公司河北精硕生物科技有限公司的肝素结合蛋白(HBP)检测试剂盒(荧光免疫层析法)测定。以10 ng/mL为临界值(cut-off值),计算出阳性符合率、阴性符合率、假阳性率、假阴性率和诊断符合率。率的比较通过χ2检验,P < 0.05有统计学差异,通过Kappa一致性分析得出两种方法一致性。
2.7. 统计学分析
数据采用prime 8.0.2统计软件进行分析。相关分析采用Pearson线性相关分析法。用ROC分析法分析诊断效能,并计算诊断符合率。检验水准α = 0.05。
3. 结果
3.1. 工艺条件的优化
3.1.1. 最适捕获抗体包被浓度
T线包被浓度分别为0.5 mg/mL、1.0 mg/mL、1.5 mg/mL和2.0 mg/mL。由图1可以看出,包被浓度为1.0 mg/mL时梯度和线性最好。
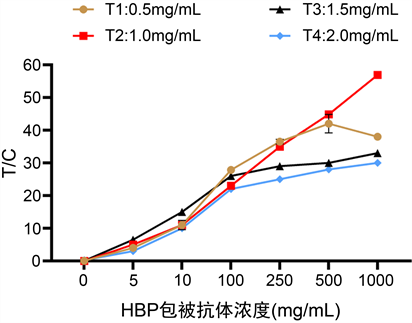
Figure 1. Screening of the HBP antibody concentration
图1. HBP包被抗体浓度筛选
3.1.2. 最适喷膜浓度
最适稀释浓度结果如图2所示,当6倍稀释时梯度变化和线性关系最好。

Figure 2. Dilution multiple screening
图2. 稀释倍数筛选
3.1.3. 最佳检测时间
检测结果如图3所示,浓度为10 ng/mL和100 ng/mL的标准品在12 min时T/C值就已经趋于稳定状态,而浓度250 ng/mL标准品的T/C值在15 min时才较为稳定,因此本方法的最佳检测时间选为15 min。

Figure 3. Detection time optimization
图3. 检测时间优化
3.1.4. 线性
结果如图4所示,该方法在5~1000 ng/mL范围内线性关系良好,方程为y = 0.0324x − 0.0971,R2 = 0.9975。

Figure 4. Standard curve
图4. 标准曲线
3.1.5. 精密度
经计算该方法的三批检测卡的批内精密度CV ≤ 5.21%,批间精密度CV ≤ 7.06%。分析结果见表1。
Table 1. Precision analysis
表1. 精密度分析
3.1.6. 临床样本比对
两种方法的一致性分析结果见表2,经计算两种方法的阳性符合率与阴性符合率分别为96.23%和95.0%,符合率较高。本方法的假阳性率和假阴性率分别为5.0%和3.77%,并且诊断符合率为94.52%。本方案荧光检测卡和中翰盛泰生物技术股份有限公司的肝素结合蛋白(HBP)检测试剂盒(荧光免疫层析法) (P < 0.05),K值为0.928。
Table 2. Analysis of the consistency results
表2. 一致性结果分析
4. 结论
本实验使用铕离子时间分辨荧光纳米微球标记HBP抗体,该方法在5~1000 ng/mL线性范围内,具有良好的线性关系,线性方程为y = 0.0324x − 0.0971,R2 = 0.9975。也有较好的精密度,批内精密度CV ≤ 5.21%,批间精密度CV ≤ 7.06%,与中翰盛泰生物技术股份有限公司的肝素结合蛋白(HBP)检测试剂盒(荧光免疫层析法)相关性良好,阳性符合率和阴性符合率分别为96.23%和95.0%,两种方法具有良好的一致性。假阳性率和假阴性率分别为5.0%和3.77%,并且诊断符合率为94.52%。本产品检测快速,操作简便,15 min便可出结果;而且成本低,标本用量少,仅需10 μL,利于普及和推广使用。
基金项目
配位聚合物在临床免疫检验技术中的标记性能研究(项目编号20200005)。
文章引用
郭金双,赵玉川,刘凤林,夏文龙. 应用时间分辨荧光免疫层析技术建立HBP定量检测的方法
Using Time Resolved Fluorescence Immunochromatography to Establish a Quantitative Detection Method for HBP[J]. 临床医学进展, 2022, 12(05): 4337-4344. https://doi.org/10.12677/ACM.2022.125628
参考文献
- 1. 赵海鹏, 李俊莹, 张晓红, 等. 肝素结合蛋白、降钙素原、中性粒细胞载脂蛋白联合检测对重症急性胰腺炎患者继发感染的评估作用[J]. 中国实验诊断学, 2020, 24(11): 1816-1818.
- 2. Fisher, J. and Linder, A. (2017) Hepa-rin-Binding Protein: A Key Player in the Pathophysiology of Organ Dysfunction in Sepsis. Journal of Internal Medicine, 281, 562-574. https://doi.org/10.1111/joim.12604
- 3. Shafer, W.M., Martin, L.E. and Spitznagel, J.K. (1984) Cationic Antimicrobial Proteins Isolated from Human Neutrophil Granulocytes in the Presence of Diisopropyl Fluoro-phosphate. Infection and Immunity, 45, 29-35. https://doi.org/10.1128/iai.45.1.29-35.1984
- 4. Herwald, H., Cramer, H., Mrgelin, M., et al. (2004) M Protein, a Classical Bacterial Virulence Determinant, for MS Complexes with Fibrinogen That Induce Vascular Leakage. Cell Press, 116, 367-379. https://doi.org/10.1016/S0092-8674(04)00057-1
- 5. Gennaro, A.D., Kenne, E., Wan, M., et al. (2009) Leukotri-ene B4-Induced Changes in Vascular Permeability Are Mediated by Neutrophil Release of Heparin-Binding Protein (HBP/CAP37/Azurocidin). The FASEB Journal, 23, 1750- 1757. https://doi.org/10.1096/fj.08-121277
- 6. Linder, A., Johansson, L., Thulin, P., et al. (2010) Erysipelas Caused by Group A Streptococcus Activates the Contact System and Induces the Release of Heparin-Binding Protein. Journal of Investigative Dermatology, 130, 1365-1372. https://doi.org/10.1038/jid.2009.437
- 7. Distasi, M.R. and Ley, K. (2009) Opening the Flood-Gates: How Neu-trophil-Endothelial Interactions Regulate Permeability. Trends in Immunology, 30, 547-556. https://doi.org/10.1016/j.it.2009.07.012
- 8. Dong, Y., Zhou, X., Zhang, Y., et al. (2021) Application Value of Blood Heparin-Binding Protein in the Diagnosis of Acute Exacerbation of Chronic Obstructive Pulmonary Disease. Contrast Media & Molecular Imaging, 2021, Article ID: 3800211. https://doi.org/10.1155/2021/3800211
- 9. 赵鸿翔. 人类免疫缺陷病毒抗体采用酶联免疫吸附法及电化学发光免疫分析法检测的效果[J]. 中国医疗器械信息, 2020, 26(24): 85-86.
- 10. Soria, C.E., Soto, M.E., Guarner, L.V., et al. (2021) The Kidnapping of Mitochondrial Func-tion Associated with the SARS-CoV-2 Infection. Histology and Histopathology, 36, 947-965.
- 11. 洪霞, 薛永来, 袁超, 等. 上转换发光免疫层析法快速检测黄曲霉毒素B1的研究[J]. 现代医学与健康研究电子杂志, 2018, 2(1): 18+20.
- 12. 姜会聪, 任舒悦, 王瑜, 等. 上转换发光免疫层析法快速检测牛奶中雌二醇[J]. 食品研究与开发, 2017, 38(3): 119-123.
- 13. Shen, L., Zhang, Q.H., Luo, X.L., Xiao, H.L., et al. (2021) A Rapid Lateral Flow Immuno-assay Strip for Detection of SARS-CoV-2 Antigen Using Latex Microspheres. Journal of Clinical Laboratory Analysis, 35, e24091. https://doi.org/10.1002/jcla.24091
- 14. 俞思明, 彭运平, 于淑娟, 等. 胶乳微球与抗体蛋白相互作用机理的荧光光谱法分析[J]. 光谱学与光谱分析, 2012, 32(8): 2166-2170.
- 15. Liu, J., Ye, Y., Hu, Z.G., et al. (2013) A Hy-persensitive Biotin-Avidin-TRFIA for Quantitative Detection of ANA-Ig (GAM) and Its Clinical Application. Journal of Immunoassay and Immunochemistry, 34, 197-207. https://doi.org/10.1080/15321819.2012.699495
- 16. 黄德智, 应昊俊, 刘飞, 等. 降钙素原时间分辨荧光免疫层析检测方法的建立及性能评价[J]. 第三军医大学学报, 2019, 41(6): 581-586.
NOTES
*通讯作者。
