Advances in Clinical Medicine
Vol.
12
No.
07
(
2022
), Article ID:
53802
,
9
pages
10.12677/ACM.2022.127963
NOTCH3基因突变与结直肠癌免疫检查点 抑制剂治疗疗效的关联性
李晶1,朱静娟2,李田军2,周娜2,张晓春2,姜曼2*
1青岛大学,山东 青岛
2青岛大学附属医院肿瘤精准医学中心,山东 青岛
收稿日期:2022年6月19日;录用日期:2022年7月11日;发布日期:2022年7月20日

摘要
目的:探讨NOTCH3基因突变与结直肠癌免疫检查点抑制剂治疗疗效的关联性。方法:采用倾向性评分匹配的方法纠正混杂因素的影响,分析NOTCH3基因突变与微卫星不稳定(MSI-H)/超突变状态及免疫检查点抑制剂治疗预后的关联性。结果:55份NOTCH3突变、105份NOTCH3野生型结直肠癌测序样本分析示NOTCH3突变与MSI-H/超突变状态密切关联(关联系数rn = 0.464,P < 0.001)。11例NOTCH3突变、33例NOTCH3野生型晚期结直肠癌患者免疫检查点抑制剂治疗生存分析显示突变患者与野生型患者平均生存期为35.55个月vs 17.03个月(HR = 0.12,95%置信区间0.02~0.88,Log-rank P值 = 0.011)。结论:NOTCH3突变型晚期结直肠癌患者免疫检查点抑制剂治疗后预后更好。
关键词
结直肠癌,免疫检查点抑制剂,NOTCH3基因,生物标志物,倾向性评分匹配

Association of NOTCH3 Mutation with the Prognosis of Colorectal Cancer Patients Treated with Immune Checkpoint Inhibitors
Jing Li1, Jingjuan Zhu2, Tianjun Li2, Na Zhou2, Xiaochun Zhang2, Man Jiang2*
1Qingdao University, Qingdao Shandong
2Cancer Precision Medicine Center, The Affiliated Hospital of Qingdao University, Qingdao Shandong
Received: Jun. 19th, 2022; accepted: Jul. 11th, 2022; published: Jul. 20th, 2022

ABSTRACT
Objective: To analyze the correlation between NOTCH3 mutation with the prognosis of colorectal cancer (CRC) patients treated with immune checkpoint inhibitors (ICIs). Methods: Propensity score matching (PSM) adjustment method was applied to reduce the influence of confounding variables to assess the association of NOTCH3 mutation with the status of MSI-H and TMB and evaluate the correlation of NOTCH3 mutation with the prognosis of CRC patients treated with ICIs. Results: A total of 55 NOTCH3-mutant and 105 NOTCH3-wildtype colorectal cancer tissues were obtained and demonstrated that NOTCH3 mutation was closely associated with MSI-H/hypermutated status and the association coefficient (rn) was 0.464 (P < 0.001). Besides, a dataset consisting of 11 NOTCH3-mutant and 33 NOTCH3-wildtype CRC patients treated with ICIs was collected and survival analysis indicated that the mean survival time of NOTCH3-mutant CRC patients versus that of NOTCH3-wildtype CRC patients was 35.55 vs. 17.03 months (hazard ratio 0.12; 95% CI, 0.02~0.88; Log-rank P = 0.011). Conclusions: NOTCH3-mutant CRC patients had a better prognosis after ICIs therapy.
Keywords:Colorectal Cancer, Immune Checkpoint Inhibitors, NOTCH3 Gene, Predictive Biomarker, Propensity Score Match

Copyright © 2022 by author(s) and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY 4.0).
http://creativecommons.org/licenses/by/4.0/


1. 引言
结直肠癌作为消化系统常见癌种,2020年癌症统计分析显示,全球约有190万结直肠癌新确诊病例,95万结直肠癌死亡病例,是第3常见癌种、第2常见癌症相关死因 [1]。并且随着人们生活条件的改善、生活方式及饮食习惯的改变,结直肠癌发病率可能会持续走高。
免疫检查点抑制剂通过靶向、阻断免疫检查点信号,恢复宿主自身的免疫反应对抗肿瘤细胞,达到抗肿瘤治疗的目的,避免了化疗、放疗等传统治疗方式的无特异性问题,在很多实体肿瘤中表现出良好且长期的抗肿瘤效应,正变革着这些癌种的治疗策略 [2] [3] [4]。
其中在一些晚期结直肠癌患者中免疫检查点抑制剂也取得了很好的治疗效果。例如KEYNOTE-177研究 [5] 显示:帕博利珠单抗对比传统化疗 ± 靶向药物一线治疗高度微卫星不稳定(microsatellite instability-high, MSI-H)/错配修复功能缺陷(defective mismatch repair, dMMR)晚期结直肠癌患者,帕博利珠单抗组生存优势明显,中位生存期16.5个月vs 8.2个月,3级以上治疗相关不良事件22% vs 66%。CheckMate-142研究 [6] 显示纳武利尤单抗联合伊匹木单抗一线治疗MSI-H/dMMR晚期结直肠患者,中位随访29.0个月后,客观反应率达69%,完全缓解率达13%,且耐受性较好。为此,NCCN指南 [7] 推荐对于适合强化治疗的MSI-H/dMMR晚期结直肠癌患者姑息一线治疗使用帕博利珠单抗/纳武利尤单抗 ± 伊匹木单抗。2021版中国结直肠癌诊疗指南 [8] 推荐对于MSI-H/dMMR晚期结直肠癌患者一线姑息治疗使用帕博利珠单抗(I级1A类推荐);对于既往一线、二线未使用免疫检查点抑制剂治疗的晚期结直肠患者推荐使用PD-1抑制剂姑息治疗(II级2A类推荐)。此外,还有研究 [9] 表明免疫检查点抑制剂在高肿瘤突变负荷(tumor mutational burden, TMB)晚期结直肠癌患者中的治疗优势也很明显。为此,MSI-H/dMMR、高肿瘤突变负荷成为了晚期结直肠癌患者免疫检查点抑制剂运用的重要指示标志物。但MSI-H/dMMR结直肠癌仅占结直肠癌病例中的很少一部分,约12%~14%,在晚期结直肠癌中仅有4%~5% [10] [11],且微卫星状态检测金标准——PCR法 [12] 及肿瘤突变负荷检测——靶基因panel [13],技术复杂、要求高,临床运用受到一定限制,寻找新的可靠的生物标志物替代或补充MSI-H、TMB,指导免疫检查点抑制剂的运用一直是肿瘤免疫治疗领域探索的方向。
NOTCH3蛋白作为一个单程跨膜受体,与其配体结合后,裂解、释放胞内结构域,胞内结构域转移至细胞核,与转录因子形成复合物,诱导多种与细胞生长、分化、肿瘤形成相关的靶基因转录 [14]。多项研究 [15] [16] [17] 表明NOTCH3基因过表达与结直肠癌的发生、发展、浸润、转移有关;还有研究 [18] 发现NOTCH3基因过表达与结直肠癌化疗耐药及不良预后有关,但最近Anqi Lin等人的研究 [19] 却发现NOTCH3突变型结直肠癌免疫检查点抑制剂治疗后预后更好,具体阐述及相关分析少。为此,该研究通过收集cBioPortal数据库中的结直肠癌测序数据及免疫检查点抑制剂治疗数据,采用倾向性评分匹配的方法,纠正患者年龄、性别、肿瘤TNM分期、原发肿瘤部位、KRAS、NRAS、BRAF 基因突变等常见混杂因素的影响后,分析NOTCH3基因突变与结直肠癌组织MSI-H/超突变状态间的关联性;分析NOTCH3基因突变与晚期结直肠癌患者免疫检查点抑制剂治疗疗效的相关性。旨在说明NOTCH3基因突变是否是晚期结直肠癌患者免疫检查点抑制剂治疗的独立预测标志物,能否预测晚期结直肠癌患者对免疫检查点抑制剂治疗的反应,协助筛选免疫检查点抑制剂治疗获益人群。
2. 研究对象与方法
2.1. 结直肠癌测序数据
从cBioPortal数据库中收集结直肠癌靶向测序数据 [20],该组数据来自MSKCC,测序平台采用的是MSK-IMPACT gene panel检测(靶序列 > 400 genes),总共有1134份结直肠癌样本,包括1011份晚期结直肠癌样本和 123份早期结直肠癌样本,其中30%的样本由穿刺活检获得,70%的样本由手术获得;52%的样本是在未经治疗前获得。收集的临床参数有:患者年龄、性别、原发肿瘤部位、肿瘤分期、分级、MSIsensor评分、肿瘤突变负荷。其中“MSIsensor评分”,代表所有检测微卫星中不稳定微卫星的百分比;MSIsensor评分和错配修复(MMR)蛋白IHC检测一致率为98.6%。“肿瘤突变负荷(TMB)”:为非同义突变数与实际分析碱基数之比,单位为“个/百万(/Mb)”。所有样本中有8份样本缺少MSIsensor评分数据,予以剔除,剩余1126份样本用于后续分析。
此外,数据将MSIsensor评分 ≥ 10或TMB ≥ 25/Mb的样本定义为MSI-H/超突变状态,将MSIsensor评分 < 10或TMB < 25/Mb的样本定义为微卫星稳定(microsatellite stability, MSS)/低突变状态,共有1018份MSS/低突变样本(90.4%)、108份MSI-H/超突变样本(9.6%)。
收集该组数据中KRAS、NRAS、BRAF、NOTCH3基因的体细胞突变数据,与临床信息匹配,并根据样本NOTCH3基因的突变状态进行分组。
2.2. 晚期结直肠癌患者免疫检查点抑制剂治疗数据
从cBioPortal数据库中收集免疫检查点抑制剂治疗数据,该组数据 [10] 来自MSKCC,含有1662例各类晚期癌种患者的临床数据及基因组数据,筛选其中的结直肠癌患者数据,共有110例。同时收集基因组数据中KRAS、NRAS、BRAF、NOTCH3基因的体细胞突变数据,与结直肠癌患者的临床数据匹配,并根据患者NOTCH3基因的突变状态进行分组。中位随访时间19个月(范围0~80个月)。主要观察指标是“总生存时间”,定义为:从第一次给予免疫检查点抑制剂治疗之日起至患者死亡或最后一次随访的时间间隔。
2.3. 统计学处理
计量资料符合正态分布用平均值 ± 标准差表示;不符合正态分布用中位数(四分位数间距)表示。计数资料用绝对数(构成比)表示。为了减少混杂因素的影响,我们基于患者年龄、性别、原发肿瘤部位、肿瘤分期、分级及KRAS、NRAS、BRAF基因突变状态使用多变量logistic回归模型进行倾向性评分匹配(Propensity Score Match, PSM),在匹配容差0.02的范围内筛选。
连续变量不符合正态分布或方差齐性用Mann-Whitney U检验(曼–惠特尼U检验);符合正态分布及方差齐性用独立t检验进行统计分析。分类变量若样本量足够大(n ≥ 40)且理论频数 ≥ 1时用卡方检验;样本量较小(n < 40)或20%以上的理论频数 < 5时用Fisher确切概率检验进行统计分析。等级资料用Mann-Whitney U检验进行统计分析。
用Kaplan-Meier法及Log-rank检验进行生存分析;用COX比例风险模型进行危险度(hazard ratio, HR)分析。所有统计检验都是双边的,且P < 0.05认为具有统计学意义。所有分析均在 SPSS 25.0版(SPSS Inc., Chicago, IL, United States)中进行。
3. 结果
3.1. 倾向性评分匹配前后结直肠癌测序数据概况
倾向性评分匹配前共有NOTCH3野生型样本1041份,NOTCH3突变型样本85份,两组间TNM分期、肿瘤分级、原发肿瘤部位分布、BRAF突变状态存在差异。倾向性评分匹配后,在匹配容差0.02的范围内,经1:2筛选,共获得55份NOTCH3突变样本,105份NOTCH3野生型样本。倾向性评分匹配后突变组与野生型组在所有参数上均匹配良好,差异没有统计学显著性(具体如表1所示)。
Table 1. Clinical information of colorectal cancer sequencing data
表1. 结直肠测序数据的临床信息
*P < 0.05,差异有统计学显著性。
3.2. NOTCH3基因突变与TMB、MSI-H之间的相关性
分析NOTCH3基因突变与结直肠癌组织MSIsensor评分及TMB间的相关性,发现NOTCH3突变组中MSIsensor评分和TMB明显升高(“MSIsensor评分”中位值8.65 vs 0.57;TMB中位值46.98 vs 7.76/Mb),差异均具有统计学显著性(如图1所示)。此外,分析NOTCH3基因突变与微卫星不稳定或超突变状态间的关联性发现:NOTCH3基因突变与结直肠癌组织MSI-H或超突变状态高度关联,关联系数(rn)为0.464 (P值 < 0.001)。
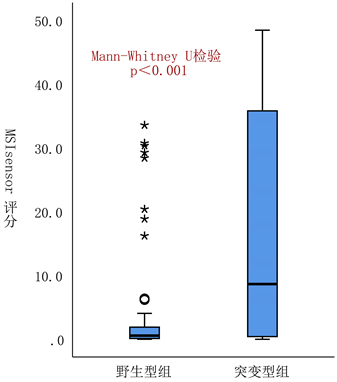
Figure 1. The correlation of NOTCH3 gene alterations with MSIsensor score and TMB
图1. NOTCH3基因型改变与MSIsensor评分及TMB之间的相关性
3.3. 倾向性评分匹配前后免疫检查点抑制剂治疗数据患者概况
倾向性评分匹配前NOTCH3野生型患者94例、NOTCH3突变型患者16例(其中5例患者具体的原发肿瘤部位不详),野生型患者组原发肿瘤部位集中在左半结肠,突变型患者组原发肿瘤部位集中在右半结肠,差异具有统计学显著性。
倾向性评分匹配后,在匹配容差0.02的范围内,经小于1:4的筛选,共获得11例NOTCH3突变患者,33例NOTCH3野生型患者(详见表2),倾向性评分匹配后两组在所有参数上均匹配良好,差异没有统计学显著性。
Table 2. The clinical information of mCRC patients treated with immune checkpoint inhibitors before and after PSM
表2. 免疫检查点抑制剂治疗数据晚期结直肠癌患者PSM前后的临床资料
1) *P < 0.05,差异有统计学显著性;2) aPSM后NOTCH3野生型组与突变型组间均无NRAS突变样本,因此其对应P值无法计算。
3.4. NOTCH3基因突变作为预测标志物的相关评价指标
以倾向性评分匹配后患者生存时间的平均值(13.41个月)作为cut-off值,区分患者预后好与预后差,为此,44例患者中实际预后更好的患者14例,实际预后更差的患者30例。NOTCH3突变组中预后更好的患者5例,预测灵敏度35.7% (5/14),95%置信区间为10.6%~60.8%;NOTCH3野生型组预后更差的患者24例,预测特异度80.0% (24/30),95%置信区间为65.7%~94.3%。
3.5. 免疫检查点抑制剂治疗后的结局
倾向性评分匹配后,NOTCH3突变组(n = 11)中有1例患者使用抗PD-1/PD-L1联合抗CTLA-4治疗,10例患者使用抗PD-1/PD-L1治疗;野生型组(n = 33)中有4例患者使用抗PD-1/PD-L1联合抗CTLA-4治疗,29例患者使用抗PD-1/PD-L1治疗。中位随访19个月后,突变组中有1例(9.1%)患者死亡,野生型组中20例(60.6%)患者死亡,风险比(hazard ratio,HR = 0.12;95%置信区间为0.02~0.88,P值 = 0.037)。突变组平均生存期为35.55个月(范围,29.09~42.00个月),野生型组平均生存期为17.03个月(范围,12.18~21.87个月),差异具有统计学显著性(P = 0.011,如图2示)。

Figure 2. Survival analysis
图2. 生存分析
4. 讨论
该研究通过收集cBioPortal数据库中的结直肠癌测序数据及免疫检查点抑制剂治疗数据,采用倾向性评分匹配的方法,减少患者年龄、性别、肿瘤TNM分期、原发肿瘤部位、KRAS、NRAS、BRAF基因突变等常见混杂因素的影响后,分析NOTCH3基因突变与结直肠癌组织MSI-H/超突变状态、NOTCH3基因突变与晚期结直肠癌患者免疫检查点抑制剂治疗疗效的相关性。
人体细胞中NOTCH通路含有四种受体、五种配体 [21],受体包括NOTCH1、NOTCH2、NOTCH3和NOTCH4,是一种跨膜蛋白,靶向在细胞表面,与特定配体结合后,发生一系列水解切割、释放胞内结构域,而胞内结构域是一种转录激活因子,能够与DNA结合蛋白结合,调控下游靶基因转录 [21] [22]。正常的NOTCH信号对于正常的细胞生长发育必不可少,异常的NOTCH信号会导致多种癌症的发生与发展 [15] [23]。NOTCH3作为NOTCH信号通路中的一员,多项研究 [15] [16] [17] 发现,其表达水平与结直肠癌肿瘤分期、淋巴结转移、肿瘤侵袭正相关;与结直肠癌化疗耐药、不良预后有关。但最近Anqi Lin [19] 等人发现NOTCH3突变型结直肠癌患者免疫检查点抑制剂治疗预后比NOTCH3野生型结直肠癌患者更好,具体分析及相关阐述少。为此,该研究通过收集公共数据库中的结直肠癌患者数据,采用倾向性评分匹配的方法,减少患者年龄、性别、原发肿瘤部位、肿瘤分期、常见基因突变等混杂因素的影响,分析NOTCH3基因突变与晚期结直肠癌患者免疫检查点抑制剂治疗疗效的关联性。首先,该研究收集了cBioPortal数据库中的结直肠癌测序数据,分析NOTCH3基因突变与结直肠癌组织MSI-H及TMB的关联性,发现NOTCH3突变型结直肠癌组织伴有明显更高的MSIsensor评分及TMB,且NOTCH3突变与结直肠癌组织MSI-H、超突变状态密切关联,关联系数(rn)为0.464 (P值 < 0.001),说明NOTCH3基因是一个关键的基因,NOTCH3基因的异常能够引起肿瘤组织呈现微卫星不稳定或高突变负荷状态,而微卫星不稳定、高肿瘤突变负荷预示着肿瘤细胞能够表达大量的新抗原,引起更明显的抗肿瘤免疫反应 [24],而良好的抗肿瘤免疫反应是免疫检查点抑制剂治疗获益的基础 [25],为此,NOTCH3突变型结直肠癌有免疫检查点抑制剂治疗获益的基础。
随后,该研究又从cBioPortal数据库中收集了一组晚期结直肠癌患者免疫检查点抑制剂治疗的数据,同样采用倾向性评分匹配的方法,减少患者年龄、性别、原发肿瘤部位、KRAS、NRAS、BRAF基因突变状态对患者生存的影响,分析NOTCH3基因突变与晚期结直肠癌患者免疫检查点抑制剂治疗疗效的相关性,发现NOTCH3突变型晚期结直肠癌患者免疫检查点抑制剂治疗后平均生存期明显优于NOTCH3野生型结直肠癌患者(35.55个月vs 17.03个月,Log-rank P值 = 0.011);且NOTCH3突变型晚期结直肠癌患者免疫检查点抑制剂治疗死亡风险较NOTCH3野生型患者下降88% (HR = 0.12,95%置信区间0.02~0.88,P值 = 0.037),说明NOTCH3基因突变是晚期结直肠癌患者免疫检查点抑制剂治疗获益因素,NOTCH3突变型晚期结直肠癌患者免疫检查点抑制剂治疗后预后更好。
该研究也存在一些不足:由于NOTCH3突变型结直肠癌患者的数量较少,NOTCH3基因突变作为晚期结直肠癌患者免疫检查点抑制剂治疗预测标志物的预测灵敏度较低(35.7%);但预测特异度高(80.0%),说明NOTCH3野生型患者免疫检查点抑制剂治疗后预后不如NOTCH3突变患者,可从侧面反映NOTCH3突变型晚期结直肠癌患者免疫检查点抑制剂治疗后预后更好。此外,由于结直肠癌患者中NOTCH3基因的突变频率较低,大约为2%~14%,平均突变率为7%,尚未收集到NOTCH3突变患者的临床数据加以验证。另外,免疫检查点抑制剂治疗数据中缺少先前或同时进行的其他非免疫检查点抑制剂治疗记录,这些治疗可能会对患者预后有一定的影响。为此,该研究的结果还需大量前瞻性研究加以验证。
总之,我们采用倾向性评分匹配的方法,减少患者年龄、性别、原发肿瘤部位、肿瘤分期、分级、KRAS/NRAS/BRAF基因突变状态的影响后发现:NOTCH3基因突变与结直肠癌组织MSI-H/超突变状态密切相关;NOTCH3突变型晚期结直肠癌患者免疫检查点抑制剂治疗死亡风险比NOTCH3野生型患者低;NOTCH3突变型晚期结直肠癌患者免疫检查点抑制剂治疗后生存期明显比NOTCH3野生型结直肠癌患者长。因此,NOTCH3基因突变是晚期结直肠癌患者免疫检查点抑制剂治疗获益因素,NOTCH3基因突变可以预测晚期结直肠癌患者对免疫检查点抑制剂治疗的反应。
文章引用
李 晶,朱静娟,李田军,周 娜,张晓春,姜 曼. NOTCH3基因突变与结直肠癌免疫检查点抑制剂治疗疗效的关联性
Association of NOTCH3 Mutation with the Prognosis of Colorectal Cancer Patients Treated with Immune Checkpoint Inhibitors[J]. 临床医学进展, 2022, 12(07): 6677-6685. https://doi.org/10.12677/ACM.2022.127963
参考文献
- 1. Sung, H., Ferlay, J., Siegel, R.L., et al. (2021) Global Cancer Statistics 2020: GLOBOCAN Estimates of Incidence and Mortality Worldwide for 36 Cancers in 185 Countries. CA: A Cancer Journal for Clinicians, 71, 209-249. https://doi.org/10.3322/caac.21660
- 2. Jenkins, R., Barbie, D. and Flaherty, K. (2018) Mechanisms of Resistance to Immune Checkpoint Inhibitors. British Journal of Cancer, 118, 9-16. https://doi.org/10.1038/bjc.2017.434
- 3. Pardoll, D. (2012) The Blockade of Immune Checkpoints in Cancer Im-munotherapy. Nature Reviews Cancer, 12, 252-264. https://doi.org/10.1038/nrc3239
- 4. Homet, M.B. and Ribas, A. (2015) Anti-Programmed Cell Death Protein-1/Ligand-1 Therapy in Different Cancers. British Journal of Cancer, 112, 1421-1427. https://doi.org/10.1038/bjc.2015.124
- 5. André, T., Shiu, K., Kim, T., et al. (2020) Pembrolizumab in Microsatellite-Instability-High Advanced Colorectal Cancer. The New England Journal of Medicine, 383, 2207-2218. https://doi.org/10.1056/NEJMoa2017699
- 6. Overman, M., Lonardi, S., Wong, K., et al. (2018) Durable Clinical Benefit with Nivolumab plus Ipilimumab in DNA Mismatch Repair-Deficient/Microsatellite Instability-High Metastatic Colorectal Cancer. Journal of Clinical Oncology: Official Journal of the American Society of Clinical Oncology, 36, 773-779. https://doi.org/10.1200/JCO.2017.76.9901
- 7. Colon Cancer, Version 1, 2021 Clinical Practice Guide-lines in Oncology (NCCN Guidelines). https://www.nccn.org
- 8. 中国临床肿瘤学会指南工作委员会. 中国临床肿瘤学会(CSCO)结直肠癌诊疗指南[M]. 北京: 人民卫生出版社, 2021: 71-76.
- 9. Samstein, R., Lee, C., Shoushtari, A., et al. (2019) Tumor Mutational Load Predicts Survival after Immunotherapy across Multiple Cancer Types. Nature Genetics, 51, 202-206. https://doi.org/10.1038/s41588-018-0312-8
- 10. Pang, J., Gindin, T., Man-sukhani, M., et al. (2020) Microsatellite Instability Detection Using a Large Next-Generation Sequencing Cancer Panel across Diverse Tumour Types. Journal of Clinical Pathology, 73, 83-89. https://doi.org/10.1136/jclinpath-2019-206136
- 11. Price, T.J., Thavaneswaran, S., Burge, M., et al. (2016) Update on Optimal Treatment for Metastatic Colorectal Cancer from the ACTG/AGITG Expert Meeting: ECCO 2015. Expert Review of Anticancer Therapy, 16, 557-571. https://doi.org/10.1586/14737140.2016.1170594
- 12. Chen, S., Watson, P. and Parmigiani, G. (2005) Accuracy of MSI Testing in Predicting Germline Mutations of MSH2 and MLH1: A Case Study in Bayesian Meta-Analysis of Di-agnostic Tests without a Gold Standard. Biostatistics (Oxford, England), 6, 450-464. https://doi.org/10.1093/biostatistics/kxi021
- 13. Cheng, D., Mitchell, T., Zehir, A., et al. (2015) Memorial Sloan Kettering-Integrated Mutation Profiling of Actionable Cancer Targets (MSK-IMPACT): A Hybridization Capture-Based Next-Generation Sequencing Clinical Assay for Solid Tumor Molecular Oncology. The Journal of Molecular Diagnos-tics: JMD, 17, 251-264. https://doi.org/10.1016/j.jmoldx.2014.12.006
- 14. Alanazi, I.O. and Khan, Z. (2018) Endocrine and Cell Surface Receptor Signaling in Breast Carcinogenesis. In: Bulut, N., Ed., Breast Cancer and Surgery, IntechOpen, London. https://doi.org/10.5772/intechopen.74679
- 15. Wang, X., Xi, X., Wu, J., et al. (2015) MicroRNA-206 Attenuates Tumor Proliferation and Migration Involving the Down-Regulation of NOTCH3 in Colorectal Cancer. Oncology Reports, 33, 1402-1410. https://doi.org/10.3892/or.2015.3731
- 16. Zhang, X., Shi, H., Yao, J., et al. (2020) FAM225A Facilitates Colorec-tal Cancer Progression by Sponging miR-613 to Regulate NOTCH3. Cancer Medicine, 9, 4339-4349. https://doi.org/10.1002/cam4.3053
- 17. Varga, J., Nicolas, A., Petrocelli, V., et al. (2020) AKT-Dependent NOTCH3 Activation Drives Tumor Progression in a Model of Mesenchymal Colorectal Cancer. Journal of Experimental Medicine, 217, e20191515. https://doi.org/10.1084/jem.20191515
- 18. Vinson, K.E., George, D.C., Fender, A.W., et al. (2016) The Notch Pathway in Colorectal Cancer. International Journal of Cancer, 138, 1835-1842. https://doi.org/10.1002/ijc.29800
- 19. Lin, A., Zhang, H., Hu, X., et al. (2020) Age, Sex, and Specific Gene Muta-tions Affect the Effects of Immune Checkpoint Inhibitors in Colorectal Cancer. Pharmacological Research, 159, Article ID: 105028. https://doi.org/10.1016/j.phrs.2020.105028
- 20. Yaeger, R., Chatila, W.K., Lipsyc, M.D., et al. (2018) Clinical Sequencing Defines the Genomic Landscape of Metastatic Colorectal Cancer. Cancer Cell, 33, 125-136e3. https://doi.org/10.1016/j.ccell.2017.12.004
- 21. Previs, R., Coleman, R., Harris, A., et al. (2015) Molecular Path-ways: Translational and Therapeutic Implications of the Notch Signaling Pathway in Cancer. Clinical Cancer Research: An Official Journal of the American Association for Cancer Research, 21, 955-961. https://doi.org/10.1158/1078-0432.CCR-14-0809
- 22. Ntziachristos, P., Lim, J., Sage, J., et al. (2014) From Fly Wings to Targeted Cancer Therapies: A Centennial for Notch Signaling. Cancer Cell, 25, 318-334. https://doi.org/10.1016/j.ccr.2014.02.018
- 23. Stremitzer, S., Zhang, W., Yang, D., et al. (2015) Variations in Genes Involved in Dormancy Associated with Outcome in Patients with Resected Colorectal Liver Metastases. Annals of Oncology: Official Journal of the European Society for Medical Oncology, 26, 1728-1733. https://doi.org/10.1093/annonc/mdv224
- 24. Verdegaal, E., de Miranda, N., Visser, M., et al. (2016) Neoantigen Landscape Dynamics during Human Melanoma-T Cell Interactions. Nature, 536, 91-95. https://doi.org/10.1038/nature18945
- 25. Becht, E., de Reyniès, A., Giraldo, N., et al. (2016) Immune and Stromal Classification of Colorectal Cancer Is Associated with Molecular Subtypes and Relevant for Precision Immunotherapy. Clinical Cancer Research: An Official Journal of the American Association for Cancer Research, 22, 4057-4066. https://doi.org/10.1158/1078-0432.CCR-15-2879
NOTES
*通讯作者Email: jasmanouc@163.com
