Advances in Clinical Medicine
Vol.
12
No.
12
(
2022
), Article ID:
59518
,
11
pages
10.12677/ACM.2022.12121672
CT影像组学预测肝硬化患者高危食管静脉曲张的价值
陈露1,宫希军2*
1安徽医科大学影像医学与核医学系,安徽 合肥
2安徽医科大学第二附属医院放射科,安徽 合肥
收稿日期:2022年11月21日;录用日期:2022年12月15日;发布日期:2022年12月26日

摘要
目的:构建肝硬化患者高危食管静脉曲张的无创预测模型。方法:回顾性分析190例确诊为肝硬化的患者,收集肝硬化患者入院后的血清学指标及胃镜检查结果,按7:3的比例随机分为训练集(n = 133)和验证集(n = 57)。采集研究人群的门脉期腹部强化CT图像,选脾门区作为感兴趣区,提取其影像组学特征,应用特征相关性分析、最小绝对收缩和选择算子(LASSO)回归分析筛选特征,建立影像组学标签(Radiomics signature, RS)并计算RS评分Rad-score;采用Logistic回归分析构建临床模型,联合Rad-score、血清学指标及影像学指标构建结合模型。使用受试者工作特征曲线(ROC)曲线分别评估三种模型的预测效能,曲线下面积(AUC)的比较采用Delong检验,通过决策曲线(DCA)分析评价结合模型的临床实用性。结果:构建的影像学模型、临床模型、结合模型在训练集中的AUC分别为0.94、0.92、0.96,在验证集中的AUC分别为0.79、0.91、0.94。在诊断效能最优的结合模型中,Rad-score及胃左静脉直径是高危食管静脉曲张的风险因子;决策曲线显示结合模型具有良好的临床实用性。结论:本研究基于影像组学特征、血清学指标及影像学指标构建的模型有助于预测肝硬化高危食管静脉曲张患者。
关键词
肝硬化,食管静脉曲张,预测,影像组学,LASSO回归

The Value of CT Radiomics in Predicting High Risk Esophageal Varices in Patients with Liver Cirrhosis
Lu Chen1, Xijun Gong2*
1Department of Imaging Medicine and Nuclear Medicine, Anhui Medical University, Hefei Anhui
2Department of Radiology, The Second Affiliated Hospital of Anhui Medical University, Hefei Anhui
Received: Nov. 21st, 2022; accepted: Dec. 15th, 2022; published: Dec. 26th, 2022

ABSTRACT
Objective: To construct a noninvasive prediction model for high-risk esophageal varices in patients with liver cirrhosis. Methods: A retrospective analysis was performed on 190 patients diagnosed with liver cirrhosis. Serological indexes and gastroscopy results of patients admitted to hospital were collected and randomly divided into a training set (n = 133) and a validation set (n = 57) in a ratio of 7:3. The enhanced abdominal CT images of the study population at portal pulse stage were collected, and the splenic portal region was selected as the region of interest to extract its image omics features. Feature correlation analysis, minimum absolute contraction and selection operator (LASSO) regression analysis were used to screen the features. Radiomics signature (RS) was established and RS score Rad-score was calculated. Logistic regression analysis was used to construct the clinical model, combined with Rad-score, serological indicators and imaging indicators to construct the combined model. The predictive efficacy of the three models was evaluated using receiver operating characteristic curve (ROC) curves. The area under the curve (AUC) was compared using Delong test. The clinical practicability of the combined models was evaluated by decision curve (DCA) analysis. Results: The AUC of the constructed imaging model, clinical model and combination model were 0.94, 0.92 and 0.96 in the training set, and 0.79, 0.91 and 0.94 in the validation set, respectively. In the optimal combination model, Rad-score and left gastric vein diameter were risk factors for high-risk esophageal varices. The decision curve shows that the combined model has good clinical practicability. Conclusions: In this study, the model built based on the image omics characteristics, serological indicators and imaging indicators is helpful to predict the patients with esophageal varices at high risk of cirrhosis.
Keywords:Liver Cirrhosis, Esophageal Varices, Forecasting, Radiomics, LASSO Regression

Copyright © 2022 by author(s) and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY 4.0).
http://creativecommons.org/licenses/by/4.0/


1. 引言
食管静脉曲张(esophageal varices, EV)是肝硬化的常见并发症,也是肝硬化患者死亡的主要原因 [1] [2]。食管静脉曲张出血(esophageal variceal bleeding, EVB)是一种与死亡率相关的医疗急症,尽管对于静脉曲张出血的研究最近取得了一定进展,但在6周时仍有10%~20%的死亡率 [3]。美国肝病研究协会指南推荐对所有肝硬化患者进行内窥镜检查 [4],但是内窥镜检查是一种侵入性检查,会引起患者恶心等不适,患者的耐受性与依从性差,未能定期检查的病人因发生上消化道出血后才至医院检查会错失及时治疗的机会,并且对于需要在短期内进行重复检查的患者,内窥镜检查不适用于疾病进展的常规评估和频繁监测 [5]。在代偿期肝硬化中,食管胃底静脉曲张(Gastroesophageal varices, GEV)的患病率为30%~40%,只有少数(10%~20%)患有高危静脉曲张(Highrisk varices, HRV)需要治疗 [6]。近年来针对肝硬化食管静脉曲张的无创预测手段逐年增多 [7] [8] [9],Baveno共识提出肝脏硬度 < 20 kPa和血小板计数 > 150,000的患者发生静脉曲张需要治疗的风险非常低,并且可以避免进行内镜检查 [10]。为此,本研究基于CT门脉期脾脏影像特征、血清学和影像学指标,构建肝硬化患者高危食管静脉曲张的无创预测模型,希望能帮助预测肝硬化患者食管静脉曲张的严重程度,为及时的治疗决策提供依据。
2. 资料与方法
1) 一般资料选取2018年1月至2021年1月在安徽医科大学第二附属医院确诊为肝硬化的患者为研究对象。纳入标准:a) 诊断标准满足2019年中华医学会肝病学分会制定的《肝硬化诊治指南》;b) 行腹部强化CT检查前2个月内接受过上消化道内窥镜检查。排除标准:a) 患者缺乏腹部强化CT图像;b) 患者既往接受过脾脏手术或其他相关手术治疗;c) 合并溃疡性消化道出血或其他可能导致消化道出血的疾病;d) 患者合并食管肿瘤、胃部肿瘤;e) 患者此前接受过内镜下手术治疗或检查期间使用β阻滞剂治疗;f) 近3个月有消化道大出血病史。最终入组患者190例。所有患者均签署知情同意书,本研究获得安徽医科大学第二附属医院伦理委员会审批。
2) 无创实验室检查指标的收集收集肝硬化患者入院后距本次CT检查时间最近的实验室检查指标,包括血小板计数(Blood platelet count, PLT)、肝功能及凝血功能指标,同时计算丙氨酸氨基转氨酶(ALT)与天冬氨酸氨基转移酶(AST)比值(AAR, AAR = AST/ALT)、AST与血小板计数(PLT)比值指数[APRI, APRI = AST/ULN × 100/PLT (×109/L)]、基于4因子的肝纤维化指标[FIB-4,FIB-4 = (年龄 × AST)/PLT × ALT1/2]。
3) 胃镜检查本研究中判断高危食管静脉曲张的标准为:曲张静脉直径 ≥ 5 mm或虽然曲张静脉直径 < 5 mm但存在红色征。
4) 图像分析使用PHILIPS iCT 256 Briliance扫描仪或GE LightSpeed VCT 64排螺旋CT机对患者进行上腹部或全腹部平扫及增强扫描。扫描参数:扫描层厚5 mm,层间距5 mm,管电压120 kV,管电流200 mA。三期动态增强扫描采用高压注射器经肘静脉团注对比剂(碘帕醇300 gI/mg),注射速率为3~4.5 ml/s,剂量为1.5 ml/kg,分别于20~25 s、60~70 s、300 s进行动脉期、门脉期、延迟期扫描。扫描后,重建层厚1 mm的门脉期图像并在工作站进行图像后处理,测量门静脉、脾静脉、胃左静脉内径以及脾脏厚径等指标,判定门静脉、脾静脉及肠系膜上静脉血栓情况。门静脉内径测量点选择脾静脉与肠系膜上静脉汇合处以上2 cm处。胃左静脉内径在胃左静脉汇入门静脉或脾静脉处上方2 cm内胃左静脉内径最宽处测量。脾静脉内径在其中点测量。脾脏厚径为脾内缘至脾外缘在脾门中心层面的最短径。所有指标测量3次取平均值。
5) 图像分割、特征提取本研究采用人手动分割法于软件ITK-SNAP 3.6 (https://www.itksnap.org/)完成感兴趣区(Region of interest, ROI)的勾画。由两位安徽医科大学医生于脾脏脾门区截面沿脏器轮廓勾画ROI,患者的内镜检查结果对这两位影像科医生设盲。通过pyradiomics提取脾脏门脉期CT图像的影像组学特征,包括一阶特征(First Order Features),形态特征(Shape Features),灰度共生矩阵特征(GLCM Features),灰度区域矩阵特征(GLSZM Features),灰度游程矩阵特征(GLRLM Features),灰度相依矩阵特征(GLDM Features),邻域灰度差分矩阵特征(NGTDM Features)。从训练组中随机抽取30例患者,两位影像科医生将在间隔一个月后重新勾画所抽取患者的ROI,分别评估前后两次ROI和两位医生各自勾画的ROI所提取特征的一致性。
6) 影像组学模型构建及评价用LASSO筛选的特征分别构建影像学模型、临床模型和结合模型。应用ROC曲线分别评估三个模型对HRV的诊断效能,并运用Delong检验比较临床模型与结合模型的AUC之间的差异是否具有统计学意义上的显著性。进一步通过决策曲线(DCA)分析评估结合模型的临床使用性。
7) 统计学分析分类变量以频率(%)表示,连续变量以平均值 ± 标准差表示。特征筛选采用特征相关性分析、LASSO回归分析进行。采用受试者工作特征曲线下面积(AUC)评估模型的准确性,应用决策曲线(DCA)评估模型的临床有效性。以P < 0.05认为差异有统计学意义。所有统计学分析都是通过Python完成的。
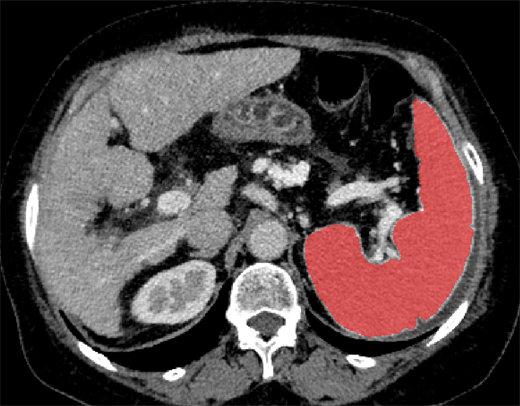
Figure 1. The spleen contours are manually outlined on the contrast-enhanced portal venous phase CT data
图1. 在门脉期CT增强图像上手动勾画脾脏的轮廓
3. 结果
1) 一般资料比较本次研究一共纳入190例患者,高危组142例,低危组48例。按照7:3的比例随机拆分为模型训练集133例,其中高危组99例,低危组34例;测试集共57例,其中高危组43例,低危组14例。患者的临床基线特征见表1。
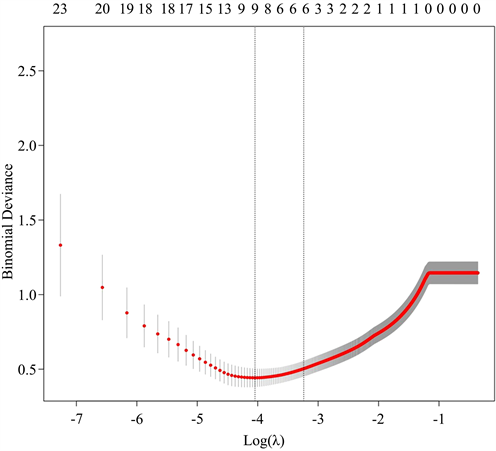
2) 特征筛选和构建影像组学模型本研究用pyradiomics提取脾脏门脉期CT图像影像特征,每个ROI共提取1652个影像组学特征,保留同类相关系数ICC (intra-class correlation coefficient)大于0.8的特征用于进一步分析建模。进一步通过LASS0逻辑回归算法进行特征降维,通过L1惩罚实现变量选择和正则化,将冗余特征的回归系数缩放至0,惩罚力度通过参数λ经行调控,在最佳λ值条件下的特征变量是最少的特征变量。经过LASSO回归分析后,在最佳λ值条件下回归系数非零的影像组学特征被认为是与HRV密切相关并建立影像组学标签(Radiomics signature, RS)的计算公式,计算RS评分Rad-score,计算得出的值反应RS对HRV的预测值。见图1。
以内径检查结果(低危和高危)为因变量,将收集的影像学指标和血清学指标作为自变量纳入分析。对所有自变量经十倍交叉检验并进行LASS0回归分析,通过最佳惩罚系数λ对惩罚力度进行调控,使模型性能优良且影响因素最少,将所筛选出的自变量进一步纳入Logistic回归模型,构建临床模型。再将Rad-score进一步纳入自变量,经过同样的筛选方法,最终筛选出Rad-score、胃左静脉直径2个预测HRV的自变量,并构建结合模型。见图2、图3。
Table 1. Clinical characteristics of enrolled patients
表1. 入组病人的临床特征
 (a)
(a) (b)
(b)
Figure 2. Feature selection. (a) Minimum absolute contraction and selection operator (LASSO) is used to select the most suitable omics features; (b) Coefficient convergence diagram of different features
图2. 特征的筛选。(a) 采用最小绝对收缩和选择算子(LASSO)筛选最合适的组学特征;(b) 不同特征的系数收敛图
 (a)
(a)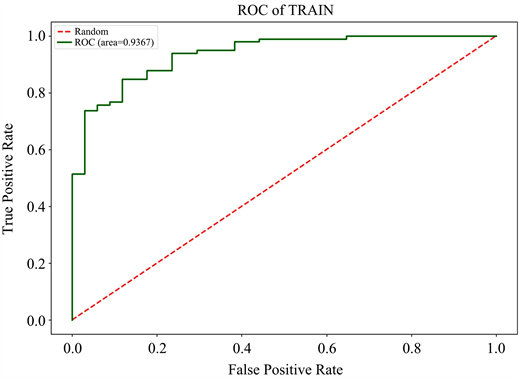 (b)
(b)
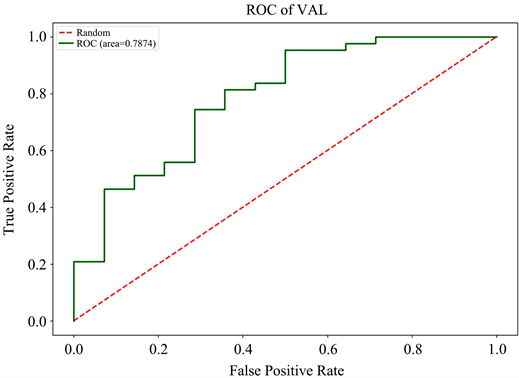
Figure 3. Receiver operator characteristic curve of the imaging model for predicting high-risk esophageal varices. (a) training set; (b) validation set
图3. 影像学模型预测高危食管静脉曲张的受试者操作曲线。(a) 训练集;(b) 验证集
3) 模型预测效能的评价构建的影像学模型、临床模型、结合模型在训练集中的AUC分别为0.94、0.92、0.96,在验证集中的AUC分别为0.79、0.91、0.94。在诊断效能最优的结合模型中,Rad-score及胃左静脉直径是高危食管静脉曲张的风险因子;Delong检验结果表明临床模型与结合模型的AUC之间的差异具有统计学上的显著性,Z值与P值在训练集中为−2.53,0.011、在验证集中为−1.98,0.047。决策分析曲线表明所构建的结合模型具有良好的临床使用性。见表2及图4~6。
 (a)
(a)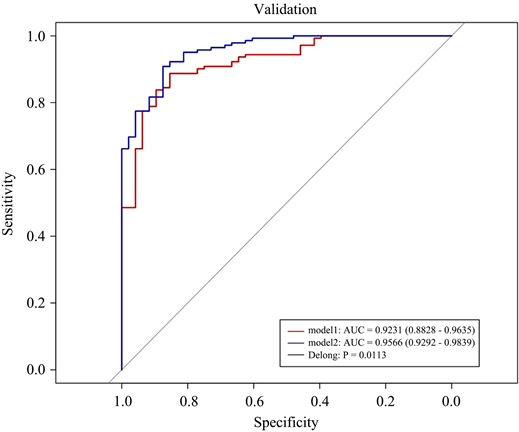 (b)
(b)
Figure 4. Receiver operator characteristic curve of the clinical and combined models, the Delong test was used to compare whether the differences between the AUC of the clinical model and the combined model were statistically significant. (a) training set; (b) validation set. Red line—clinical model; blue line—combined model. When P < 0.05, the difference between the AUC of the two models was considered to be statistically significant
图4. 临床模型与结合模型的预测高危食管静脉曲张的受试者操作曲线,并运用Delong检验比较临床模型与结合模型的AUC之间的差异是否具有统计学意义上的显著性。(a) 训练集,(b) 验证集。红色线——临床模型,蓝色线——结合模型;当P < 0.05时认为两个模型的AUC之间的差异性具有统计学意义上的显著性
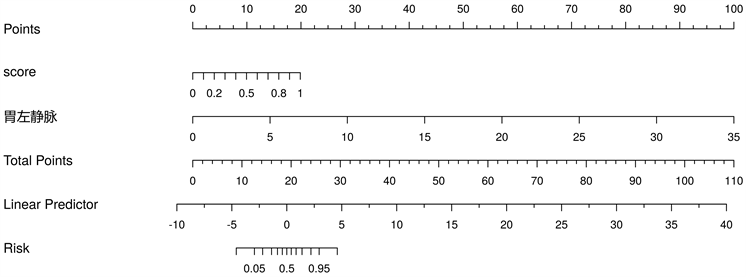
Figure 5. The nomogram of combined model to predict high risk esophageal varices
图5. 结合模型预测高危食管静脉曲张的列线图

Figure 6. The DCA curve of combined model
图6. 结合模型的决策曲线分析
Table 2. Predictive value of imaging model, clinical model and combined model for HRV
表2. 影像学模型、临床模型以及结合模型对于HRV的预测价值
4. 讨论
食管静脉曲张出血是肝硬化的最严重并发症之一,具有发生率高、病死率高的特点。早期预测高危食管静脉曲张并对其进行密集监测和早期干预能有效改善患者的预后 [11]。
近年来多种无创技术用于预测高危食管静脉曲张并且具有较高的诊断价值 [12]。此前并没有研究单独探讨脾脏影像组学特征与食管静脉曲张的关系。既往研究发现在肝硬化患者中脾脏发生了一系列改变,包括脾红髓血容量增加,脾组织细胞增生、动脉末端延长、白髓体积增大以及脾小梁间的纤维化等 [13]。一项关于高危食管静脉曲张的Meta分析发现,对于高危食管静脉曲张的诊断,脾硬度的诊断效能要优于肝硬度 [14]。林译垦 [15] 的研究发现,相对于肝脏,在脾脏能提取的特征与高危食管静脉曲张更优。本研究结果显示,基于CT门脉期脾脏图像提取的影像组学特征所构建的影像组学标签(Rad-score)对于高危食管静脉曲张具有一定的诊断价值。
为了进一步提高模型的诊断价值,本研究进一步将脾脏的影像组学特征联合传统影像学指标及血清学指标构建肝硬化食管静脉曲张高危患者的结合模型。结果显示相对于单一的影像学或临床模型,结合模型对高危食管静脉曲张具有更高的预测价值。在结合模型中,影像组学标签(Rad-score)及胃左静脉直径是预测高危食管静脉曲张的最佳风险因子。根据肝硬化门静脉高压的病理生理机制,当侧枝循环出现后,肝内阻力并非门静脉高压的主要动力,内脏血管收缩和高动力循环状态是维持和导致门静脉压力进一步升高的主要因素 [16],由于胃左静脉内径是肝硬化食管静脉曲张的主要供血来源,随着胃左静脉管径增宽,肝硬化并发食管静脉曲张的风险增大 [17],胃左静脉内径在预测肝硬化食管静脉曲张方面较其他侧枝循环参数具有更高的参考价值。在过往的研究中 [18] [19],随着血小板计数的减低,肝硬化并发高危食管静脉曲张的概率随之增加,本研究中血小板计数在临床模型及结合模型中均不是最具代表性的高危食管静脉曲张预测因子,这可能与所收集的实验室数据距离影像学检查时的时间长短不一有关,在数据收集中发现部分病例在CT检查前的多次血常规检查中,虽未经过升血小板治疗,但是部分病人的血小板计数较初次入院时有一定升高,这可能是对研究结果造成影响的原因之一。
本研究具有一定的局限性。尽管本研究入组病例严格按照纳入和排除指标,但是由于高危食管静脉曲张患者的比例较大,可能会对研究人群带来一些潜在的偏差。此外,本研究的患者排除率较高,最终纳入的样本量较小,未能使用独立的样本对构建的模型进行外部验证,未来需要进一步扩大研究样本进行验证。
总之,本研究表明,结合影像组学特征和影像及血清学指标所构建的模型是一种有用的无创检测肝硬化患者高危食管静脉曲张的预测工具,可作为内窥镜检查评估肝硬化患者食管静脉曲张严重程度的补充。
基金项目
安徽医科大学校科研基金(编号2020xkj193)。
文章引用
陈 露,宫希军. CT影像组学预测肝硬化患者高危食管静脉曲张的价值
The Value of CT Radiomics in PredictingHigh Risk Esophageal Varices in Patientswith Liver Cirrhosis[J]. 临床医学进展, 2022, 12(12): 11600-11610. https://doi.org/10.12677/ACM.2022.12121672
参考文献
- 1. Takehara, T. and Sakamori, R. (2019) Remaining Challenges for the Noninvasive Diagnosis of Esophageal Varices in Liver Cirrhosis. Esophagus: Official Journal of the Japan Esophageal Society, 17, 19-24.https://doi.org/10.1007/s10388-019-00699-4
- 2. Hwang, J., Shergill, A.K.M., Acosta, R.D.M., et al. (2014) The Role of Endoscopy in the Management of Variceal Hemorrhage. Gastrointestinal Endoscopy, 80, 221-227.https://doi.org/10.1016/j.gie.2013.07.023
- 3. Solanki, S., Haq, K.F., Chakinala, R.C., et al. (2019) Inpatient Burden of Esophageal Varices in the United States: Analysis of Trends in Demographics, Cost of Care, and Outcomes. Annals of Translational Medicine, 7, Article No. 480. https://doi.org/10.21037/atm.2019.08.34
- 4. Garcia-Tsao, G., Abraldes, J.G., Berzigotti, A., et al. (2017) Portal Hypertensive Bleeding in Cirrhosis: Risk Stratification, Diagnosis, and Management: 2016 Practice Guidance by the American Association for the Study of Liver Diseases. Hepatology, 65, 310-335. https://doi.org/10.1002/hep.28906
- 5. Spiegel, B. (2003) Endoscopic Screening for Esophageal Varices in Cirrhosis: Is It Ever Cost Effective? Hepatology, 37, 366-377. https://doi.org/10.1053/jhep.2003.50050
- 6. Kovalak, M., Lake, J., Mattek, N., et al. (2007) Endoscopic Screening for Varices in Cirrhotic Patients: Data from a National Endoscopic Database. Gastrointestinal Endoscopy, 65, 82-88. https://doi.org/10.1016/j.gie.2006.08.023
- 7. Morisaka, H., Motosugi, U., Ichikawa, S., et al. (2015) Association of Splenic MR Elastographic Findings with Gastroesophageal Varices in Patients with Chronic Liver Disease. Journal of Magnetic Resonance Imaging, 41, 117-124.https://doi.org/10.1002/jmri.24505
- 8. Stefanescu, H., Allegretti, G., Salvatore, V., et al. (2017) Bidimensional Shear Wave Ultrasound Elastography with Supersonic Imaging to Predict Presence of Oesophageal Varices in Cirrhosis. Liver International, 37, Article No. 1405. https://doi.org/10.1111/liv.13418
- 9. Karagiannakis, D.S., Voulgaris, T., Koureta, E., et al. (2019) Role of Spleen Stiffness Measurement by 2D-Shear Wave Elastography in Ruling out the Presence of High-Risk Varices in Cirrhotic Patients. Digestive Diseases and Sciences, 64, 2653-2660. https://doi.org/10.1007/s10620-019-05616-4
- 10. de Franchis, R. (2015) Expanding Consensus in Portal Hypertension: Report of the Baveno VI Consensus Workshop: Stratifying Risk and Individualizing Care for Portal Hypertension. Journal of Hepatology, 63, 743-752.https://doi.org/10.1016/j.jhep.2015.05.022
- 11. 徐小元, 丁惠国, 贾继东, 等. 肝硬化门静脉高压食管胃静脉曲张出血的防治指南[J]. 临床肝胆病杂志, 2016, 32(2): 203-219.
- 12. 刘宏, 刘光耀, 周俊林. 肝硬化食管静脉曲张及出血风险影像学研究进展[J]. 磁共振成像, 2021, 12(9): 109-112.
- 13. Talwalkar, J.A., Yin, M., Venkatesh, S., et al. (2009) Feasibility of in Vivo MR Elastographic Splenic Stiffness Measurements in the Assessment of Portal Hypertension. AJR—The American Journal of Roentgenology, 193, 122-127.https://doi.org/10.2214/AJR.07.3504
- 14. Ma, X., Wang, L., Wu, H., et al. (2016) Spleen Stiffness Is Superior to Liver Stiffness for Predicting Esophageal Varices in Chronic Liver Disease: A Meta-Analysis. PLOS ONE, 11, e165786.https://doi.org/10.1371/journal.pone.0165786
- 15. 林译垦. 基于影像组学技术构建肝硬化高风险食管胃底静脉曲张的非侵入性预测模型[D]: [硕士学位论文]. 济南: 山东大学, 2021.
- 16. Turco, L. and Garcia-Tsao, G. (2019) Portal Hypertension: Pathogenesis and Diagnosis. Clinics in Liver Disease, 23, 573-587. https://doi.org/10.1016/j.cld.2019.07.007
- 17. 胡齐, 薛雁山, 王莉, 等. 肝硬化胃左静脉变化的MSCTA 初步研究[J]. 中国医学影像学杂志, 2009, 17(2): 114-117.
- 18. Liu, H., Chen, P., Jiang, B., et al. (2021) The Value of Platelet Parameters and Related Scoring System in Predicting Esophageal Varices and Collateral Veins in Patients with Liver Cirrhosis. Journal of Clinical Laboratory Analysis, 35, e23694. https://doi.org/10.1002/jcla.23694
- 19. Afsar, A., Nadeem, M., Shah, S.A.A., et al. (2021) Platelet Count Can Predict the Grade of Esophageal Varices in Cirrhotic Patients: A Cross-Sectional Study. F1000Research, 10, Article No. 101.https://doi.org/10.12688/f1000research.28005.1
NOTES
*通讯作者。
