Asian Case Reports in Oncology
Vol.4 No.01(2015), Article ID:14715,6 pages
DOI:10.12677/ACRPO.2015.41001
Clinical Observation of High Intensity Focused Ultrasound (HIFU) Ablation Combined with Qingyihuaji Formula for Salvage Treatment for Advanced Pancreatic Cancer Patients Failed to Systemic Chemotherapy
1Department of Hepato-Biliary and Pancreatic Oncology and Integrative Oncology, Fudan University, Shanghai Cancer Center, Minhang Branch, Shanghai
2Department of Integrative Oncology, Fudan University Shanghai Cancer Center, Department of Oncology, Shanghai Medical College, Fudan University, Shanghai
Email: *llm1010@613.com
Copyright © 2014 by authors and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY).
http://creativecommons.org/licenses/by/4.0/



Received: December 23rd, 2014; accepted: Jan. 7th, 2015; published: Jan. 16th, 2015
ABSTRACT
Objective: To evaluate the efficacy and toxicity of high intensity focused ultrasound (HIFU) for local ablation of pancreatic tumor combined with Qingyihuaji formula as the palliative treatment for advanced pancreatic cancer patients failed to systemic chemotherapy. Methods: 29 advanced pancreatic cancer patients who failed systemic chemotherapy accepted HIFU and Qingyihuaji formula treatment from January 2012 to December 2013. The occurrence of liver, retroperitoneal, and other parts of the metastasis in 23 cases, 6 cases of local advanced. The curative effects, the pain changes and toxicity were evaluated, and progression-free survival (PSF) and over survival (OS) were calculated from the date of follow-up. Results: All the 29 patients can receive the short-term efficacy evaluation. There were 3 cases of partial response (PR), 7 of stable disease (SD) and 19 of progressive disease (PR) with RR of 10.3% and DCR of 34.5%. The median PFS and OS were 2.5 and 8.1 months, respectively. 75% patients reported significant reductions in their pain levels. The KPS was 78.5 ( 6.4 after combination treatment, higher than 64.5 ( 4.2 before treatment. The major side effect was grade 1 - 2 gastrointestinal response. There were no marrow toxicities and serious complications such as gastrointestinal hemorrhage or perforation of gastrointestinal tract. Conclusion: HIFU for local ablation of pancreatic tumor combined with traditional Chinese medicine in the treatment of failure of chemotherapy in advanced pancreatic cancer is safe, effective, and light toxicity, worthy of further clinical study.
Keywords:Qingyihuaji Formula, High Intensity Focused Ultrasound (HIFU), Pancreatic Cancer

清胰化积方联合高强聚焦超声消融
治疗化疗失败晚期胰腺癌的临床疗效观察
何胜利1,沈 婕1,胡南华1,蔡芸芸1,孙贤俊1,刘鲁明2*
1复旦大学附属肿瘤医院闵行分院肝胆胰肿瘤中西医结合科,上海
2复旦大学附属肿瘤医院中西医结合科,上海
Email: *llm1010@613.com
收稿日期:2014年12月23日;录用日期:2015年1月7日;发布日期:2015年1月16日

摘 要
目的:研究高强度聚焦超声(HIFU)胰腺肿瘤局部消融联合清胰化积方治疗化疗失败的中晚期胰腺癌临床疗效观察。方法:采用HIFU联合清胰化积方治疗29例中晚期胰腺癌患者,其中发生肝、后腹膜淋巴结等部位转移23例,局部晚期6例。本研究主要观察联合治疗疗效、生存期、疼痛变化及并发症等情况。结果:29例患者均可进行近期疗效评估,部分缓解3例(10.3%),稳定7例(24.1%),进展19例(65.5%),有效率(RR)10.3% (3例),疾病控制率(DCR)为34.5%。中位无疾病进展时间(PFS)为2.8个月,中位总生存时间(OS)8.1个月。75%患者疼痛获得了不同程度的减轻。治疗后的KPS评分为78.5 ( 6.4,高于治疗前64.5 ( 4.2,差异有统计学意义(P < 0.05)。不良反应主要以1~2级消化道反应为主,未出现骨髓毒性、上消化道出血或胃肠穿孔等严重并发症。结论:HIFU联合中药治疗化疗失败的中晚期胰腺癌具有一定临床疗效、且毒副作用轻,值得临床进一步研究。
关键词
清胰化积方,高强聚焦超声,胰腺癌

1. 引言
吉西他滨作为晚期胰腺癌标准一线治疗已有20余年,获得中位生存期6个月,1年生存率为18% [1] ;近年来开展的两个Ⅲ期临床研究证实,奥沙利铂,伊立替康联合氟尿嘧啶和亚叶酸钙方案将中晚期胰腺癌患者提高生存率从6.8个月至11.1个月[2] ;白蛋白结合紫杉醇联合吉西他滨将中晚期胰腺癌患者的中位生存期由6.7个月提高到8.5个月[3] 。但对于一线治疗失败的晚期胰腺癌患者,目前尚无标准的治疗方
'法。近年来,临床研究证实以清胰化积方为主的中西医综合疗法在中晚期胰腺癌治疗中可稳定瘤灶,延缓疾病进展,延长患者生存期,药物不良反应少,使患者的生存质量得到改善,尤其对一些全身治疗失败的患者,显示出良好的临床疗效[4] 。
高强聚焦超声(High intensity focused ultrasound, HIFU)是近年发展起来的无创治疗肿瘤的新方法,它利用了超声声束的穿透性、可汇聚性、指向性好的特点,将体外低能量超声聚焦于体内肿瘤靶区处,致组织细胞发生凝固性坏死,达到热消融的目的[5] 。目前对于无法手术的中晚期胰腺癌的治疗,HIFU作为一种非侵入性治疗实体肿瘤的新技术,已被业界所瞩目。现将我院2012年1月~2013年12月期间,使用HIFU联合清胰化积方为主中药治疗的29例化疗失败的晚期胰腺癌病例临床疗效报告如下。
2. 资料与方法
2.1. 临床资料
组病例均为来自我科及肿瘤内科患者,经组织学或细胞学明确诊断诊断,既往接受过一线化疗或二线治疗失败的患者。自愿接受中药和HIFU治疗,签写治疗知情同意书。预计生存期大于3个月;其中男性19例,女性10例;年龄42~80岁,平均年龄58岁。ECOG评分6例为0、12例为1、13例为2;胰头癌13例,胰体、尾癌16例;局部晚期(III期)无法手术的6例,伴有远处转移的23例,主要转移部位为肝、腹膜后、肺等部位,之前接受过胆–肠吻合手术的7例(24.1%);14例患者CA199大于700 u,15例患者小于700 u;入组前仅接受过一线治疗9例,接受过二线治疗全身治疗有20例;入组时22例(75.9%)有不同程度的腹痛、腰背度疼痛,需要止痛药控制疼痛。
2.2. 临床诊断标准
腹部影响包括(CT, MRI, CT-PET)检查,或经手术证实胰腺肿瘤。伴或不伴有黄疸、消瘦、腹痛、上腹包块、腹泻等症状体征以及血清学CA199、CEA、CA72-4等升高。病理证实为胰腺上皮恶性肿瘤的。中医辨证标准:依据国家中医药管理局颁布的《中医病证诊断疗效标准》进行辨证分型。
2.3. 纳入标准
有明确的病理学或细胞学检查诊断;局部晚期无法行根治性手术或伴有转移;接受过一线或二线化疗,病情进展且一个月内未接受其他抗肿瘤治疗;伴有梗阻性黄疸经引流达到符合治疗要求;血常规、肝肾功能均正常;至少一个可测量的胰腺病灶且直径在2 cm以上。根据2010年UICC的TNM分期标准进行肿瘤分期;自愿接受局部HIFU消融术和中药治疗,入组治疗前,签署知情同意书。
2.4. 排除标准
服用中药不到一个疗程(不包括在此期间死亡者),临床资料记录或用药记录不完整者。育龄妇女在治疗期间计划受孕者;妊娠妇女治疗收益未超过对胎儿产生的可能危害者;哺乳期妇女在治疗期间计划哺乳者;肝肾功能不全,门脉主干癌栓;凝血功能障碍患者;发生心肌缺血或心肌梗死患者、心功能不全患者;发生心律失常或电解质紊乱,重度肝损害(Child-Pugh C级);预期寿命小于3个月患者,局部皮肤溃破;有精神疾患的;不能平卧的患者及腹腔内金属植入物;感染,不能进食;肠梗阻或不完全肠梗阻。
2.5. 应用设备、治疗参数及方法
应用上海爱申科技发展有限公司生产的HIFUNIT9000型高能聚焦超声(HIFU)肿瘤治疗机。治疗期间禁食易产气食物;术前一天晚8时后禁食、可饮水,术晨禁食水,治疗中以加热至20℃~25℃脱气自来水作为超声波传播介质,采用点点成线,线线成面,面面成体的累积方式治疗。以机载超声(频率:2.0 MHz~5.0 MHz)确定胰腺肿瘤位置、大小、边界,确定肿瘤治疗靶区。常用治疗参数:(1) 治疗时间(t1):指每次发射脉冲串的持续时间,为0.20 s;(2) 间隔时间(t2):指两次发射之间的间歇时间,为0.40 s;(3) t1:t2 = 1:2;(4) 单点次数:指完成一个点治疗需要的发射总次数,一般在30~60次,以40次居多。(5):声功率80~100 W;有效治疗深度2~18 cm;焦域范围3 mm × 3 mm × 10 mm。上述参数视瘤体大小、靶皮距及治疗时患者耐受度进行调整。定位仪器为意大利百盛超声诊断仪。治疗前用机载手持探头观察到瘤体全貌,行十字交叉定位法体表定位,测量靶皮距,再用机载探头定位。在0度和90度二个空间画框,确定治疗范围,进行治疗参数预置和治疗控制,并根据治疗中患者的耐受情况作适当调整。根据胰腺瘤体大小及数目采取一次或分次治疗。治疗选择从远场向近场逐层治疗,直至覆盖整个预定的治疗靶区。每疗程第一天开始,每天一次,连续5天为一疗程,28天重复。治疗全过程采用超声实时监控。
2.6. 中医辨证及中药治疗:
中药治疗:予以清胰化积方为基本方(清胰化积方组成:白花蛇舌草30 g、绞股蓝15 g、半枝莲30 g、蛇六谷15 g、豆蔻6、薏苡仁30、灵芝20 g),根据中医辨证出不同证型,适当用其他中药,最多不超过3味中药。每日一剂,水煎,早晚分服。连服3周为一疗程,休息1周重复下一疗程。
2.7. 疗效评价
治疗前及每两周期均行CT、MRI或CT-PET等影像学检查,每个周期治疗前后均检查血常规、尿常规、大便常规、潜血、肝肾功能及肿瘤标志物。按照RECIST1.1标准评价疗效,分为完全缓解(CR)、部分缓解(PR)、稳定(SD)和疾病进展(PD);以CR + PR计算有效率(RR)。以CR + PR + SD为疾病控制率(DCR)。按照VRS分级评估疼痛缓解程度,分为显效:疼痛减轻二级以上;有效:疼痛减轻一级;无效:疼痛未减轻、加重或虽有减轻但疗程中又回至原有程度及以上。根据NCI CTC 3.0版分级标准评价毒副作用,分为0~4级。
2.8. 随访情况
自入组治疗开始随访,随访至2013.12.31.无进展生存期(PFS)指从治疗开始到肿瘤进展或死亡时间;总生存期(OS)为从治疗至任何原因死完或末次随访的时间。
2.9. 统计分析
采用SPSS17.0版软件进行系统处理。PFS和OS分析采用Kaplan-Meier法,剂量资料采用t检验。以P < 0.05为差异有统计学意义。
3. 结果
3.1. 肿瘤控制情况
29例患者共完成85个疗程,平均为2.9个疗程。29例患者进行了疗效评价,无CR病例,其中获得PR 3例,SD 7例,PD 19例,RR为10.3%,DCR为34.5%.
3.2. 生存情况
29例完成随访,随访时间为5~18个月,随访率为100%。中位PFS为2.1个月,中位OS为8.1个月。见图1、图2。
3.3. 疼痛级生活质量改善
29例患者治疗前12例(41.4%)有不同程度的腹痛、腰背部疼痛均需要止痛药减轻疼痛。治疗后,9
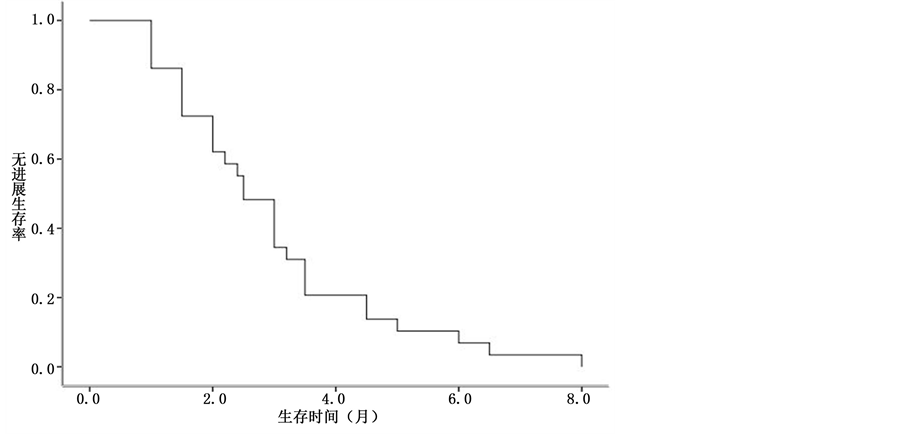
Figure 1. PFS of the treatment with combination of HIFU and Qingyihuaji Formula in advanced pancreatic cancer patients failed to systemic chemotherapy
图1. 清胰化积方联合HIFU治疗化疗失败的晚期胰腺癌患者的PFS
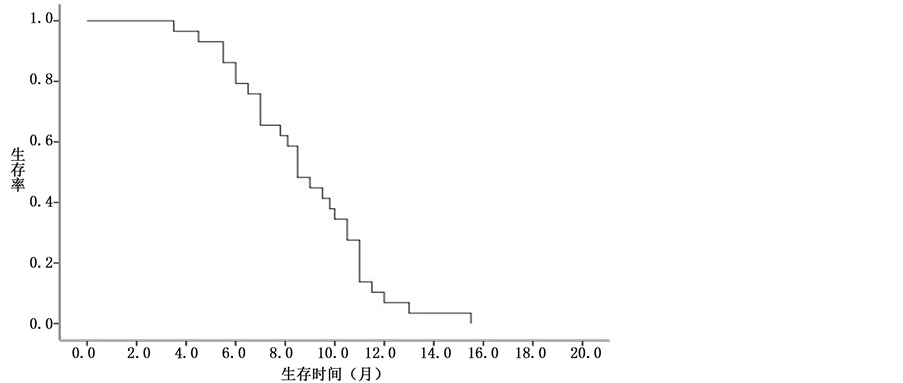
Figure 2. OS of the treatment with combination of HIFU and Qingyihuaji Formula in advanced pancreatic cancer patients failed to systemic chemotherapy
图2. 清胰化积方联合HIFU治疗化疗失败的晚期胰腺癌患者的OS
例(75%)患者上述疼痛症状减轻,其中4例停止运用任何止痛药,5例患者降低止痛药级别或减轻止痛药的使用剂量。治疗后止痛药的使用率为24.1% (7例),与治疗前比较具有统计学意义(P < 0.05)。治疗后的PS评分为78.5 ± 6.4,高于治疗前64.5 ± 4.2,差异有统计学意义(P < 0.05)。
3.4. 毒副作用
主要毒副反应主要为1~2级消化道不良反应,3例1~2级腹泻,1例恶心,2例1~2级胆红素升高,2例血淀粉酶轻度升高,未见3~4级毒副反应。无上消化道出血或胃肠穿孔等严重并发症,患者均无皮肤灼伤、发热、骨髓抑制等。
4. 讨论
胰腺癌无法手术切除患者预后非常差,缺乏有效治疗手段。对于以吉西他滨为主的一线方案治疗失败的患者,目前尚无大型随机对照临床研究报道二线治疗中化疗方案是否由于最佳支持治疗。即使目前推荐使用的厄罗替尼,也仅使胰腺癌患者中位生存提高了0.5个月[6] 。目前已报道的二线化疗方案,大部分为Ⅱ期临床试验,尚未进行广泛临床研究。其中以Vatalanib作为中晚期胰腺癌对吉西他滨化疗失败的二线治疗临床研究显示,6个月生存期仅为29%,中位进展时间仅为2个月,3/4度的不良反应发生率69% [7] 。对于化疗失败的患者,如何寻找一个有效且毒副作用较少的治疗方法是目前临床关注的焦点。
HIFU依据超声束可以聚焦且穿透体内固体组织,由此产生的能量可以通过热效应和空洞形成彻底地破坏并凝结肿瘤组织[8] 。HIFU治疗通过照射部位来凝结靶向病变,而不需要手术暴露及置入器具。借助实时监控,它可以对实体肿瘤进行适形无创治疗。动物实验和临床研究都已经证实,HIFU治疗通过皮肤摄入,可以选择性对原位病灶及转移灶进行靶向定位并毁灭肿瘤,达到治疗胰腺癌的目的[9] 。胰腺癌导致的疼痛大多为癌细胞浸润腹膜后神经丛所引起的神经原性疼痛以及肿瘤阻塞和压迫胰胆管所致的内脏性疼痛剧烈且顽固,严重影响患者的生活质量。因此,HIFU通过定向、实时监控实施局部肿瘤消融,对这部分患者尤为适合。孟志强等发现对晚期胰腺癌患者进行HIFU治疗后,患者先前存在的严重背部疼痛明显缓解,其随访影像学资料显示肿瘤的血供缺失及消融肿瘤缩小,认为HIFU消融是一种安全可行的胰腺肿瘤局部治疗方法[10] 。另一项中国的研究也显示了其在安全性及疼痛缓解方面的优势[11] 。
胰腺为腹膜后脏器,其周围有十二指肠环绕,周围有胃、十二指肠、结肠、等空腔脏器,超声无法穿透气体,另外,HIFU治疗容易引起周围上消化道系统出血、穿孔等严重并发症。另外,骨骼对声束的吸收、反射等影响,HIFU消融往往受限制于骨骼肿瘤或骨骼阻挡的部位肿瘤[12] 。因此,通道浅面的气体及肠道是HIFU治疗胰腺癌声通道上的主要障碍,通过术前的禁食、灌肠、促进肠道排气等肠道准备,并借助于水囊推挤声通道前方的肠道和气体已经较好的解决了这个问题;对于通过肝内或其他因为骨骼阻挡部位的肿瘤,未能进行HIFU局部消融。从本研究来看,所有的患者术后均未出现上消化道出血或穿孔等严重并发症,仅有2例出现淀粉酶的轻度异常,未经特别处理恢复正常,保证了胃肠道危险因素的安全性,未出现肋骨及其他部位的骨骼损伤。
以清胰化积方为主的中西医综合治疗对老年胰腺癌患者生存时间及生存质量有明显提高[13] 。KPS < 80、CA19-9 ≥ 500 U/ml、消瘦、肝转移是胰腺癌不良预后因子,而根治手术、全身化疗和清胰化积中药是长期生存保护因素。清胰化积方中主要成分:蛇六谷化痰散积、解毒消肿、行瘀化食为君;白花蛇舌草、半枝莲清热解毒、利湿消肿、活血止痛为臣;绞股蓝扶助正气、清热解毒、化痰抗癌为佐;白豆蔻化湿和胃、行气宽中为使。诸药合用,发挥清热解毒、化湿散结、理气行瘀之功效,使热毒湿邪得除,有邪去正安之效。清胰化积方为主的综合治理方案在晚期胰腺癌治疗中显示了明显的治疗优势,其1年,3年和5年生存率均明显高于目前国内外的报道,证实了该治疗模式的有效性,其中清胰化积方是一个独立的预后相关的因素,一方面验证了清胰化积方在胰腺癌综合治疗中的重要作用[2] 。同时,一项II临床研究提示:清胰化积中药与动脉灌注化疗、放疗联合治疗晚期胰腺癌具有协同作用,可延长患者生存期,改善临床受益率,并有可能提高治疗有效率,且不增加放化疗的不良反应[14] 。针对清胰化积方的抑制胰腺癌的机制研究发现,主要通过下调Ski表达起到抑制胰腺肿瘤的生长[15] 。
HIFU胰腺肿瘤局部消融联合清胰化积方治疗化疗失败的中晚期胰腺癌患者具有毒副反应轻,耐受性良好,性价比明显高于其他治疗。目前该方尚未完成制剂以适应大规模多中心临床试验。
基金项目
上海市第三批中医临床优势专科(肿瘤)建设项目(ZYSNXD-YL-YSZK025);上海市优秀青年中医临床人才培养计划项目(ZYSNXD011-RC-XLXX-2011027)。
参考文献 (References)
- [1] Burris 3rd, H.A., Moore, M.J., Andersen, J., et al. (1997) Improvements in survival and clinical benefit with gemcitabine as first-line therapy for patients with advanced pancreas cancer: A randomized trial. Journal of Clinical Oncology, 15, 2403-2413.
- [2] Conroy, T., Desseigne, F., Ychou, M., Bouche, O., Guimbaud, R., Becouarn, Y., et al. (2011) FOLFIRINOX versus gemcitabine for metastatic pancreatic cancer. The New England Journal of Medicine, 364, 1817-1825.
- [3] Von Hoff, D.D., Ervin, T., Arena, F.P., Chiorean, E.G., Infante, J., Moore, M., et al. (2013) Increased survival in pancreatic cancer with nab-paclitaxel plus gemcitabine. The New England Journal of Medicine, 369, 1691-1703.
- [4] 沈晔华, 刘鲁明, 孟志强, 等 (2009) 以清胰化积方为主的中西医综合治疗晚期胰腺癌64例生存分析. 中医杂志, 1, 39-42.
- [5] Lee, J.Y., Choi, B.I., Ryu, J.K., et al. (2011) Concurrent chemotherapy and pulsed high-intensity focused ultrasound therapy for the treatment of unresectable pancreatic cancer: Initial experiences. Korean Journal of Radiology, 12, 176-186.
- [6] Moore, M.J., Goldstein, D., Hamm, J., et al. (2007) Erlotinib plus gemcitabine compared with gemcitabine alone in patients with advanced pancreatic cancer: a phase III trial of the National Cancer Institute of Canada Clinical Trials Group. Journal of Clinical Oncology, 25, 1960-1966.
- [7] Dragovich, T., Laheru, D., Dayyani, F., et al. (2014) Phase II trial of vatalanib in patients with advanced or metastatic pancreatic adenocarcinoma after first-line gemcitabine therapy (PCRT O4-001). Cancer Chemotherapy and Pharmacology, 74, 379-387.
- [8] Wang, K., Chen, L., Meng, Z., et al. (2012) High intensity focused ultrasound treatment for patients with advanced pancreatic cancer: A preliminary dosimetric analysis. International Journal of Hyperthermia, 28, 645-652.
- [9] Orsi, F., Arnone, P., Chen, W., et al. (2010) High intensity focused ultrasound ablation: A new therapeutic option for solid tumors. Journal of Cancer Research and Therapeutics, 6, 414-420.
- [10] Gao, H.F., Wang, K., Meng, Z.Q., et al. (2013) High intensity focused ultrasound treatment for patients with local advanced pancreatic cancer. Hepatogastroenterology, 60, 1906-1910.
- [11] Wu, F., Wang, Z.B., Zhu, H., et al. (2005) Feasibility of US-guided high-intensity focused ultrasound treatment in patients with advanced pancreatic cancer: Initial experience. Radiology, 236, 1034-1040.
- [12] Yang, R., Sanghvi, N.T. and Rescorla, F.J. (1993) Liver cancer ablation with extracorporeal high intensity focused ultrasound. European Urology, 23, 17-22.
- [13] 刘鲁明 (2005) 胰腺癌的中西医综合治疗进展. 癌症进展杂志, 6, 551-555.
- [14] 沈晔华, 刘鲁明, 陈震, 等 (2010) 清胰化积中药联合动脉灌注化疗及放疗治疗无法手术切除胰腺癌患者41的临床研究. 中医杂志, 12, 1093-1097.

NOTES
*通讯作者。