Advances in Analytical Chemistry
Vol.06 No.03(2016), Article ID:18185,8
pages
10.12677/AAC.2016.63007
Review on Analysis of Related Structure Impurities in Synthetic Peptide Medicines
Songhui Chen1, Ming Li2*, Hongmei Li2, Yan Chen1
1Product Quality Supervising and Inspecting Institute of Taizhou City, China National Supervision & Testing Center of Fine Chemicals, Taizhou Jiangsu
2Division of Chemical Metrology & Analytical Science, National Institute of Metrology, Beijing

Received: Jul. 14th, 2016; accepted: Aug. 5th, 2016; published: Aug. 9th, 2016
Copyright © 2016 by authors and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY).
http://creativecommons.org/licenses/by/4.0/



ABSTRACT
Peptide medicines have been widely used because of the advantages of relatively low cost, high biological activity, low side effects, target specificity, etc. At present, the peptide drug market is growing twice as fast as other drug markets. Currently, most of the peptides are manufactured by solid-phase peptide synthesis. During synthesis and transportation process, related structure impurities such as amino acid deletion, amino acid insertion, incomplete removal of protecting groups, oxidation/reduction are easily generated. Many related structure impurities don’t have therapeutic effect; on the contrary they have toxic and side effect. In the paper, the analysis of related structure impurities in synthetic peptide medicines is systematically reviewed. This will be helpful to establish related regulation on quality control of medicine and improve quality of peptide medicine.
Keywords:Peptide Medicine, Impurity, Quality Control, Mass Spectrometry, Review

合成多肽药物中相关结构杂质分析综述
陈松辉1,李明2*,李红梅2,陈妍1
1国家精细化学品质量监督检验中心,泰州市产品质量监督检验所,江苏 泰州
2中国计量科学研究院,化学计量与分析科学研究所,北京

收稿日期:2016年7月14日;录用日期:2016年8月5日;发布日期:2016年8月9日

摘 要
多肽药物具有相对成本低、生物活性强、毒副作用小、作用靶点专一等优点,因而被广泛使用。目前,多肽药物市场的增速是其他药物市场增速的2倍。大多数的多肽药物是通过固相肽合成技术来获得。多肽药物在合成和储存过程,容易形成相关结构杂质,如氨基酸丢失、氨基酸插入、保护基残留、氧化/还原等。很多相关结构杂质不但没有药物疗效,反而具有毒副作用。本文系统地对合成多肽药物中相关结构杂质分析进行了综述,将有助于建立相关药物质量管理规范,最终提高多肽药物质量。
关键词 :多肽药物,杂质,质量控制,质谱,综述

1. 引言
多肽是氨基酸脱水缩合的反应产物。根据美国药典定义,氨基酸数量在40以下的缩合产物称为多肽;氨基酸数量大于40的缩合产物则需要考虑其空间结构,称为蛋白质。多肽易于人工合成和序列优化,可很快确定其药用价值。由于本身的特性,多肽从临床试验到获得美国食品药物监督管理局批准所需的时间比小分子药物短很多,而多肽药物通过临床试验的机率比小分子化合物要高两倍 [1] [2] 。与小分子化合物相比,多肽的半衰期一般较短,在体内容易被快速代谢;相对大分子蛋白或抗体类药物,多肽更稳定用量更少、单位活性也更高;与大分子蛋白相比,多肽化学合成技术成熟,易与杂质分离,纯度更高 [3] [4] ;另外,重组蛋白不能引入非天然氨基酸、很难在末端修饰、生产周期长、成本高。多肽比蛋白抗体类药物成本低,但比很多小分子药物的成本高,随着科技的进步,设备更新和工艺改善,多肽的合成成本和商业成本已经大幅度下降。这些优点使多肽在药物开发中具有特定的优势。
多肽的化学合成最初始于液相合成,但由于多肽液相合成的每一步都要进行纯化和分离,操作繁琐。1963年美国化学家Merrifield [5] 报道了用固相树脂作为载体合成四肽化合物(Leu-Ala-Gly-Val)的方法,标志着多肽固相合成时代的开始,推动了多肽固相合成的规模化生产。如今,多肽固相合成法已被广泛应用。在多肽合成和储存过程,容易形成相关结构杂质,如氨基酸丢失、氨基酸插入、去氨基化、降解产物等。很多相关结构杂质不但没有药物疗效,反而具有一定的毒副作用。因此,欧盟药典规定需对含量在0.5%以上的相关结构杂质进行定性分析,对含量在1%以上的相关结构杂质进行定量分析并考察其毒副作用。美国药典也有类似规定。本文系统综述了合成多肽药物中相关结构杂质分析进展,旨在推动我国建立与国际接轨的相关药物质量管理规范,最终提高生物医药产业中多肽药物产品质量。
2. 多肽固相合成
目前,大多数多肽药物是通过固相合成技术来获得。固相合成以连接在固相载体的首个氨基酸为起点,经脱保护基、活化、缩合耦连的循环过程,将氨基酸逐一连接直到获得目标序列多肽 [6] 。主要步骤如图1:a,将氨基保护的第一个氨基酸通过酯键固定到树脂上。b,脱保护基。c,将氨基保护的第二个氨基酸的羧基与固定在树脂上的第一个氨基酸的氨基进行脱水缩合,通过肽键将氨基酸逐个连接。d,将多肽从树脂上洗脱,并脱侧链保护基 [7] [8] 。
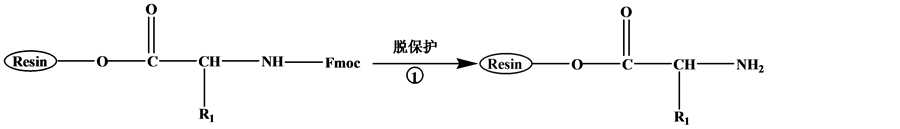
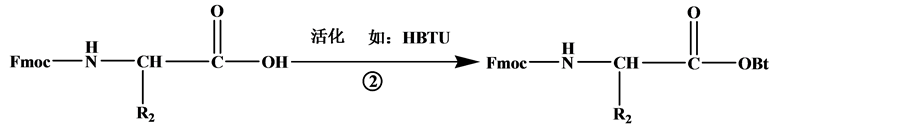
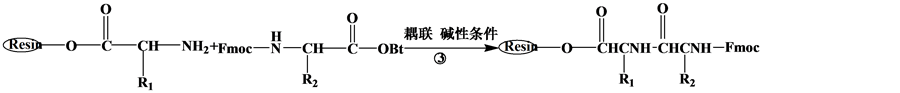



Figure 1. Solid phase peptide synthesis route
图1. 多肽固相合成线路
另外,加热、微波等辅助手段可加快反应速度、减少反应时间、提高合成效率 [9] [10] 。
3. 杂质类别
多肽药物在合成和储存过程,容易形成相关结构杂质 [11] ,如氨基酸丢失、氨基酸插入、保护基残留、氧化/还原、侧链修饰、末端修饰、聚集体等。
3.1. 氨基酸缺失
在多肽固相合成中,连接在树脂上的氨基酸保护基的不完全脱除或引入了未完全活化的氨基酸都会降低缩合反应效率,这将导致整个肽链缺失一个或多个氨基酸残基。在运输和储存过程中,也会产生少量降解产物,在N或C端缺失一个或多个氨基酸残基,也可归为氨基酸缺失的杂质 [12] 。Sanz-Nebot等人 [13] - [19] 采用质谱技术测量相关结构杂质的分子量,并通过与目标多肽的分子量差别来识别杂质的种类,研究了卡贝缩宫素、章鱼唾腺精、亮丙瑞林、戈舍瑞林和曲普瑞林等多肽中的杂质概况,均发现了氨基酸缺失的杂质。Taichrib等人 [20] 在合成激素替可沙肽过程中发现了许多截短了的杂质肽。作者通过计算获得N或C端截短了的替可沙肽杂质的理论分子量,采用反相C18色谱和毛细管电泳加上质谱技术检测替可沙肽中的杂质,将杂质的实验数据与理论分子量进行对此,从而确认杂质序列。
3.2. 氨基酸插入
在多肽固相合成中,为确保最大缩合效率,往往加入过量的氨基保护的氨基酸。然而,如果缩合反
应结束后,过量的反应物没有被完全冲走,就会造成额外的氨基酸插入到目标肽序列中。Sanz-Nebot等人 [13] - [19] 在研究卡贝缩宫素、依来多辛、醋酸亮丙瑞林、戈舍瑞林和曲普瑞林等多肽时,发现了许多氨基酸插入的杂质,通过杂质分子量与目标肽分子量的差别判断插入氨基酸的类型,但并没有进一步研究氨基酸插入的位置。De Spiegeleer等人 [21] 在研究肥胖抑制素时,发现了质量偏移 + 137.1的杂质,这是由于一个额外的组氨酸残基插入到目标肽序列中。Taichrib等人 [20] 研究替可沙肽时,发现了两个氨基酸插入的杂质,即 + YMS(质量数增加381)和 + SYSM (质量数增加468)。另外,还发现了截短的替可沙肽却插入一个额外的甘氨酸残基的杂质。Verbeke等人 [22] 也报道了一些氨基酸插入的杂质肽,例如插入甘氨酸残基。
3.3. 保护基残留
在多肽固相合成中,有时候不能完全去除保护基(氨基保护、侧链保护等),将导致保护基仍残留在目标肽中。Sanz-Nebot等人 [13] - [19] 发现了分子量比目标肽增加56的相关结构杂质,确认了样品中含有保护基(tBu和Fmoc)残留的杂质。在替可沙肽中,也发现了tBu和tBoc残留的杂质 [23] 。Verbeke等人 [22] 通过谷氨酸残基甲基化确定了多种保护基残留的杂质。
3.4. 氧化/还原
在多肽固相合成中,某些氨基酸残基易于发生氧化/还原反应。在卡比托辛和依来多辛粗产品中分别发现了半胱氨酸和蛋氨酸被氧化生成的杂质。相对于目标多肽,这些杂质的分子量增加了16、32和48,根据氧化程度,分别为亚砜、砜、磺酸。Taichrib等人 [20] 发现了替可沙肽的亚砜杂质。此外,Verbeke等人 [22] 报道了两个半胱氨酸残基被氧化为胱氨酸(质量数减少2)的杂质。组氨酸和赖氨酸也容易被氧化,分别形成2-氧代组氨酸和氨基脂肪酸 [24] [25] 。在储存过程中,长时间暴露在光和空气中也会生成氧化杂质。另一方面,色氨酸在酸性条件下很活泼,可被氧化生成羟基色氨酸,而犬尿氨酸,3-羟基犬尿氨酸,N-甲酰犬尿氨酸和羟基-N-甲酰犬尿氨酸可被还原 [15] [24] 。当多肽发生氧化反应时会产生活性氧 [26] ,包括自由基:超氧阴离子(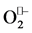 ),羟基(OH•),过氧化基(
),羟基(OH•),过氧化基(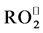 ),烷氧基(RO•)和超氧化氢基(
),烷氧基(RO•)和超氧化氢基( );中性分子:过氧化氢(H2O2),次氯酸(HClO),臭氧(O3),单线态氧(1O2);过氧亚硝基阴离子(ONOO−)。
);中性分子:过氧化氢(H2O2),次氯酸(HClO),臭氧(O3),单线态氧(1O2);过氧亚硝基阴离子(ONOO−)。
3.5. 非对映异构化
非对映异构化的机理可分为两种:烯醇化和噁唑酮反应机理,这两者都是碱性催化机理 [27] - [31] 。Fmoc保护的氨基酸在缩合步骤中采用烯醇化机理(图2(a)),即一个叔胺夺走a碳上的氢原子,在a碳上形成碳负离子 [32] ,质子可从平面两侧进攻,从而生成外消旋产物。Elsawy等人 [33] 合成AVPPhgY-NH2时,发现了苯甘氨酸(Phg)的外消旋化过程。另一种多肽合成路线,先活化羧基端(通常为酰卤活化),通过噁唑酮中间体发生外消旋化(图2(b))。为避免这种情况,合成反应通常从C端到N端,通过键合羧基活化的游离氨基酸来完成,而不是采用增长肽链的方式 [34] 。
Finder等人 [35] 发现重组的β-淀粉肽(Aβ1-42)的聚集速率比其合成样品更快。为探索重组样品与合成样品之间的差别,作者利用制备色谱、在相同的分离条件下分别将重组肽和合成肽进行纯化。氨基酸分析结果表明,相对于无非对映异构化的重组肽,合成肽中存在1.01%的D型组氨酸残基、0.14%的D型精氨酸残基和0.10%的D型蛋氨酸残基。β-淀粉肽中含有三个组氨酸、一个蛋氨酸和一个精氨酸,合成样品中大约有3.5%的非对映体杂质。此外,相比于无非对映异构化的重组肽,这些非对映异构体杂质改变了聚集的动力学过程。即使是少量的异构体杂质,甚至只有一个氨基酸异构化,也会极大影响整体的生物学功能。此外,常用的高效液相色谱并不能够将这些非对映异构体杂质与主成分完全分离。
 (a)
(a)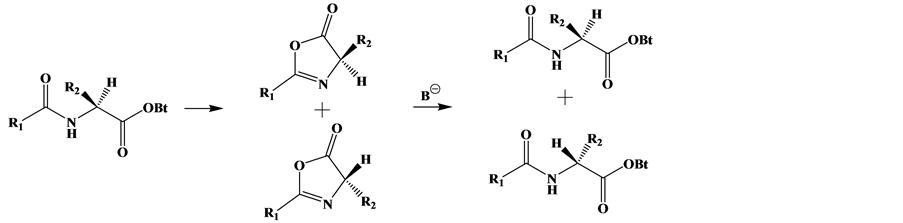 (b)
(b)
Figure 2. (a) Mechanism of enolization; (b) mechanism of oxazolone
图2. (a) 烯醇化机理;(b) 噁唑酮机理
Sanz-Nebot等人 [13] - [19] 报道了卡贝缩宫素、依来多辛、醋酸亮丙瑞林、戈舍瑞林和曲普瑞林肽中非对映异构化的杂质,但没有确认异构化的准确位置。
3.6. 侧链修饰杂质
3.6.1. 去氨基化产物
天冬酰胺和谷氨酰胺等两种碱性氨基酸侧链含有氨基,在多肽合成和储存过程中,易失去氨基、增加羟基,从而形成去氨基化的产物,机理如图3。
由于-CONH2转换为-COOH,去氨基化产物的分子量增加1。De Spiegeleer等 [21] 和Lai等 [36] 在研究狗和鼠的肥胖抑制素时,发现了去氨基化杂质。日本国家计量院 [37] 在研制C肽标准物质过程中,发现了去氨基化C肽,但没有对去氨基化位点进行深入研究。
3.6.2. 其他
使用氨基酸活化剂N,N’-二异丙基碳二亚胺时,组氨酸残基易发生侧链反应,产生分子量+126的取代胍。使用二甲基甲酰胺试剂时,易形成二甲胺衍生物。另外,戈舍瑞林的研究中,发现了多种精氨酸残基侧链修饰的杂质 [37] 。另外,丝氨酸残基的侧链乙酰化也是一种常见的侧链修饰 [38] 。
3.7. 末端修饰杂质
N端为谷氨酰氨的多肽在储存过程中,当温度高于4˚C时,易脱水发生焦谷氨酰化,其机理如图4。日本国家计量院 [37] 在研制C肽标准物质过程中,发现了焦谷氨酰化的杂质。
另外,N端的乙酰化也是一种常见的末端修饰。
3.8. 聚集体
多肽聚集可分为共价和非共价两种,其形成的程度取决于各种环境因素。共价聚集体通常由两个单体通过酰胺键、二硫键形成。非共价聚集体是疏水作用、静电作用等弱相互作用的结果。通常非共价聚
 (a)
(a)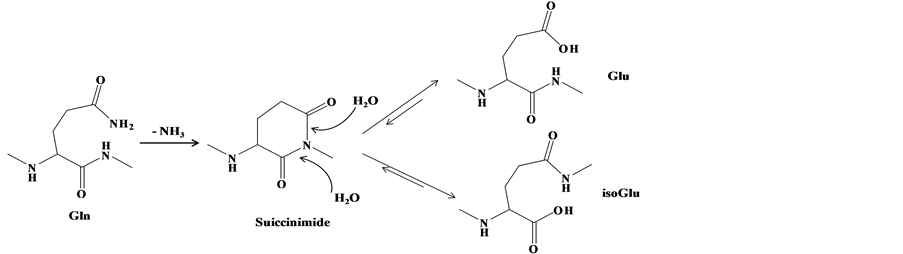 (b)
(b)
Figure 3. (a) Mechanism of asparagine deamidation; (b) mechanism of glutamine deamidation
图3. (a) 天冬酰胺去氨基化机理;(b) 谷氨酰胺去氨基化机理
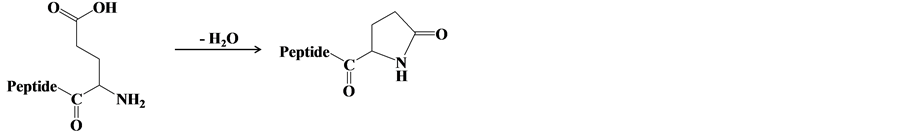
Figure 4. Mechanism of pyroglutamylation
图4. 焦谷氨酰化机理
集体与其单体之间存在平衡转换。这种平衡受样品浓度和溶剂性质(如pH)影响 [39] [40] 。De Spiegeleer等人 [21] 利用尺寸排阻色谱–质谱技术研究肥胖抑制素时,发现了二聚体杂质。
4. 结论
在多肽药物的合成、储存及运输过程中,会产生多种类型的相关结构杂质。存在于多肽药物中的相关结构杂质会影响其生物功能及药效。因此,在药物研发阶段和临床使用过程中,相关结构杂质分析及控制是需要考虑的重要因素之一。现有的文献报道,多肽药物中杂质分析通常利用分子量的变化推测可能的氨基酸序列及修饰,而对氨基酸插入、去氨基化等修饰位点的研究较少。作者认为,开发对多肽药物中杂质序列及修饰的准确分析方法至关重要,串联质谱技术及高分辨质谱技术的发展将在多肽药物中杂质分析领域发挥重要作用。
基金项目
国家国际科技合作专项(2014DFA31810)。
文章引用
陈松辉,李 明,李红梅,陈 妍. 合成多肽药物中相关结构杂质分析综述
Review on Analysis of Related Structure Impurities in Synthetic Peptide Medicines[J]. 分析化学进展, 2016, 06(03): 43-50. http://dx.doi.org/10.12677/AAC.2016.63007
参考文献 (References)
- 1. Sun, J., Chen, X., Deng, C., et al. (2007) Direct Formation of Giant Vesicles from Synthetic Polypeptides. Langmuir, 23, 8308-8315. http://dx.doi.org/10.1021/la701038f
- 2. Nestor Jr., J.J. (2009) The Medicinal Chemistry of Peptides. Current Medicinal Chemistry, 16, 99-4418. http://dx.doi.org/10.2174/092986709789712907
- 3. Vlieghe, P., Lisowski, V., Martinez, J., et al. (2010) Synthetic the Rapeutic Peptides: Science and Market. Drug Discovery Today, 15, 40-56. http://dx.doi.org/10.1016/j.drudis.2009.10.009
- 4. Craik, D.J., Fairlie, D.P., Liras, S., et al. (2013) The Future of Peptide Based Drugs. Chemical Biology & Drug Design, 81, 136-147. http://dx.doi.org/10.1111/cbdd.12055
- 5. Merrifield, R.B. (1963) Solid Phase Peptide Synthesis I: The Synthesis of a Tetrapeptide. Journal of the American Chemical Society, 85, 2149-2154. http://dx.doi.org/10.1021/ja00897a025
- 6. Tamura, K. and Alexander, R.W. (2004) Peptide Synthesis through Evolution. Cellular and Molecular Life Sciences, 61, 1317-1330. http://dx.doi.org/10.1007/s00018-004-3449-9
- 7. Amblard, M., Fehrentz, J.A., Martinez, J., et al. (2006) Methods and Protocols of Modern Solid Phase Peptide Synthesis. Molecular Biotechnology, 33, 236-254. http://dx.doi.org/10.1385/MB:33:3:239
- 8. Isidro-Llobet, A., Alvarez, M. and Albericio, F. (2009) Amino Acid-Protecting Groups. Chemical Reviews, 109, 2455- 2504. http://dx.doi.org/10.1021/cr800323s
- 9. Santagada, V., Frecentese, F., Perissutti, E., et al. (2009) Microwave Assisted Synthesis: A New Technology in Drug Discovery. Mini-Reviews in Medicinal Chemistry, 9, 340-358. http://dx.doi.org/10.2174/1389557510909030340
- 10. Bacsa, B., Desai, B., Dibo, G., et al. (2006) Rapid Solid-Phase Peptide Syn-thesis Using Thermal and Controlled Microwave Irradiation. Journal of Peptide Science, 12, 633-638. http://dx.doi.org/10.1002/psc.771
- 11. D’Hondt, M., Bracke, N., Taevernier, L., et al. (2014) Related Impurities in Peptide Medicines. Journal of Pharmaceutical and Biomedical Analysis, 101, 2-30. http://dx.doi.org/10.1016/j.jpba.2014.06.012
- 12. Marder, O. and Albericio, F. (2003) Industrial Application of Coupling Reagents in Peptides. Chimica Oggi, 6, 35-40.
- 13. Sanz-Nebot, V., Benavente, F., Toro, I., et al. (2004) Separation and Characterization of Complex Crude Mixtures Produced in the Synthesis of Therapeutic Peptide Hormones by Liquid Chromatography Coupled to Electrospray Mass Spectrometry (LC-ES-MS). Analytica Chimica Acta, 521, 25-36. http://dx.doi.org/10.1016/j.aca.2004.05.041
- 14. Sanz-Nebot, V., Benavente, F., Toro, I., et al. (2003) Liquid Chromatography-Mass Spectrometry Approach for the Characterisation and Purification of Crude Synthetic Peptide Hormones. Analytical and Bioanalytical Chemistry, 377, 306-315. http://dx.doi.org/10.1007/s00216-003-2104-x
- 15. Sanz-Nebot, V., Benavente, F., Toro, I., et al. (2002) Liquid Chromatography Mass Spectrometry and Capillary Electrophoresis Combined Approach for Separation and Characterization of Multicomponent Peptide Mixtures Applications to Crude Products of Leuprolide Synthesis. Journal of Chromatography A, 950, 99-111. http://dx.doi.org/10.1016/S0021-9673(02)00025-0
- 16. Sanz-Nebot, V., Benavente, F., Castillo, A. and Barbosa, J. (2000) Liquid Chromatography-Electrospray Mass Spectrometry of Multicomponent Peptide Mixtures, Characterization of a Mixture from the Synthesis of the Hormone Goserelin. Journal of Chromatography A, 889, 119-133. http://dx.doi.org/10.1016/S0021-9673(00)00394-0
- 17. Sanz-Nebot, V., Benavente, F. and Barbosa, J. (2000) Separation and Char-acterization of Multicomponent Peptide Mixtures by Liquid Chromatography Electrospray Ionization Mass Spectrometry, Applications to Crude Products of the Synthesis of Leuprolide. Journal of Chromatography A, 870, 315-334. http://dx.doi.org/10.1016/S0021-9673(99)01088-2
- 18. Sanz-Nebot, V., Toro, I., Garcés, A. and Barbosa, J. (1999) Separation and Identification of Peptide Mixtures in a Synthesis Crude of Carbetocin by Liquid Chromatography-Electrospray Ionization Mass Spectrometry. Rapid Communications in Mass Spectrometry, 13, 2341-2347. http://dx.doi.org/10.1002/(SICI)1097-0231(19991215)13:23<2341::AID-RCM795>3.0.CO;2-9
- 19. Sanz-Nebot, V., Toro, I., Cas-tillo, A. and Barbosa, J. (2001) Investigation of Synthetic Peptide Hormones by Liquid Chromatography Coupled to Pneumatically Assisted Electrospray Ionization Mass Spectrometry: Analysis of a Synthesis Crude of Peptide Triptorelin. Rapid Communications in Mass Spectrometry, 15, 1031-1039. http://dx.doi.org/10.1002/rcm.343
- 20. Taichrib, A., Scriba, G.K.E. and Neusü, C. (2011) Identification and Characterization of Impurities of Tetracosactide by Capillary Electrophoresis and Liquid Chromatography Coupled to Time-of-Flight Mass Spectrometry. Analytical and Bioanalytical Chemistry, 401, 1365-1375. http://dx.doi.org/10.1007/s00216-011-5183-0
- 21. De Spiegeleer, B., Vergote, V., Pezeshki, A., Peremans, K. and Burvenich, C. (2008) Impurity Profiling Quality Control Testing of Synthetic Peptides Using Liquid Chromatography-Photodiode Array-Fluorescence and Liquid Chromatography-Electrospray Ionization-Mass Spec-trometry: The Obestatin Case. Analytical Biochemistry, 376, 229-234. http://dx.doi.org/10.1016/j.ab.2008.02.014
- 22. Verbeke, F., Wynendaele, E., Braet, S., D’Hondt, M. and De Spiegeleer, B. (2015) Quality Evaluation of Synthetic Quorum Sensing Peptides Used in R&D. Journal of Pharmaceutical Analysis, 5, 169-181. http://dx.doi.org/10.1016/j.jpha.2014.12.002
- 23. Isidro-Llobet, A., Just-Baringo, X., Ewenson, A., Álvarez, M. and Albericio, F. (2007) Fmoc-2-mercaptobenzothiazole, for the Introduction of the Fmoc Moiety Free of Side-Reactions. Peptide Science, 88, 733-737. http://dx.doi.org/10.1002/bip.20732
- 24. Ji, J.A., Zhang, B., Cheng, W. and John Wang, Y. (2009) Methionine, Tryptophan, and Histidine Oxidation in a Model Protein, PTH: Mechanisms and Stabilization. Journal of Pharmaceutical Sciences, 98, 4485-4500. http://dx.doi.org/10.1002/jps.21746
- 25. Uchida, K. (2003) Histidine and Lysine as Targets of Oxidative Modification. Amino Acids, 25, 249-257. http://dx.doi.org/10.1007/s00726-003-0015-y
- 26. Dalle-Donne, I., Rossi, R., Giustarini, D., Milzani, A. and Colombo, R. (2003) Protein Carbonyl Groups as Biomarkers of Oxidative Stress. Clinica Chimica Acta, 329, 23-38. http://dx.doi.org/10.1016/S0009-8981(03)00003-2
- 27. Palasek, S.A., Cox, Z.J. and Collins, J.M. (2007) Limiting Racemization and Aspartimide Formation in Micro-Wave Enhanced Fmoc Solid Phase Peptide Synthesis. Journal of Peptide Science, 13, 143-148. http://dx.doi.org/10.1002/psc.804
- 28. Loffrendo, C., Assuncão, N.A., Gerhardt, J. and Miranda, M.T.M. (2009) Microwave Assisted Solid-Phase Peptide Synthesis at 60˚C: Alternative Conditions with Low Enantiomerization. Journal of Peptide Science, 15, 808-817. http://dx.doi.org/10.1002/psc.1178
- 29. Souza, M.P., Tavares, M.F.M. and Miranda, M.T.M. (2004) Racemization in Stepwise Sol-id-Phase Peptide Synthesis at Elevated Temperatures. Tetrahedron, 60, 4671-4681. http://dx.doi.org/10.1016/j.tet.2004.03.070
- 30. Han, Y., Albericio, F. and Barany, G. (1997) Occurrence and Minimization of Cys-teine Racemization during Stepwise Solid-Phase Peptide Synthesis. The Journal of Organic Chemistry, 62, 4307-4312. http://dx.doi.org/10.1021/jo9622744
- 31. Angell, Y., Alsina, J., Albericio, F. and Barany, G. (2002) Practical Protocols for Stepwise Solid-Phase Synthesis of Cysteine-Containing Peptides. The Journal of Peptide Research, 60, 292-299. http://dx.doi.org/10.1034/j.1399-3011.2002.02838.x
- 32. Kaiser, T., Nicholson, G., Kohlbau, H. and Voelter, W. (1996) Racemization Studies of Fmoc-Cys(Trt)-OH during Stepwise Fmoc-Solid Phase Peptide Synthesis. Tetrahedron Letters, 37, 1187-1190. http://dx.doi.org/10.1016/0040-4039(95)02406-9
- 33. Elsawy, M.A., Hewage, C. and Walker, B. (2012) Racemization of N-Fmoc Phenylglycine under Mild Microwave- SPPS and Conventional Stepwise SPPS Conditions: Attempts to Develop Strategies for Overcoming This. Journal of Peptide Science, 18, 302-311. http://dx.doi.org/10.1002/psc.2398
- 34. Montalbetti, C.A.G.N. and Falque, V. (2005) Amide Bond Formation and Peptide Coupling. Tetrahedron, 61, 10827- 10852. http://dx.doi.org/10.1016/j.tet.2005.08.031
- 35. Finder, V.H., Vodopivec, I., Nitsch, R.M. and Glockshuber, R. (2010) The Recom-binant Amyloid-β Peptide Aβ1-42 Aggregates Faster and Is More Neurotoxic than Synthetic Aβ1-42. Journal of Molecular Biology, 396, 9-18. http://dx.doi.org/10.1016/j.jmb.2009.12.016
- 36. Lai, M.C. and Topp, E.M. (1999) Solid-State Chemical Stability of Proteins and Peptides. Journal of Pharmaceutical Sciences, 88, 489-500. http://dx.doi.org/10.1021/js980374e
- 37. Kinumi, T., Goto, M., Eyama, S., Kato, M., Kasama, T. and Takatsu, A. (2012) Development of SI-Traceable C-Pep- tide Certified Reference Material NMIJ CRM 6901-a Using Isotope-Dilution Mass Spectrometry-Based Amino Acid Analyses. Analytical and Bioanalytical Chemistry, 404, 13-21. http://dx.doi.org/10.1007/s00216-012-6097-1
- 38. Litowski, J.R., Semchuk, P.D., Mant, C.T. and Hodges, R.S. (1999) Hydrophilic Interaction/Cation-Exchange Chromatography for the Purification of Synthetic Peptides from Closely Related Impurities: Serine Side-Chain Acetylated Peptides. The Journal of Peptide Research, 54, 1-11. http://dx.doi.org/10.1034/j.1399-3011.1999.00066.x
- 39. Cromwell, M.E.M., Hilario, E. and Jacobson, F. (2006) Protein Aggregation and Bioprocessing. The AAPS Journal, 8, E572-E579. http://dx.doi.org/10.1208/aapsj080366
- 40. Liu, S., Zhou, L., Chen, L., et al. (2008) Effect of Structural Parameters of Peptides on Dimer Formation and Highly Oxidized Side Products in the Oxidation of Thiols of Linear Analogues of Human β-Defensin 3 by DMSO. Journal of Peptide Science, 15, 95-106. http://dx.doi.org/10.1002/psc.1100