Advances in Clinical Medicine
Vol.06 No.03(2016), Article ID:18427,7
pages
10.12677/ACM.2016.63020
Construction of a Lentiviral Vector Harboring Dominant-Negative Mutant of Growth Hormone Receptor for Tibet Minipigs
Junshuang Jia1, Xiaolin Lin1, Dong Xiao1,2, Wei Liu2*
1Cancer Research Institute, Southern Medical University, Guangzhou Guangdong
2Institute of Comparative Medicine and Laboratory Animal Center, Southern Medical University, Guangzhou Guangdong

Received: Aug. 3rd, 2016; accepted: Aug. 27th, 2016; published: Aug. 30th, 2016
Copyright © 2016 by authors and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY).
http://creativecommons.org/licenses/by/4.0/



ABSTRACT
Objective: To generate lentiviral vector harboring the dominant-negative mutant of porcine growth hormone receptor, and in vitro confirm the functionality of the resulting plasmid. Methods: Firstly, CAG promoter was amplified from pRLG3A, and subsequently subcloned into pCD550A-1 at the Cla I/BamH I sites by In-Fusion cloning, designated pCAGGP, as verified by restriction enzyme digestion and sequencing. Secondly, the fragment of dominant-negative mutant of growth hormone receptor (dnGHR) was amplified from liver cDNA of Tibet minipig, and then inserted into pCAGGP at the multiple cloning site (MCS) by In-Fusion cloning to generate pCdnGGP, as verified by restriction enzyme digestion and sequencing. To in vitro confirm the functionality of the resulting plasmid (pCdnGGP), pCdnGGP was transiently transfected into 293T cells to produce lentiviurs LV- CdnGGP, and LV-CdnGGP was used to infect pig embryonic fibrolast (PEFs), followed by EGFP assay under inverted fluorescence microscope and detecting dnGHR transgene expression by RT-PCR. Results: Enzyme digestion and DNA sequencing demonstrated that pCdnGGP was successfully constructed. 293T cells transiently transfected with pCdnGGP and PEFs infected by LV-CdnGGP displayed the green fluorescence under inverted fluorescence microscope and the increased expression of dnGHR. Conclusion: The lentiviral vector harboring pig dnGHR gene was successfully constructed, which will lay a solid foundation for further research.
Keywords:Tibet Minipigs, GHR, Dominant-Negative Mutant, EGFP, Lentivirus Vector

过表达西藏小型猪GHR显负性突变体的慢病毒载体构建及其功能验证
贾俊双1,林晓琳1,肖东1,2,刘薇2*
1南方医科大学肿瘤研究所,广东 广州
2南方医科大学比较医学研究所暨实验动物中心,广东 广州

收稿日期:2016年8月3日;录用日期:2016年8月27日;发布日期:2016年8月30日

摘 要
目的:构建过表达西藏小型猪GHR基因显负性突变体的慢病毒载体,并对其进行功能验证。方法:首先以pRLG3A为模板,PCR扩增CAG启动子,In-Fusion克隆至Cla I/BamH I双酶切的pCD550A-1载体中,替换其EF1α启动子,获得pCAGGP;然后从西藏小型猪肝脏组织cDNA中PCR扩增GHR基因的显负性突变体片段(dnGHR);最后将dnGHR片段插入pCAGGP多克隆位点,最终得到过表达猪GHR显负性突变体的慢病毒载体pCdnGGP。对所构建的质粒进行测序和酶切鉴定。将所构建的pCdnGGP载体转染293T细胞,并将包装好的慢病毒感染猪的胚胎成纤维细胞(PEFs),倒置荧光显微镜检测GFP表达,收集细胞并提取总RNA检测dnGHR基因在293T细胞和PEFs中的表达,以对pCdnGGP进行体外功能验证。结果:测序和酶切证实成功构建了pCdnGGP。pCdnGGP转染293T细胞以及病毒感染PEFs之后,倒置荧光显微镜下可见绿色荧光,RT-PCR检测证实dnGHR在293T细胞和PEFs中均能正常表达。结论:成功构建过表达猪GHR基因显负性突变体的慢病毒载体,为相关后续研究打下了良好基础。
关键词 :西藏小型猪,GHR,显负性突变体,EGFP,慢病毒载体

1. 前言
小型猪在解剖、生理生化、心血管系统、消化系统、皮肤系统、骨骼发育、营养代谢等方面与人有较大的相似性,用小型猪作为医学实验动物模型近年来呈越来越普遍的趋势,目前小型猪已广泛应用于心血管疾病、糖尿病、皮肤烧伤、外科、牙科、肿瘤、血液病、遗传病、营养代谢病、新药安全性评价等生物医学研究的多个方面 [1] - [4] 。
西藏小型猪是由南方医科大学实验动物中心顾为望教授等人于2004年由西藏自治区引种至广州培育而成的小型猪品系,在近几年,已基于其建立了几种转基因动物模型 [5] - [7] 。其具有抗感染能力强、抗逆性好、耐粗饲、体型小、被毛黑而粗的特点。其成年体重在40 kg左右,若能培育出体型更小的微型化西藏小型猪,将大大增加其在生物医学研究中的应用。
生长激素受体(Growth hormone receptor, GHR)是一种由单一基因编码的跨膜蛋白,是细胞因子受体超家族成员之一。GHR在动物生长发育及新陈代谢中发挥重要作用,GHR功能缺失会导致动物生长发育迟缓 [8] - [10] 。显负性突变体技术是一种过表达某种蛋白的显负性突变体,使其与正常的蛋白发生竞争性抑制,从而实现某种蛋白功能缺失的技术。目前已有研究者通过在五指山小型猪过表达GHR基因的显负性突变体制备了GHR功能缺失的转基因猪,并发现过表达GHR显负性突变体的转基因五指山小型的体型较野生型猪要小 [11] 。
本研究拟构建过表达西藏小型猪GHR显负性突变体的慢病毒载体,并对其进行功能验证,以为制备微型化的西藏小型猪奠定基础。
2. 材料与方法
2.1. 材料与试剂
2.1.1. 载体
载体pRLG3A由美国科学家Manuela Martins-Green教授惠赠 [12] ,慢病毒载体pCDH-EF1-MCS-BGH- PGK-GFP-T2A-Puro (pCD550A-1)购自System Biosciences (SBI)公司。慢病毒包装质粒psPAX2和pMD2.G由瑞士Didier Trono博士惠赠。
2.1.2. 主要试剂
Trizol裂解液RNAiso Plus (Code No. D9108)、逆转录试剂盒PrimeScript®RT reagent Kit (Code No. DRR037A)、PCR扩增试剂PrimeSTAR®HS DNA Polymerase (Code No. DR010S)、胶回收试剂盒Agarose Gel DNA Purification Kit Ver.2.0 (Code No. DV805)、DNA克隆试剂In-Fusion®HD Cloning Kit (Clontech Code No. 639633)、dNTP和Taq酶等购自大连TaKaRa公司,质粒小提试剂盒购自天根公司,质粒大提试剂盒购自QIAGEN公司,限制性内切酶购自大连TaKaRa公司;脂质体转染剂Lipofectamine 2000、高糖DMEM、Opti-MEM Medium和DMSO等购自Invitrogen公司;培养瓶及培养板等购自Corning公司;其余试剂为国产或进口化学纯或分析纯。
2.1.3. 细胞
293T细胞来源和培养方法等参见文献 [13] ,西藏小型猪胚胎成纤维细胞(PEFs)的分离和培养参见文献 [14] 。以上细胞所用培养基为含10%胎牛血清的DMEM。
2.2. 方法
2.2.1. 构建过表达猪GHR显负性突变体的慢病毒载体pCdnGGP
首先以质粒pRLG3A为模板,PCR扩增CAG启动子(1740 bp),In-Fusion克隆至Cla I/BamH I双酶切的pCDH-EF1-MCS-BGH-PGK-GFP-T2A-Puro载体(回收其中的7980 bp片段)中,替换其EF1α启动子,获得pCAG-MCS-BGH-PGK-GFP-T2A-Puro (pCAGGP) (9720 bp);然后从西藏小型猪肝脏组织cDNA中PCR扩增GHR基因的显负性突变体片段(dnGHR) (GHR基因第1~7号外显子,在7号外显子后引入3’-aaggaaaattag-5’终止序列,共888 bp) [11] ,克隆进pMD18-T-simple,获得pMD18-dnGHR-C1;最后,从pMD18-dnGHR-C1载体中PCR扩增dnGHR片段,插入pCAGGP多克隆位点,最终得到过表达猪GHR显负性突变体的慢病毒载体pCAG-dnGHR-BGH-PGK-GFP-T2A-Puro (pCdnGGP) (10,608 bp)。对每一步所构建的质粒进行测序和酶切鉴定。
2.2.2. pCdnGGP体外功能验证
借助LipofectamineTM 2000将pCdnGGP和对照载体pCD550A-1转染入293T细胞,进行慢病毒LV-CdnGGP和LV-con包装,用包装好的慢病毒LV-CdnGGP和LV-con感染PEFs,慢病毒包装和感染的方法参见文献 [13] ,使用嘌呤霉素对感染后的细胞进行筛选,直到筛选到GFP全阳性的PEFs。在转染48小时和病毒感染后96小时以及嘌呤霉素筛选7天后,倒置荧光显微镜检测GFP表达,从生产慢病毒时转染了pCdnGGP、pCD550A-1的293T细胞以及嘌呤霉素筛选完成后的LV-CdnGGP和LV-con感染的PEFs中提取总RNA,进行逆转录,RT-PCR检测细胞中dnGHR基因表达,以对载体pCdnGGP进行体外功能验证。RT-PCR所用的引物为pdnGHR-F:GATCCACCCATTGGCCTCAA,pdnGHR-R:CATCTGCAT TGGGAGGTGGT,dnGHR的PCR产物为100 bp;猪GAPDH引物为:pGAPDH-F:TTGGCTACAGCAACA GGG,pGAPDH-R:CTGGGATGGAAACTGGAAGT,产物大小为186 bp;人GHPDH引物为:hGAPDH-F:ACCCAGAAGACTGTGGATGG,hGAPDH-R:TCTAGACGGCAGGTCAGGTC,产物大小为200 bp。PCR反应中以上三对引物均设置60℃退火温度,30个循环。
3. 结果
3.1. 慢病毒表达载体pCdnGGP构建和鉴定
所需构建的载体pCdnGGP的结构示意图如图1(a)所示,pCdnGGP载体构建分三步进行。
3.1.1. 西藏小型猪GHR基因显负性突变体的扩增
从两份西藏小型猪肝脏组织cDNA样品中成功扩增GHR基因编码区(1718 bp),并进行测序,两个样品的测序结果一致。设计PCR引物将GHR基因编码区前876 bp片段(第1~7号外显子)扩增出来,其中下游引物5’端添加带有终止密码的3’-aaggaaaattag-5’序列,PCR产物共888 bp,命名为dnGHR片段。将dnGHR片段克隆进pMD18-T-Simple,挑取单克隆测序,获取序列完全正确的pMD18-dnGHR质粒。
3.1.2. 载体pCAGGP构建
以质粒pRLG3A为模板,PCR扩增CAG启动子,取产物5 μl进行1%琼脂糖凝胶电泳,出现一条带与预测值1740 bp相符(图1(b);Lane 2:Insert DNA)。将此产物In-Fusion克隆至利用Cla I和BamH I双酶切的CD550A-1 (图1(b);Lane 1:Vector DNA) (回收7980 bp片段作为Vector DNA)中,获得所构建的载体pCAGGP。pCAGGP经Bam HI酶切并电泳可见一条带,其长度与理论预测值相符(图1(b);Lane 3);
 (a)
(a)
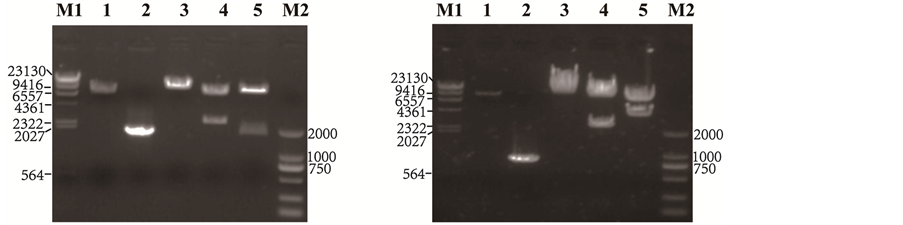 (b)(c)(a) Schematic illustrationof pCdnGGP. CAG promoter: the CMV early enhancer/chicken β actinpromoter; dnGHR: dominant negative mutant of GHR protein; PGK promoter: phosphoglycerate kinase genepromoter; GFP: green fluorescent protein; Puro: puromycin. (b) Enzyme digestion identification of pCAGGP. Lane M1: λ-Hind III digest (TAKARA); Lane M2: DL2000 Marker (TAKARA); Lane 1: Vector DNA; Lane 2: Insert DNA; Lane 3: pCAGGP-BamH I; Lane 4: pCAGGP-Nde I; Lane 5: pCAGGP-Sal I/BamH I. (c) Enzyme digestion identification of pCdnGGP. Lane M1: λ-Hind III digest (TAKARA); Lane M2: DL2000 Marker (TAKARA); Lane 1: Vector DNA; Lane 2: Insert DNA; Lane 3: pCdnGGP-Xho I; Lane 4: pCdnGGP-Nde I; Lane 5: pCdnGGP-EcoR I/KpnI.
(b)(c)(a) Schematic illustrationof pCdnGGP. CAG promoter: the CMV early enhancer/chicken β actinpromoter; dnGHR: dominant negative mutant of GHR protein; PGK promoter: phosphoglycerate kinase genepromoter; GFP: green fluorescent protein; Puro: puromycin. (b) Enzyme digestion identification of pCAGGP. Lane M1: λ-Hind III digest (TAKARA); Lane M2: DL2000 Marker (TAKARA); Lane 1: Vector DNA; Lane 2: Insert DNA; Lane 3: pCAGGP-BamH I; Lane 4: pCAGGP-Nde I; Lane 5: pCAGGP-Sal I/BamH I. (c) Enzyme digestion identification of pCdnGGP. Lane M1: λ-Hind III digest (TAKARA); Lane M2: DL2000 Marker (TAKARA); Lane 1: Vector DNA; Lane 2: Insert DNA; Lane 3: pCdnGGP-Xho I; Lane 4: pCdnGGP-Nde I; Lane 5: pCdnGGP-EcoR I/KpnI.
Figure 1.Schematic illustration of pCdnGGP and the resulting plasmids identified by enzyme digestion
图1. pCdnGGP结构示意图及载体酶切鉴定
pCAGGP经Nde I酶切产生两条片段,其大小与理论预测值相符(图1(b);Lane 4);pCAGGP经Sal I和BamH I酶切产生的两条带亦与预测值一致(图1(b);Lane 5)。同时,对pCAGGP质粒进行测序,结果与预期相符(结果未显示)。
3.1.3. 载体pCdnGGP构建
以pMD18-dnGHR为模板,PCR扩增dnGHR片段,取产物1 μl电泳可见一条带,与预测值888 bp相符(图1(c);Lane 2:Insert DNA)。将此产物In-Fusion克隆至利用Xho I酶切的pCAGGP (图1(c);Lane 1:Vector DNA)中,获得所构建的载体pCdnGGP。对pCdnGGP质粒进行测序,结果与预期相符(结果未显示)。pCdnGGP经Xho I单酶切电泳可见一条带,其长度与理论预测值10,608 bp相符(图1(c);Lane 3);经Nde I单酶切电泳可见两条带,其长度与理论预测值2322 bp和8286 bp相符(图1(c);Lane 4);pCdnGGP经EcoR I和Kpn I双酶切则可产生两条带,其大小与预测值3636 bp和6972 bp一致(图1(c);Lane 5);以上结果表明pCdnGGP构建成功。
3.2. 慢病毒包装
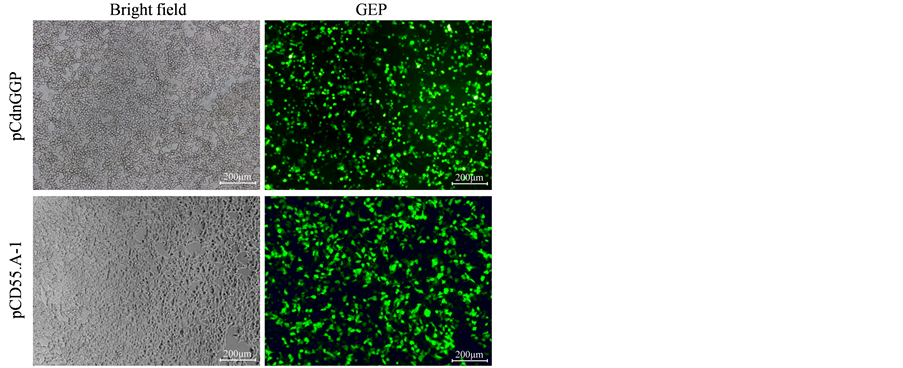
借助LipofectamineTM 2000将pCdnGGP和对照载体pCD550A-1转染入293T细胞后48小时,倒置荧光显微镜下观察到被转染的293T细胞中可见绿色荧光,证明转染成功(图2)。
3.3. 慢病毒LV-CdnGGP感染PEFs
将包装好的慢病毒LV-CdnGGP感染PEFs之后,96小时可见部分细胞有绿色荧光表达(图3(a)、图3(b)),证明慢病毒包装成功,之后细胞培养液中加入2 μg/ml嘌呤霉素对转基因阳性的PEFs进行筛选,每两天换液一次,在筛选7天后可见大部分PEFs均带有绿色荧光(图3(c)、图3(d)),筛选完成后的PEFs使用加入1 μg/ml维持浓度嘌呤霉素的培养基进行培养。
3.4. RT-PCR检测在pCdnGGP转染的293T细胞和LV-CdnGGP感染PEFs中dnGHR的表达
RT-PCR结果显示,在转染pCdnGGP的293T细胞和感染LV-CdnGGP的PEFs中,均实现了dnGHR转基因的表达(图4)。以上这些证明所构建的慢病毒载体pCdnGGP能在细胞中实现dnGHR的正常表达,为接下来的相关研究奠定了坚实的基础。
4. 讨论
猪的GHR基因位于第16号染色体,包含10个外显子,其中1~7号外显子编码GHR胞外结构域(生长激素结合域)和跨膜结构域,8~10号外显子编码GHR胞内结构域。已有文献表明,GHR基因敲除的小鼠和猪均会出现生长受抑制的现象,体型较野生型小鼠和猪要小 [10] [15] 。同时,也有研究者通过过表达仅含有GHR基因胞外结构域和跨膜结构域的突变体,使GHR突变体与动物体内的生长激素结合,从而造成野生型GHR功能被竞争性地抑制,造成显性负效应,通过此方法制备了过表达GHR显负性突变体的五指山小型猪,这些转基因猪也出现生长受抑制的现象 [11] 。
本研究成功构建了过表达西藏小型猪GHR显负性突变体的慢病毒载体,从基因层面上检测到其能实现目的转基因在PEFs中的过表达。接下来可以利用此慢病毒载体,制备GHR功能缺失的转基因西藏小型猪,从而创制体型更小的微型猪品系。
本研究构建的慢病毒载体包含CAG启动子调控dnGHR表达的元件,同时,在同一载体上还包含了PGK启动子调控报告基因GFP和嘌呤霉素抗性筛选基因的元件。GFP的引入有利于通过绿色荧光来监测目的基因在转基因细胞以及在转基因动物体内的表达,也有助于转基因猪可视化筛选和鉴定,嘌呤霉素抗性筛选基因的设置有助于转基因阳性细胞的筛选。
 48 h after transfection
48 h after transfection
Figure 2. 293T cells were transiently transfected with pCD550A-1 and pCdnGGP, respectively
图2. pCD550A-1和pCdnGGP分别瞬时转染293T细胞(病毒包装)
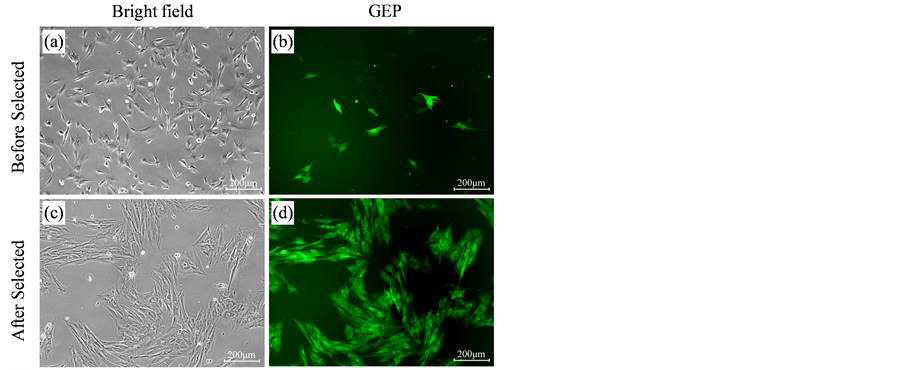 (a) and (b): 96h after LV-CdnGGP infection; (c) and (d): LV-CdnGGP-infected PEFs selected by puromycin
(a) and (b): 96h after LV-CdnGGP infection; (c) and (d): LV-CdnGGP-infected PEFs selected by puromycin
Figure 3. PEFs infected by lentivirus LV-CdnGGP
图3. 慢病毒LV-CdnGGP感染PEFs

Figure 4. The expression of dnGHR transgene in 293T cells transfected with pCdnGGP and PEFs infected with LV-CdnGGP by RT-PCR
图4. RT-PCR检测pCdnGGP转染的293T细胞和LV-CdnGGP感染的PEFs中dnGHR表达
基金项目
广东省科技计划项目(2013B060300013),构筑制作遗传工程小型猪的社会化服务支撑平台。
文章引用
贾俊双,林晓琳,肖 东,刘 薇. 过表达西藏小型猪GHR显负性突变体的慢病毒载体构建及其功能验证
Construction of a Lentiviral Vector Harboring Dominant-Negative Mutant of Growth Hormone Receptor for Tibet Minipigs[J]. 临床医学进展, 2016, 06(03): 111-117. http://dx.doi.org/10.12677/ACM.2016.63020
参考文献 (References)
- 1. 王桂花, 尹晓敏, 孙霞, 等. 国内外小型猪资源概况[J]. 中国比较医学杂志, 2009, 19(2): 71-73.
- 2. 冯书堂. 我国小型猪资源实验化培育及开发利用[J]. 实验动物科学, 2007, 24(6): 111-118.
- 3. 罗刚, 张乐, 刘连生, 等. 我国实验用小型猪的应用研究前景[J]. 实验动物科学与管理, 2004, 21(2): 37-38.
- 4. 袁进, 顾为望. 小型猪作为人类疾病动物模型在生物医学研究中的应用[J]. 动物医学进展, 2011, 32(2): 108-111.
- 5. Yan, Q., Yang, H., Yang, D., et al. (2014) Production of Transgenic Pigs Over-Expressing the Antiviral Gene Mx1. Cell Regeneration (Lond), 3, 11. http://dx.doi.org/10.1186/2045-9769-3-11
- 6. Deng, W., Yang, D., Zhao, B., et al. (2011) Use of the 2A Peptide for Generation of Multi-Transgenic Pigs through a Single Round of Nuclear Transfer. PLoS One, 6. http://dx.doi.org/10.1371/journal.pone.0019986
- 7. Yang, D., Wang, C.E., Zhao, B., et al. (2010) Expression of Huntington’s Disease Protein Results in Apoptotic Neurons in the Brains of Cloned Transgenic Pigs. Human Molecular Genetics, 19, 3983-3994. http://dx.doi.org/10.1093/hmg/ddq313
- 8. Savage, M.O., Attie, K.M., David, A., et al. (2006) Endocrine Assessment, Molecular Characterization and Treatment of Growth Hormone Insensitivity Disorders. Nature Clinical Practice Endocrinology & Metabolism, 2, 395-407. http://dx.doi.org/10.1038/ncpendmet0195
- 9. David, A., Hwa, V., Metherell, L.A., et al. (2011) Evidence for a Continuum of Genetic, Phenotypic, and Biochemical Abnormalities in Children with Growth Hormone Insensitivity. Endocrine Reviews, 32, 472-497. http://dx.doi.org/10.1210/er.2010-0023
- 10. Li, F., Li, Y., Liu, H., et al. (2014) Production of GHR Double-Allelic Knockout Bama Pig by TALENs and Handmade Cloning. Yi Chuan, 36, 903-911.
- 11. Li, F., Li, Y., Liu, H., et al. (2015) Transgenic Wuzhishan Minipigs Designed to Express a Dominant-Negative Porcine Growth Hormone Receptor Display Small Stature and a Perturbed Insulin/IGF-1 Pathway. Transgenic Research, 24, 1029-1042. http://dx.doi.org/10.1007/s11248-015-9912-6
- 12. Zheng, L., Njauw, C.N. and Martins-Green, M. (2007) A hCXCR1 Transgenic Mouse Model Containing a Conditional Color-Switching System for Imaging of hCXCL8/IL-8 Functions In Vivo. Journal of Leukocyte Biology, 82, 1247- 1256. http://dx.doi.org/10.1189/jlb.0307141
- 13. 贾俊双, 孙妍, 肖东, 等. 慢病毒介导的外源基因体外投递系统的建立[J]. 热带医学杂志, 2008(10): 1028-1029.
- 14. Shi, J.W., Liu, W., Zhang, T.T., et al. (2013) The Enforced Expression of c-Myc in Pig Fibroblasts Triggers Mesenchymal-Epithelial Transition (MET) via F-Actin Reorganization and RhoA/Rock Pathway Inactivation. Cell Cycle, 12, 1119-1127. http://dx.doi.org/10.4161/cc.24164
- 15. Lupu, F., Terwilliger, J.D., Lee, K., Segre, G.V. and Efstratiadis, A. (2001) Roles of Growth Hormone and Insulin- Like Growth Factor 1 in Mouse Postnatal Growth. Developmental Biology, 229, 141-162. http://dx.doi.org/10.1006/dbio.2000.9975
*通讯作者。