Hans Journal of Food and Nutrition Science
Vol.04 No.01(2015), Article ID:14789,10
pages
10.12677/HJFNS.2015.41001
Effect of Ethanol Extracts from Hericium erinaceum Solid-State Fermented Wheat on Nerve Cells Growth
Chun-Yi He1, Su-Der Chen1*, Want-Ju Lu1, Hung-Cheng Wang1, Yung-Chung Chang1, Yeong-Hsiang Cheng2, Yu-Shen Lai2
1Department of Food Science,
2Department of Biotechnology and Animal Science, National Ilan University, Taiwan
Email: *sdchen@niu.edu.tw
Received: Jan. 14th, 2015; accepted: Jan. 29th, 2015; published: Feb. 4th, 2015
Copyright © 2015 by authors and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY).
http://creativecommons.org/licenses/by/4.0/



ABSTRACT
Nerve growth factor (NGF) is one of neurotrophic factors, which is responsible for neuronal growth and prevents from neurodegeneration. Hericium erinaceums (H. erinaceus) is an important medicinal and edible mushrooms, and it has bioactive components such as erinacines and hericenones, which can induce nerve growth factor (NGF) production, and increase the neurite outgrowth. This study was to observe the growth of PC 12 cell and analyze NGF contents by producing 28-days H. erinaceus solid-state fermented wheat and feeding the rat pheocromocytoma PC12 cell with the ethanol extracts. The concentration 1 - 100 μg/mL ethanol extracts (HEE) from H. erinaceum solid-state fermented wheat product did not significantly cause cytotoxicity of cultured PC12 cells. The NGF contents and neurite development of PC12 cells were significantly increased by adding 10 μg/mL 28-days HEE to medium.
Keywords:Hericium erinaceus, Solid-State Fermentation, Nerve Growth Factor (Ngf), Neurite

猴头菌固态发酵小麦的萃取物 对神经细胞生长的影响
何纯谊1,陈淑德1*,吕宛儒1,王桢翔1,张永钟1,郑永祥2,赖裕顺2
1国立宜兰大学,食品科学系,台湾
2国立宜兰大学,生物技术和动物科技系,台湾
Email: *sdchen@niu.edu.tw
收稿日期:2015年1月14日;录用日期:2015年1月29日;发布日期:2015年2月4日

摘 要
神经生长因子(nerve growth factor, NGF)是神经营养因子之一,为神经细胞生长的重要因素,可防止神经退化。猴头菇(Hericium erinaceum)为一种重要的药膳兼用真菌,它含有猴头素和猴头酮等生理活性成分,可促进NGF的生成,增加神经轴突的生长。本研究通过猴头菌小麦固态发酵28天的乙醇萃取物与大鼠肾上腺髓质嗜铬细胞株(rat pheochromocytoma cell line, PC12)共培养,观察其生长情形及检测NGF含量。结果显示浓度为1~100 μg/mL的猴头菌小麦固态发酵萃取物(HEE)对PC12细胞无明显的细胞毒性作用。同时发现,添加10 μg/mL猴头菌固态发酵小麦的萃取物可显著促使PC12细胞产生轴突及分泌NGF。
关键词 :猴头菌,固态发酵,神经生长因子,轴突

1. 引言
神经营养因子(neurotrophic factors)是主要调节神经细胞的生长以及活性的因子,为神经细胞生长的重要因素,也是维护许多神经元的关键。其中包含有神经生长因子(nerve growth factor, NGF)、脑源性神经营养因子(brain-derived neurotrophic factor, BDNF)、神经营养因子-3(neurotrophin-3, NT-3)、神经营养因子-4/5(neurotrophin-4/5, NT-4/5)、神经营养因子-6(neurotrophin-6, NT-6)。NGF为最早发现并广泛被用于研究的一个神经营养因子,可防止神经退化,其分子量约为140 kD,而这些因子主要可与神经细胞表面上的Tyrosine specific receptor kinases (Trk) A、B、C等专一性接受器结合 [1] ,進而促使神经细胞的轴突长度增加以利讯息传递。但由于其分子量过大,无法通过血脑障壁(blood-brain barrier),故对于脑部神经退化性疾病并无法以外源性方式进行治疗 [2] [3] 。
猴头菌是中国传统的菇蕈类,为著名药膳兼用菌 [4] 。其产地主要为黑龙江、四川、云南、湖北、广西等一带,而美国、日本、俄罗斯、欧洲也有分布,在台湾则是分布于南投和宜兰山区 [5] [6] 。近年来多使用液态发酵的方法培养猴头菌 [7] [8] ,林玉婷等人 [8] 将猴头菌液添加至5%葡萄糖培养液下,培养14天期间的菌丝干重变化,预活化5天可得最多的菌丝干重为0.54 g,即发酵液中菌丝浓度为3.6 mg/mL;孙红斌等人 [9] 及刘艳芳等人 [10] 皆以淀粉当作碳源其多醣含量可达0.6 mg/mL以上;Krzyczkowski等人 [11] 以50 mg/mL 葡萄糖、10 mg/mL 酵母萃取物、10 mg/mL 酪蛋白胨及1.0 mg/mL 磷酸二氢钾添加于培养液中,并于pH 5.0、110 rpm、25℃下进行猴头菌液态发酵8天,可得猴头素A 192 mg/mL。另一方面也可以固态发酵、椴木栽培及使用瓶栽或袋栽(俗称太空包)的栽培法,取得菌丝和子实体中含有生理活性的代谢产物,包括多醣、猴头素(erinacines)、猴头酮(hericenones);其中猴头素主要来自于猴头菌发酵的菌丝体,若改以固态发酵可得到产量高之菌丝体,且培养后期亦会造成子实体生长,其花费成本低、加工原料少、技术简单并没有操作上的问题,低水分含量的固态谷类基质也利于真菌的生长,可大幅缩短后段干燥的时间及成本。
猴头菇及猴头菌发酵产物中之多醣体 [12] - [16] ,具增强免疫力 [17] [18] 、抗肿瘤 [17] 、抗氧化 [18] 、降血压 [19] 、降血糖 [20] 等生理功能;猴头菇及其菌丝含有猴头素及猴头酮,猴头素具有多种类型,猴头素A [21] [23] 、B [21] [23] 、C [23] [24] 、E、F、G [25] 、H、I [26] 、J、K [27] 、P [21] [24] 、Q [24] 和R [28] ,其中A、B、C、E、F及H均可刺激老鼠星状细胞(rat astroglial cells)分泌神经生长因子(NGF) [23] [25] [26] ,其他不同类型之猴头素也可促使神经细胞产生轴突或树突 [29] ,治疗智力衰退 [25] 、神经衰弱 [30] 及抗阿兹海默症、帕金森氏症 [21] [22] [25] 等效果。猴头酮也具有多种类型,而猴头酮C、D、E [31] [32] 、F、G、H [33] 也与NGF的合成有关,但两者相较下又以猴头素较能促使神经细胞分泌NGF [23] 。
本研究的目的为探讨以小麦作为基质,进行猴头菌固态发酵,并将28天猴头菌小麦固态发酵乙醇萃取物培养于PC12神经细胞,观察其生长情形及检测NGF含量,以研究其对神经细胞轴突生长之影响。
2. 材料与方法
2.1. 材料
猴头菌Hericiumerinaceus (BCRC 36470)购自生物资源保存及研究中心(Hsinchu, Taiwan)。猴头菇子实体购自礁溪松杉灵芝场(Ilan, Taiwan)。大鼠嗜铬性瘤细胞(PC12)由阳明大学附设医院(Ilan, Taiwan)所提供。小麦购自鸿鑫米行(Ilan, Taiwan)。马铃薯葡萄糖洋菜培养基(potato dextrose agar, PDA)、酵母抽出物(yeast extract)购自Difco Co. (Sparks, MD, USA)。磷酸氢二钾(K2HPO4)、硫酸镁(MgSO4∙7H2O)、葡萄糖(C6H12O6)、碳酸钙(CaCO3)购自日本和光纯药工业株式会社(Osaka, Japan)。乙醇(C2H5OH)购自Lab-Scan (Asia Co., Ltd.,
2.2. 方法
2.2.1. 菌种培养与活化
猴头菌Hericiumerinaceus (BCRC 36470)置于PDA平板培养基,在25℃培养箱中培养,每个月继代培养,而长出菌落后将菌丝移至具有挡板三角瓶的5%葡萄糖培养液(含5%葡萄糖、0.1%酵母萃取物、0.1%磷酸氢二钾及0.05%硫酸镁,以蒸馏水定量至150 mL),在25℃、pH 5-6、150 rpm条件下进行预活化摇瓶培养七天。
2.2.2. 固态发酵
将预活化猴头菌液10 mL接种于已杀菌的1 kg小麦基质中(含0.1%酵母萃取物、0.1%磷酸氢二钾、0.1%碳酸钙及0.05%硫酸镁),其水分含量约为50%,于25℃恒温培养箱中培养28天,再将发酵产物进行121℃杀菌60 min、50℃热风干燥后并磨粉收集。
2.2.3. 猴头菌小麦固态发酵乙醇萃取物(HEE)与猴头菇子实体乙醇萃取物(FBE)之制备
分别称取已干燥磨粉的猴头菌小麦固态发酵产物和猴头菇子实体0.2 g,加入85%乙醇1 mL进行超音波震荡2 h,再以5000 × g离心10 min后,取上清液以50℃干浴至干,再加入1 mL细胞培养液以超音波震荡10 min溶解,最后用0.22 μm滤膜过滤,将萃取液配置成适当浓度备用。
2.2.4. 猴头素之高效能液相层析(HPLC)分析
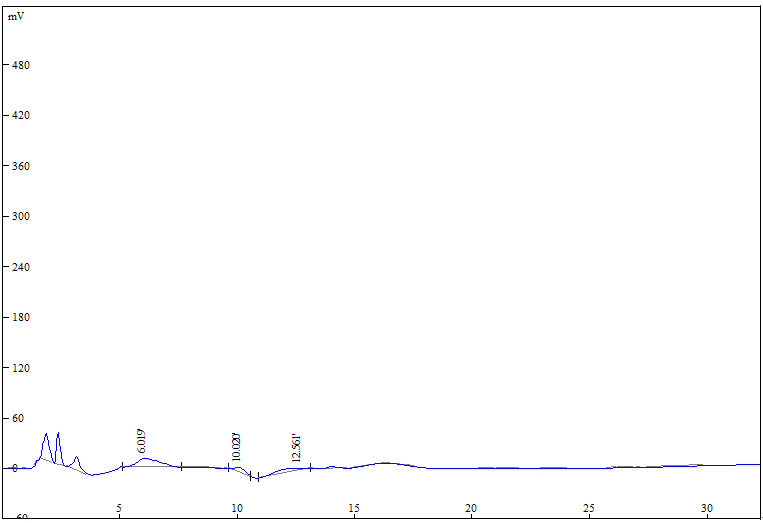
取5 g的未发酵小麦原料和猴头菌小麦固态发酵产物,与15 mL的乙醇以超音波震荡萃取10 min,经6000 × rpm离心10 min,进行过滤、减压浓缩,而后加入15 mL的乙酸乙酯以超音波震荡回溶,进行过滤、减压浓缩,最后加入乙醇回溶,以0.22 μm PTFE滤膜过滤后,进行初步HPLC分析猴头菌发酵前后之变化,依据Kenmoku等人 [24] 的分析条件使用C18 (250 × 4.6 mm)为管柱,移动相:80%甲醇,流速为1.5 mL/min,温度条件在室温中进行,以紫外光检测器测波长:210 nm,直到60 min结束。其报告指出HPLC图谱在4.1 min出现的波峰,经NMR和IR分析鉴定后分别为猴头素A。
2.2.5. 神经细胞培养与继代 [34]
细胞培养皿先以50 μg/mL之poly-D-lysine进行涂抹,待5 min后备用,以利细胞黏着。
大鼠肾上腺髓质嗜铬性细胞瘤细胞株(PC12)培养于含有1% L-glutamine、1% penicillin、10% FBS和5% HS的DMEM培养液中,调整pH 7置于5% CO2、90%相对湿度37℃的恒温培养箱中。约二至三天九成满时,以PBS溶液轻轻延着罐壁清洗细胞,注入1.5 mL 0.25% trypsin拍打使细胞完全剥落,此时再注入6 mL培养液中止反应,将细胞均匀冲散、离心,依实验目的进行继代培养(passage)。
2.2.6. 细胞存活率分析
以细胞存活率试验(MTT assay) [35] 评估未发酵小麦萃取物、HEE和FBE处理前后细胞的存活比例。MTT的基本作用原理,是利用活细胞内粒线体酵素能将黄色tetrazolium salt代谢成formazan针状结晶,再利用有机溶剂DMSO将之溶解后可在酵素免疫分析仪(ELISA reader)下读取560 nm吸光值,依据读值的高低可以代表活细胞的多寡。
将PC12接种(seeding)约6 × 104个细胞于96孔盘24 h,吸除培养液,加入不同浓度未发酵小麦乙醇萃取物、HEE和FBE 0、1、10及100 μg/mL培养24 h,吸除培养液且倒扣拍干,加入100 mL MTT在37℃下作用3 h,之后将含有MTT的培养液吸除,加入100 mL DMSO将结晶溶解10 min,以酵素免疫分析仪读取560 nm吸光值。
2.2.7. 神经突触外观分析
将PC12接种约6 × 104个细胞于6孔盘24 h,吸除培养液,加入1、10及100 μg/mL HEE及10 μg/mL FBE培养72 h,以200倍倒立式显微镜观察并拍摄。
2.2.8. 神经生长因子分析
PC12神经细胞接种(seeding)约6 × 104个细胞于6孔盘24 h,吸除培养液,分别加入10 μg/mL HEE和FBE培养72 h,分别取上清液备用测NGF分泌量。
利用Human β-NGF ELISA development kit分析,ELISA 96 well plate前置备先用PBS稀释capture antibody至1 μg/mL,立即取100 μL/well抗体置plate,于室温下放置过夜配用;再吸除上清液后,用300 μL 缓冲洗液(0.05% Tween-20/PBS)清洗每well四次,最后清洗完后,用擦手巾铺底,将plate倒扣在纸巾上至干,每well加入300 μL block buffer (1% BSA/PBS),于室温下静置至少1 h,再吸除上清液并用缓冲洗液清洗四次备用。
标准液、样品用稀释液将标准液从2 ng/mL到0稀释,立即加入100 μL标准液、样品(固定浓度)到每well三重复,于室温下静置2 h,吸除上清液后用200 μL缓冲洗液清洗每well四次且倒扣,有气泡时需搓破以免残留,用稀释液稀释detection antibody到0.25 μg/mL,取100 μL至每well于室温下静置2 h,吸除上清液并用缓冲洗液清洗四次,取5.5 μL avidin-HRP conjugate用稀释液稀释至总体积11 mL,取100 μL至每well于室温下静置30 min,吸除上清液并用缓冲洗液清洗四次,加入100 μL受质(ABTS液态受质,使用前须回温)于室温下反应,直至颜色产生,于ELISA reader 450 nm侦测颜色变化,650 nm校正。
2.2.9. 统计分析
试验结果三重复,并以平均值±标准偏差表示,所得之数据使用Statistical Package for Social Science (SPSS, SPSS INC. 宏德国际软件咨询顾问有限公司) 14.0版统计软件包进行统计分析,以多元全距检定分析(Duncan’s Multiple Range Test),以显着水平α = 0.05,以较其差异之显着性。
3. 结果与讨论
3.1. 猴头菌固态发酵产物之猴头素分析
将未发酵小麦及猴头菌小麦固态发酵产物进行猴头素之检测,并以Kenmoku等人 [24] 之报告为对照,其结果指出HPLC图谱在4.1 min出现的波峰,经NMR和IR分析鉴定后分别为猴头素A。本研究在相同的HPLC分析条件下,图1 HPLC图谱显示未发酵小麦(a)之乙醇萃取物并无4.1 min之波峰,而HEE则在4.1 min有明显波峰(b),且此波峰和Kenmoku等人 [24] 的猴头素分析结果接近,由此波峰之对照可显示,本研究所使用之猴头菌固态发酵产物,与一般液态发酵之猴头菌有相同之有效成分猴头素产生,显示经由固态发酵可节省成本且与一般液态发酵达相同之有效成分。除了本篇所使用之分析條件外,另有Krzyczkowski等人 [36] 是以HPLC分析猴头菌液态发酵产物之乙醇和乙酸乙酯萃取物,其条件为C18管柱,40℃、70%甲醇水溶液以1 mL/min流速冲提,检测波长为340 nm,则于6.33 min时同樣出现明显猴头素A的波峰,其浓度为192 mg/mL。
3.2. MTT细胞存活率试验
进一步检测不同浓度的未发酵小麦乙醇萃取物、HEE与FBE对PC12细胞存活率的影响(见表1),结果显示,不同浓度的(1、10、100 μg/mL)未发酵小麦乙醇萃取物处理的细胞存活率并无显着差异性,均不会产生毒性。HEE及FBE均促进PC12细胞生长,且HEE在三种不同浓度下均较FBE及未发酵小麦乙醇萃取物更有效。
Nagai等人 [37] 将0.01及0.1 μg/mL猴头菇萃取物培养于小鼠神经细胞瘤细胞系(Neuro2a)中24 h,可有效地减少因内质网压力所造成的细胞凋亡,可将约10%的细胞存活率提高至约65%及75%。Park等人 [29] 也取用不同浓度(0.2、0.5、0.8、1 μg/mL)的猴头菇菌丝体萃取物将其培养PC12细胞0~8天,检测其细胞数目,可发现添加猴头菇菌丝体萃取物含量越高的组别其细胞数目成长越快,并无低于控制组的死亡情形,故均显示猴头菇及其菌丝体萃取物不会造成神经细胞的死亡,还有助提高其存活率。
3.3. 不同浓度HEE对PC12神经细胞生长之影响
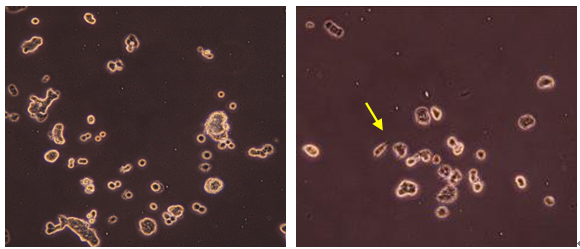
观察HEE浓度对PC12细胞生长之影响,添加浓度1~100 μg/mL之HEE培养PC12细胞72 h后,以酵素免疫分析各浓度之HEE促进细胞分泌至胞外之NGF总含量,并与未发酵小麦乙醇萃取物之效果比较。由图2摄像观察结果可发现,控制组(a)并无明显之轴突生长,各浓度之未发酵小麦萃取物组别(b)(c)(d)也只有少数细胞有单一短小轴突生长,而HEE各浓度组别(f)(g)(h)可观察到许多细胞均有明显较长的轴突之产生及生长,与10 μg/mL FBE组别(e)有相同之生长情形,其结果显示HEE可促使大多数的细胞分化产生明显且多分支之轴突,并与FBE有相同之效果。
3.4. HEE浓度对PC12神经细胞分泌NGF含量之影响
接着进一步的分析各种乙醇萃取物促使PC12细胞所产生之NGF含量。由表2的结果显示,各种浓度之HEE均能促使PC12细胞分泌NGF,其中又以10 μg/mL可促使PC12细胞分泌于3 mL培养液中之NGF分泌量最高可达492.63 pg,其次为100 μg/mL所产生之浓度为470.46 pg,添加1 μg/mL所产生之浓度为453.54 pg,相较控制组173.54 pg均达显着差异(p < 0.05)。而与相同浓度之10 μg/mL FBE相较,无显着之差异。虽未发酵的小麦基质于NGF检测中也有提高NGF的表现量,推测可能未发酵小麦的萃取物中虽有一些营养成分可使神经细胞产生NGF的表达,但仍显着低于HEE及FBE所能促使分泌NGF
 (a)
(a) (b)
(b)
Figure 1.HPLC analysis diagrams of ethanol and ethyl acetate extracts from (a) wheat and (b) H. erinaceus 28-days solid-state fermented wheat product
图1.(a)纯小麦、(b)猴头菌固态发酵28天小麦产物的乙醇、乙酸乙酯萃取物之HPLC分析图

1Data are expressed as mean ± S.D. (n = 4). a-bMeans in 1-100 μg/mL groups with different letters are significantly different (p< 0.05). *Mean values in fermented wheat with * are significantly different from different letters (p< 0.05).
1数据表示为平均± S.D. (n = 4);a-b不同字母表示1~100 μg/mL之组别间达显著差异(p< 0.05);*表示同浓度组别中之发酵产物组别达显著差异 (p< 0.05)。
Table 1.Effect of 1, 10, 100 μg/mL ethanol extracts from wheat, HEE and FBE on PC12 viability at 24 hr cultivation
表1.添加1、10、100 μg/mL未发酵小麦乙醇萃取物、HEE和FBE对PC12培养24 h之细胞存活率的影响
 (a) (b)
(a) (b)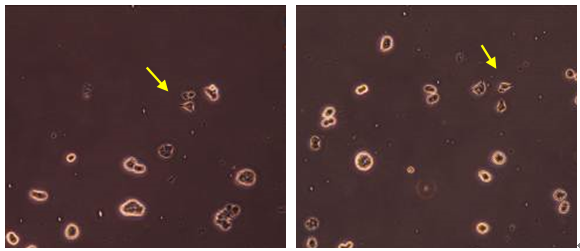 (c) (d)
(c) (d)
 (e) (f)
(e) (f) (g) (h)
(g) (h)
Figure 2.The synapse growth instance of adding different concentration HEE and FBE for PC12 cells after 72 h cultivation. (a) Control; (b) 1 μg/mL unfermented wheat; (c) 10 μg/mL unfermented wheat; (d) 100 μg/mL unfermented wheat; (e) 10 μg/mL FBE; (f) 1 μg/mL HEE; (g) 10 μg/mL HEE (h) 100 μg/mL HEE
图2. 添加不同浓度未发酵小麦乙醇萃取物、HEE及10 μg/mL FBE培养于PC12细胞72 h后之生长情形;(a) 控制组;(b) 1 μg/mL未发酵小麦;(c) 10 μg/mL未发酵小麦;(d) 100 μg/mL未发酵小麦;(e) 10 μg/mL FBE;(f) 1 μg/mL HEE;(g) 10 μg/mL HEE;(h) 100 μg/mL HEE;箭头标示为细胞轴突生长处
Table 2. Effect of adding different concentration ethanol extracts from unfermented wheat, HEE and FBE on PC12 cells producing NGF
表2. 添加不同浓度之未发酵小麦、HEE及10 μg/mL FBE对PC12细胞产生NGF之影响
1Data are expressed as mean ± S.D. (n = 3); a-bMeans in different NGF group with different letters are significantly different (p < 0.05).
1数据表示为平均± S.D. (n = 3);a-d不同字母表示不同NGF数值间达显著差异(p < 0.05)。
之含量。
Mori等人 [38] 以不同浓度猴头菇子实体萃取物50、100和150 μg/mL注入人类星状细胞(1321N1)细胞,24 h后检测其合成NGF的含量分别约为60、70和175 pg/mL,而添加50及100 μg/mL所产生之NGF含量并无显着差异。然而在PC12神经细胞分化观察中,Mori等人 [38] 将125及250 μg/mL的猴头菇子实体乙醇萃取物先将其培养于1321N1细胞中24 h,再取其80%的培养液培养PC12细胞48 h,由PC12神经细胞产生轴突分化的统计情况也可发现,125及250 μg/mL的猴头菇萃取物均可间接促使PC12细胞产生轴突分化。而本研究则进一步针对NGF含量作分析,也可发现其分泌之NGF含量有所提升。故由此结果得知猴头菌固态发酵小麦产物与猴头菇子实体均有促进神经生长之效果,而猴头菌固态发酵小麦产物可有效缩短其发酵时间,其萃取物未来可作为健脑食品之发展潜力。
4. 结论
细胞存活率实验中显示1~100 μg/mL未发酵小麦萃取物及HEE对PC12细胞生长之存活率并无显着影响。各浓度之HEE均能促使PC12产生轴突之生长,其中又以10 μg/mL所产生之NGF总含量最高可达492.63 pg。故采用猴头菌固态发酵菌丝体产物可有效缩短栽培时间,且促进之NGF分泌量与猴头菇子实体相当。
致谢
本试验感谢农委会科技计划99农科-3.1.3-粮-Z1(7) [猴头菌子实体和发酵产物萃取液化学组成和生理功能之探讨(三)]经费支持,及妍华生技公司的董鸿楠先生协助教导PC12细胞的培养,使本试验得以完成,特此致谢。
文章引用
何纯谊,陈淑德,吕宛儒,王桢翔,张永钟,郑永祥,赖裕顺. 猴头菌固态发酵小麦的萃取物对神经细胞生长的影响
Effect of Ethanol Extracts from Hericium erinaceum Solid-State Fermented Wheat on Nerve Cells Growth[J]. 食品与营养科学, 2015, 04(01): 1-10. http://dx.doi.org/10.12677/HJFNS.2015.41001
参考文献 (References)
- 1. Schulte-Herbrüggen, O., Jockers-Scherübl, M.C. and Hellweg, R. (2008) Neurotrophins-from pathophysiology to treatment in Alzheimer’s disease. Current Alzheimer Research, 5, 38-44.
- 2. Allen, S.J. and Dawbarn, D. (2006) Clinical relevance of the neurotrophins and their receptors. Clinical Science, 110, 175-91.
- 3. Barbara, O.-N. and Bacia, A. (1994) Expression of astroglial nerve growth factor in damaged brain. Acta Neurobi- ologiae Experimentalis, 54, 73-80.
- 4. 蔡德华, 董洪新, 肖长生, 等 (2003) 猴头菌液体发酵的环境条件试验. 湖北农业科学, 3, 78-80.
- 5. 王伯彻 (1990) 食用菇及药用菇系列报导(九)——猴头菌. 食品工业, 12, 42-47.
- 6. 王伯彻, 陈启桢, 华杰 (1998) 食药用菇類的培养与应用. 食品工业发展研究所, 新竹, 台湾.
- 7. 吴姿宜 (2001) 探讨不同培养方式对猴头菇抗氧化与抗肿瘤性质的影响. 硕士论文, 国立中央大学化学工程所, 新竹, 台湾.
- 8. 林玉婷, 陈淑德, 郑永祥, 等 (2009) 猴头菌发酵米浆之研发. 宜兰大学生物资源学刊, 2, 83-89.
- 9. 孙红斌, 刘梅森, 陈海晏 (2001) 液态发酵猴头菌多醣工艺优化研究(I)——碳、氮源对得率的影响. 食品与发酵工业, 9, 30-33.
- 10. 刘艳芳, 杨焱, 贾薇, 等 (2003) 猴头菌深层发酵培养基筛选初探. 食用菌学报, 3, 26-31.
- 11. Krzyczkowski, W., Malinowska, E. and Herold, F. (2010) Erinacine A biosynthesis in submerged cultivation of Heri- cium erinaceum: Quantification and improved cultivation. Engineering in Life Sciences, 10, 446-457.
- 12. 王进琦, 李聪明, 赖敏男 (1998) 猴头菇以液体浸渍培养产制水溶性多醣类之探讨. 食品科学, 6, 714-726.
- 13. 吴云艳, 宋慧, 马福 (2005) 猴头菌属(Hericium)真菌多糖的研究进展. 吉林农业大学学报, 6, 621-626.
- 14. 但飞君, 付若秋 (2000) 猴头菇的研究概况. 中医药研究, 4, 60.
- 15. Jia, L., Liu, L., Dong, Q. and Fang, J. (2004) Structural investigation of a novel rhamnoglucogalactan isolated from the fruiting bodies of the fungus Hericium erinaceus. Carbohydrate Research, 339, 2667-2671.
- 16. 姜瑞芝, 王颖, 陈英红 (2007) 猴头菌寡醣的分离及其结构确定. 高等学校化学学报, 7, 1313-1315.
- 17. Wang, J.C., Hu, S.H., Su, C.H. and Lee, T.M. (2001) Antitumor and immunoenhancing activities of polysaccharide from culture broth of Hericium spp. The Kaohsiung Journal of Medical Sciences, 17, 461-467.
- 18. 林玉婷 (2009) 研发猴头菌发酵米浆及其抗氧化活性和免疫调节之研究. 硕士论文, 国立宜兰大学食品科学研究所, 宜兰.
- 19. Yang, B.K., Park, J.B. and Song, C.H. (2003) Hypolipidemic effect of exo-biopolymer produced from a submerged mycelial culture of Hericium erinaceus. Bioscience, Biotechnology, and Biochemistry, 67, 1292-1298.
- 20. Wang, J.C., Hu, S.H., Wang, J.T., Chen, K.S. and Chia, Y.C. (2005) Hypoglycemic effect of extract of Hericium eri- naceus. Journal of the Science of Food and Agriculture, 85, 641-646.
- 21. Kenmoku, H., Sassa, T. and Kato, N. (2000) Isolation of erinacine P, a new parental metabolite of cyathane xylosides, from Hericium erinaceum and its biomimetic conversion into erinacines A and B. Tetrahedron Letters, 41, 4389-4393.
- 22. Shimbo, M., Kawagishi, H. and Yokogoshi, H. (2005) Erinacine A increases catecholamine and nerve growth factor content in the central nervous system of rats. Nutrition Research, 25, 617-623.
- 23. Kawagishi, H., Shimada, A., Shirai, R., Okamoto, K., Ojima, F., Sakamoto, H., Ishiguro, Y. and Furukawa, S. (1994) Erinacines A, B and C, strong stimulators of nerve growth factor (NGF)-synthesis, from the mycelia of Hericium eri- naceum. Tetrahedron Letters, 35, 1569-1572.
- 24. Kenmoku, H., Shimai, T., Toyomasu, T., Kato, N. and Sassa, T. (2002) Erinacine Q, a new erinacine from Hericium erinaceum, and its biosynthetic route to erinacine C in the basidiomycete. Bioscience, Biotechnology, and Biochemistry, 66, 571-575.
- 25. Kawagishi, H., Shimada, A., Hosokawa, S., Mori, H., Sakamoto, H., Ishiguro, Y., Sakemi, S., Bordner, J., Kojima, N. and Furukawa, S. (1996) Erinacines E, F, and G, stimulators of nerve growth factor (NGF)-synthesis, from the mycelia of Hericium erinaceum. Tetrahedron Letters, 37, 7399-7402.
- 26. Lee, E.W., Shizuki, K., Hosokawa, S., Suzuki, M., Suganuma, H., Inakuma, T., Li, J., Ohnishi-Kameyama, M., Nagata, T., Furukawa, S. and Kawagishi, H. (2000) Two novel diterpenoids, erinacines H and I from the mycelia of Hericium erinaceum. Bioscience, Biotechnology, and Biochemistry, 64, 2402-2405.
- 27. Kawagishi, H., Masui, A., Tokuyama, S. and Nakamura, T. (2006) Erinacines J and K from the mycelia of Hericium erinaceum. Tetrahedron, 62, 8463-8466.
- 28. Ma, B.J., Zhou, Y., Li, L.Z., Li, H.M., Gao, Z.M. and Ruan, Y. (2008) A new cyathane-xyloside from the mycelia of Hericium erinaceum. Zeitschrift für Naturforschung, 63, 1241-1242.
- 29. Park, Y.S., Lee, H.S., Won, M.H., Lee, J.H., Lee, S.Y. and Lee, H.Y. (2002) Effect of an exo-polysaccharide from the culture broth of Hericium erinaceus on enhancement of growth and differentiation of rat adrenal nerve cells. Cytotech- nology, 39, 155-162.
- 30. 陈清农, 杨梅春, 陈劲初 (1999) 猴头菌. 乡间小路, 8, 34-35.
- 31. Kawagishi, H., Ando, M., Sakamoto, H., Yoshida, S., Ojima, F., Ishiguro, Y., Ukai, N. and Furukawa, S. (1991) He- ricenones C, D and E, stimulators of nerve growth factor (NGF)-synthesis, from the mushroom Hericium erinaceum. Tetrahedron Letters, 32, 4561-4564.
- 32. Arnone, A., Cardillo, R., Nasini, G. and de Pava, O.V. (1994) Secondary mold metabolites: Part 46. hericenes A-C and erinapyrone C, new metabolites produced by the fungus Hericium erinaceus. Journal of Natural Products, 57, 602- 606.
- 33. Kawagishi, H., Ando, M., Shinbab, K., Sakamotoa, H., Yoshidaa, S., Ojimaa, F., Ishiguroa, Y., Ukaia, N. and Furuka- wa, S. (1992) Chromans, hericenones F, G and H from the mushroom Hericium erinaceum. International Journal of Plant Sciences, 32, 175-178.
- 34. Greene, L. and Tischler, A.S. (1976) Establishment of a noradrenergic clonal line of rat adrenal pheochromocytoma cells which respond to nerve growth factor. Proceedings of the National Academy of Sciences of the United States of America, 73, 2424-2428.
- 35. Mosmann, T.R. and Coffman, R.L. (1989) TH1 and TH2 cells: Different patterns of lymphokine secretion lead to di- fferent functional properties. Annual Review of Immunology, 7, 145-173.
- 36. Krzyczkowski, W., Malinowska, E., Suchocki, P., Kleps, J., Olejnik, M. and Herold, F. (2009) Isolation and quantita- tive determination of ergosterol peroxide in various edible mushroom species. Food Chemistry, 113, 351-355.
- 37. Nagai, K., Chiba, A., Nishino, T., Kubota, T. and Kawagish, H. (2006) Dilinoleoyl-phosphatidylethanolamine from Hericium erinaceum protects against ER stress-dependent Neuro2a cell death via protein kinase C pathway. The Jour- nal of Nutritional Biochemistry, 17, 525-530..
- 38. Mori, K., Obara, Y., Hirota, M., Azumi, Y., Kinugasa, S., Inatomi, S. and Nakahata, N. (2008) Nerve growth factor-in- ducing activity of Hericium erinaceus in 1321N1 human astrocytoma cells. Biological & Pharmaceutical Bulletin, 31, 1727-1732.
