Hans Journal of Food and Nutrition Science
Vol.04 No.04(2015), Article ID:16193,10
pages
10.12677/HJFNS.2015.44014
Chemical Composition of Bleeding Sap of Sponge Gourd and in Vitro Antioxidant Activity
Xiaoli Wang, Qi Ding, Hanju Sun*, Dandan Li, Pingping Zhang, Pengcheng He, Shudong He, Xiaodong Cao
School of Biotechnology and Food Engineering, Hefei University of Technology, Hefei Anhui

Received: Sep. 26th, 2015; accepted: Oct. 14th, 2015; published: Oct. 21st, 2015
Copyright © 2015 by authors and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY).
http://creativecommons.org/licenses/by/4.0/



ABSTRACT
The physicochemical properties and in vitro antioxidant properties of bleeding sap of sponge gourd were investigated. First, its pH, solid content, total acid, total sugar, polysaccharides, reducing sugar, protein and free amino acid were analyzed. Its organics was detected with GC-MS. After treatment at 4˚C, 25˚C, 50˚C, 75˚C and 100˚C for 4 h, its activity of hydroxyl radical scavenging and DPPH radical scavenging and reducing power were studied at different concentrations (20%, 40%, 60%, 80% and 100%). The results were as follows. Its pH was 6.42 and solid content was 0.4 g/L. The content of total acid in citric acid was 7.86 mg/L and inorganic salt was 0.32 g/L. Its total sugar content was 11.213 mg/L, while polysaccharide content was 4.054 µg/L. Reducing sugars, proteins and free amino acids were not detected. There were 4 alkanes, 4 ketones, 3 aldehydes, 3 phenols, 3 amines and 1 acid. Finally, its hydroxyl radical scavenging activity was 63.4%. Its scavenging activity was nearly 0 after open at air for 50 h and strongest in 4˚C. Its scavenging ability to DPPH radical was 46.7%. The activity was nearly 0 after open at air for 75 h, highest in 4˚C. The reducing ability was highest at 4˚C, which was three times than that at 100˚C. In conclusion, there were probably 3-methyl-1,2-benzenediol, n-valeraldehyde and 3,4-diene-2-heptanone in bleeding sap of sponge gourd. Therefore, its fresh stock solutions had better to be stored at 4˚C in order to preserve its antioxidant activity.
Keywords:Sponge Bleeding Sap, Physicochemical Property, In Vitro, Antioxidant Property

丝瓜伤流液的化学组成及体外抗氧化活性 的研究
王晓莉,丁琦,孙汉巨*,李丹丹,章萍萍,何鹏程,何述栋,操小栋
合肥工业大学生物与食品工程学院,安徽 合肥

收稿日期:2015年9月26日;录用日期:2015年10月14日;发布日期:2015年10月21日

摘 要
本文研究了丝瓜伤流液的化学组成及其体外抗氧化活性。首先,分析其富含主要化学物质的含量,通过GC-MS分析其小分子有机物质的组成及含量,并分析温度及浓度对其清除DPPH与·OH的能力及总还原能力的影响,确定其体外抗氧化活性。结果表明:丝瓜伤流液的pH为6.42,固形物为0.4 g/L,总酸(以柠檬酸计)为7.86 mg/L,无机盐为0.32 g/L,总糖为11.213 mg/L,多糖为4.054 µg/L。还原糖、蛋白质、游离氨基酸均未检测出;含有4种烷类,4种酮类,3种醛类,3种酚类,3种胺类和1种酸类物质;丝瓜伤流液的原液对·OH及DPPH清除率最高,分别为63.4%、46.7%;在4℃的条件下,其对·OH及DPPH清除能力及还原能力最强。综合分析,冷藏的丝瓜伤流液原液具有较强的体外抗氧化能力。
关键词 :丝瓜伤流液,理化性质,体外,抗氧化

1. 引言
丝瓜(Luffa cylindrical, LC)又名天罗、天丝瓜和布瓜等,属葫芦科一年生攀援性草本植物,是我国夏秋季节主要的瓜果类蔬菜之一,在我国南北各地被广泛种植 [1] - [3] 。丝瓜不仅含有丰富的多糖、蛋白质、瓜氨酸、甾醇、三萜、微量元素及黄酮类化合物等成分,而且含有皂苷、木质素、氢氰酸、木聚糖、纤维素、苦味质、半乳聚糖和甘露聚糖等多种药用化学成分。现代药理学研究表明,丝瓜亦具有抗辐射、抗病毒、抗肿瘤、抗坏血病、抗真菌及增强机体免疫等作用 [4] - [8] 。
丝瓜伤流液是在丝瓜生长旺盛时,取粗大健壮的植株从近根处或嫩茎处剪断,收集从藤中流出的汁液,中药名为“天罗水”。其药食兼用,可消痰火,解毒如神,兼清内热,治肺痈、肺萎,具有“镇咳,治头痛、腹痛、感冒、脚气水肿及酒中毒”等作用 [9] [10] 。其对因自由基介导的卵黄脂质过氧化和红细胞溶血有一定的抑制作用。并且,具有抑制酪氨酸酶活性,抑制黑色素的生成,祛斑,预防老年斑的形成,延缓皮肤衰老等作用 [11] - [13] 。目前,丝瓜伤流液已被开发为护肤产品及功能性含片等产品 [14] 。本研究主要探讨其基本理化性质及其体外抗氧化活性,为其后续的产业化开发奠定技术基础。
2. 材料与方法
2.1. 原材料与试剂
丝瓜伤流液(产自合肥市新站区三十头镇);考马斯亮蓝G250、无水乙醇、95%乙醇、苯酚、浓硫酸、葡萄糖、磷酸、酒石酸钾钠、重苯酚、甲醇、氢氧化钠、氯化钠、亚硫酸钠、水杨酸、磷酸氢二钠、磷酸二氢钠、过氧化氢及DPPH均为分析纯。
2.2. 仪器与设备
HH-2型数显恒温水浴锅(江苏金坛市杰瑞尔电器有限公司有限公司);LGJ-12 型真空冷冻干燥机(北京松源华兴科技发展有限公司;BL-220H型电子天平(福州科迪电子科技有限公司);PHS-2型精密pH计(上海精密科学仪器有限公司);DGZ20/4型电热真空真空干燥箱(南京实验仪器厂);722E型可见分光光度计(上海光谱仪器有限公司);FA1104N型分析天平(上海民侨医疗仪器有限公司);S-433D型氨基酸自动分析仪(德国SYKAM公司);LDZX-30KBS型立式压力蒸汽灭菌锅(上海申安医疗器械厂);R-201型旋转蒸发仪(上海申胜生物技术有限公司);SHZ-D型循环水式真空泵(巩义市予华仪器有限公司);SCION TQ型气质联用仪(布鲁克公司)等。
2.3. 测定方法
2.3.1. 主要理化成分的检测
pH值:pH计法 [15] ;固形物:折光计法 [16] ;蛋白质:考马斯亮蓝法 [17] ;游离氨基酸:氨基酸自动分析仪法;还原糖:DNS法 [18] ;总糖:直接滴定法 [19] ;总酸:电位滴定法 [20] ;无机盐:粗灰分法 [21] 。
2.3.2. 多酚类测定
取少量丝瓜伤流液于试管中,分别加入高锰酸钾溶液、1%FeCl3溶液、1%FeCl3-1%KFe(CN)6溶液和中性醋酸铅溶液,观察试管的颜色变化;在200~800 nm进行全波段扫描,来确定伤流液中是否有酚类。
2.3.3. 矿质元素的测定
奈氏试剂的配制:将10 g碘化汞和7 g碘化钾溶于10 mL水中,另取70 mL水于100 mL容量瓶中,加入24.4 g氢氧化钾,并冷却至室温。将上述碘化汞和碘化钾溶液慢慢加入100 mL容量瓶中,加水至刻度,摇匀,保存在棕色玻璃瓶中,于暗处放置2天后使用。
二苯胺试剂的配制:A液:取1.5 g二苯胺(C12H11N)溶于100 mL乙酸中,再加入1.5 mL浓硫酸,棕色瓶保存。如乙酸呈结晶状态,则需加热熔化后,再使用。B液:体积分数为0.2%乙醛溶液。将0.1 mL的B液加入到10 mL的A液中,制成二苯胺试剂,现配现用。
如表1所示,丝瓜伤流液分别与各试剂反应,定性分析伤流液中是否含有氨态氮( )、硝态氮(
)、硝态氮(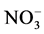 )和自由氨基。
)和自由氨基。
2.3.4. GC-MS检测
样品制备:取0.2 g丝瓜伤流液冻干粉用甲醇萃取备用。色谱条件如下。色谱柱:DB-5MS毛细管色谱柱(60 m × 0.32 mm,1 µm,Agilent公司);升温程序:起始柱温40℃,保持3 min,以2℃/min上升至60℃,保持2 min;再以8℃/min上升至108℃,保持2 min,再以8℃/min上升至220℃,保持18 min载气为He气,流速1 mL/min;恒压40 kPa,不分流。质谱条件:电子轰击(EI)离子源;电子能量70 eV;进样口温度与接口温度均为250℃,检测温度240℃;离子源温度200℃;质量扫描范围m/z 45~450。化合物定性与定量:利用布鲁克GC-MS solution工作站与NIST 11 library数据库检索,从而确定其化学成分;化合物相对百分含量按峰面积归一化计算,并应用Excel软件分析处理数据。
2.3.5. 清除·OH的能力
反应体系中含有8.8 mmol/L H2O2 1 mL、9 mmol/L FeSO4 1 mL、9 mmol/L水杨酸–乙醇1 mL以及
Table 1. Determination of mineral elements of BS
表1. 丝瓜伤流液中矿质元素的检测
不同浓度(0%、20%、40%、60%、80%及100%)的样品溶液1 mL。最后,加入H2O2启动Fenton反应,摇匀,在37℃温度下反应30 min后,以蒸馏水为参比,在510 nm下测定各浓度的吸光度。以9 mmol/LFeSO4 1 mL,9 mmol/L水杨酸–乙醇1 mL,不同浓度(0%、20%、40%、60%、80%及100%)的丝瓜伤流液和蒸馏水各1 mL作为空白对照。每个浓度重复3次,取平均值。·OH自由基清除率的计算如公式(1)所示。
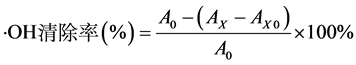 (1)
(1)
其中:A0——不加样液空白对照液的吸光度;
Ax——加入样液后的吸光度;
AX0——不加显色剂H2O2样品溶液的吸光度。
2.3.6. 清除DPPH的能力
准确称量40 mg DPPH用无水乙醇定容至250 mL,得到浓度为4 × 10−4 mol/L DPPH溶液。然后,分别量取0%、20%、40%、60%、80%及100%丝瓜伤流液溶液2 mL于10 m试管中,再加入DPPH溶液2 mL,在517 nm下测吸光值;空白组为2 mL无水乙醇溶液代替DPPH溶液;对照组为2 mLDPPH溶液与2 mL蒸馏水;并以等体积蒸馏水和无水乙醇混合液作为空白调零。DPPH自由基清除率(K)的计算如公式2所示。
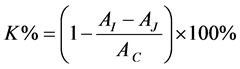 (2)
(2)
其中:AI——2 mLDPPH + 2 mL待测溶液的吸光度;
AJ——2 mL无水乙醇 + 2 mL待测溶液的吸光度;
AC——2 mL DPPH + 2 mL无水乙醇的吸光度。
2.3.7. 还原力的测定 [22]
分别取丝瓜伤流液0、1、2、3、4及5 mL加入试管中,添加1%铁氰化钾2.5 mL和0.2 mol/L的磷酸盐缓冲液(pH6.6) 2.5 mL,补加蒸馏水至10 mL,摇匀, 在50℃下保温20 min。然后,加入10 mg/mL三氯乙酸2.5 mL,混匀后在3000 rpm/min下离心10 min,取上清液2.5 mL,加入蒸馏水2.5 mL,1 g/L的FeCl30.5 mL混匀,37℃下保温10 min。用试剂空白作参比,Vc作为标准对照,在700 nm的条件下测定混合溶液的吸光度值。
2.3.8. 贮藏时间对·OH和DPPH清除能力的影响
分别量取相同体积丝瓜伤流液于试管中,敞口放在室温下,每隔10小时测定清除·OH及DPPH能力,测定方法同上。
2.3.9. 不同处理温度对·OH、DPPH清除能力及还原能力的影响
分别量取相同体积的丝瓜伤流液于4℃、25℃、50℃、75℃、100℃的条件下下放置4 h,按照上述测定方法测定丝瓜伤流液清除·OH、DPPH能力及还原力。
2.3.10. 统计分析
所有试验均平行三次,试验结果取三次的平均值。
3. 结果与分析
3.1. 丝瓜伤流液中氨基态氮、硝态氮和自由氨基的定性分析
如表2所示,在丝瓜伤流液中按照顺序加入上述各试剂后,在一定的条件下反应,结果均有显色反应发生,初步说明其中含有氨基态氮(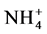 )、硝态氮(
)、硝态氮(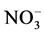 )和自由氨基。
)和自由氨基。
3.2. 丝瓜伤流液中酚类物质的定性分析
KMnO4溶液、FeCl3溶液及FeCl3-KFe(CN)6溶液与酚类物质发生特征显色反应。由表3可知,丝瓜伤流液能够使KMnO4溶液褪色,FeCl3溶液中呈蓝绿色,还能使FeCl3-KFe(CN)6溶液显蓝色反应,并且在其中滴加饱和中性醋酸铅溶液后,产生蓝紫色沉淀,并且随着饱和中性醋酸铅加入量的增多,沉淀增多。由图1可以看出,丝瓜伤流液在在215 nm附近有特征吸收峰,综上所述,丝瓜伤流液中含有酚类物质 [23] 。
Table 2. The test results of mineral elements of BS
表2. 丝瓜伤流液中氨基态氮、硝态氮和自由氨基的检测结果
Table 3. The test results of phenols of BS
表3. 丝瓜伤流液中酚类物质的检测结果
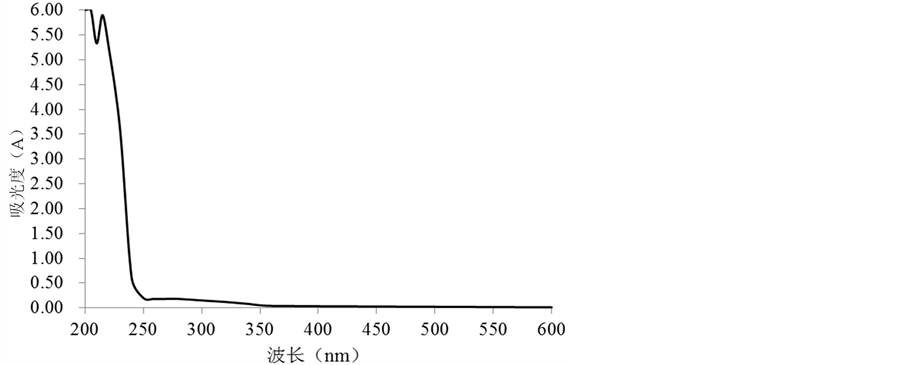
Figure 1. Full spectrum scan of BS
图1. 丝瓜伤流液的全波长扫描图谱
3.3. 丝瓜伤流液中小分子有机成分分析
植物的根不仅是重要的合成器官,而且是水分和矿质营养的吸收器官。根系吸收的无机盐,有一部分在根中进行初级同化,转变成有机物并向地上部分运输 [24] 。因此,伤流液中除含大量水分和无机盐外,还含有少量的有机物。
丝瓜伤流液的总离子流图见图2;其小分子有机成分分析结果见表4。很显然,其成分组成主要为:烷类4种,占76.008%;酮类4种,占4.518%;醛类3种,占10.042%;酚类3种,占6.686%,胺类3种,占0.609%;酸类1种,占0.479%;其他占0.137%。
3.4. 丝瓜伤流液的主要化学成分
由表5 可以看出,丝瓜伤流液的pH值为6.42,固形物含量为0.4 g/L,总酸含量(以柠檬酸计)为7.86 mg/L,无机盐为0.32 g/L,总糖含量为11.213 mg/L,多糖含量为4.054 µg/L。还原糖、蛋白质及游离氨基酸均未检测出。
3.5. 丝瓜伤流液的还原力
样品的还原能力与其抗氧化能力呈正相关。在700 nm的波长下测定样品的吸光值,值越大,反映其还原能力越强。由图3可以看出,丝瓜伤流液具有一定的还原能力,且随着浓度的增大,还原能力越强。
3.6. 不同浓度的丝瓜伤流液对·OH、DPPH的清除作用
不同浓度的丝瓜伤流液对·OH和DPPH的清除能力如图4所示。可以看出,丝瓜伤流液具有一定的体外清除·OH和DPPH的能力,且随着浓度的增大其清除能力逐渐越大,呈现正相关。100%的丝瓜伤流液(原液)清除自由基的能力最大,分别可以清除体系内46.7%的DPPH和63.4%的·OH,并且丝瓜伤流液清除·OH的能力高于其清除DPPH的能力。原因是在细胞内,最先形成的ROS是超氧阴离子(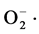 ),超氧阴离子继而被转化为羟自由基(·OH),羟自由基是机体内活性最高的一种活性氧,会优先被清除。因此,丝瓜伤流液清除·OH能力会比清除DPPH能力稍强 [25] 。
),超氧阴离子继而被转化为羟自由基(·OH),羟自由基是机体内活性最高的一种活性氧,会优先被清除。因此,丝瓜伤流液清除·OH能力会比清除DPPH能力稍强 [25] 。
3.7. 贮藏时间对丝瓜伤流液清除·OH及DPPH能力的影响
丝瓜伤流液在室温下敞口放置0~50 h,其对·OH及DPPH清除率的变化如图5所示,随着贮藏时间的增加,丝瓜伤流液对·OH及DPPH的清除率逐渐减低。在20~30 h时,丝瓜伤流液对·OH能力下降明
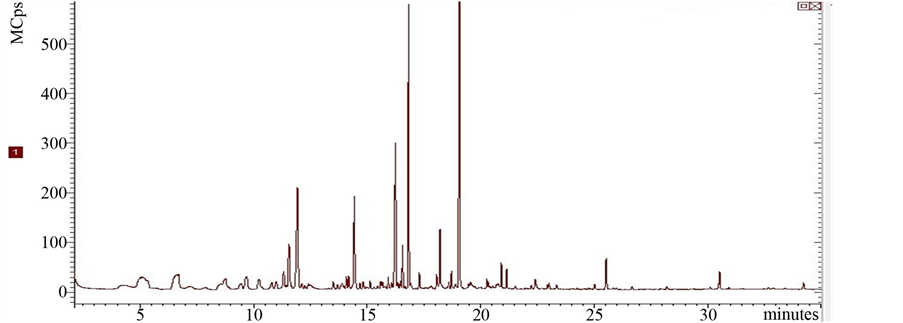
Figure 2. Total ion chromatogram of BS
图2. 丝瓜伤流液的总离子流图
Table 4. Results of fermented BS by GC-MS
表4. 丝瓜伤流液中小分子有机成分分析结果
Table 5. Basic physicochemical properties of BS
表5. 丝瓜伤流液中主要化学成分
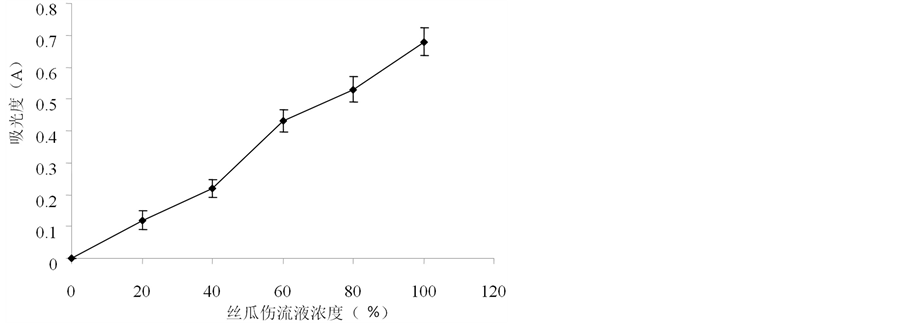
Figure 3. Total ion chromatogram of BS
图3. 丝瓜伤流液的总离子流图
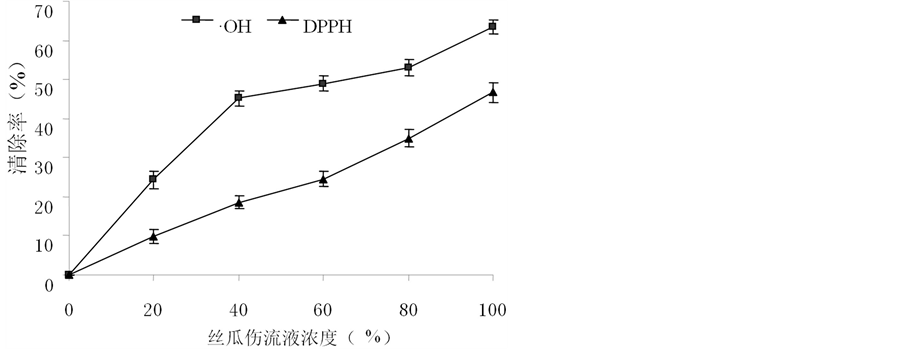
Figure 4. Reducing ability of BS at different concentrations
图4. 不同浓度的丝瓜伤流液对OH和DPPH的清除效应
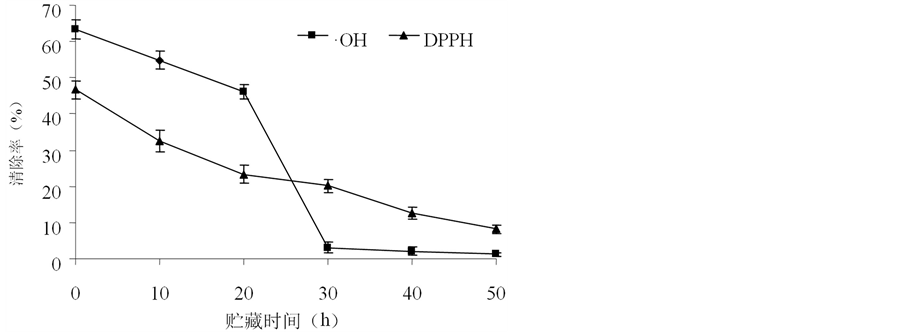
Figure 5. Effects of different time on ·OH and DPPH radical scavenging ability of BS
图5. 贮藏时间对丝瓜伤流液清除OH和DPPH的影响
显,且30 h基本失去对·OH的清除能力;丝瓜伤流液对DPPH清除能力的稳定性较·OH稳定,且清除能力维持时间较长。因此,伤流液在平时保存中要注意密封,开发相关产品时要选择新鲜的丝瓜伤流液。
3.8. 温度对丝瓜伤流液清除·OH及DPPH能力的影响
经过不同温度处理的丝瓜伤流液,其清除·OH与DPPH的能力如图6所示,随着温度的升高,丝瓜伤流液清除·OH与DPPH的能力逐渐下降。因此,冷藏的丝瓜伤流液体外抗氧化效果最佳。而丝瓜伤流液抗氧化效果可能与其中含有3,4-二烯-2-庚酮和3-甲基-1,2-邻苯二酚等物质有关。
3.9. 温度对丝瓜伤流液还原能力的影响
分别经过不同温度处理的丝瓜伤流液,其还原能力如图7所示。吸光度高低与丝瓜伤流液还原能力呈正相关。对于同一样品,还原能力随着温度的升高逐渐降低。4℃的冷藏条件下,还原能力最高。其还原能力可能与丝瓜伤流液中的3,4-二烯-2-庚酮和正戊醛有关 [26] 。

Figure 6. Effects of different temperature on ·OH and DPPH radical scavenging ability of BS
图6. 温度对丝瓜伤流液清除OH和DPPH的影响

Figure 7. Effects of temperature on reducing ability of BS
图7. 处理温度对丝瓜伤流液还原能力的影响
4. 结论
丝瓜伤流液的pH值为6.42,固形物含量为0.4 g/L,总酸含量(以柠檬酸计)为7.86 mg/L,无机盐为0.32 g/L,总糖为11.213 mg/L,多糖为4.054 µg/L。还原糖、蛋白质、游离氨基酸均未检测出;GC-MS分析表明,其含有4种烷类,4种酮类,3种醛类,3种酚类,3种胺类和1种酸类物质。最后,丝瓜伤流液原液对·OH及DPPH清除率最高,分别为63.4%、46.7%,起作用的物质可能为3,4-二烯-2-庚酮及 3-甲基-1,2-邻苯二酚;在4℃下还原能力最高,其中起还原作用的物质可能为3,4-二烯-2-庚酮和正戊醛。因此,丝瓜伤流液中的抗氧化物质可能为3,4-二烯-2-庚酮、3-甲基-1,2-邻苯二酚和正戊醛。
基金项目
国家级星火计划项目“安徽特色农产品绿色加工及产业化”项目编号:2013GA710003。子课题“标准化丝瓜基地建设及丝瓜伤流液加工产业化”;国家自然科学基金项目(31171787)。
文章引用
王晓莉,丁 琦,孙汉巨,李丹丹,章萍萍,何鹏程,何述栋,操小栋. 丝瓜伤流液的化学组成及体外抗氧化活性的研究
Chemical Composition of Bleeding Sap of Sponge Gourd and in Vitro Antioxidant Activity[J]. 食品与营养科学, 2015, 04(04): 101-110. http://dx.doi.org/10.12677/HJFNS.2015.44014
参考文献 (References)
- 1. 宋士清, 刘桂智, 刘微, 等. 丝瓜的药用价值研究概述[J]. 园艺园林科学, 2004, 20(2): 166-167.
- 2. 仝金文. 北方地区普通丝瓜的栽培技术[J]. 科技致富向导, 2010(6): 282-283.
- 3. 杜黎黎, 王晓莉, 孙汉巨, 等. 丝瓜伤流液的体内抗氧化活性研究[J]. 农产品加工(学刊), 2013(11): 1-3.
- 4. 苏小俊, 徐海, 高军, 等. 普通丝瓜果实性状的遗传分析[J]. 江苏农业学报, 2009, 25(5): 1112-1118.
- 5. 江苏新医学院. 中药大词典[M]. 上海: 上海人民出版社, 1977.
- 6. Ng, Y.M., Yang, Y., Sze, K.H., Zhang, X., Zheng, Y.T. and Shaw, P.C. (2011) Structural Charac-terization and Anti- HIV-Activities of Arginine/Glutamate-Rich Polypeptide Luffin P1 from the Seeds of Sponge Gourd (Luffa cylindrica). Journal of Structural Biology, 174, 164-172. http://dx.doi.org/10.1016/j.jsb.2010.12.007
- 7. Khajuria, A., Gupta, A., Garai, S. and Wakhloo, B.P. (2007) Immunomodulatory Effects of Two Sapogenins 1 and 2 Isolated from Luffa Cylindrical in Balb/C Mice. Bioorganic & Medical Chemistry Letters, 17, 1608-1612. http://dx.doi.org/10.1016/j.bmcl.2006.12.091
- 8. 熊淑玲, 方乍浦, 曾宪仪. 丝瓜化学成分的分离与鉴定[J]. 中国中药杂志, 1994(4): 233-234.
- 9. 王蔓丽, 唐泽紫, 陈敏敏, 等. 丝瓜伤流液的抗氧化活性及稳定性研究[J]. 食品科技, 2009(7): 149-154.
- 10. Du, Q., Xu, Y., Li, L., Zhao, Y., Jerz, G., Winterhalter, P. (2006) Antioxidant Con-stituents in the Fruits of Luffa cylindrica (L.) Roem. Journal of Agricultural and Food Chemistry, 54, 4186-4190. http://dx.doi.org/10.1021/jf0604790
- 11. 刘微, 朱小平, 侯东军, 等. 丝瓜伤流液对食用菌的保鲜效果[J]. 中国农学通报, 2004, 20(2): 63-66.
- 12. 王洋阳, 唐泽紫, 陈敏敏, 等. 丝瓜伤流液中抗氧化物质的初步探讨[J]. 食品工业科技, 2009(3): 84-87.
- 13. 刘微, 朱小平, 王之岭, 等. 丝瓜伤流液对果蔬几种病菌的抑制活性[J]. 中国农学通报, 2004, 20(3): 224-226.
- 14. 王晓莉, 杨帆, 孙汉巨, 等. 丝瓜伤流液含片的工艺研究[J]. 农产品加工(学刊), 2013(1): 24-30.
- 15. GB/T 6920-86食品安全国家标准食品中pH的测定[S]. 1986
- 16. GB/T 12143.1-88食品安全国家标准食品中固形物的测定[S]. 1988.
- 17. 许淑芳, 朱江, 刘邻渭. 考马斯亮兰G-250法测定苹果浓缩汁生产中的蛋白含量[J]. 饮料工业, 2005, 8(1): 45-47.
- 18. 赵凯, 许鹏举, 谷广烨. 3,5-二硝基水杨酸比色法测定还原糖含量的研究[J]. 食品科学, 2008, 29(8): 534-536.
- 19. GB/T 15038-2006食品安全国家标准食品中总糖的测定[S]. 2006.
- 20. GB/T 12456-90食品安全国家标准食品中总酸的测定[S]. 1990.
- 21. GB/T 5009.4-85食品安全国家标准食品中无机盐的测定[S]. 1985.
- 22. 张艳芳. 苦瓜伤流液降血糖及抗氧化活性研究[D]: [硕士学位论文]. 镇江: 江苏大学, 2008.
- 23. Xiang, Z. and Ning, Z. (2008) Scavenging and Antioxidant Properties of Com-pound Derived from Chlorogenic Acid in South-China Honeysuckle. LWT—Food science and Technology, 41, 1189-1203. http://dx.doi.org/10.1016/j.lwt.2007.08.006
- 24. 黎晶晶, 徐格非. 苯酚–硫酸法测定灵芝多糖含量的研究[J]. 杭州化工, 2008, 38(1): 23-26.
- 25. 吴谋成. 食品分析与感官评定[M]. 北京: 中国农业出版社, 2002.
- 26. 王晓莉. 丝瓜伤流液的抗氧化及对细胞增殖作用研究[D]: [硕士学位论文]. 合肥: 合肥工业大学, 2014.
