Medical Diagnosis
Vol.06 No.03(2016), Article ID:18542,9
pages
10.12677/MD.2016.63011
Pancreatic Neuroendocrine Tumors: Correlation between the Imaging Findings and Pathology
Yuting Zhang, Daming Li, Fengxian Wei, Dan Wang, Junlin Zhou
Department of Radiology, Lanzhou University Second Hospital, Lanzhou Gansu

Received: Aug. 19th, 2016; accepted: Sep. 9th, 2016; published: Sep. 14th, 2016
Copyright © 2016 by authors and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY).
http://creativecommons.org/licenses/by/4.0/



ABSTRACT
Objective: To investigate imaging features of pancreatic neuroendocrine tumors (PanNETs), so as to improve its clinical diagnosis. Materials and Methods: A retrospective analysis of the imaging data of 24 patients with pathologically confirmed PanNETs is conducted and the results were compared with the pathology. Results: There were 8 functional PanNETs with an average size of 2.1 cm × 2.6 cm, which showed homogeneous density or signal, 1 case of which had invasion of duodenum. There were 16 non-functional PanNETs with an average size of 2.5 cm × 4.3 cm, nine of which were solid lesions, seven of which were cystic lesions. Solid part of the PanNETs showed equal or slightly low density, and slightly longer T1, T2 signal in the MRI. Cystic part of the PanNETs showed water-like density or signal. 6 cases had unclear boundaries with duodenum, 1 case had unclear boundaries with spleen, and two cases appeared to thinner splenic vein. 5 cases had lymph node metastasis in retroperitoneal or peripancreatic. Contrast-enhanced examinations showed that 17 lesions had marked enhancement, 7 lesions had mild-moderate enhancement, and 9 lesions had capsule marked ring-like enhancement. 19 lesions had decreased enhancement in the portal venous phase and delay phase, 3 lesions had progressive enhancement, and 2 lesions had filled enhancement. The preoperative accuracy of diagnosis compared with pathology was 67% (16/24). Conclusion: Functional PanNETs could be manifested as small solid nodules, and non-functional ones could be manifested as large heterogeneous lump. PanNETs were characterized by marked enhancement with capsule marked ring-like enhancement during contrast scanning, mild-moderate enhancement and obviously cystic changes were relatively rare.
Keywords:Pancreatic Neuroendocrine Tumors, Magnetic Resonance Imaging, Computed Tomography, Pathology

胰腺神经内分泌肿瘤的影像学表现与病理对照分析
张玉婷,李大铭,魏丰贤,王丹,周俊林
兰州大学第二医院放射科,兰州 甘肃

收稿日期:2016年8月19日;录用日期:2016年9月9日;发布日期:2016年9月14日

摘 要
目的:探讨胰腺神经内分泌肿瘤的影像学特征,以提高对其诊断水平。方法:回顾性分析24例经病理证实的胰腺神经内分泌肿瘤患者的影像资料,并与病理结果进行对照分析。结果:8例功能性胰腺神经内分泌肿瘤平均大小为2.1 cm × 2.6 cm,平扫7例呈均匀的等或稍低密度,1例呈稍长T1、稍长T2信号,1例胰头肿瘤侵及十二指肠;16例非功能性胰腺神经内分泌肿瘤平均大小为2.5 cm × 4.3 cm,其中9例为实性,5例为囊实性,2例为囊性,实性部分呈等或稍低密度,MRI上呈稍长T1、稍长T2信号,囊性部分呈近似水样密度或信号,6例与十二指肠分界不清,2例出现脾静脉局部变细,1例肿瘤与脾脏分界不清,5例出现腹膜后或胰周淋巴结转移。增强扫描动脉期17例表现为明显强化,7例表现为轻-中度强化,9例可见包膜环形强化;与动脉期强化程度相比,门静脉期及延迟期19例强化程度下降,另有2例呈肝血管瘤样的填充式强化,3例呈渐进性强化。与手术病理诊断对照,术前影像诊断符合率为67% (16/24)。结论:功能性胰腺神经内分泌肿瘤多表现为较小的实性结节,非功能性者多表现为较大的不均质肿块,增强扫描呈明显强化、包膜环形强化为其特征,轻-中度强化及明显囊变者相对少见。
关键词 :胰腺神经内分泌肿瘤,磁共振成像,计算机体层摄影术,病理表现

1. 引言
胰腺神经内分泌肿瘤(pancreatic neuroendocrine tumors, PanNETs)是一种少见的胰腺肿瘤,近年来其发病率呈不断上升趋势。影像学对PanNETs的诊断仍存在不足,容易发生误诊和漏诊,而PanNETs具有很高的恶性率,如能及早确诊、及时治疗,预后较好 [1] 。故探讨PanNETs的影像学表现,对于提高PanNETs的诊断率以及临床制定适当的治疗方案有重要价值。笔者收集24例PanNETs的临床及影像资料,并与手术、病理结果进行对照分析,以期提高对该病的认识和诊断率,现报道如下。
2. 资料与方法
2.1. 一般资料
回顾性分析2012年1月至2015年9月确诊的24例PanNETs患者的临床及影像资料,其中女8例,男16例;年龄27~56岁,平均(44 ± 13)岁。纳入标准:1) 临床资料完整;2) 手术病理结果证实为胰腺神经内分泌肿瘤(G1-G3级);3) 术前未经任何放、化疗或其他相关治疗;排除标准:胃肠道气体伪影明显,影响图像观察或者病灶测量者。1例表现为双小腿及双足背皮肤反复出丘疹、红斑,瘙痒明显;7例表现为间断发作性晕厥、软瘫,发作时视物不清明显,伴有意识丧失、头晕、心慌等,予以高糖饮食后上述症状可缓解;12例表现为上腹部不同程度的胀痛不适,其中3例伴有梗阻性黄疸;另外4例为体检时发现,无明显临床症状。术前19例行CT平扫及增强检查,10例行MR平扫及增强检查,其中5例同时行CT、MR检查。
2.2. 设备与方法
CT检查:4例患者于术前采用GE宝石CT (Discovery 750HD)扫描仪进行平扫及增强检查。检查前禁饮食8 h,扫描前30 min口服清水500 ml。行螺旋扫描,选择管电压120 kV,管电流选择在噪声指数(noise index)为9.0的条件下Auto mA,准直器宽度0.625 mm,螺距1.0。层厚与层间距均为5 mm,增强扫描采用对比剂优维显(300 mgI/m1) 100 m1以3.5 ml/s的流率经肘正中静脉注射,腹部采用三期增强扫描,分别在注射后25~30 s行动脉期扫描、45 s行门静脉期扫描、120 s行延迟期扫描。原始数据在GE AW4.6 (Advanced Workstation 4.6)工作站进行观察和分析,以MPR进行多平面重建。
MR检查:4例患者于术前采用Siemens 3.0T超导磁共振扫描仪进行平扫及增强检查。扫描范围自膈顶至肝下缘,连续扫描15~18层,层厚8 mm,间距2 mm。扫描序列包括常规轴面和冠状面序列:1) 常规SE序列T1WI、T2WI;2) 脂肪抑制T2WI(FS-T2WI);3) 脂肪抑制T1WI(FS-T1WI)平扫和动态增强,采用快速多平面扰相梯度回波(FMPSPGR)序列,对比剂为钆喷替酸葡甲胺(Gd-DTPA) 15 ml,以3.0 ml/s的流率经肘正中静脉注射,分别于动脉期(25 s)、胰期(45 s)、门静脉期(65 s)、延迟期(120 s、180 s)各屏气扫描1次。动态增强扫描层厚5 mm,间隔1 mm,矩阵256 × 160。
影像观测指标:由两名高年资影像诊断医师对所有CT、MRI图像共同阅片,评价并记录胰腺肿瘤的位置、直径、形态、密度/信号、有无坏死或囊变、出血、钙化、边界清晰与否、是否伴有胰管或胆总管扩张、强化特征、有无邻近结构侵犯以及淋巴结或肝脏转移。其中病变直径测量选择轴面及冠状面重建病变最大截面进行测量。
手术:8例行肿瘤摘除术,7例行胰头十二指肠切除术,2例行腹腔镜下胰体尾部切除术,1例行胰体尾部 + 脾脏切除术,6例行根治性胰十二指肠切除术。
病理检查:手术切除的组织标本经10%甲醛液固定,常规脱水,石蜡包埋,4 μm切片HE染色。免疫组织化学染色采用S-P法或EnVision法,选择细胞角蛋白(cytokeratin, CK)、神经元特异性烯醇化酶(neuron specific enolylase, NSE)、波形蛋白(vimentin, Vim)、突触素(synaptophysin, Syn)、嗜铬粒蛋白(chromogranin, CgA)、神经细胞粘附分子(CD56)等抗体进行免疫组织化学染色。光学显微镜下分析病变的病理组织形态及免疫表型。
3. 结果
3.1. 基本情况
肿瘤病灶共24个,其中位于胰头部14个,胰体部6个,胰尾部4个。经临床和病理诊断功能性PanNETs 8例,包括7例胰岛素瘤和1例胰高血糖素瘤;非功能性PanNETs 16例。功能性PanNETs大小范围0.8 cm × 1.2 cm~3.5 cm × 4.0 cm,平均2.1 cm × 2.6 cm;非功能性PanNETs大小范围0.5 cm × 0.8 cm~3.7 cm × 5.2 cm,平均2.5 cm × 4.3 cm。与手术病理诊断对照,术前影像诊断符合率为67% (16/24),8例分别误诊为十二指肠间质瘤1例,胰腺癌5例,胰腺黏液性囊腺瘤、囊腺癌各1例。
3.2. 肿瘤的CT、MRI表现
平扫:8例功能性PanNETs均表现为类圆形结节或肿块影(图1(a)),与正常胰腺组织相比,5例呈均

 (a) (b)
(a) (b)

 (c) (d)
(c) (d)
 (e) (f)(a) CT平扫示胰头部似可见一类圆形等密度结节;(b) 增强扫描动脉期病变呈明显强化,强化程度高于正常胰腺实质;(c),(d) 门静脉期及延迟期病变强化程度逐渐降低;(e) 细胞轻度异型,核分裂象小于2/10HPFs (HE ×400);(f) 免疫组化染色示Syn (+) (HE ×200)
(e) (f)(a) CT平扫示胰头部似可见一类圆形等密度结节;(b) 增强扫描动脉期病变呈明显强化,强化程度高于正常胰腺实质;(c),(d) 门静脉期及延迟期病变强化程度逐渐降低;(e) 细胞轻度异型,核分裂象小于2/10HPFs (HE ×400);(f) 免疫组化染色示Syn (+) (HE ×200)
Figure 1. Functional PanNETs (G1)
图1. 功能性PanNETs G1级
匀等密度,2例呈稍低密度,1例胰高血糖素瘤呈稍长T1、稍长T2信号;6例病灶边界清楚,2例边界欠清,其中1例胰头肿瘤侵及十二指肠降段;3例伴有胆总管及胰管扩张;8例均未出现局部淋巴结转移或其他脏器的转移。16例非功能性PanNETs中11例表现为类圆形肿块,5例呈不规则形(图3(a));9例为实性,5例为囊实性,2例为囊性,实性部分呈等或稍低密度,MRI扫描呈稍长T1、稍长T2信号,囊性部分呈近似水样密度或信号,其中1例囊内见等T1稍短T2出血信号(图2(a)、图2(b)),另有3例瘤体内见点状、结节状钙化;5例病灶边界清楚,11例边界模糊,其中6例肿瘤位于胰头者与十二指肠分界不清,3例肿瘤位于胰腺体部及尾部者,2例出现脾静脉局部变细(其中1例脉管内见癌栓),1例肿瘤与脾脏分界不清;8例伴有胰胆管不同程度扩张,3例出现胰体尾萎缩;5例出现腹膜后或胰周淋巴结转移,无一例出现其他脏器的转移(表1)。
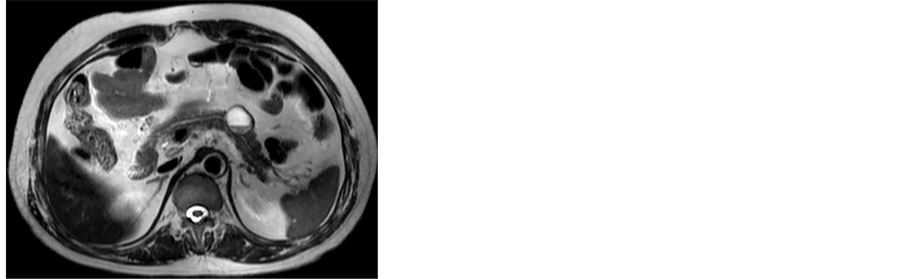
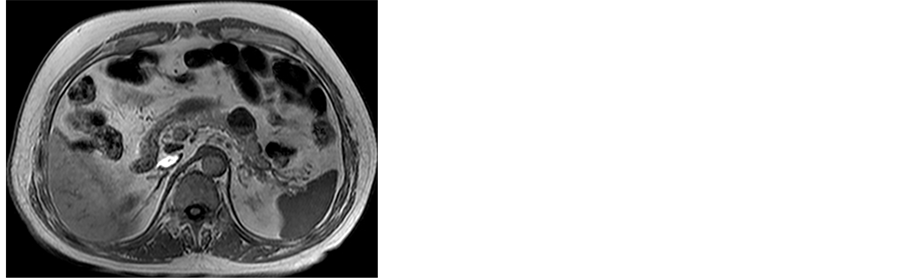 (a) (b)
(a) (b)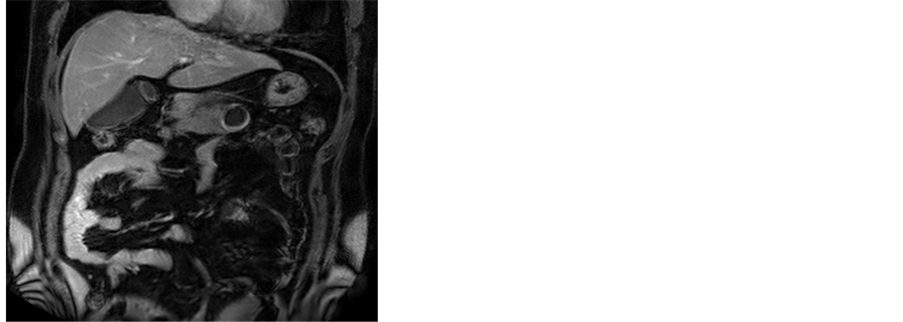
 (c) (d)(a),(b) T2WI及T1WI轴位示胰体部见一类圆形囊性病灶,其内可见分层,上层为长T1长T2信号影,下层为等T1稍短T2信号影,边界较清;(c) 增强扫描门静脉期囊壁呈不均匀中度强化;(d) 免疫组化染色示CD56 (+) (HE ×200)
(c) (d)(a),(b) T2WI及T1WI轴位示胰体部见一类圆形囊性病灶,其内可见分层,上层为长T1长T2信号影,下层为等T1稍短T2信号影,边界较清;(c) 增强扫描门静脉期囊壁呈不均匀中度强化;(d) 免疫组化染色示CD56 (+) (HE ×200)
Figure 2. Non-functional PanNETs (G2)
图2. 非功能性PanNETs G2级
Table 1. The CT/MRI plain scan findings of 24 cases of PanNETs
表1. 24例PanNETs的CT/MRI平扫特征
增强:根据病灶动脉期的强化程度分为明显强化(强化程度接近主动脉强化)、中度强化(强化程度类似门静脉期肝脏的强化)和轻度强化(强化程度低于门静脉期肝脏的强化) 3种,本组8例功能性PanNETs中6例在增强扫描动脉期表现为明显强化(图1(b)),2例表现为中度强化,其中6例可见完整的包膜环形强化;16例非功能性PanNETs中11例呈明显强化(图3(b)),2例呈中度强化(图2(c)),3例呈轻度强化,其中3例可见完整的包膜环形强化。与动脉期强化程度相比,门静脉期及延迟期19例强化程度有所下降(图1(c)、图1(d)),2例呈肝血管瘤样的填充式强化,另有3例强化程度呈渐进性升高(表2)。
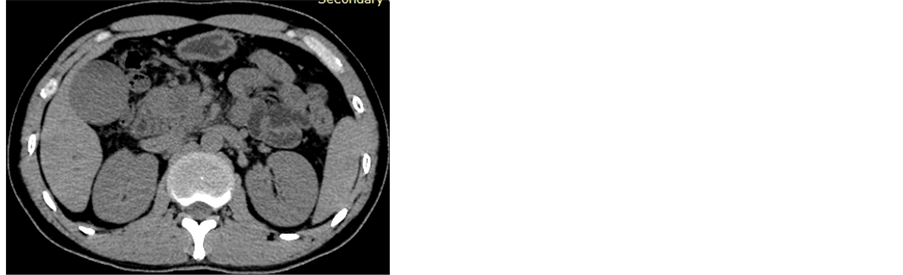
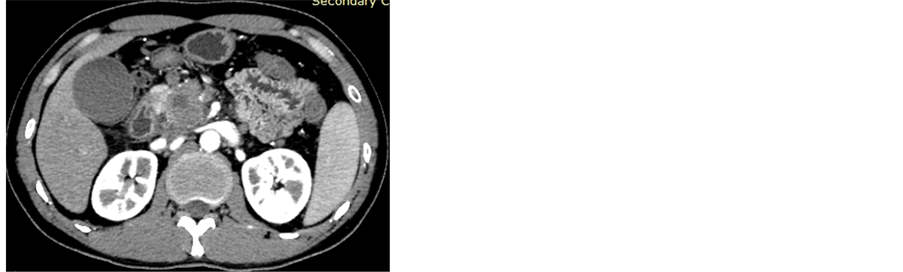 (a) (b)
(a) (b)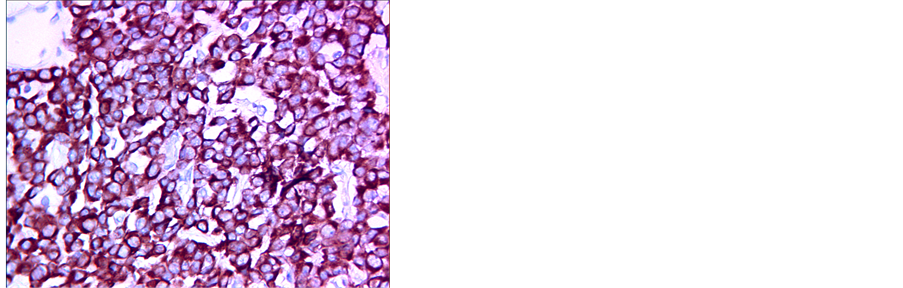 (c)(a) CT平扫示胰头部可见不规则形肿块影,其内见囊状低密度影;(b) 增强扫描动脉期示病变局部明显强化;(c) 免疫组化染色示Syn (+) (HE ×400)
(c)(a) CT平扫示胰头部可见不规则形肿块影,其内见囊状低密度影;(b) 增强扫描动脉期示病变局部明显强化;(c) 免疫组化染色示Syn (+) (HE ×400)
Figure 3. Non-functional PanNETs (G3)
图3. 非功能性PanNETs G3级
Table 2. The contrast-enhanced features of 24 cases of PanNETs
表2. 24例PanNETs的强化特征
3.3. 病理结果
3.3.1. 肿瘤分级、大体及镜下表现
24例患者均行手术切除,病理结果6例为PanNETs G3级,PanNETs G1和G2各9例。标本颜色呈灰白或灰红色,7例伴坏死、囊变,其中1例切开见一囊腔,囊内含棕红色液体。镜检示瘤细胞呈巢状、小梁状、腺泡状(图1(e))排列,瘤巢间血窦较丰富,细胞大小、形态较一致,胞浆红染、细颗粒状,核圆形、卵圆形,核仁清楚;14例与周围组织界限不清,其中5例瘤组织侵犯神经、脉管,1例侵及脾脏包膜;10例与周围组织界清,其中9例可见完整包膜。
3.3.2. 免疫组化
免疫组化染色显示神经内分泌标志物如突触素(Syn) (图1(f)、图3(c))、嗜铬粒蛋白(CgA)和细胞角蛋白8/18 (CK8/18)在所有病例中均为阳性,此外神经细胞粘附分子(CD56) (图2(d)) 17例为阳性,神经元特异性烯醇化酶(NSE) 13例为阳性。
4. 讨论
4.1. PanNETs的临床与病理特点
PanNETs是一种来源于肽能神经元或神经内分泌细胞的异质性肿瘤,仅占全部胰腺肿瘤的1%~2%,年发病率低于十万分之一 [2] 。PanNETs由Oberndorfer于1907年首先报道,并称之为类癌,它被描述为一种类似于腺癌但生物学行为更接近良性的肿瘤。然而,进一步的临床报告显示,部分类癌仍然有侵袭和转移的特性,肝脏为最常见的转移部位 [3] 。WHO 2010年最新分类弃用“类癌”这一概念,并且认为所有的PanNETs都具有不同程度恶性潜能,根据核分裂象计数和Ki-67指数分为G1级(核分裂象 < 2个/10 HPF,和/或Ki-67 ≤ 2%)、G2级(核分裂象2~20个/10 HPF,和/或Ki-67为2%~20%)和G3级(核分裂象 ≥ 20个/10 HPF,和/或Ki-67 > 20%),即低度、中度和高度恶性,分期和分级决定其预后 [4] 。
根据临床上有无内分泌症状,PanNETs可分为功能性PanNETs和非功能性PanNETs,前者包括胰岛素瘤、胃泌素瘤、舒血管肠肽瘤、胰高血糖素瘤、生长激素释放抑制激素瘤和部分类癌等,其临床表现因肿瘤分泌的主要活性物质不同而异;非功能性PanNETs早期常无特异性临床表现,当肿瘤生长较大压迫或浸润邻近脏器和结构时,方产生如上腹部不适和疼痛、梗阻性黄疸、黑便等临床表现 [5] 。本组24例PanNETs的临床表现与文献报道一致,16例非功能性PanNETs中12例表现为腹痛腹胀,4例无明显临床症状;另外8例功能性PanNETs中7例为胰岛素瘤,表现为间断发作性低血糖症状,1例为胰高血糖素瘤,表现为双小腿及双足背皮肤坏死松解性游走性红斑。
4.2. PanNETs的CT、MRI表现
关于PanNETs的好发部位文献报道不一,有研究认为好发于胰头部,也有统计以胰体尾部多见。本组病例以发生于胰头部居多,位于胰头部14例,位于胰体部和胰尾部分别为6例和4例。功能性PanNETs多数较小,CT平扫时不造成胰腺形态和轮廓改变;非功能性PanNETs多形成较大肿块,直径可达3~24 cm。本组功能性PanNETs平均大小为2.1 cm × 2.6 cm,非功能性PanNETs平均大小为2.5 cm × 4.3 cm大于功能性PanNETs,与文献报道一致。功能性PanNETs CT平扫多表现为类圆形肿块,边界锐利,常呈等或稍低密度,且密度均匀,在MRI上多呈稍长T1、稍长T2信号 [6] ;非功能性PanNETs CT平扫密度常不均匀,可出现更低密度坏死或囊变区,约20%可见结节状钙化,为非功能性PanNETs的特征之一 [7] ,在MRI上其信号亦呈不均匀稍长T1、稍长T2改变。本组8例功能性PanNETs中2例病灶边界欠清,可能是由于该肿瘤病理分级为G2级,呈浸润性生长所致。16例非功能性PanNETs中,3例CT平扫病灶内见钙化灶,7例见多发囊变,其中2例完全呈囊性改变,1例囊内见分层及出血信号。近年来有学者报道囊性PanNETs在非功能性PanNETs中占较大比例,约13%到17%之间 [8] 。囊性PanNETs囊变形成的原因尚存在争议,一般认为囊性PanNETs为实性PanNETs内发生坏死的结果,因此肿瘤的囊性部分在生物学行为和恶性潜能上与实性部分类似 [9] 。但是也有报告提出,PanNETs的囊变与坏死有着本质的不同 [10] ,与实性PanNETs相比,囊性PanNETs通常会表现为较低的病理分级和Ki-67的指数 [11] 。然而,这能否作为囊性PanNETs的有效预后因素仍有待进一步研究证实。恶性PanNETs除显示上述肿瘤本身表现外,还可发现血管或邻近组织侵犯、局部淋巴结肿大、肝转移等。本组15例G2和G3级PanNETs中,8例肿瘤位于胰头者与十二指肠分界不清,4例肿瘤位于胰腺体部及尾部者,3例出现脾静脉局部变细(其中1例脉管内见癌栓),1例肿瘤与脾脏分界不清,但均未见有肝转移。
典型的PanNETs具有富血供性,增强扫描动脉期肿瘤实性部分多表现为明显强化,强化程度高于正常胰腺组织,门静脉期肿瘤强化程度接近或略低于正常胰腺组织,延迟期肿瘤CT值较门静脉期下降 [12] 。本组有17例在增强扫描动脉期表现为明显强化,但其余7例仅呈轻-中度强化,这可能与肿瘤病理分级较高有关。Koji Takumi等 [13] 的研究表明肿瘤在门脉期和胰腺实质相比呈现低密度与G2级PanNETs具有明显相关性。周延等 [14] 的研究进一步表明高级别PanNETs更易发生瘤栓,导致肿瘤血供减少,故分化越差、病理分级越高的肿瘤的血供可能越差,影像所见其强化程度越低。本组PanNETs的强化方式有3例呈渐进性延迟强化,还有2例肝血管瘤样的填充式强化,这可能与肿瘤内纤维组织含量较多,或病灶较大时肿瘤血管迂曲扩张,对比剂进入肿瘤的时间延长有关。部分PanNETs在增强扫描时可出现瘤体周边环形薄壁明显强化,强化程度高于正常胰腺及瘤体内部,此征象被认为是PanNETs的另一特征性的影像表现 [5] ,这与病理显示PanNETs多带有部分或完整的包膜且包膜血窦丰富相一致。本组9例PanNETs可见环形的包膜强化,其余病例未出现这一典型征象的原因可能是部分肿瘤恶性程度较高以致包膜受侵破坏,也可能是部分肿瘤强化程度较低,包膜的强化未能超过正常胰腺组织而突显出来。
4.3. 鉴别诊断
PanNETs发生明显囊变时需鉴别:1) 胰腺黏液性囊性肿瘤,黏液性囊性肿瘤多为大单囊,少数呈多囊,囊壁厚薄不一,囊内可有粗细不均的分隔和(或)壁结节,增强后囊壁、分隔及壁结节可轻度强化;2)胰腺实性-假乳头状瘤,好发于年轻女性,多为囊实性肿块,钙化、出血较常见,增强扫描呈渐进性轻-中度强化,且强化程度始终低于胰腺实质。
PanNETs强化不明显时需鉴别:1) 胰腺癌,多为乏血供性,强化程度低于正常胰腺组织,但其有明显围管性浸润和嗜神经生长的特点,侵犯胰管和胆总管(见于胰头癌)引起的“双管征”、胰腺萎缩较PanNETs更为常见且明显,因其嗜神经生长的特点,临床上患者经常有顽固性腹痛;2) 胰腺结核,CT增强扫描时也可表现为胰腺内局灶性的低密度肿块,但胰腺结核病灶很大时仍然很少累及血管,并可见胰管穿通征,胰周、门静脉周围肿大淋巴结呈周边环形强化为其特征,存在其他部位播散结核灶也可为其诊断提供佐证。
5. 结论
总之,PanNETs的影像学表现具有特征性,功能性PanNETs多表现为较小的实性结节,非功能性PanNETs多表现为较大的不均质肿块,增强扫描呈明显强化、包膜环形强化为其特征,轻-中度强化及明显囊变者较少见。掌握PanNETs的影像学特征及不典型表现,有利于提高对PanNETs的认识和诊断准确率。
文章引用
张玉婷,李大铭,魏丰贤,王丹,周俊林. 胰腺神经内分泌肿瘤的影像学表现与病理对照分析
Pancreatic Neuroendocrine Tumors: Correlation between the Imaging Findings and Pathology[J]. 医学诊断, 2016, 06(03): 59-67. http://dx.doi.org/10.12677/MD.2016.63011
参考文献 (References)
- 1. 吉帆, 征锦. 胰腺神经内分泌肿瘤的影像学表现及其诊断进展[J]. 医疗卫生装备, 2013, 34(11): 91-94.
- 2. Pomianowska, E., Gladhaug, I.P., Grzyb, K., et al. (2010) Survival Following Resection of Pancreatic Endocrine Tumors: Importance of R-Status and the WHO and TNM Classification Systems. Scandinavian Journal of Gastroenterology, 45, 971. http://dx.doi.org/10.3109/00365521003782363
- 3. Huang, Y.-Q., Xu, F., Yang, J.-M., Huang, B. (2010) Primary Hepatic Neuroendocrine Carcinoma: Clinical Analysis of 11 Cases. Hepatobiliary & Pancreatic Diseases International, 9, 44-48.
- 4. Pasaoglu, E., Dursun, N., Ozyalvacli, G., et al. (2015) Comparison of World Health Organization 2000/2004 and World Health Organization 2010 Classifications for Gastrointestinal and Pancreatic Neuroendocrine Tumors. Annals of Diagnostic Pathology, 19, 81-87. http://dx.doi.org/10.1016/j.anndiagpath.2015.01.001
- 5. 史玉振, 王中秋, 卢光明, 等. 胰腺神经内分泌肿瘤的影像学表现与临床病理对照分析[J]. 临床放射学杂志, 2011, 30(11): 1618-1623.
- 6. Lewis, R.B., Lattin Jr., G.E. and Paal, E. (2010) Pancreatic Endocrine Tumors: Radiologic Clinicopathologic Correlation. Radiographics, 30, 1445-1464. http://dx.doi.org/10.1148/rg.306105523
- 7. 吉帆, 孔嶷, 征锦, 等. 无功能性胰腺神经内分泌肿瘤的CT表现与病理对照[J]. 放射学实践, 2013, 28(11): 1148-1151.
- 8. Yoon, W.J., Daglilar, E.S., Pitman, M.B. and Brugge, W.R. (2013) Cystic Pancrea-tic Neuroendocrine Tumors: Endoscopic Ultrasound and Fine-Needle Aspiration Characteristics. Endoscopy, 45, 189-194. http://dx.doi.org/10.1055/s-0032-1325990
- 9. McKenna, L.R. and Edil, B.H. (2014) Update on Pancreatic Neuroendocrine Tumors. Gland Surgery, 3, 258-275.
- 10. Couvelard, A., O’Toole, D., Turley, H., Leek, R., Sauvanet, A., Degott, C., et al. (2005) Microvascular Density and Hypoxia-Inducible Factor Pathway in Pancreatic Endocrine Tumours: Negative Correlation of Micro-vascular Density and VEGF Expression with Tumour Progression. British Journal of Cancer, 92, 94-101. http://dx.doi.org/10.1038/sj.bjc.6602245
- 11. Gaujoux, S., Tang, L., Klimstra, D., et al. (2011) The Outcome of Resected Cystic Pancreatic Endocrine Neoplasms: A Case-Matched Analysis. Surgery, 151, 518-525. http://dx.doi.org/10.1016/j.surg.2011.09.037
- 12. Giesel, F.L., Kratochwil, C., Mehndiratta, A., Wulfert, S., et al. (2012) Com-parison of Neuroendocrine Tumor Detection and Characterization Using DOTATOC-PET in Correlation with Contrast Enhanced CT and Delayed Contrast Enhanced MRI. European Journal of Radiology, 81, 2820-2825. http://dx.doi.org/10.1016/j.ejrad.2011.11.007
- 13. Takumi, K., Fukukura, Y., Higashi, M., et al. (2015) Pancreatic Neuroendo-crine Tumors: Correlation between the Contrast-Enhanced Computed Tomography Features and the Pathological Tumor Grade. Eu-ropean Journal of Radiology, 84, 1436-1443. http://dx.doi.org/10.1016/j.ejrad.2015.05.005
- 14. 周延, 刘剑羽, 朱翔, 等. 胰腺神经内分泌肿瘤多层螺旋CT双期增强扫描特征[J]. 中华放射学杂志, 2013, 47(3): 225-230.
