Asian Case Reports in Oncology
Vol.05 No.01(2016), Article ID:18147,13
pages
10.12677/ACRPO.2016.51001
Analysis of Prognostic Factors in 168 Cases of Lung Adenocarcinoma Patients Treated with Targeted Therapy Combined with Chemotherapy
Zhenzhen Wang1, Yanhong Yang2*, Yue Feng1, Qianying Li1, Bo Feng1, Xiaoyu Wang1
1Chengde Medical College Graduate School, Chengde Hebei
2The First Hospital of Qinhuangdao, Qinhuangdao Hebei

Received: Jul. 7th, 2016; accepted: Jul. 26th, 2016; published: Jul. 29th, 2016
Copyright © 2016 by authors and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY).
http://creativecommons.org/licenses/by/4.0/



ABSTRACT
Objectives: The subject of this study is to investigate whether the lung adenocarcinoma patients accept chemotherapy and the cycles of chemotherapy, whether they accept radiotherapy, whether they have received targeted therapy and what specific targeted drugs they used and the effect on prognosis, aiming to find out the influential clinical factors in the prognosis of lung adenocarcinoma in order to provide a theoretical basis to carry out individualized treatment and prolong the survival time of the patients. Methods: 168 Patients who first received treatment from January 2010 to December 2012 in the first hospital of Qinhuangdao and diagnosed through pathological science examination with lung adenocarcinoma were enrolled. These patients do not have other serious underlying diseases and have never received any anti-tumor therapy. Statistical data are analyzed by SPSS17.0. Kaplan-Meier survival analysis and Log-rank test analysis are applied to compare the influences of clinical features on the prognosis. Cox regression model is used for multivariate analysis to identify independent factors of prognosis in patients with lung adenocarcinoma. The difference value of P < 0.05 is considered statistically significant. Result: It is found through single factor analysis that whether they have received surgical treatment or chemotherapy, the number of chemotherapy cycles, and whether targeted treatment has been applied to them have effect on the prognosis of lung adenocarcinoma patients (P value < 0.05). In contrast, little effects can be found in factors such as patient’s age when diagnosed, gender, whether they smoke or not, the number of cigarettes they smoke, family history of malignant tumor, experience of radiotherapy (P value > 0.05). Statistical analysis showed that there were no significant differences in the median survival time between who took TKI drugs, who used anti-angiogenesis drugs and who used both of the drugs (P = 0.230). There were significant differences in the median survival time between who received targeted treatment alone, who received targeted treatment and chemotherapy, who received targeted treatment and radiotherapy and who received targeted treatment, chemotherapy and radiotherapy (P = 0.020). Cox proportional hazards model showed that the independent factors affecting the prognosis of lung adenocarcinoma included: whether patients received chemotherapy or not, chemotherapy cycles, whether patients received targeted therapy (P < 0.05). Conclusion: Chemotherapy and targeted therapy are independent prognostic factors in patients with lung adenocarcinoma. Targeted therapy helps to improve the prognosis in patients with lung adenocarcinoma. The combination of targeted therapy, chemotherapy and radiotherapy can prolong the survival time for patients with lung adenocarcinoma.
Keywords:Lung Cancer, Prognosis, Survival Analysis, Targeted Therapy

168例肺腺癌患者靶向治疗联合放化疗 与其预后因素分析
王真真1,杨雁鸿2*,冯悦1,李倩影1,冯博1,王小玉1
1承德医学院研究生院,河北 承德
2秦皇岛市第一医院,河北 秦皇岛

收稿日期:2016年7月7日;录用日期:2016年7月26日;发布日期:2016年7月29日

摘 要
目的:本课题主要探讨肺腺癌患者是否接受化疗及化疗周期数、是否放疗、是否接受过靶向治疗以及具体应用哪种靶向药物对其预后的影响,旨在找出影响肺腺癌预后的临床因素,为肺腺癌患者开展个体化治疗、延长生存期提供理论依据。方法:以2010年1月至2012年12月间首次就诊于秦皇岛市第一医院经病理学检查确诊为肺腺癌且无其他严重基础疾病及未接受过任何抗肿瘤治疗的168例患者为研究对象(临床资料信息来源:恶性肿瘤患者会定期返院做放化疗或全面复查评估病情,患者的一般情况、肿瘤情况、治疗情况及血分析检查都有完整的住院志记录,同时结合自己电话随访结果)。采用SPSS17.0进行统计分析,采用Kaplan-Meier生存分析、Log-rank检验分析比较各临床特征对预后的影响,采用Cox回归模型进行多因素分析,找出肺腺癌患者预后的独立因素,以P < 0.05为差异有统计学意义。结果:单因素分析可见化疗与否及化疗周期数、是否应用过靶向治疗均可影响肺腺癌患者的预后(P值均 < 0.05),而患者确诊年龄、性别、吸烟与否及吸烟数量、恶性肿瘤家族史、是否接受过放疗等因素对预后无明显影响(P值均 > 0.05)。统计分析结果显示口服TKI类药物者、使用抗肿瘤血管生成类药物者及两种药物均使用者,三者中位生存期间无明显差异(P = 0.230)。单纯靶向治疗者既应用靶向治疗又接受化疗者、既应用靶向治疗又接受放疗者及既应用靶向治疗又接受放化疗者,各组间中位生存期有差异(P = 0.020)。Cox比例风险模型结果显示化疗与否及化疗周期数、是否应用过靶向治疗是影响肺腺癌预后的独立因素(P值均 < 0.05)。结论:化疗及应用靶向治疗是影响肺腺癌患者预后的独立因素,靶向治疗可改善肺腺癌患者的预后,既应用靶向治疗又行放化疗可延长肺腺癌患者的生存期。
关键词 :肺腺癌,预后,生存分析,靶向治疗

1. 引言
肺癌以发现晚而转移早,病死率高而生存率低著称,是对当今人类健康和生命威胁最大的恶性肿瘤,从2014年我国恶性肿瘤死因构成中可见,肺癌是目前最主要癌症死因。肺腺癌作为非小细胞肺癌的一种主要病理类型,其发病率上升速度明显快于鳞癌,已成为最常见的类型,约占每年全球确诊的新增肺癌病患的40% [1] 。因此,肺腺癌患者的预后受到了越来越多的重视。近年来,医学发展迅速使肺腺癌患者的生存期有所延长,但是个体间预后差异仍较大。纵观肺腺癌患者临床特征,患者在自身因素、肿瘤情况及所接受治疗等方面均有差异,因此,综合分析影响肺腺癌预后的各因素,对制定个体化治疗方案显得尤为重要。
本研究回顾性分析秦皇岛市第一医院168例肺腺癌患者的临床特征及生存情况,针对上述三方面差异做进一步具体分析,找出影响肺腺癌预后的临床因素,旨在为肺腺癌患者开展个体化治疗、延长生存期提供理论依据。
2. 材料与方法
2.1. 一般材料
2.1.1. 研究对象
以2010年1月至2012年12月间首次就诊于秦皇岛市第一医院经病理学检查确诊为肺腺癌的患者为研究对象。
1) 纳入标准:肺部肿瘤经病理学确诊为原发性肺腺癌;患者本身无其他严重基础疾病,PS评分在0~1之间;确诊前未接受过放化疗等任何抗肿瘤治疗。
2) 排除标准:肺部肿瘤为转移性腺癌;患者本身患有严重基础疾病;随访困难者;随访过程中死于非肺腺癌因素的患者。
2.1.2. 研究对象资料收集
按上诉标准共收集168例肺腺癌患者,对患者自身因素、肿瘤情况及所接受治疗三方面临床资料特征进行详细记录。
2.2. 研究方法
2.2.1. 随访
以每位患者确诊日期为研究起点,电话随访所有患者至2015年12月31日,以死亡日期、失访日期或随访截止日期为研究终点。以月为计量单位,计算每位患者研究起点到终点的时间作为该患者的总生存期,并以总生存期作为评价预后的指标。其中失访或者随访截止日期仍存活的患者记为删失。
2.2.2. 数据统计分析
统计数据均采用SPSS17.0统计软件进行统计分析,对患者进行标号,以资料搜集中各信息为变量并进行相应的量化赋值,采用Kaplan-Meier生存分析、Log-rank检验分析比较各临床特征对预后的影响,采用Cox回归模型进行多因素分析,找出肺腺癌患者预后的独立因素,以P < 0.05为差异有统计学意义。
3. 结果
3.1. 总体生存分析
本研究共纳入符合要求的肺腺癌患者168例,截止到2015年12月31日,失访9例,随访率为94.6%,仍存活的患者11例,死亡148例,所有患者的总生存期为0.5个月到68.2个月不等,中位生存期为14.2个月,1年生存率为60.2%,2年生存率为34.1%,3年生存率为20.2% (生存曲线见图1)。
3.2. 单因素分析
单因素分析显示:化疗与否及化疗周期数、是否应用过靶向治疗均可影响肺腺癌患者的预后(P值均 < 0.05),而确诊年龄、性别、吸烟与否及吸烟数量、是否接受过放疗对肺腺癌预后影响不大(P值均 > 0.05) (具体详见表1)。
3.2.1. 确诊年龄
本研究168例患者发病年龄在38岁~83岁之间,青年患者(<45岁)10例,总生存期为4.5~48个月,中位生存期为12.8个月,1、2、3年生存率分别为60%、10%、10%。中年患者(45岁~59岁)74例,总生存期为1.5~68.2个月,中位生存期为19.5个月,1、2、3年生存率分别为64.2%、44.4%、26.3%。老年患者(≥60岁) 84例,总生存期为0.5~58个月,中位生存期为14.2个月,1、2、3年生存率分别为56.7%、26.8%、16.2%。数据显示中年患者预后最好,老年患者次之,而青年患者预后较差,但其差异未见统计学意义(P = 0.148) (各组生存曲线见图2)。
3.2.2. 性别
男性患者90例,总生存期为0.5~68.2个月,中位生存期为13.8个月,1、2、3年生存率分别为56.8%、34.5%、21.2%。女性患者78例,总生存期为0.6~65.3个月,中位生存期为14.8个月,1、2、3年生存率分别为64.1%、33.6%、19.2%。统计分析显示男女患者生存期无显著性差异(P = 0.874) (各组生存曲线见图3)。
3.2.3. 吸烟史
在全部患者中,吸烟患者有67例,其中绝大多数为男性且大量吸烟(吸烟指数 ≥ 400)者。不吸烟患者患者101例,总生存期为0.6~68.2个月,中位生存期为15.2个月,1、2、3年生存率分别为57.1%、35.7%、23.3%。少量吸烟(吸烟指数 < 400)者14例,总生存期为2~40.1个月,中位生存期为13个月,1、2、3年生存率分别为64.1%、33.6%、7.1%。大量吸烟(吸烟指数 ≥ 400)者53例,总生存期为0.5~55.7个月,中位生存期为12.6个月,1、2、3年生存率分别为51.8%、29.2%、16.1%。数据显示随着吸烟数
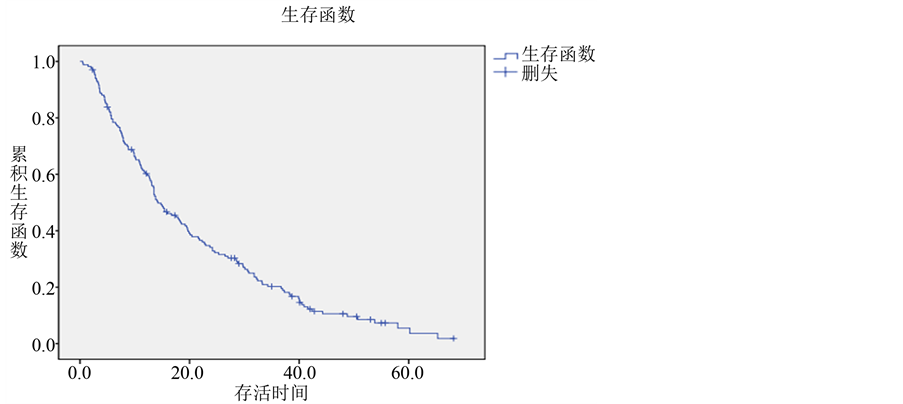
Figure 1. Overall survival curve of lung adenocarcinoma
图1. 肺腺癌的总生存曲线
Table 1. Prognosis of lung adenocarcinoma in univariate analysis
表1. 肺腺癌的单因素预后分析
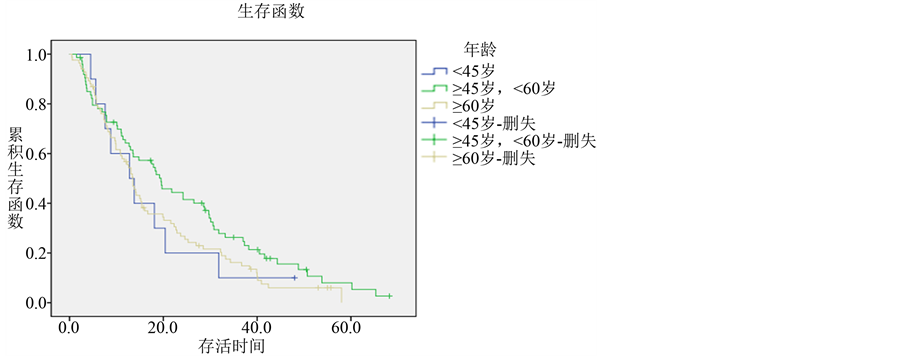
Figure 2. Survival curves of different age groups in lung adenocarcinoma
图2. 肺腺癌不同年龄组的生存曲线
量的增加,肺腺癌患者中位生存期变短,但统计学分析未见明显差异(P = 0.526) (各组生存曲线见图4)。
3.2.4. 化学治疗
结合秦皇岛市第一医院肺腺癌患者化疗情况,将所有患者按化疗周期分组,未接受过化疗者40例,总生存期为0.5~58个月,中位生存期为9.9个月,1、2、3年生存率分别为46.3%、20.6%、12%。接受过1~6周期化疗的患者最多,共计93例,总生存期为2~60.2个月,中位生存期为13.8个月,1、2、3年生存率分别为55.4%、33.8%、19.5%。化疗超过6周期的患者共35例,总生存期为7~68.2个月,中
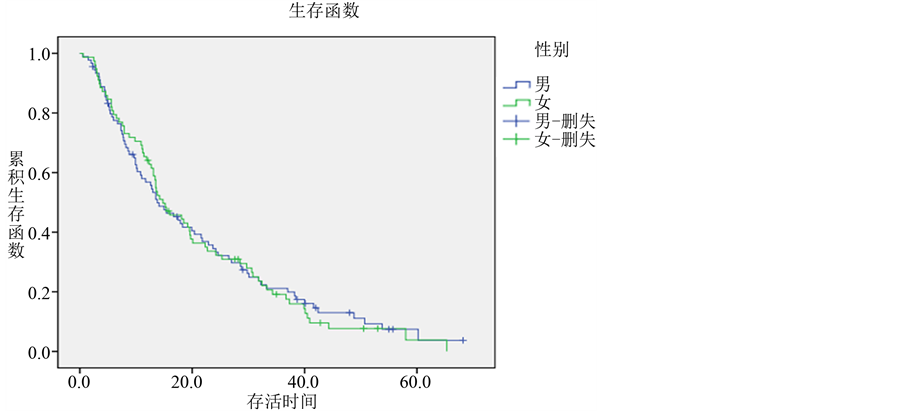
Figure 3. Survival curves of different sex groups in lung adenocarcinoma
图3. 肺腺癌不同性别组的生存曲线
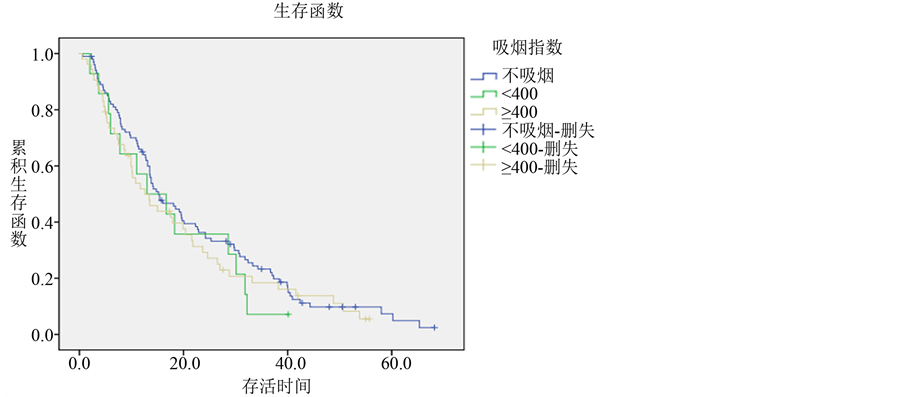
Figure 4. Survival curves of different Smoking history groups in lung adenocarcinoma
图4. 肺腺癌不同吸烟史组的生存曲线
位生存期为24.2个月,1、2、3年生存率分别为88.6%、50.2%、31.8%。由上可见,肺腺癌患者的生存期随着化疗周期的增加而延长,有统计学差异(P = 0.004) (各组生存曲线见图5)。
3.2.5. 放射治疗
本研究中,共有87例患者接受过放射治疗,总生存期为0.5~68.2个月,中位生存期为15.4个月,1、2、3年生存率分别为59.2%、36.1%、24.5%。未接受过放疗的患者共计81例,总生存期为0.6~58个月,中位生存期为13.8个月,1、2、3年生存率分别为61.3%、31.9%、15.6%。统计学分析显示两组患者间预后差异无统计学意义。(P = 0.620) (各组生存曲线见图6)。
3.2.6. 靶向治疗
本研究所纳入患者中,应用靶向治疗的患者亦不在少数,共计69例,总生存期为3.1~65.3个月,中
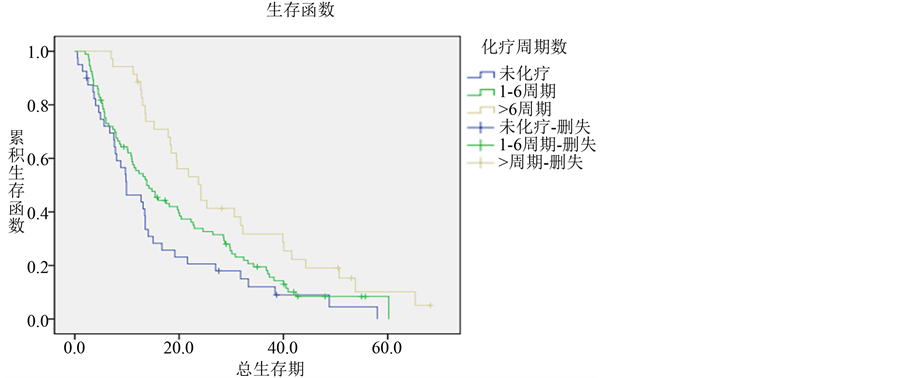
Figure 5. Survival curves of different chemotherapy periodicities groups in lung adenocarcinoma
图5. 肺腺癌不同的化疗周期组的生存曲线
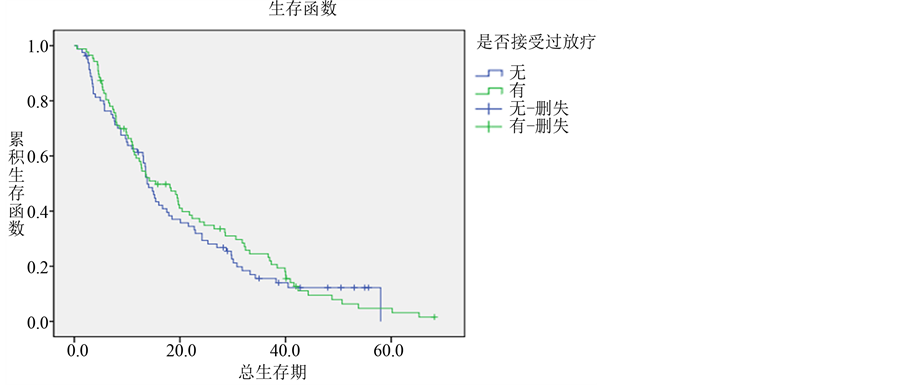
Figure 6. Survival curves of different radiotherapy groups in lung adenocarcinoma
图6. 肺腺癌不同的放疗组的生存曲线
位生存期为21.6个月,1、2、3年生存率分别为75.4%、46.4%、29.7%。未接受靶向治疗的患者99例,总生存期为0.5~58个月,中位生存期为11.7个月,1、2、3年生存率分别为49.5%、25.3%、13.7%。本研究显示,靶向治疗改善了患者的预后,延长了患者的生存期,两者之间有明显差异。(P = 0.006) (各组生存曲线见图7)。
对本研究中69例接受过靶向治疗的肺腺癌患者进行亚组分析(具体详见表2),分析结果如下:
根据患者所使用靶向药物种类进行预后比较,结果如下:69例接受靶向治疗的患者中,单独应用TKI类药物的患者48例,总生存期为3.1~65.3个月,中位生存期为19.6个月,1、2、3年生存率分别为68.7%、39.4%、26.5%。单独应用抗肿瘤血管生成类药物的患者有14例,总生存期为5.7~53个月,中位生存期为32.2个月,1、2、3年生存率分别为85.7%、64.3%、48.2%。两类药物均有应用的患者7例,总生存期为13.8~36.7个月,中位生存期为21.6个月,1、2、3年生存率分别为85.7%、57.1%、13.3%。统计学分析显示,各组间差异未见统计学意义(P = 0.230) (各组生存曲线见图8)。
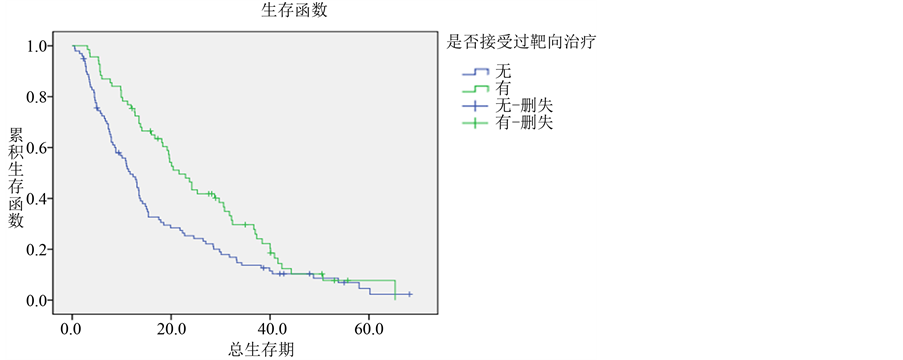
Figure 7. Survival curves of different targeted therapy groups in lung adenocarcinoma
图7. 肺腺癌不同的靶向治疗组的生存曲线
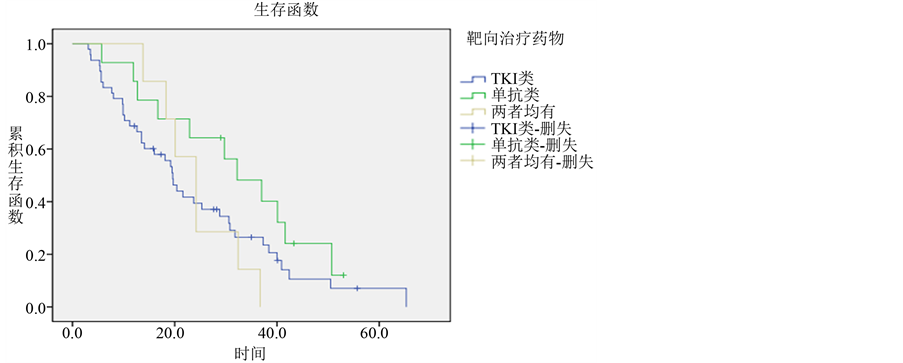
Figure 8. Survival curves of different targeted medicine groups in lung adenocarcinoma
图8. 肺腺癌不同的靶向药物治疗组的生存曲线
Table 2. Univariate survival analysis of the prognosis of lung adenocarcinoma patients with targeted therapy
表2. 肺腺癌患者靶向治疗单因素预后生存分析
根据患者所用治疗模式进行预后比较,结果如下:69例接受过靶向治疗的患者中,单纯应用靶向治疗的患者6例,总生存期为5.6~21.6个月,中位生存期为13.5个月,1、2、3年生存率分别为66.7%、0%、0%。既接受过靶向治疗又接受过化疗的患者有23例,总生存期为3.1~55.7个月,中位生存期为24.2个月,1、2、3年生存率分别为78.3%、52.2%、24.2%。既接受过靶向治疗又接受过放疗的患者9例,总生存期为3.5~38.4个月,中位生存期为12.7个月,1、2、3年生存率分别为55.6%、33.3%、16.7%。既接受过靶向治疗又接受过放化疗的患者31例,总生存期为5.3~65.3个月,中位生存期为30.6个月,1、2、3年生存率分别为80.6%、52.8%、42.2%。上述四组中,既接受过靶向治疗又接受过放化疗的患者中位生存期及生存率高于其他治疗模式的患者,且各组生存期差异有统计学意义(P = 0.020) (各组生存曲线见图9)。
3.3. 多因素分析
多因素分析显示:化疗与否及化疗周期数、是否应用过靶向治疗是影响肺腺癌预后的独立因素(P值均 < 0.05)。其中接受过化疗且化疗周期 > 6周期的患者预后较好,死亡风险是未接受过化疗患者的0.458倍,靶向治疗同样改善了肺腺癌患者的预后,接受过靶向治疗的患者死亡风险是非靶向治疗患者的0.224倍(具体详见表3)。
4. 讨论
癌症是威胁人类健康、导致人类死亡的第一大恶疾和顽症,而在所有的恶性肿瘤中,肺癌无论在发病率还是死亡率均居于首位。肺腺癌作为非小细胞肺癌(non-small-cell lung cancer, NSCLC)的一种主要病理类型,其发病率上升速度明显快于鳞癌,已成为NSCLC最常见的类型,约占每年全球确诊的新增肺癌病患的40% [1] 。其典型表现为小的外周病灶,不易被发现且经常无明显症状,但极易出现区域淋巴结
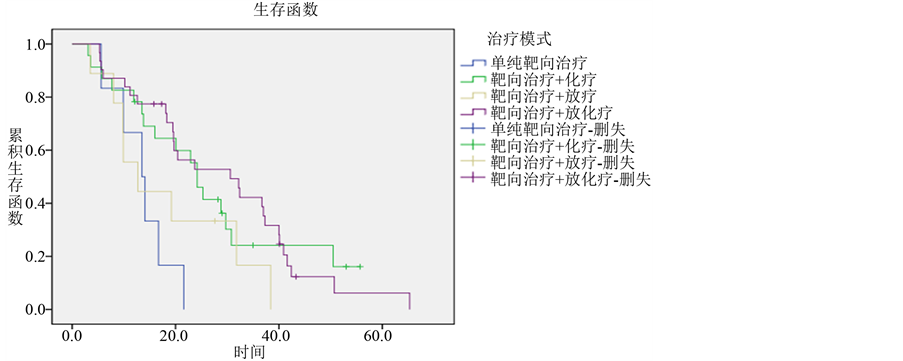
Figure 9. Survival curves of different treatment modalities groups in lung adenocarcinoma
图9. 肺腺癌不同治疗模式组的生存曲线
Table 3. Prognosis of lung adenocarcinoma in multivariate regression analysis of Cox
表3. 肺腺癌预后的Cox多元回归分析
和远处转移,5年生存率不足30% [2] ,故肺腺癌的预后受到越来越多的重视。近年来,医学发展迅速,多样化的抗肿瘤治疗使肺腺癌患者的生存期有所延长,但是个体间预后差异仍较大。纵观肺腺癌患者临床特征,患者在自身因素、肿瘤情况及所接受治疗等方面均有差异,国内外关于肺腺癌预后方面的研究不在少数,但侧重点多有不同且争议较多,故仍需我们深入研究。
为了进一步明确肺腺癌预后的影响因素,本研究回顾性分析秦皇岛市第一医院168例肺腺癌患者的临床特征及生存情况,从患者自身及接受治疗差异入手,总结各患者在确诊年龄、性别、吸烟与否及吸烟数量、是否接受化疗及化疗周期数、是否放疗、是否接受过靶向治疗以及具体应用的哪种靶向药物和治疗模式等方面的不同,并找出影响肺腺癌预后的临床因素,为肺腺癌患者开展个体化治疗、延长生存期提供理论依据。
结合本研究所得结果,对可能影响肺腺癌预后的各因素讨论如下:
4.1. 年龄
肺癌患者老年居多,60~80岁则为肺癌的发病高峰年龄 [3] 。Yang等 [4] 以50岁为分界线,得出青年人肺癌中腺癌类型占52%,远远大于鳞癌的9%,且易出现远处器官转移,预后不佳。Yazgan等 [5] 通过对不同年龄的肺癌患者行肺切除术后进行对照研究,得出在45岁以下的肺癌患者中,腺癌类型最多,且预后稍好于老年组。
本研究显示青年患者(<45岁)、中年患者(45~59岁)及老年患者(≥60岁)生存期差异未见统计学意义,老年人生存期略低可能与老年人肝肾功能较差,对抗肿瘤治疗耐受性下降从而影响生存有关。本研究结果与曹建忠 [6] 等人的报道相同,故认为年龄不是影响肺腺癌预后的因素。
4.2. 性别
近年来,女性患者肺癌的发病率增长更快。Minami等 [7] 认为女性比男性更易患腺癌,女性肺腺癌的发病率比鳞癌高30%。关于性别对肺腺癌预后的影响则结论不一,Jubelirer等 [8] 对2000多例早期肺癌术后患者进行回顾性分析发现,肺癌患者的5年生存率不存在性别差异,而Moore R等 [9] 认为女性患者预后更好。
本研究结果显示男性与女性患者生存期无差异,这可能与本研究包含中早期患者、且接受靶向治疗患者较多,从而导致生存期较长有关。与国内岳东升 [10] 、黄彬鋆 [11] 等人的研究结果一致,由此认为性别对肺腺癌预后无明显影响。
4.3. 吸烟史
1950年Doll首次证实了吸烟是导致肺癌的重要原因 [12] 。虽然大部分肺癌与吸烟相关,但仍有部分肺癌患者从未吸过烟,并且随着戒烟越来越被提倡,此部分患者比例在不断升高。Wakele等 [13] 的研究显示非吸烟肺癌患者中,病理类型多为腺癌,且以女性多见。然而吸烟史对肺腺癌患者预后的影响目前仍有争议,方美玉等 [14] 对3751例肺癌患者针对吸烟与否进行了临床比较,分层分析显示在肺腺癌病例中不吸烟者肺癌患者生存明显好于吸烟者肺癌患者。而Mequid [15] 研究了4546例非小细胞肺癌患者的临床资料,发现吸烟与否对患者的长期生存率影响甚微。
本研究结果显示随着吸烟数量的增加,肺腺癌患者中位生存期变短,但统计学分析未见明显差异。这可能与本研究样本量较少,患者吸烟量有统计误差,同时又存在被动吸烟等原因相关,因而得出吸烟史对肺腺癌预后影响不大的结论。但我们可以肯定长期吸烟损伤肺组织,影响肺功能是,而肺功能低下的肺腺癌患者往往预后不佳。我们仍需进一步规范化吸烟史的统计标准,深入研究其对肺腺癌预后的影响,同时大力提倡戒烟。
4.4. 化疗
大多数肺腺癌患者在确诊时已失去了手术机会,即便是早期手术患者,由于肺腺癌病情发展迅速,术后复发率很高,预后明显较差,其5年生存率不足30% [2] 。化疗属于全身系统治疗,可消除亚临床微转移灶,从而达到控制肿瘤发展的目的,因此,化疗在肺腺癌的综合治疗中发挥着不可替代的作用。1995年,非小细胞肺癌协作组织对以往的临床研究进行了Meta分析,显示化疗与最佳支持治疗相比,化疗减少了27%的死亡风险,增加了10%的1年生存率 [16] 。化疗可改善肺腺癌患者的预后得到了普遍认可,但是否化疗周期越多,预后越好,目前尚无定论。Socinski教授在2003年美国临床肿瘤协会(ASCO)年会中,针对晚期非小细胞肺癌的化疗周期做了一篇精彩的综述,报告称长化疗周期组(≥6个周期)较常规治疗组(3~4个周期化疗),在短期缓解率、症状缓解率、生活质量及生存率方面并未显示任何优势反而毒副反应更为严重 [17] 。而学者王彩 [18] 在2014年的研究报告称,一线化疗周期≥3的肺腺癌患者预后好于未化疗及化疗周期<3的患者。
本研究结果显示患者的生存期随着化疗周期的增加而延长,化疗周期>6周期的患者死亡风险是未接受过化疗患者的0.458倍。但本研究仅以生存期为评价指标,未结合化疗所致副反应进行综合分析,故我们应该选择有效率高且耐受性好的化疗药物,在延长肺腺癌患者生存期的同时尽量提高患者的生活质量。
4.5. 放疗
放射治疗作为晚期肺癌的主要治疗手段之一,其主要目的为控制肿瘤的局部发展,缓解骨转移、脑转移等相关脏器受累所引起的不适症状,对于不能手术切除的晚期非小细胞肺癌患者,目前普遍认为,同期放化疗疗效优于单纯放疗或序贯化疗 + 放疗 [19] 。尤其随着近年来的三维适形放射治的发展,有学者认为,放疗在晚期NSCLC的治疗中起到了缓解症状、提高生活质量、延长生存期的作用 [20] 。
本研究显示放疗与否并不影响患者生存,这与Nagata Y [21] 学者观点一致,认为单纯放疗延长肺腺癌患者总生存期方面尚不尽如人意,5年生存率仅为4%~10%。结合大多数学者观点,我们认为单纯放疗不能改善肺腺癌患者的预后,而应严格限制放疗靶区范围,采用三维适形或调强放疗技术,提高靶区照射剂量同时降低放射性毒性反应,同时联合对肺腺癌相对敏感的化疗方案同步治疗,以达到延长患者生存期的目的。
4.6. 靶向治疗
传统的放化疗治疗晚期非小细胞肺癌已经到了一个平台期,伴随着肿瘤基础研究的深入及生物学的进展,靶向药物为突破这一瓶颈提供了行之有效的解决方案,不仅提高了抗肿瘤治疗的有效率,同时减轻了传统放化疗所带来的毒副反应。本研究结果同样显示靶向治疗可改善肺腺癌患者的预后。
目前临床应用靶向药物主要有两类:一类是小分子酪氨酸激酶抑制剂(tyrosine kinase inhibitors, TKI),主要是针对表皮生长因子受体(epidermal growth factor receptor, EGFR)的;另一类是单克隆抗体,主要为针对血管内皮生长因子(vascular endothelial growth factor, VEGF)的。其中,EGFR-TKI类药物的效果和EGFR基因突变密切相关,而肺腺癌的EGFR基因的突变率是肺癌中最高的 [22] ,故其对肺腺癌的疗效更佳。针对亚洲人群的IPASS [23] 实验接受TKI治疗组的无进展生存期明显优于化疗组,进一步分层分析显示,收益主要来自EGFR突变患者。而作为单克隆抗体类药物中最常用的贝伐珠单抗,可以通过抑制内皮细胞增殖和新生血管形成,达到抗肿瘤目的 [24] 。大型IV临床研究SAIL中,亚洲患者的总缓解率为57.7%,疾病控制率为94.1%,中位OS高达18.9个月,均好于该研究总体人群水平。结果还显示,延长贝伐珠单抗的应用时间并未明显增加患者不良反应的发生率。总之贝伐珠单抗联合标准化疗一线治疗晚期肺腺癌疗效较好,安全性较高。本研究将69例接受靶向治疗的患者根据所用靶向药物肿瘤进行比较,差异未见统计学意义,考虑可能与本研究样本量较少有关。
接受靶向治疗的肺癌患者,其治疗模式多种多样。根据2013版NCCN指南,治疗前因进行EGFR基因检测,若为突变型,则选择EGFR-TKI一线治疗,若在一线化疗过程中检测出EGFR突变,则可选择化疗过程中加用EGFR-TKI治疗或行TKI的维持治疗。中国学者王竞 [25] 在2011年针对靶向药物同步个体化放疗晚期/转移性非小细胞肺癌进行Ⅱ期临床试验,结果显示TKI同步放疗安全性可控,可使患者生存获益。抗血管生成类药物的应用,目前临床上应用较多主要为贝伐珠单抗,且主张其与化疗联合应用效果更佳。2011年AVAPERL研究评估了贝伐珠单抗+联合培美曲塞 + 顺铂一线治疗非鳞癌NSCLC并以贝伐珠单抗加和(或)减培美曲塞作为维持治疗的疗效及安全性,结果显示贝伐珠单抗 + 培美曲塞作为维持治疗组的PFS高于单药维持组,且安全性较好。总体来说AVAPERL的结果强烈支持贝伐单抗 + 培美曲塞用于非鳞癌NSCLC患者的维持治疗。本研究亦针对靶向治疗患者的治疗模式进行了分层研究,结果显示既接受过靶向治疗又接受过放化疗的患者最多,且中位生存期最长为30.6个月,各组生存期差异有统计学意义。但本研究为回顾性研究,未考虑患者EGFR基因突变等情况,且样本量较少,可能存在偏倚,对于何种治疗模式能为肺腺癌患者带来最大获益,仍需我们扩大样本、综合多因素细化分组并进行前瞻性研究。
肺腺癌预后受多因素影响,结合患者自身情况及肿瘤情况,制定个体化、规范化的综合治疗方案将成为延长患者生存期的关键。我们相信,随着全球控烟力度的加强,肿瘤发病机制的深入研究,癌症治疗新靶点及新抗癌药物的出现,肺腺癌终将得到治愈。
文章引用
王真真,杨雁鸿,冯 悦,李倩影,冯 博,王小玉. 168例肺腺癌患者靶向治疗联合放化疗与其预后因素分析
Analysis of Prognostic Factors in 168 Cases of Lung Adenocarcinoma Patients Treated with Targeted Therapy Combined with Chemotherapy[J]. 亚洲肿瘤科病例研究, 2016, 05(01): 1-13. http://dx.doi.org/10.12677/ACRPO.2016.51001
参考文献 (References)
- 1. Yourdon, D.R., Cramb, S.M. and Baade, P.D. (2008) The International Epidemiology of Lung Cancer: Geographical Distribution and Secular Trends. Journal of Thoracic Oncology, 3, 819-831. http://dx.doi.org/10.1097/JTO.0b013e31818020eb
- 2. Brundage, M.D., Davies, D. and Mackillop, W.J. (2002) Prognostic Factors in Non-Small Cell Lung Cancer: A Decade of Progress. Chest, 122, 1037-1057. http://dx.doi.org/10.1378/chest.122.3.1037
- 3. Libby, P. (2002) Inflammation in Atherosclerosis. Nature, 420, 868-870. http://dx.doi.org/10.1038/nature01323
- 4. Yang, P., Bamlet, W.R., Ebbert, J.O., et al. (2004) Glutathione Pathway Genes and Lung Cancer Risk in Young and Old Populations. Carcinogenesis, 25, 1935-1944. http://dx.doi.org/10.1093/carcin/bgh203
- 5. Yazgan, S., Gursoy, S., Yaldiz, S., et al. (2005) Outcome of Surgery for Lung Cancer in Young and Elderly Patients. Surgery Today, 35, 823-827. http://dx.doi.org/10.1007/s00595-004-3035-7
- 6. 曹建忠. 局部晚期非小细胞肺癌放疗或化放综合治疗预后因素分析MicroRNA在小细胞肺癌中的预后价值[D]: [博士学位论文]. 北京: 中国协和医科大学, 2009.
- 7. Minami, H., Yoshimura, M., Matsuoka, H., et al. (2001) Lung Cancer Treated Surgically in Patients < 50 Years of Age. Chest, 120, 32-36. http://dx.doi.org/10.1378/chest.120.1.32
- 8. Jubelirer, S.J., Varela, N.L., Welch, C.A., et al. (2009) Does Sex Make a Difference in Survival of Patients Undergoing resection for Early Stage Non-Small Cell Lung Cancer (NSCLC)? West Virginia Medical Journal, 105, 18-22.
- 9. Moore, R., Doherty, D., Chamberlain, R., et al. (2004) Sex Differences in Survival in Non Small Cell Lung Cancer Patients 1974-1998. Acta Oncologica, 43, 57-64. http://dx.doi.org/10.1080/02841860310017973
- 10. 岳东升, 王长利, 张真发, 等. 107例细支气管肺泡癌临床特征及预后分析[J]. 中国肿瘤临床, 2007, 34(9): 515- 518.
- 11. 黄彬鋆, 肖静, 吴桂云, 等. 214例肺腺癌患者预后因素分析[J]. 中华疾病控制杂志, 2015, 19(8): 806-810.
- 12. Don, R. and Hill, A.B. (1950) Smoking and Carcinoma of the Lung Preliminary Report. British Medical Journal, 2, 739-748. http://dx.doi.org/10.1136/bmj.2.4682.739
- 13. Wakelee, H.A., Chang, E.T., Gomlez, S.L., et al. (2007) Lung Cancer Incidence in Never Smokers. Journal of Clinical Oncology, 25, 472-478. http://dx.doi.org/10.1200/JCO.2006.07.2983
- 14. 方美玉, 姜初明, 赵亚珍, 等. 无吸烟史肺癌与吸烟相关肺癌临床比较[J]. 中国呼吸与危重监护杂志, 2010, 9(2): 177-180.
- 15. Meguid, R.A., Hooker, C.M., Harris, J., et al. (2010) Long-Term Survival Outcomes by smoking Status in Surgical and Nonsurgical Patients with Non-Small Cell Lung Cancer: Comparing Never Smokers and Current Smokers. Chest, 138, 500-509. http://dx.doi.org/10.1378/chest.08-2991
- 16. (1995) Chemotherapy in Non-Small Cell Lung Cancer: A Meta-Analysis Using Updated Data on Individual Patients from 52 Randomised Clinical Trials. Non-small Cell Lung Cancer Collaborative Group. British Medical Journal, 311, 899-909. http://dx.doi.org/10.1136/bmj.311.7010.899
- 17. Stephens, R.J., Fairlamb, N., Gower, N., et al. (2002) The Big Lung Trial (BLT): Determining the Value of Cisplatin-Based Chemotherapy for all Patients with Non-Small Cell Lung Cancer (NSCLC). Preliminary Results in the Supportive Care Setting. Proceedings of the Annual Meeting of the American Society of Clinical Oncology, 21, 1161.
- 18. 王彩. 319例晚期肺腺癌患者临床预后因素分析[D]: [硕士学位论文]. 河北: 河北医科大学, 2014.
- 19. O’Rourke, N., Roqu, I., Figuls, M., et al. (2010) Concurrent Chemoradiotherapy in Non-Small Cell Lung Cancer. Cochrane Database of Systematic Reviews, 16, 140-146. http://dx.doi.org/10.1002/14651858.cd002140.pub3
- 20. 杨俊体. 姑息性放疗对IV期非小细胞肺癌预后及生存质量的影响[D]: [硕士学位论文]. 山西: 山西医科大学, 2012.
- 21. Nagata, Y., Oro, Y., Aoki, T., et al. (2002) Clinical Outcomes of 3D Conformal Hypofractionated Single High-Dose Radiotherapy for One or Two Lung Tumors Using a Stereotactic Body Frame. International Journal of Radiation Oncology * Biology * Physics, 52, 1041-1043. http://dx.doi.org/10.1016/S0360-3016(01)02731-6
- 22. Huang, S.F., Liu, H.P., Li, L.H., et al. (2004) High Frequency of Epidermal Growth Factor Receptor Mutations with Complex Patterns in Non-Small Cell Lung Cancers Related to Gefitinib Responsiveness in Taiwan. Clinical Cancer Research, 10, 8195-8203. http://dx.doi.org/10.1158/1078-0432.CCR-04-1245
- 23. Mok, T.S., Wu, Y.L., Thongprasert, S., et al. (2009) Gefitinib or Carboplatin-Paclitaxel in Pulmonary Adenocarcinoma. The New England Journal of Medicine, 361, 947-957. http://dx.doi.org/10.1056/NEJMoa0810699
- 24. Jenab-Wolcott, J. and Giantonio, B.J. (2009) Bevacizumab: Current Indicationgs and Future Development for Management of Solid Tumors. Expert Opinion Biological Therapy, 9, 507-517. http://dx.doi.org/10.1517/14712590902817817
- 25. 王竞, 夏廷毅, 王颖杰等. 靶向药物同步个体化放疗晚期/转移性非小细胞肺癌的Ⅱ期临床试验[J]. 癌症进展. 2011, 1(9): 94-101.
NOTES
*通讯作者。
