Hans Journal of Medicinal Chemistry
Vol.03 No.02(2015), Article ID:15193,3
pages
10.12677/HJMCe.2015.32002
The Synthesis of the Oxidation of Chenodeoxycholic Acid
Liefeng Cai
Heze Pharmaceuticals, Co. Ltd., Hangzhou Zhejiang
Email: caijacky0912@sina.com
Received: Apr. 20th, 2015; accepted: May 7th, 2015; published: May 11th, 2015
Copyright © 2015 by author and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY).
http://creativecommons.org/licenses/by/4.0/



ABSTRACT
Objective: Regioselective oxidation of chenodeoxycholic acid in different positions. Methods: The third was oxidized with silver carbonate; the seventh was oxidized with N-bromosuccinimide; the third and the seventh were oxidized with Jones reagent. Results: The synethesis of regioselective oxidation of chenodeoxycholic acid has advantages such as lower cost, higher yield, easier in aftertreatment and more suitable for industrialized production. Conclusion: This synthetic process has advantages such as mild conditions, easy operation, low cost and high yield, and is suitable for large-scale production.
Keywords:Chenodeoxycholic Acid, Oxidation, Synthesis
鹅去氧胆酸的氧化产物合成
蔡烈峰
杭州和泽医药科技有限公司,浙江 杭州
Email: caijacky0912@sina.com
收稿日期:2015年4月20日;录用日期:2015年5月7日;发布日期:2015年5月11日

摘 要
目的:选择性氧化得到鹅去氧胆酸不同位置的氧化产物。方法:使用碳酸银作氧化剂得到3位羟基被氧化的产物;使用N-溴代丁二酰二胺作氧化剂得到7位羟基被氧化产物;使用琼斯试剂作氧化剂得到3位和7位羟基均被氧化的产物。结果:本工艺提供的选择性氧化方法成本更低,收率更高,后处理更方便,适合工业化生产。结论:本文所选择的方法具有条件温和,操作简单,成本低,收率高,适合工业化大生产的优点。
关键词 :鹅去氧胆酸,氧化,合成

1. 引言
鹅去氧胆酸Chenodeoxycholic acid (CDCA)的化学名为3α,7α-二羟基-5β-胆甾烷-24-酸,分子式C24H40O4,分子量392.57,是一种白色或淡黄色针状晶体,CDCA是内源性、疏水性的初级胆汁酸,1848年首次在鹅胆汁中发现,1972年美国、英国相继报道CDCA能溶解X线可透射的胆结石,1975年CDCA写入药典,中国2000年版药典中没有收录。CDCA的存在比熊去氧胆酸广泛,在鸡、鸭、鹅、猪、羊等动物的胆汁中,都有相当比例的CDCA存在[1] 。
鹅去氧胆酸含有两个羟基,因此它的氧化产物理论上有3个,分别是3位氧化,7位氧化和3位,7位同时被氧化的产物,但是3种氧化产物的合成方法不同,相应得到不同的氧化产物。使用碳酸银作为氧化剂得到3位氧化的产物,使用N-溴代丁二酰亚胺和丙酮反应得到的产物是7位氧化产物,使用琼斯试剂氧化得到的目标产物是3位,7位同时被氧化的产物。具体见图1 [2] [3] 。
2. 实验部分
2.1. 仪器和试剂
集热式恒温加热磁力搅拌器(杭州惠创仪器设备有限公司),磁力搅拌器(杭州惠创仪器设备有限公司),旋转蒸发仪(上海申胜生物技术有限公司),电热恒温鼓风干燥箱(上海精宏实验设备有限公司),核磁共振仪Bruker A V400 (内标TMS) (BRUKER公司),质谱Waters micromass ZQ400 (Waters公司),试剂为分析纯,使用前未进一步纯化。
2.2. 3位氧化产物的合成 [4]
室温下,将5.00 g鹅去氧胆酸(1) (12.74 mmol,1.0 eq)和甲苯(50 ml)加入到三口烧瓶中,将14.33 g碳酸银和硅藻土形成的配体(25.47 mmol,2.0 eq)加入到100 ml三口瓶中,加装分水器分水,回流12 h,反应完全。
处理:冷却到室温,加入甲苯(50 ml)和四氢呋喃(50 ml)洗涤滤渣,滤液浓缩得到白色固体,用乙酸乙酯重结晶得到纯的目标产物(2) (3.77 g,75.79%)。
氢谱:1H NMR (500 MHz,DMSO) δ:12.001 (s,1H),3.354 (d,1H),2.925~2.889 (m,2H),2.471~2.425 (t,1H),2.269~2.209 (m,1H),2.135~2.042 (m,2H),1.945~1.920 (m,1H),1.857~1.799 (m,1H),1.737~1.673 (m,1H),1.520~0.997 (m,18H),0.957~0.843 (m,5H),0.622 (s,1H)。
碳谱:13C NMR (500 MHz,DMSO) δ:210.805,176.452,69.505,54.932,49.350,49.125,45.976,45.788,45.451,42.901,38.751,37.862,35.624,35.523,34.211,31.199,30.186,28.770,24.429,23.246,21.815,18.735,12.388。
质谱:ESI/MS[M-1]:389.1。
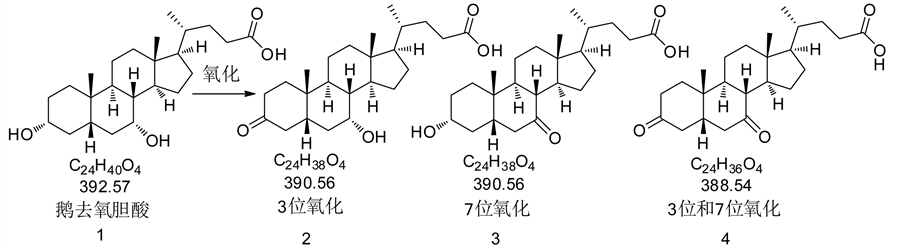
Figure 1. Synthesis of cinacalcet hydrochloride
图1. 鹅去氧胆酸氧化产物的合成
2.3. 7位氧化产物(3)的合成 [5]
室温下,将5.00 g鹅去氧胆酸(1) (12.74 mmol,1.0 eq),丙酮(45 ml)和水(15 ml)加入到100 ml的三口瓶中,分批缓慢加入3.63 g N-溴代丁二酰亚胺(20.38 mmol,1.6 eq),加完后TLC监控(DCM/CH3OH = 10:1),溶液由无色变成深红色。
反应完全后,剧烈搅拌下,加入饱和亚硫酸钠溶液,溶液由深红色变成无色,溶液浓缩去除溶剂丙酮,大量白色固体生成,加入50 ml水,过滤,滤饼用50 ml水洗涤,鼓风干燥器中50℃烘干,然后用乙酸乙酯重结晶,得到目标产物(3) (4.50 g,90.46%)。
氢谱:1H NMR (500 MHz,DMSO) δ:11.912 (s,1H),4.491~4.429 (m,1H),2.532~2.460 (m,1H),2.234~0.577 (m,35H)。
碳谱:13C NMR (500 MHz,DMSO) δ:210.884,175.328,69.562,54.810,49.270,49.057,45.862,45.746,45.542,42.654,39.051,37.909,35.237,35.193,34.345,31.188,30.309,28.297,24.870,23.255,21.689,18.700,12.364。
质谱:ESI/MS[M-1]:389.1。
2.4. 3位和7位同时氧化产物(4)的合成 [6]
室温下,将5.00 g鹅去氧胆酸(1) (12.74 mmol,1.0 eq),丙酮(50 ml)加入到100 ml的三口瓶中,冷却到0℃左右,将琼斯试剂(配制方法:将26.72 g三氧化铬加入到23 ml浓硫酸中,用水稀释到100 ml而成)缓慢滴加到反应溶液中,控温5℃以下,TLC监控反应(DCM/CH3OH = 10:1),溶液中先析出大量墨绿色沉淀,然后溶液变成灰色溶液。
反应完全后,加水淬灭反应,过滤,滤渣用丙酮(50 ml)洗涤,浓缩去掉溶剂,析出大量固体,50℃鼓风干燥烘干得到目标产物(3.38 g,68.30%)。
氢谱:1H NMR (500 MHz,DMSO) δ:11.960 (s,1H),2.927 (s,1H),2.353~0.648 (m,35H)。
碳谱:13C NMR (500 MHz,DMSO) δ:211.629,210.368,175.328,54.907,49.105,48.968,47.289,44.994,43.034,42.719,41.945,38.791,36.824,35.423,35.201,31.186,28.311,24.843,22.246,22.115,18.725,12.342。
质谱:ESI/MS[M-1]:387.0。
3. 结果与讨论
鹅去氧胆酸的结构中含有两个羟基,理论上会存在一个或者两个被氧化的情况,但是本领域的研究者基本上都会考虑到两个同时被氧化的情况,但是对于3位和7位单独被氧化的情况往往研究甚少,而本文却创造性的使用三种不同的方法得到鹅去氧胆酸的3位,7位单独氧化的产物和同时被氧化的产物。
在选择性氧化3位羟基的方法中,有文献 [7] 报道使用叔丁醇铝作用氧化剂的方法,但是这个试剂不仅价格昂贵,成本较高,而且极易燃烧,使用条件苛刻,不适合工厂大量使用,而本工艺采用的碳酸银和硅藻土形成的配体作为氧化剂,虽然价格也比较贵,但是后处理能回收套用,适合工业化大生产。
在选择性氧化7位羟基的方法中,有文献 [8] 报道采用PCC(氯铬酸吡啶鎓盐)作为氧化剂方法,该试剂价格便宜,使用时条件温和,但是该物质会产生大量的固体废渣,会造成严重的环境污染,而且后处理时还需要使用柱层析纯化,不适合工业化生产;而本公司使用N-溴代丁二酰亚胺和丙酮体系,条件温和,所使用试剂均是工业上常用的试剂,后处理方便,收率能达到90%以上,成本低,适合工业化放大。
在同时氧化3位和7位羟基的方法中,有文献[9] 报道了使用生物氧化的方法得到目标产物,但是这种条件需要特定的酶和比较苛刻的反应条件,不利于工业化,本工艺采用琼斯试剂直接将两个羟基氧化得到目标产物,不仅条件温和,反应迅速,后处理方便,利于工业化生产。
4. 结论
本文重点介绍了鹅去氧胆酸使用不同的氧化方法合成不同的氧化产物,使用碳酸银和N-溴代丁二酰亚胺分别能氧化3位和7位的羟基,反应选择性好,使用方便;使用琼斯试剂能全部将羟基氧化。本文所选择的方法具有操作简单,条件温和,成本低,适合工业化大生产的优点。
文章引用
蔡烈峰, (2015) 鹅去氧胆酸的氧化产物合成
The Synthesis of the Oxidation of Chenodeoxycholic Acid. 药物化学,02,11-14. doi: 10.12677/HJMCe.2015.32002
参考文献 (References)
- 1. 郑兴 (2008) 鹅去氧胆酸和熊去氧胆酸的对比研究. 内蒙古科技与经济, 2, 28-32.
- 2. Poša, M. and Kuhajda, K. (2010) Hydrophobicity and haemolytic potential of oxo derivatives of cholic, deoxycholic and chenodeoxycholic acids. Steroids, 75, 424-431.
- 3. Bianchini, E., Chinaglia, N., Dean, M., Giovannini, P.P., Medici, A., Pedrini, P. and Poli, S. (1999) Regiospecific oxi- doreductions catalyzed by a new pseudomonas paucimobilis hydroxysteroid dehydrogenase. Tetrahedron, 55, 1391- 1398.
- 4. Okumura, K., Nakamura, Y., Takeuchi, S., Kato, I., Fujimoto, Y. and Ikekawa, N. (2003) Formal synthesis of squala- mine from desmosterol. Chemical and Pharmaceutical Bulletin, 51, 1177-1182.
- 5. 杨先金, 张晓奇 (2013) 一种熊去氧胆酸的制备方法. 中国专利: 103319560.
- 6. 黄燕敏, 崔建国, 姚秋翠, 甘春芳, 林启福 (2013) 3-氧代-7-肟基-4-氮杂-A-homo-鹅脱氧胆酸甲酯和3-O-苄肟基-7-氮杂-7α-氧代-β-homo-鹅脱氧胆酸甲酯及其在制备抗肿瘤药物中的应用. 中国专利: 103044518.
- 7. Iguchi, Y., Nishimaki-Mogami, T., Yamaguchi, M., Teraoka, F., Kaneko, T. and Une, M. (2011) Effects of chemical modification of ursodeoxycholic acid on TGR5 activation. Biological & Pharmaceutical Bulletin, 34, 1-7.
- 8. Yu, D., Mattern, D.L. and Forman, B.M. (2012) An improved synthesis of 6a-ethylchenodeoxycholic acid (6ECDCA), a potent and selective agonist for the Farnesoid X Receptor (FXR). Steroids, 77, 1335-1338.
- 9. Fantin, G., Ferrarini, S., Medici, A., Pedrini, P. and Poli, S. (1998) Regioselective microbial oxidation of bile acids. Tetrahedron, 54, 1937-1942.