Water pollution and treatment
Vol.2 No.03(2014), Article ID:13832,8 pages
DOI:10.12677/WPT.2014.23004
Study on the Determination of Organo-Chlorine Pesticides in Water by Method of Hollow Fiber Membrane Liquid Microextraction-Gas Phase Chromatography
1Jiangxi Province Environmental Monitoring Centre, Nanchang
2Key Laboratory of Jiangxi Province for Persistent Pollutants Control and Resources Recycle, College of Environmental & Chemical Engineering, Nanchang Hangkong University, Nanchang
Email: *dongyongquan@gmail.com
Copyright © 2014 by authors and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY).
http://creativecommons.org/licenses/by/4.0/



Received: Jun. 15th, 2014; revised: Jul. 5th, 2014; accepted: Jul. 10th, 2014
ABSTRACT
The determination method for organo-chlorine pesticide in water using hollow fiber membrane liquid microextraction coupling with gas phase chromatography was developed. The effects of extracting system, extraction time, pH value, mixing speed and extraction temperature on recovery of organo-chlorine pesticide in water were investigated and the optimum extraction conditions were gained and listed as follows: using n-hexane/toluene as organic extractant, extraction time of 20 min, extraction temperature of 40℃, mixing speed of 500 rpm, neutral solution. Under the optimum conditions, the recovery rates of α-666, β-666, γ-666, δ-666, P,p’-DDE, P,p’-DDD, o,p’-DDT, P,p’-DDT in actual sample were 101.1%, 56.7%, 60.3%, 67.0%, 135.1%, 83.1%, 121.7% and 74.3%, respectively. The results showed that this method is feasible for P,p’-DDT, α-666 and P,p’-DDE determination in water.
Keywords:Hollow Fiber Membrane, Liquid Microextraction, Organo-Chlorine Pesticides, Gas Phase Chromatography

中空纤维膜液相微萃取–气相色谱法测定
水中有机氯农药的研究
徐 洁1,李秀峰1,储险峰1,马驰远2,吴小琴2,董永全2*
1江西省环境监测中心站,南昌
2江西省持久性污染物控制与资源循环利用重点实验室,南昌航空大学环境与化学工程学院,南昌
Email: *dongyongquan@gmail.com
收稿日期:2014年6月15日;修回日期:2014年7月5日;录用日期:2014年7月10日

摘 要
建立中空纤维膜液相微萃取–气相色谱测定水中有机氯农药的新方法。研究了萃取体系、萃取时间、萃取温度、溶液pH值、搅拌速度等因素对萃取效率的影响,确定中空纤维膜液相微萃取的最佳条件:以正己烷/甲苯为萃取剂,萃取时间为20 min,萃取温度为40℃,搅拌速度为500 r/mim,pH值为中性。在最优条件下,对实际水样进行分析检测,α-666、β-666、γ-666、δ-666、P,p’-DDE、P,p’-DDD、o,p’-DDT、P,p’-DDT的加标回收率分别为101.1%、56.7%、60.3%、67.0%、135.1%、83.1%、121.7%和74.3%,表明这种方法对水中α-666、P,p’-DDT和P,p’-DDE有很好的检出效果。
关键词
中空纤维膜,液相微萃取,有机氯农药,气相色谱

1. 引言
农业生产中有机氯农药(OCPs)的大量使用,导致其随地表径流、大气沉降进入水环境中。这些有机氯农药在环境中难以降解,具有强烈的亲脂性,持久存在于环境及生物体中,被称之为持久性有机污染物[1] 。它们可以通过食物链在生物体内逐级放大,最终对人类的身体健康造成严重危害[2] [3] ,因此准确、快速的分析检测水中有机氯农药的浓度,对于有机氯农药废水的处理具有十分重要的意义。
国家方法[4] 规定了水中有机氯农药的检测方法为液液萃取–气相色谱法[5] ,液液萃取的样品前处理方法,存在有机试剂用量大,对环境和操作人员危害较大,痕量物质的定量检测误差较大等缺点。基于固相萃取的固相萃取–气相色谱/质谱法[6] 、顶空固相微萃取–气相色谱法[7] 、分散固相萃取–气相色谱/质谱法[8] 、乳液/液液微萃取–气相色谱/质谱法[9] 等用来测定水中有机氯农药。近年来膜技术得到迅猛发展,把膜和萃取技术结合的中空纤维膜液相微萃取(HF-LPME)[10] -[12] 开始用于样品的前处理:把萃取剂密封于中空纤维膜内腔中,萃取剂和样品中的目标物在膜壁孔中进行萃取并进入膜内腔中,用进样器从膜内腔中抽出萃取物,注入检测仪器进行分析检测。这种方法无需样品转移,操作简便,分析时间短,已用于生物样品、土壤样品中污染物的分离与富集[13] [14] 。目前利用这种技术对水样中有机氯农药的检测的报道较少,故本文提出了用中空纤维膜液相微萃取同气相色谱法联用,测定水中有机氯农药的方法,考察这种方法对实际样品中有机氯农药检测的效果。
2. 实验部分
2.1. 化学试剂与中空纤维膜材料
有机氯农药混合溶液标准物质(GBW(E)060133和SB05-068-2008,国家标准物质中心)、甲苯(分析纯,西陇化工股份有限公司)、二氯甲烷(分析纯,西陇化工股份有限公司)、丙酮(分析纯,西陇化工股份有限公司)、正己烷(分析纯,上海实验试剂有限公司)、去离子水(自制)。聚丙烯中空纤维膜(膜内径400 μm,膜壁厚100 μm,膜孔径0.2 μm,孔隙率45%)。
2.2. 分析仪器及测试条件
GC7890A-uECD气相色谱仪(美国Agilent公司)。HP-5石英毛细管色谱柱(30.0 m × 0.25 mm × 0.25 μm)(美国Agilent公司)。
GC7890A-uECD气相色谱测试条件:进样口温度:220℃;压力:5.6 Psi;流速1.00 mL/min;隔垫吹扫流量:3.0 mL/min;程序升温:90℃保持5 min,再以15℃/min升温到180℃,保持5 min,再以2.5℃/min升温到220℃,保持2 min;检测器温度:300℃;尾吹流量:60.00 mL/min,信号值:160 Hz;色谱柱流量:1.000 mL/min;进样量:1 μL。
2.3. 标准曲线溶液配制与模拟水样中间溶液配制
2.3.1. 标准溶液配置
将GBW(E)060133有机氯农药混合溶液标准物质,配制成0.2 μg/L、0.5 μg/L、1.0 μg/L、2.0 μg/L、5.0 μg/L、10.0 μg/L备用。
2.3.2. 模拟水样配置
模拟水样中间溶液的配制采用中国天津农业部环境保护科研检测所SB05-068-2008型有机氯农药混合溶液标准物质。8种有机氯农药标液和中间液浓度如表1所示。
2.4. 中空纤维膜液相微萃取实验
截取一定长度的聚丙烯中空纤维膜在正己烷中超声清洗10 min以便除去吸附在膜上面的污物,风干后弯成U型,两端分别与注射器针头相连,用快干胶密封后,置于样品溶液瓶中得到中空纤维膜液相微萃取装置(图1),有效膜面积为8.0 cm2。
将一定量的模拟水样或者实际水样置于中空纤维液相微萃取实验装置的料液瓶中。用微量进样器量取一定体积的萃取剂注入密封好的U型中空纤维膜内腔中,润湿10秒,待萃取剂完全充满中空纤维膜内腔和孔壁后,放入料液瓶中,打开磁力搅拌器以一定的转速开始萃取。萃取完成后,用微量进样器从中空纤维膜中抽取1 μL萃取液注入GC7890A-uECD气相色谱中进行分析。
3. 结果与讨论
3.1. 萃取条件优化
3.1.1. 萃取体系对萃取效果的影响
中空纤维膜液相微萃取的萃取效果和使用的萃取剂密切相关,选择萃取剂要遵循“相似相容”的原理。目标物在萃取剂中的溶解度越大,萃取的效果越好。同时萃取剂在水相中的溶解度应尽可能小,以减少萃取剂的溶解损失。本文分别选用甲苯/正己烷、丙酮/正己烷、二氯甲烷/正己烷三种萃取体系对模拟水样中的有机氯农药进行萃取。萃取操作条件:萃取时间为30 min,搅拌速度500 r/min,水样pH值为7,水样温度为30℃,萃取剂的体积为0.2 mL。不同萃取体系对水样中目标物的萃取回收浓度(对应于色谱峰面积)如图2所示。
从图2可知,二氯甲烷/正己烷体系的萃取效果最差;丙酮/正己烷体系对有机氯农药中的β-666、γ-666、P,p’-DDT的萃取回收效果较差;甲苯/正己烷体系对8种有机氯农药的萃取回收效果都比较好。从萃取剂选择的“相似相溶”原理,四种萃取剂的极性大小顺序为:正己烷 < 甲苯 < 二氯甲烷 < 丙酮。再者,正己烷与聚丙烯中空纤维膜材料的极性相似,且具有一定的粘滞系数,较好的兼容性和亲和性使其能在较短的时间内固定于纤维膜孔中。其中甲苯的极性与正己烷最接近,相互作用力越大,因此甲苯优于其他两种溶剂,并且甲苯具有与有机氯农药类似的苯环结构,对有机氯农药更具选择性,因此试验选择萃
Table 1. Concentration of standard solution and bulk standard solution of eight organo-chlorine pesticides (μg/mL)
表1. 8种有机氯农药标液和中间液浓度表(μg/mL)
相对不确定度0.9,介质,正己烷。
 (a)
(a) (b)
(b)
Figure 1. The diagram (a) and real picture (b) of hollow fiber membrane liquid microextraction
图1. 中空纤维膜液相微萃取示意图(a)和实物图(b)

Figure 2. The effect of extraction system on recovery of object compounds
图2. 萃取体系对目标物回收效果的影响
取体系为甲苯/正己烷。
3.1.2. 萃取时间对萃取效果的影响
HF-LPME是目标物从样品中迁移到萃取相中的过程,实质上是动态的传质过程,目标物需要一定时间才能在样品与萃取液之间达到分配平衡,在达到分配平衡时,目标物的萃取量将达到最大值。试验了萃取时间分别为10,20,30,40,50 min时对萃取效率的影响,见图3。
由图可知,10 min萃取时间时,8种有机氯农药的峰面积都很低,萃取效果较差。20 min萃取时间,所有的有机氯农药的回收效果最好。随着萃取时间的延长,目标物的萃取回收逐渐降低。萃取10 min时,可能萃取相在膜表面还未完全与料液达到分配平衡;当萃取时间超过20 min后,在膜表面出现严重的浓差极化现象,膜的传递性能及分离性能均将迅速衰减,导致进入萃取相的目标物扩散回料液相中,因此试验选择萃取时间为20 min。
3.1.3. 搅拌速度对萃取效果的影响
搅拌速度可以改善传质过程,加快目标物进入萃取剂的速度,提高萃取效率,但搅动过快会产生气泡,气泡黏附在中空纤维膜表面上,反而会阻碍传质过程,并且会加速有机溶剂的流失。试验考察了搅拌速度为400~700 r/min时,对萃取效率的影响,结果如图4所示。
由图4可知,搅拌速度对8种有机氯农药的回收效果不一样。搅拌速度为500 r/min时,α-666、β-666、γ-666、δ-666的萃取回收效果较好。当搅拌速度为400 r/min时,P,p’-DDT、O,p’-DDT、P,p’-DDE、P,p’-DDD的萃取回收效较好大。但是当搅拌转速继续增大,600和700 r/min时,8种有机氯农药的萃取回收效果都呈现下降趋势。因此试验选择萃取搅拌速度为500 r/min。
3.1.4. pH值对萃取效果的影响
对三种不同pH值的水样中目标物的萃取回收效果进行了比较,结果如图5所示。萃取操作条件:甲苯/正己烷为萃取体系,萃取时间20 min,500 r/min的搅拌速度时。
由图5可知,对中性水溶液中P,p’-DDT、O,p’-DDT、P,p’-DDE、P,p’-DDD的萃取回收效果最好,α-666、β-666、γ-666、δ-666的回收效果最差。因此试验选择pH值呈中性的水溶液。
3.1.5. 萃取温度对萃取效果的影响
考察了30℃~60℃范围内,萃取温度对目标物萃取效果的影响,试验结果如图6所示。
由图可知,萃取温度对8种有机氯农药的萃取回收效果影响不一样。萃取温度为50℃时,α-666、β-666、γ-666、δ-666的萃取回收效果最好;萃取温度为40℃时,P,p’-DDT、O,p’-DDT、P,p’-DDE、P,p’-DDD的萃取效果最好。适当的提高萃取温度,可以使分子运动加剧,提高目标物在水样和萃取剂间中的扩散系数,扩散速度随之增大,有利于缩短萃取平衡的时间。但是继续提高萃取温度,当达到60℃时,每种有机氯农药的回收效果都变差。可能是因为萃取温度过高,水样中出现大量气泡,并聚集在中空纤维膜外表面,从而阻碍了目标物向萃取剂的传递。试验选择萃取温度为40℃。
3.2. 标准曲线和最低检出限
把2.3配制的有机氯农药的混标溶液,分别配成浓度为0.2、0.5、1.0、2.0、5.0、10.0 μg/L的系列标准溶液,采用气相色谱进行测定,确定标准曲线。以峰面积Y对有机氯浓度X(μg//L)作线性回归,回归方程、相关系数、线性范围、方法检出限和测定下限如表2所示。
由表2可知,8种有机氯农药的相关系数为0.99920~0.99987,有机氯农药浓度在0.2~10 μg//L内线性关系良好,方法检出限为8.5~38.4 ng/L,说明气相色谱法测定OCPs的相关性良好,检出限均较低,适用于水中痕量有机氯农药类物质的检测。
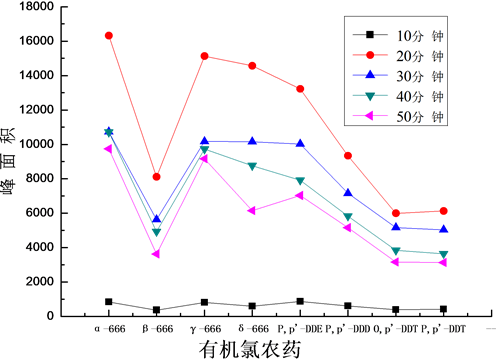
Figure 3. The effect of extraction time on recovery of OCPs
图3. 萃取时间对有机氯农药回收效果的影响

Figure 4. The effect of stirring speed on recovery of OCPs
图4. 搅拌速度对有机氯农药回收效果的影响
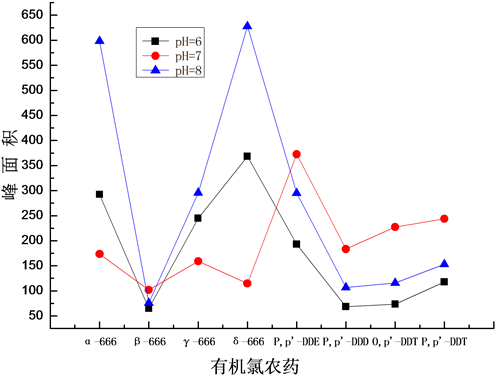
Figure 5. The effect of pH value on recovery of OCPs
图5. pH值对有机氯农药回收效果的影响
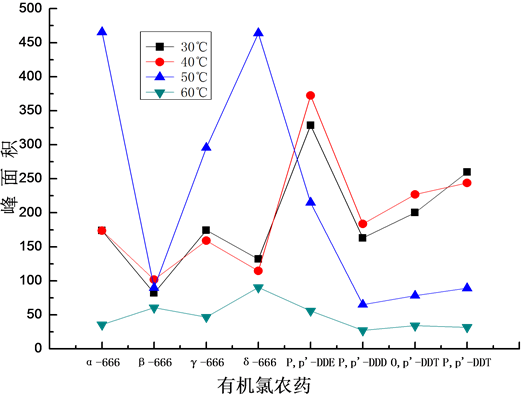
Figure 6. The effect of extraction temperature on recovery of OCPs
图6. 萃取温度对有机氯农药回收效果的影响
Table 2. The regression equation, correlation coefficient, linear range, standard deviation and detection limit for analysis of OCPs by method of gas phase chromatography
表2. 气相色谱法分析有机氯农药的回归方程、相关系数、线性范围、标准差和检出限
3.3. 水样分析
按试验方法测定了某农药厂污水排放口附近水体中8种有机氯农药,并做加标回收试验,8种有机氯农药的加标量、测定总量及加标回收率如表3所示。各有机氯农药目的气相色谱分析谱图如图7所示。
从表中可以看出,该方法对实际水体中有机氯农药实现了有效的分离与富集。仪器分析结果表明,目标物之间得到了较好的分离,加标回收为56.7%~135.1%,表明这种方法对P,p’-DDT,α-666和P,p’-DDE的回收效果较好,而其他几种污染物的回收效果较差,说明这种方法对水中α-666,P,p’-DDT和P,p’-DDE有较好的检出效果。
4. 结论
本文采用对比试验对中空纤维膜液相微萃取法对水中有机氯农药回收效果的影响进行了研究,得到了中空纤维膜液相微萃取的最佳操作条件:以正己烷/甲苯为萃取体系,萃取时间为20 min,中性水样、萃取温度为40℃、搅拌速度为500 r/min。在此萃取条件下,实际水样中有机氯农药:α-666、β-666、γ-666、δ-666、P,p’-DDE、P,p’-DDD、o,p’-DDT、P,p’-DDT的加标回收率分别为101.1%、56.7%、60.3%、67.0%、
表3. 实际水样分析及回收试验结果
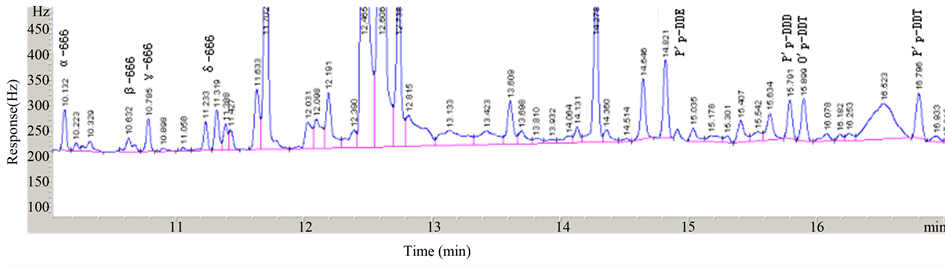
Figure 7. The gas chromatogram spectrogram of OCPs in water sample
图7. 水样中有机氯农药气相色谱图
135.1%、83.1%、121.7%和74.3%,表明这种方法对水中α-666、P,p’-DDT和P,p’-DDE有很好的检出效果。
与普通的液液萃取相比,中空纤维膜液相微萃取的有机溶剂使用量大大减少,检测方法简便,样品分离、富集和检测时间大大缩短。除此之外,中空纤维膜液相微萃取在血液、生物、医药制品的农药残留的快速检测等方面具有十分广阔的应用前景。
基金项目
国家自然科学基金(20866007),江西省环境保护厅科技项目(JXHBKJ2011-5),江西省教育厅科技项目(GJJ12417,GJJ11507)。
参考文献 (References)
- [1] 谢武明, 胡勇有, 刘焕彬, 等 (2004) 持久性有机污染物(POPs)的环境问题与研究进展. 中国环境监测, 2, 58-61.
- [2] 齐美富, 桂双林 (2008) 持久性有机污染物(POPs)治理现状及研究进展. 江西科学, 1, 92-96.
- [3] 陈晓娟, 皇甫铮 (2011) 持久性有机污染物(POPs)的危害及现状分析. 污染防治技术, 6, 17-21.
- [4] Stig, P.B., Knut, E.R. and Trine, G.H. (2000) Liquid-liquid extraction procedures for sample enrichment in capillary zone electrophoresis. Journal of Chromatography A, 902, 91-105.
- [5] 王娜, 王海娇, 汪寅夫, 等 (2010) 液–液萃取–气相色谱法测定水中9种有机氯农药. 岩矿测试, 5, 497-502.
- [6] 许秀艳, 张颖, 程麟钧, 等 (2010) 固相萃取-GC/MS法测定水中16种有机氯农药. 环境监测管理与技术, 6, 51-54.
- [7] 董春洲, 王文芳 (2006) 顶空固相微萃取气相色谱法测定水中有机氯农药及类似物. 化学分析计量, 1, 27-29.
- [8] 史景程, 张丽君, 张占恩 (2013) 分散固相萃取–气相色谱–质谱法直接测定水中20种有机氯农药. 江苏农业科学, 7, 284-286.
- [9] 王宇, 朱成华, 邹晓莉, 等 (2013) 溶剂去乳化–悬浮固化分散液液微萃取–气相色谱–质谱联用测定水中的有机氯农药. 色谱, 11, 1076-1080.
- [10] Ouyang, G. and Pawliszyn, J. (2006) Kinetic calibration for automated hollow fiber-protected liquid-phase microextraction. Analytical Chemistry, 78, 5783-5788.
- [11] Dubey, D.K., Pardasani, D., Tak, V., et al. (2006) Hollow fiber-mediated liquid-phase microextraction of chemical warfare agents from water. Journal of Chromatography A, 1107, 29-35.
- [12] Basheer, C., Obbard, J.P. and Lee, H.K. (2005) Analysis of persistent organic pollutants in marine sediments using a novel microwave assisted solvent extraction and liquid-phase microextraction technique. Journal of Chromatography A, 1068, 221-228.
- [13] Pedersen-Sjergaard, S. and Rasmussen, K.E. (1999) Liquid-liquid-liquid microextraction for sample preparation of biological fluids prior to capillary electrophoresis. Analytical Chemistry, 71, 2650-2656.

NOTES
*通讯作者。
