Studies in Synthetic Chemistry
Vol.04 No.02(2016), Article ID:18745,8
pages
10.12677/SSC.2016.42002
The Summary of the Synthesis of Amines
Yongfu He, Rongjiang Li
Hangzhou Yuanchang Pharmaceutical Sci-Tech Co., Ltd., Hangzhou Zhejiang

Received: Sep. 30th, 2016; accepted: Oct. 16th, 2016; published: Oct. 19th, 2016
Copyright © 2016 by authors and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY).
http://creativecommons.org/licenses/by/4.0/



ABSTRACT
Amines, as a class of very effective drug functional groups, exist on most pharmaceutical structures. In this paper, we summarize the main methods for the synthesis of existing amines, and explore the methods for the synthesis of novel amines.
Keywords:Amine, Amino, Synthesis of Amines

胺的合成反应综述
何永富,李荣疆
杭州源昶医药科技有限公司,浙江 杭州

收稿日期:2016年9月30日;录用日期:2016年10月16日;发布日期:2016年10月19日

摘 要
胺作为一类非常有效的药物官能团,存在于大多数药物结构之上。本文总结现有胺的合成的主要方法,以及探索寻找新的胺的合成方法。
关键词 :胺,氨基,胺的合成

1. 引言
胺类广泛存在于生物界,是一种十分有效的药物官能团,具有极重要的生理活性和生物活性,如蛋白质、核酸、许多激素、抗生素和生物碱等都是胺的复杂衍生物,目前在临床上使用的大多数药物都是胺或者胺的衍生物,因此研究和掌握胺的性质以及合成方法就显得尤为重要,是保证人们健康的必须手段。
胺作为一种药效基团主要参与特异的受体结合并启动生物效应。药效团的基本意义在于当化合物的部分变化结构发生时,生物活性随之产生相应的改变,而其余部分结构发生变化时,生物活性发生微小变化或者不变。现代药物化学研究与设计已经把胺类结构定位为最重要药效基团之一。此外胺类结构对于改善化合物的整体水油分配系数(即logP)亦有十分重要作用,通过将胺制备成从不同类型的盐,如盐酸盐、磷酸盐、硫酸盐或有机盐等,从而用以改善药物在生物体内的吸收和代谢。同时从化学合成的角度来说,氨基的存在有利于化合物结构多样性的产生,有利于优化过程的快速进行。因此,氨基不但是现代药物的关键活性基团,胺类化合物同时也是有机合成化学中的重要中间体和配体 [1] [2] 。而胺类化合物的合成方法一直是化学家关注的热点之一 [3] [4] 。本文主要总结现有胺的合成方法。
2. 硝基的还原
硝基的还原是制备胺最常用的方法。主要方法分为化学还原法和催化氢化法,其中化学还原法分为金属还原法,金属氢化物还原法。
2.1. 金属还原法
金属与质子溶剂还原是使用的最早,研究的较多,应用范围较广的一类还原方法。铁粉还原法最为常见,该方法操作简单,选择性高,还原效率高,尤其是对芳胺的制备具有一定的优越性。除了常用的铁粉外,锌和锡也可以用来还原芳香族硝基化合物,主要是在Zn/HCl,Sn/HCl,SnCl2/HCl等体系中进行还原反应。此外镁,锰,镍也可以作为还原剂进行硝基化合物的还原。这些金属与铁粉相比,价格相对较贵,易氧化,甚至需要加入其它催化剂来进行反应,因此实验室更加倾向于使用铁粉来进行硝基化合物的还原(图1)。
Abderahman曾报 [5] 使用保险粉在乙醇中加热的方法也能够还原硝基,该方法在实践中只要用保险粉在乙醇中回流几小时即可,并且这也是一个较为简便,易于处理的反应(图2)。
2.2. 金属氢化物还原
自从1946 年发现了氢化铝锂的制备和应用以来 [6] ,金属氢化物和复氢化物在有机合成上作为还原剂应用的研究,受到很大的重视 [7] - [11] 。该方法条件温和,收率高,容易实现工业化等优点,常用于醛类、酮、酸、酯,硝基化合物的还原,在实验室和精细有机工业中已成为不可缺少的还原手段,在某些方面已经成为无可代替的方法。
还原反应常用的催化氢化和金属与供质子剂还原,虽然它们的应用十分广泛,但还是有不少还原反应无法满足它们的要求,因此只能用金属氢化物还原来完成。目前常见的金属氢化物有LiH,CaH2,LiAlH4,LiBH4,KBH4等,其中以氢化铝锂(LiAlH4)和硼氢化钠(NaBH4)的研究和应用最为广泛(图3)。

Figure 1. The iron powder reduction of nitro
图1. 硝基的铁粉还原

Figure 2. The sodium dithionite reduction of nitro
图2. 硝基的保险粉还原

Figure 3. The LAH reduction of unsaturated nitro
图3. 不饱和硝基的氢化铝锂还原
2.3. 催化氢化
1897年萨巴迪阿(Paul Sabatier)发现镍可以催化氢化还原烯类化合物,此后催化氢化就得到迅速的发展。现在它已经成为有机合成的重要手段,工业上也已大量采用。该方法,操作简便,反应快速,产量较高,产物较纯,因而被广泛使用。催化加氢的常用的催化剂为金属类,分为贵重金属和一般金属,其中以贵重金属为主。贵重金属常以钯,铂为主,其次铑、铱、锇、钌、铼等;一般金属以镍为主,其次铜、钼、钴、铁等(图4);常用的溶剂是水,醇类,乙酸乙酯,乙酸,四氢呋喃环己烷等。
2.4. 联氨(肼)还原
联氨作为一种强还原剂应用于工业,在无机化学上早就有人应用它做还原剂,最早是在锅炉内壁使氧化铁还原成黑色磁性四氧化三铁保护膜,副产物是氮气和水。但是在有机化学方面,对联氨的还原的研究起步比较晚。直到1911年和1912年,凯希涅和吴尔夫以及后来做出重大改进的黄鸣龙 [12] [13] ,分别以腙在碱性介质中加热的到烃,发现了还原羰基成为亚甲基的方法,人们才引起了对联氨的重视。联氨催化还原具有工艺流程短、设备简单、操作容易、生产效率高、成本低等优点。实验室常将联氨和被还原物在醇类溶剂中回流反应,反应至无气泡即可(图5)。
3. 醛酮的还原胺化反应
还原胺化反应,又称鲍奇还原(Borch Reduction),是一种简便的把醛酮转换成胺的方法。
醛酮的还原胺化可分为两步,先是将羰基跟胺脱水生成亚胺(西弗碱),然后用硼氢化钠或者氰基硼氢化钠还原成胺。该反应可在弱酸催化或者无催化剂下自发进行,因为弱酸一方面使羰基质子化增强了亲电性促进了反应,另一方面也避免了胺过度质子化造成亲核性下降的发生。用氰代硼氢化钠比硼氢化钠

Figure 4. The Pd/C reduction of nitro
图4. 硝基的Pd/C还原

Figure 5. The hydrazine hydrate reduction of nitro
图5. 硝基的水合肼-Raney Ni还原
要好,因为氰基的吸电诱导效应削弱了硼氢键的活性,使得氰代硼氢化钠只能选择性地还原西弗碱而不会还原醛、酮的羰基,从而避免了副反应的发生。当用NaBH(OAc)3作还原剂时,使用1,2-二氯乙烷做溶剂可以缩短反应时间并显著提高产率。
如果化合物结构中的某些官能团对还原剂敏感,甚至可能存在一些副反应时,该方法就无法满足反应的需求,因此出现了一些新的还原体系如吡啶-硼烷 [14] [15] ,硼氢化锌 [16] [17] ,有机硅烷 [18] - [20] ,有机锡氢化物等氢化试剂 [21] [22] 。另外一种新的还原方法Hantzsch二氢吡啶体系最近也已有报道 [23] 。
但是这些制备仲胺的还原方法都存在这样的问题,在相当多的反应中不可避免地会有过烷基化反应的发生。特别是氨气与醛或酮反应制备伯胺时,更难控制产物进一步烷基化的发生。2004年,Bhattacharyya [24] 报道了一种新的还原体系Ti(OPr-i)4-NaBH4,不但可以高产率地合成伯胺,而且可以从氨气和醛,通过还原胺化有效制备对称的伯胺(图6)。
研究发现,低浓度的氨气更有利于仲胺的生成,因此Bhattacharyya采用了NH4Cl-Et3N体系作为氨源替代氨气,NH4Cl在无水乙醇中溶解度低,可以缓慢释放出氨气。运用此法,醛与氯化铵,三乙胺和异丙醇钛在乙醇中反应,随后用硼氢化纳还原,中等产率得到相应的仲胺。含各种取代基包括带供电子基和吸电子取代基的芳香醛都可以制备相应的仲胺,脂肪醛也可以用来制备相应的仲胺。
4. 酰胺的还原
酰胺还原是有机合成中最重要的反应之一,也是合成胺基的一种常用的方法。通过选择和控制合适的反应条件,可以将酰胺(包括内酰胺)还原成醛、醇、亚胺或胺等不同的目标产物,其中将酰胺还原成胺是最重要的反应。酰胺的还原常用催化加氢和金属氢化物还原,最常见的方法就是通过LAH在加热回流下进行。该方法在室温和非质子溶剂如乙醚、四氢呋喃中,能将酰胺或者内酰胺还原成胺。另外碳酰胺在LAH的还原条件下,也可被还原成为甲基,这也是一个常用的将伯胺单甲基化的一种方法。一般由于Boc (叔丁氧羰基)易于反应,及中间体的提纯,因此常用于此类反应(图7)。
如果分子结构中具有不饱和的官能团如羰基、酯基、酰卤时,它也能够将其还原,选择性较差。因此这时需要一些温和的还原条件,目前常用的有:硼烷还原,NaBH4-Lewis酸体系还原,DIBAL还原等等。
硼氢化钠的还原能力属于中等,一般在常温下它无法将酰胺、腈、羧酸酯和羧酸还原,因此在回流的四氢呋喃中进行反应,它可以将二级酰胺和三级酰胺还原。在回流的叔丁醇和甲醇混合液中,能将内酰胺还原成胺 [25] (图8)。
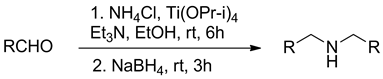
Figure 6. The Ti(OPr-i)4-NaBH4 system synthesis of secondary amine
图6. Ti(OPr-i)4-NaBH4体系合成仲胺

Figure 7. The single methylation of primary amine
图7. 伯胺的单甲基化
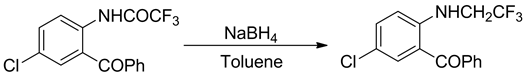
Figure 8. The NaBH4 reduction of amide
图8. 酰胺的NaBH4还原
5. 腈基还原
将腈基还原成伯胺还是较为容易的,利用氢化将氰基还原制备伯胺的方法在工艺上已经比较成熟,催化加氢的催化剂也有很多,如镍、钯、氧化铂,钴和硼化镍等,其中使用最多的为镍和钯。使用镍还原氰基该技术目前已经非常成熟,该反应收率较高,大多都在90%以上,因此应用最为广泛(图9)。使用钯还原的应用也越来越广泛,反应条件不仅多变,可以在常压,高压,酸性,中性下进行;高压进行时反应速率快,收率高,而且钯作为还原剂还可以使用肼,甲酸铵代替氢气进行反应。
6. 叠氮的还原
叠氮化合物自Curtius发现由叠氮化合物制备一级胺后,叠氮化合物才慢慢引起人们的注意。几十年来,化学家在叠氮方面的研究上做了大量的工作,在大量关于叠氮化合物的报道中,将叠氮化合物还原成胺或者酰胺一直是关注的热点。随着杂环化学、糖化学、核苷酸化学和药物化学的不断发展,胺类化合物的合成与修饰越来越复杂。叠氮基可方便地通过无机叠氮化合物引入到有机分子中,主要是对分子中的卤素(通常是溴)进行亲核取代;然后通过合适的试剂将其还原成胺。此外还可以通过适当的试剂在温和的条件下,在叠氮基还原成氨基时对氨基进行保护。该方法还可用于制取采用其它方法不易合成的胺类化合物。
通过叠氮化合物还原也是制备胺的一个较为常用的方法,一般常用的方法有硼氢化物法,氢化还原法,氢化铝锂法。硼氢化物法反应条件温和、选择性较好,因而受到人们的重视;催化氢化法法的选择性较差,但通过控制反应条件,可以实现只还原叠氮基而不影响如醇、酯、羧酸、酰胺、酮、糖、β-内酰胺、杂环等结构;氢化铝锂法由于LAH对空气特别敏感,故反应需要在惰性气体保护条件下进行,而且需要大量过量的LAH和较长的反应时间,同时某些官能团(如酯基)对LAH可能特别敏感。因此,这种方法一般只是在不需要考虑化学选择性时使用(图10)。
7. 霍夫曼(Hofmann)降解反应
氮上无取代基的酰胺与次氯酸钠或次溴酸钠的碱溶液作用时,脱去羰基生成伯胺,在反应中使碳链减少一个碳原子,这是霍夫曼所发现制胺的一个方法,通常称为霍夫曼降解反应(图11)。
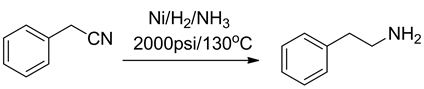
Figure 9. The Raney Ni Hydride reduction of cyan
图9. 腈基的Raney Ni氢化还原

Figure 10. The azide back into amine
图10. 叠氮还原成胺

Figure 11. The Hofmann rearrangement
图11. 霍夫曼降解反应

Figure 12. The reduction of imines
图12. 亚胺的还原
这个反应的过程比较复杂,其历程如下:步骤(1)是酰胺的卤代,即氮原子上的氢被卤素取代,得到N-卤代酰胺的中间体。第(2)步是在碱作用下,脱去卤化氢,得到一个缺电子的氮原子的中间体酰基氮烯。酰基氮烯很不稳定,容易发生重排。第(3)步是烷基带着一对电子转移到缺电子的氮原子上,生成异腈酸酯。第(4)步是异腈酸酯的水解反应,即异腈酸酯在碱性水溶液中很容易脱去CO而生成伯胺和碳酸根离子。在反应过程中由于发生了重排,所以又称为霍夫曼重排反应。该反应过程虽然很复杂,但其反应产率较高。
8. 亚胺的还原
亚胺的还原也是制备胺的一种常用方法,主要采用硼氢化物或者氢化铝锂法,以及催化加氢进行还原。催化氢化在无选择性的催化剂下,往往得到外消旋体,若在手性催化剂下,催化氢化有可能得到手性化合物,该方法是制备手性化合物的方法之一。随着手性技术的发展,在手性试剂或手性催化剂的诱导下,亚胺的不对称还原是近年来研究的热点 [26] (图12)。
9. 结语
胺作为一类非常有效的药物官能团,存在于大多数药物结构之上。有关胺的合成方法研究不仅有利于促进现代有机合成方法学的研究和应用,而且对于当代药物化学发展有着举足轻重的作用和意义。虽然关于胺的合成,文献已经报道了相当多的方法和策略,但是近年来,新的合成方法还是不断涌现,层出不穷,本文只是总结了有关胺合成的一些代表性的方法。由于胺在药物化学和有机合成化学领域占有特殊重要的地位,相信关于胺的合成方法学研究今后仍将是人们关注的重要研究热点之一。
文章引用
何永富,李荣疆. 胺的合成反应综述
The Summary of the Synthesis of Amines[J]. 合成化学研究, 2016, 04(02): 11-18. http://dx.doi.org/10.12677/SSC.2016.42002
参考文献 (References)
- 1. Insaf, S.S. and Witiak, D.T. (1999) Facile Non-Racemizing Route for the N-Alkylation of Hindered Secondary Amines. Synthesis, 3, 435-440.
- 2. Swamura, M. and Ito, Y. (1992) Catalytic Asymmetric Synthesis by Means of Secondary Interaction between Chiral Ligands and Substrates. Chemical Reviews, 92, 857-871. http://dx.doi.org/10.1021/cr00013a005
- 3. Salvatore, R.N., Yoon, C.H. and Jung, K.W. (2001) Synthesis of Secondary Amines. Tetrahedron, 57, 7785-7811. http://dx.doi.org/10.1016/S0040-4020(01)00722-0
- 4. 凌青, 李欣, 沈竞康. 仲胺的合成方法新进展[J]. 合成化学, 2007, 15(3): 245-253.
- 5. Er-Rhaimini, A. and Mornet, R. (1988) 4-Nitrobenzyl as a N-Protective Group in N-heterocycles: An Easy Access to 7-Arylmethyladenines from 3-(4-Nitrobenzyl)Adenine. Synthesis, 2, 154-155. http://dx.doi.org/10.1055/s-1988-27500
- 6. Finholt, A.E., Bond Jr., A.C. and Schlesinger, H.I. (1947) Lithium Aluminum Hydride, Aluminum Hydride, and Lithium Gallium Hydride, and Some of Their Applications in Organic and Inorganic Chemistry. Chemical Society, 69, 1199-1203. http://dx.doi.org/10.1021/ja01197a061
- 7. Brown, W.G. (1951) Reductions by Lithium Aluminum Hydride. Organic Reactions, 6, 469.
- 8. Hormann, H. (1963) Reduction of Carbonyl Compounds with Complex Hydrides. In: Forest, W., Ed., Newer Methods of Preparative Organic Chemistry, Translated into English by F. K. Kirchner, Vol. 2, Academic Press, New York, 213.
- 9. House, H.O. (1965) Modern Synthetic Reactions. W. A. Benjamin Inc., New York, 23.
- 10. Malek, J. and Cerny, M. (1972) Reduction of Organic Compounds by Alkoxyaluminohydrides. Synthesis, 5, 217-234. http://dx.doi.org/10.1055/s-1972-21858
- 11. Chen, S.-C. (1974) Molecular Rearrangements in Lithium Aluminum Hydride Reduction. Synthesis, 10, 691-703. http://dx.doi.org/10.1055/s-1974-23404
- 12. Ludwig, W. (1912) Methode zum Ersatz des Sauerstoffatoms der Ketone und Aldehyde durch Wasserstoff. European Journal of Organic Chemistry, 394, 86-108. http://dx.doi.org/10.1002/jlac.19123940107
- 13. Todd, D. (1948) Wolff-Kishner Reduction. Organic Reactions, 4, 378.
- 14. Pelter, A., Rosser, R.M. and Mills, S. (1984) Reductive Aminations of Ketones and Aldehydes Using Borane-Pyridine. Organic and Bio-Organic Chemistry, 4, 717-720.
- 15. Bomann, M.D., Guch, I.C. and Di Mare, M. (1995) A Mild, Pyridine-Borane-Based Reductive Amination Protocol. The Journal of Organic Chemistry, 60, 5995-5996. http://dx.doi.org/10.1021/jo00123a049
- 16. Bhattacharyya, S., Chatterjee, A. and Duttachowdhury, S.K. (1994) Use of Zinc Borohydride in Reductive Amination: An Efficient and Mild Method for N-Methylation of Amines[J]. Organic and Bio-Organic Chemistry, 1, 1-2.
- 17. Ranu, B.C., Majee, A. and Sarkar, A. (1998) One-Pot Reductive Amination of Conjugated Aldehydes and Ketones with Silica Gel and Zinc Borohydride. The Journal of Organic Chemistry, 63, 370-373. http://dx.doi.org/10.1021/jo971117h
- 18. Han, Y.L. and Chorev, M. (1999) A Novel, One-Pot Reductive Alkylation of Amines by S-Ethyl Thioesters Mediated by Triethylsilane and Sodium Triacetoxyborohydride in the Presence of Palladium on Carbon. The Journal of Organic Chemistry, 64, 1972-1978. http://dx.doi.org/10.1021/jo982125g
- 19. Chen, B.-C., Sundeen, J.E., Guo, P., Bednarz, M.S. and Zhao, R. (2001) Novel Triethylsilane Mediated Reductive N-Alkylation of Amines: Improved Synthesis of 1-(4-Imidazolylmethyl)-4-Sulfonylbenzodiazepines, New Farnesyltransferase Inhibitors. Tetrahedron Letters, 42, 1245-1246. http://dx.doi.org/10.1016/S0040-4039(00)02257-7
- 20. Apodaca, R. and Xiao, W. (2001) Direct Reductive Amination of Aldehydes and Ketones Using Phenylsilane: Catalysis by Dibutyltin Dichloride. Organic Letters, 3, 1745-1748. http://dx.doi.org/10.1021/ol015948s
- 21. Suwa, T., Shibata, I., Nishino, K. and Baba, A. (1999) Synthesis of Nitrogen Heterocycles by Intramolecular Michael Type of Amination via Reduction of Imines with Di-n-Butyliodotin Hydride (n-Bu2SnIH). Organic Letters, 1, 1579- 1581. http://dx.doi.org/10.1021/ol990225i
- 22. Suwa, T., Sugiyama, E., Shibata, I. and Baba, A. (2000) Chemoselective Reductive Amination of Aldehydes and Ketones by Dibutylchlorotin Hydride-HMPA Complex. Synthesis, 6, 789-800. http://dx.doi.org/10.1055/s-2000-6273
- 23. Itoh, T., Nagata, K., Kurihara, A., Miyazaki, M. and Ohsawa, A. (2002) Reductive Amination of Aldehydes and Ketones by a Hantzsch Dihydropyridine Using Scandium Triflate as a Catalyst. Tetrahedron Letters, 43, 3105-3108. http://dx.doi.org/10.1016/S0040-4039(02)00493-8
- 24. Miriyala, B., Bhattacharyya, S. and Williamson, J.S. (2004) Chemoselective Reductive Alkylation of Ammonia with Carbonyl Compounds: Synthesis of Primary and Symmetrical Secondary Amines. Tetrahedron, 60, 1463-1471. http://dx.doi.org/10.1016/j.tet.2003.12.024
- 25. 陈晓, 花文廷. 酰胺还原反应研究进展[J]. 化学通报, 2001, 64(12): 749-754.
- 26. 谷利军, 高兴文, 宋宝安, 徐应淑, 李彩虹. 亚胺反应的研究进展[J]. 化学研究, 2006, 17(2): 92-96.