Material Sciences
Vol.05 No.03(2015), Article ID:15302,6
pages
10.12677/MS.2015.53017
Pluronic F127 Regulated Coprecipitation Preparation and Characterization of MnFe2O4 Nanoparticles
Yang Hu, Guangfu Yin*, Ximing Pu
College of Materials Science and Engineering, Sichuan University, Chengdu Sichuan
*通讯作者。
Email: *nic0700@scu.edu.cn
Received: May 4th, 2015; accepted: May 20th, 2015; published: May 27th, 2015
Copyright © 2015 by authors and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY).
http://creativecommons.org/licenses/by/4.0/



ABSTRACT
MnFe2O4 nanoparticles have great potentials in Magnetic Resonance Imaging and tumor hyperthermia. However for biomedical applications, the main challenges would be of great difficulty to synthesize MnFe2O4 nanoparticles with homogeneous size and morphology, high magnetization, and good biocompatibility. Pluronic F127 was utilized to regulate the coprecipitation process of MnFe2O4 nanoparticles. Objective: The regulation of Pluronic F127 in the coprecipitation process was expected to facilitate the formation of MnFe2O4 nanoparticles with uniform size and morphology, higher magnetization, and low cytotoxicity. Methods: MnFe2O4 nanoparticles were prepared by chemical coprecipitation method in presence of Pluronic F127. X-ray diffraction (XRD), transmission electron microscopy (TEM), and vibrating sample magnetometer (VSM) were used to characterize the composition, microstructure, morphology, and magnetization of the prepared MnFe2O4 nanoparticles. And MTT assays were conducted to investigate their cytotoxicity. Results: The ferromagnetic MnFe2O4 nanoparticles (F127-NPs) were successfully synthesized in the presence of Pluronic F127 via coprecipitation method. Compared to the nanoparticles prepared without Pluronic F127, F127-NPs exhibited a more uniform size of ca. 50 nm and a sphere-like shape. Moreover, F127-NPs possessed a higher magnetization (44.8 emu/g) and exhibited little inhibition to HUVE cells. Conclusion: Pluronic F127 could regulate the coprecipitation process to form the high quality MnFe2O4 nanoparticles and improve the cytocompatibility of nanoparticles. And this method is of a great potential to be applied in the field of biomedicine.
Keywords:MnFe2O4 Nanoparticles, Pluronic F127, Coprecipitation, Ferromagnetism, Cytocompatibility

普朗尼克F127调控下MnFe2O4纳米粒子的共沉淀制备及其性能表征
胡杨,尹光福*,蒲曦鸣
四川大学材料科学与工程学院,四川 成都
Email: *nic0700@scu.edu.cn
收稿日期:2015年5月4日;录用日期:2015年5月20日;发布日期:2015年5月27日

摘 要
MnFe2O4纳米粒子在核磁共振成像和肿瘤磁热疗的应用上具有很大潜力。但是其应用于生物医学领域的主要障碍是难以制备形貌均一、分散性好、磁性能优异且生物相容性良好的MnFe2O4纳米粒子。目的:通过F127调控下的共沉淀法制备粒径均匀且磁性能较好的MnFe2O4纳米粒子,且通过普朗尼克F127的修饰提高其分散性并降低MnFe2O4纳米粒子的细胞毒性。方法:以F127为模版,采用共沉淀法制备MnFe2O4磁性纳米粒。利用X射线衍射(XRD)、透射电子显微镜(TEM)、振动样品磁强计(VSM)、傅立叶变换红外光谱(FT-IR)等对样品的成分、微观结构、形貌和粒径以及磁性能进行表征。通过MTT实验对样品的细胞毒性进行评价。结果:采用普朗尼克F127调控下的共沉淀法成功制备大约50 nm的球形MnFe2O4铁磁性纳米粒子,其比饱和磁化强度为44.8 emu/g,对HUVEC细胞无明显毒性。结论:共沉淀过程中,F127能够控制MnFe2O4纳米粒子的形貌、粒径,从而提高其磁性能,另外还可以降低其细胞毒性。该方法在生物医学应用上具有很大的潜力。
关键词 :MnFe2O4纳米粒子,普朗尼克F127,共沉淀法,铁磁性,细胞相容性

1. 前言
由于具有特殊的光学、电学、磁学以及生物学性质,纳米粒子受到了广泛的研究和应用[1] 。尤其是在生物医学领域,如核磁共振成像(MRI)造影剂 [2] ,肿瘤磁热疗介质 [3] 等,具有特殊磁性能的纳米粒子被广泛研究和应用 [4] [5] 。而这些生物医学应用通常要求磁性纳米粒子具有良好的分散性、均匀的形貌和粒径、特殊的磁性能(例如超顺磁性、顺磁性、铁磁性)以及良好的生物相容性 [6] ,尤其是应用于人体内的磁性纳米粒子的粒径应介于10 nm~100 nm从而避免被肾脏清除或者被巨噬细胞吞噬 [7] 。MnFe2O4纳米粒子在生物医学应用上具有极大的潜力和广阔的前景 [8] 。但其应用往往受到其形貌、粒径以及生物相容性的限制。虽然许多研究都致力于MnFe2O4纳米粒子的表面修饰和功能化,使其能更好的应用于生物医学领域。但是制备形貌和粒径均匀、分散性良好、磁性能优异且生物相容性良好的MnFe2O4纳米粒子仍然是目前研究中的一个难题。MnFe2O4纳米粒子的制备方法多种多样。其中,化学共沉淀法由于具有操作简便、成本低廉、制备条件温和等优势被广泛使用。但该方法对MnFe2O4纳米粒子的形貌、尺寸以及粒径分布缺乏控制,从而导致所制备的MnFe2O4纳米粒子具有不均匀的磁学性质,因此限制了其在生物医学领域的应用。然而其它化学方法,例如水(溶剂)热法 [9] 、高温分解法 [10] 等,虽然可以合成具有良好形貌、均匀粒径且分布窄的纳米粒子,但通常会涉及有毒的化学试剂或苛刻的条件,从而降低了所制备MnFe2O4纳米粒子的生物相容性。本文采用在模板剂普朗尼克F127调控下的化学共沉淀过程制备MnFe2O4纳米粒子。并利用生物相容的普朗尼克F127与MnFe2O4纳米粒子结合,以降低其细胞毒性。另外,普朗尼克F127在水溶液中能稳定地形成球状自组装结构,利用这一性质来控制MnFe2O4纳米粒子的形貌和粒径,提高其磁学性能。作为对照,在水溶液中不能形成稳定自组装结构且含有羧基官能团的聚丙烯酸也被用作模板剂来调控MnFe2O4纳米粒子的共沉淀形成过程。
2. 材料与方法
2.1. 试剂与仪器
实验所用的试剂MnSO4∙H2O、FeCl3∙6H2O、NaOH、无水乙醇,聚丙烯酸(PAA)均为分析纯,购置于成都科龙化工有限公司。普朗尼克-F127(F127)亦为分析纯,购置于阿拉丁(中国)化工有限公司。
使用的主要仪器包括德国布鲁克D8-Advance X射线衍射仪(Cu靶,Kα射线,λ = 1.54178 Å);日本电子JEM-100CX透射电子显微镜(TEM);美国Lake shore-7400振动样品磁强计(VSM);日本岛津IR Prestige-21红外光谱仪(KBr压片);美国Molecular Devices VM酶标仪等。
2.2. 实验方法
2.2.1. MnFe2O4纳米粒的制备
称取一定质量的普朗尼克F127并充分地溶解于50 ml去离子水中,另称取一定质量的MnSO4∙H2O和FeCl3∙6H2O并溶于50 ml去离子水中。将上述两种溶液充分混合后,加热到一定温度,然后滴加化学计量数的0.1 mol/L的NaOH溶液。化学共沉淀法制备MnFe2O4的反应方程式为Mn2+ + 2Fe3+ + 8OH− → MnFe2O4 + 4H2O。最后,产物经离心分离,用去离子水和无水乙醇分别洗涤3次,在60℃下真空干燥。作为对照,在以PAA为模板的情况下,以相同的方法进行实验。实验条件设计如表1所示。
2.2.2. 材料表征
本文采用德国布鲁克D8-Advance X射线衍射仪(Cu靶,Kα射线,λ = 1.54178 Å)对纳米粒子的物相进行分析;采用日本电子JEM-100CX透射电子显微镜(TEM)对MnFe2O4纳米粒子的表面形貌、粒径大小及尺寸分布进行了表征;采用美国Lake shore-7400振动样品磁强计(VSM)对MnFe2O4纳米粒子的磁性能进行了考察;采用日本岛津IR Prestige-21红外光谱仪(IR,KBr压片)对MnFe2O4纳米粒子的表面成分进行了分析。
2.2.3. 细胞毒性测试
采用MTT法对MnFe2O4纳米粒子的细胞毒性进行评价。具体方法如下:首先将人脐静脉血管内皮细胞(HUVEC)接到96孔板中,保证细胞初始浓度为2 × 104个/孔。当细胞聚集后,加入不同浓度(6.25,12.5,25,50,100 µg/mL)的MnFe2O4纳米粒子悬浊液。然后,分别在培养1天、2天和3天之后加入20 µL MTT溶液(5 mg/mL)。继续培养4小时之后,除去培养孔中细胞培养液,加入200 µL的二甲亚砜。最后,通过酶标仪(美国Molecular Devices, VM)在波长为490 nm处测量吸光度。作为对照,在不加入MnFe2O4纳米粒子的情况下用相同的条件培养细胞并测量。
2.2.4. 统计学分析
本文使用版本为13.0 的Statistical Package for the Social Sciences (SPSS)软件进行统计学分析。每组平行样品数为5个(n = 5),数据以平局值 ± 标准差的形式表示,显著水平为小于0.05 (P < 0.05)。对所比较样品进行了单因素方差分析。
Table 1. Design of the experiment condition
表1. 实验条件设计
3. 结果与讨论
图1是不同条件下制备样品的X射线衍射(XRD)图谱。从图中可以看出,C60-NPs和C40-NPs样品的图谱中其特征衍射峰很不明显甚至没有,且杂峰较多。而C80-NPs样品在2-Theta为18.2˚,29.8˚,35.2˚,42.7˚,51.3˚以及61.9˚处显现出明显的衍射峰,分别对应于尖晶石型MnFe2O4标准衍射图谱(JCPDS为88-1965)中的(111),(220),(311),(400),(511)和(440)晶面,并且其特征衍射峰的峰位与标准图谱基本一致,且无杂峰。这说明采用化学共沉淀法,在80℃制备的样品为纯的尖晶石型MnFe2O4晶体,而在40℃和60℃没能形成MnFe2O4晶体。由此得出结论,反应温度对产物的物相和结晶性质有很大的影响。在MnFe2O4共沉淀过反应温度对产物的物相和结晶性质有很大的影响。在MnFe2O4共沉淀过程中,首先生成无定型的Mn(OH)2和Fe(OH)3前驱体,然后它们再反应从而生成MnFe2O4。而较低的温度不利于物质传输和能量转换,因此阻碍了Mn(OH)2和Fe(OH)3的反应从而导致所得到产物结晶性差。因此,采用F127调控下的化学共沉淀法制备MnFe2O4纳米粒子时,其反应温度设为80℃。如图所示,F127-NPs样品在2-Theta为18.2˚,29.8˚,35.2˚,42.7˚,51.3˚以及61.9˚处也出现了对应于尖晶石型MnFe2O4(111),(220),(311),(400),(511)和(440)晶面的特征衍射峰,并且峰位与标准图谱相同,且无杂峰。这就说明采用F127调控下的化学共沉淀法制备的产物为纯相的尖晶石型结构的MnFe2O4晶体。另外,PAA-NPs样品几乎没有出现明显的特征衍射峰,这说明其结晶度很低,可能没有形成MnFe2O4晶体或者无定型的杂质较多。由此看来,模板剂都对产物的物相以及结晶性质也有很大的影响。PAA含有许多羧基,其水溶液为酸性,在反应过程中会消耗一部分OH−,从而导致Mn2+、Fe3+以及OH−之间的反应不完全,生成的中间体无法结晶,从而所得到的产物无定型程度高。而F127没有能与OH−反应的基团,因此能顺利的形成MnFe2O4晶体。另外,PAA在水溶液中不能自发形成稳定的自组装结构来限制Fe3+、Mn2+与OH−的反应也可能是没有形成MnFe2O4晶体的重要原因之一。
图2是F127-NPs和C80-NPs的透射电子显微镜(TEM)照片。从图中可以看出,C80-NPs (图2(a))的形貌和粒径不均匀,分布较宽,一般在20 nm~80 nm之间。且粒子团聚较为严重,分散性较差。而F127-NPs (图2(b))的粒径较均匀,平均在30 nm~50 nm之间。并且形貌多为球形,没有严重的团聚现象,分散性较好。由此可见,F127在MnFe2O4纳米粒子的形成过程中对其形貌和粒径具有一定的调控作用。F127是一种聚氧乙烯–聚氧丙烯–聚氧乙烯(PEO-PPO-PEO)三嵌段共聚物,这种三嵌段共聚物在水溶液中通常可以自发形成多分子聚集的胶束。其内核以疏水PPO嵌段为主成分,掺有若干的PEO嵌段,其余的PEO嵌段环绕在外构成外壳 [11] [12] 。而这种胶束为MnFe2O4的形成提供了一个微型反应环境,不仅可以调控其成核位点和物质传输,还可以限制其晶粒的生长。因此,在F127的调控下形成的MnFe2O4纳米粒子的形貌和粒径都较为均匀。
图3是F127-NPs和C80-NPs的磁滞回线。从图中可以得知,F127-NPs和C80-NPs都具有明显的铁磁性,其比饱和磁化强度分别为44.8 emu/g和27.5 emu/g,矫顽力分别为69.8 Oe和66.6 Oe。由此看出,
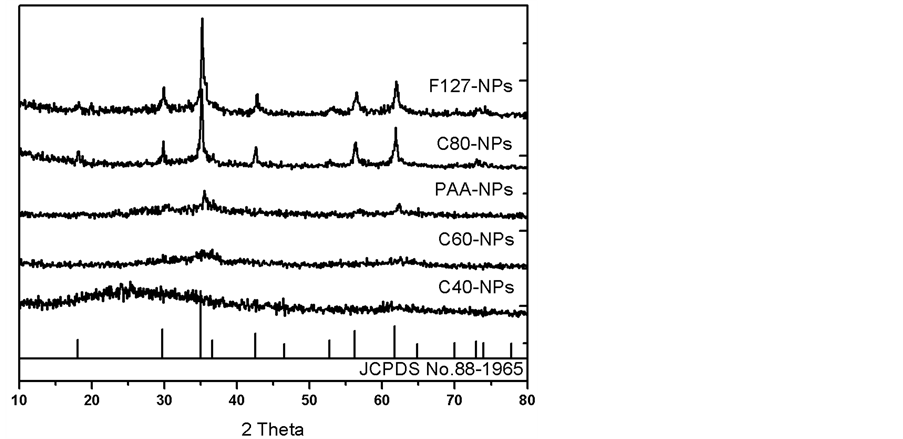
Figure 1. XRD patterns of the samples prepared under different conditions
图1. 不同条件下制备的样品的XRD衍射图谱

Figure 2. TEM images of (a) C80-NPs and (b) F127-NPs
图2. (a) C80-NPs和(b) F127-NPs的TEM照片
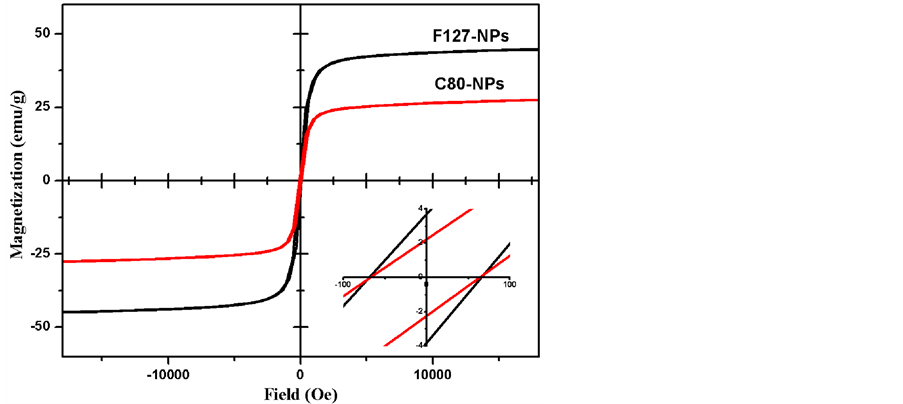
Figure 3. Magnetic hysteresis loops of F127-NPs and C80-NPs
图3. 室温下F127-NPs和C80-NPs的磁滞回线
F127-NPs具有较高的比饱和磁化强度,这是由于在F127的调控下,所生成的MnFe2O4纳米粒子具有更均匀的形貌和粒径以及更高的结晶度。这与XRD结果和TEM结果是相一致的。通过这种方法制备的具有良好磁性能的F127-NPs在生物医学应用上具有很大潜力。
图4是F127-NPs、C80-NPs以及纯的F127的红外吸收光谱。从图中可以看出,F127-NPs与纯的F127在波数为2880 cm−1、1460 cm−1、1280 cm−1、1230 cm−1、1100 cm−1以及840 cm−1处具有相同的吸收峰,而C80-NPs在这些波数处不具有明显的吸收峰。这就说明F127-NPs中有F127的存在。并且,F127可能是在制备过程中包覆、缠绕于MnFe2O4纳米粒子,或者是通过静电吸引以及氢键作用与MnFe2O4纳米粒子相互结合。
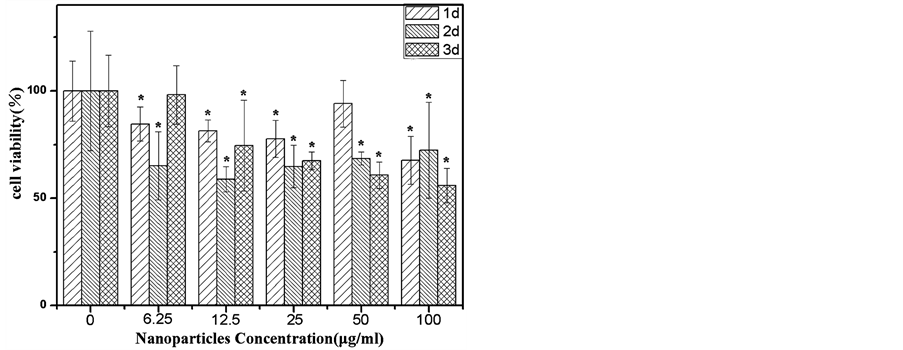
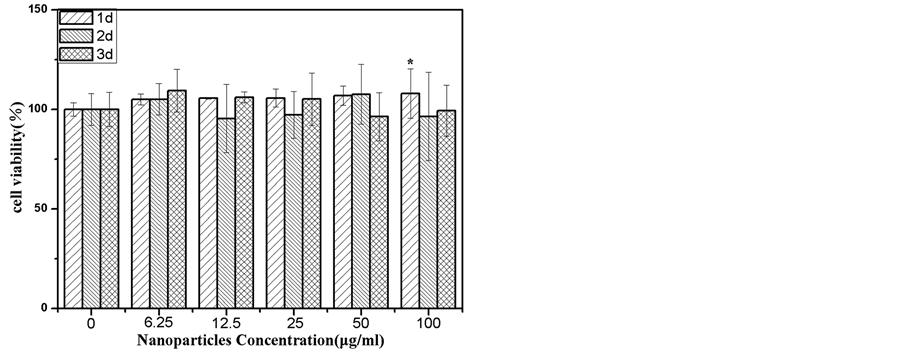
F127具有良好的生物相容性 [13] ,在F127调控下制备的MnFe2O4纳米粒子可能通过F127的修饰从而改善其细胞毒性。因此,MTT法被用来考察F127-NPs是与F127-NPs和C80-NPs共培养后HUVEC的细胞对人脐静脉上皮细胞(HUVEC)的细胞毒性。图5为活性统计图。由图可知,与不同浓度的C80-NPs
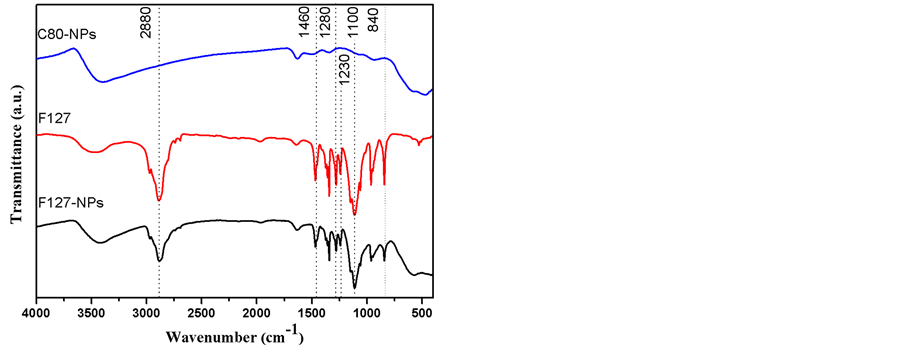
Figure 4. IR spectrum of F127-NPs, F127, and C80-NPs
图4. F127-NPs、F127以及C80-NPs的红外吸收光谱
 (a) (b)
(a) (b)
Figure 5. Cell viability of HUVEC cells incubated with (a) C80-NPs and (b) F127-NPs of concentrations (0/control, 6.25, 12.5, 25, 50 and 100 µg/mL) after different time. Error bars indicate standard deviation (n = 5). The asterisk (*) represents a significant difference, P < 0.05
图5. 分别与浓度为6.25、12.5、25、50 和100 µg/mL的(a) C80-NPs和(b) F127-NPs共培养后的HUVEC细胞的细胞活性
共培养1天、2天或者3天后,HUVEC的细胞活性几乎都明显地下降(显著水平P < 0.05),这说明C80-NPs对HUVEC的增殖具有明显的的抑制作用。然而,与100 μg/ml的F127-NPs共培养1天后,HUVEC的细胞活性明显上升。并且在与其他浓度的F127-NPs共培养1天、2天或者3天后,HUVEC的细胞活性没有显著性地上升或者下降(显著水平P < 0.05)。这说明F127-NPs对HUVEC的增殖没有明显的促进或者抑制作用。由以上结果可知,F127-NPs的细胞毒性明显低于C80-NPs。以上结果说明在F127调控下的化学共沉淀法制备过程中,F127的确可以通过某种作用方式与MnFe2O4纳米粒子结合,从而降低所其细胞毒性。
4. 结论
用化学共沉淀法在三嵌段共聚物F127的调控下成功制备了形貌和粒径都较均匀且分散性较好的MnFe2O4纳米粒子。相比之下,通过该方法制备的MnFe2O4纳米粒子具有良好的铁磁性,其比饱和磁化强度为44.8 emu/g。并且在制备过程中,通过F127的修饰可有效降低其细胞毒性。总之,通过该方法制备的MnFe2O4纳米粒子在生物医学应用,特别是作为核磁共振成像造影剂以及肿瘤磁热疗介质,具有很大的潜力和广阔的前景。
致谢
感谢国家自然科学基金(No. 51372157)对本研究的资助。
文章引用
胡 杨,尹光福,蒲曦鸣, (2015) 普朗尼克F127调控下MnFe2O4纳米粒子的共沉淀制备及其性能表征
Pluronic F127 Regulated Coprecipitation Preparation and Characterization of MnFe2O4 Nanoparticles. 材料科学,03,119-125. doi: 10.12677/MS.2015.53017
参考文献 (References)
- 1. Laurent, S., Forge, D., Port, M., et al. (2008) Magnetic iron oxide nanoparticles: Synthesis, stabilization, vectorization, physicochemical characterizations, and biological applications. Chemical Reviews, 108, 2064-2110.
- 2. Lam, T, Pouliot, P, Avti, P.K., et al. (2013) Superparamagnetic iron oxide based nanoprobes for imaging and theranostics. Advances in Colloid and Interface Science, 199-200, 95-113.
- 3. Liu, X.L. and Fan, H.M. (2014) Innovative magnetic nanoparticle platform for magnetic resonance imaging and magnetic fluid hyperthermia applications. Current Opinion in Chemical Engineering, 4, 38-46.
- 4. Gupta, A.K. and Gupta, M. (2005) Synthesis and surface engineering of iron oxide nanoparticles for biomedical applications. Biomaterials, 26, 3995-4021.
- 5. Gebreel, D., Shalaby, T., Yousef, Y., et al. (2014) Magnetic fluid based on Fe3O4 nanoparticles: Preparation and hyperthermia application. International Journal of Chemical and Applied Biological Sciences, 1, 24.
- 6. Shokrollahi, H. (2013) Structure, synthetic methods, magnetic properties and biomedical applications of ferrofluids. Materials Science & Engineering C, Materials for Biological Applications, 33, 2476-2487.
- 7. Bañobre-López, M., Piñeiro, Y., López-Quintela, M.A. and Rivas, J. (2014) Magnetic Nanoparticles for Biomedical Applications. Handbook of Nanomaterials Properties, Springer, 457-493.
- 8. Kim, D.-H., Nikles, D.E. and Brazel, C.S. (2010) Synthesis and characterization of multifunctional chi-tosan-MnFe2O4 nanoparticles for magnetic hyperthermia and drug delivery. Materials, 3, 4051-4065.
- 9. Alvani, C., Ennas, G., La Barbera, A., et al. (2005) Synthesis and characterization of nanocrystalline MnFe2O4: advances in ther-mochemical water splitting. International Journal of Hydrogen Energy, 30, 1407-1411.
- 10. Zeng, H., Rice, P.M., Wang, S.X., et al. (2004) Shape-controlled synthesis and shape-induced texture of MnFe2O4 nanoparticles. Journal of the American Chemical Society, 126, 11458-11459.
- 11. Nivaggioli, T., Alexandridis, P., Hatton, T.A., et al. (1995) Fluorescence probe studies of pluronic copolymer solutions as a function of temperature. Langmuir: The ACS Journal of Surfaces and Colloids, 11, 730-737.
- 12. Alexandridis, P. and Hatton, T.A. (1995) Poly(ethylene oxide)/poly(propylene oxide)/poly(ethylene oxide) block copolymer surfactants in aqueous solutions and at interfaces: thermodynamics, structure, dynamics, and modeling. Colloids and Surfaces A: Physicochemical and Engineering Aspects, 96, 1-46.
- 13. Yildirim, A., Demirel, G.B., Erdem, R., et al. (2013) Pluronic polymer capped biocompatible mesoporous silica nanocarriers. Chemical Communications, 49, 9782-9784.
