Hans Journal of Chemical Engineering and Technology
Vol.06 No.06(2016), Article ID:19075,6
pages
10.12677/HJCET.2016.66023
Separation and Identification of a Bacterum Which Can Produce Cellulase and Tolerate Methanol
Zhaoqiu Ji1, Pengfei Qi2, Kun Pei2, Zhongliang Ma2*
1Hongze Farm, Jiangsu Petroleum Exploration Bureau, Huai’an Jiangsu
2School of Life Sciences, Shanghai University, Shanghai

Received: Nov. 5th, 2016; accepted: Nov. 26th, 2016; published: Nov. 29th, 2016
Copyright © 2016 by authors and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY).
http://creativecommons.org/licenses/by/4.0/



ABSTRACT
Bioenergy is a green and economic energy in modern times. To have Celluose used more efficiently, in this study, from soil samples in Yancheng Industrial Park of Jiangsu, we isolated a bacterium that cannot only grow in the presence of methanol, but also produce higher activity cellulase Provice. By sequencing analysis of 16S rDNA, the phylogenetic tree was constructed, and the similarity between the strain and B. megaterium was 99.7%. The testing of tolerance in methanol showed that the strains had higher tolerance of methanol and could even grow in the M9 medium with 11.85% methanol.
Keywords:B. megaterium, Cellulose, 16S rDNA, Resistance Methanol

一株产纤维素酶甲醇耐受细菌的分离与鉴定
嵇朝球1,祁鹏飞2,裴坤2,马中良2*
1江苏石油勘探局洪泽农场,江苏 淮安
2上海大学生命科学学院,上海

收稿日期:2016年11月5日;录用日期:2016年11月26日;发布日期:2016年11月29日

摘 要
当今时代,生物能源已经成为一种绿色经济的能源。为了更有效地利用纤维素,在这项研究中,自江苏盐城工业园区采集的土样中分离到一株既可耐受甲醇,又可产生高活性纤维素酶的细菌。通过16S rDNA序列分析,构建系统发育树,该菌株与巨大芽孢杆菌(B. megaterium)相似性为99.7%。甲醇耐受实验表明,菌株具有较高的甲醇耐受,甚至能在11.85%甲醇的M9培养基中生长。
关键词 :巨大芽孢杆菌,纤维素酶,16S rDNA

1. 引言
巨大芽孢杆菌(Bacillus megaterium)为好氧型革兰氏阳性菌,属芽孢杆菌属(Bacillus),是原核生物中一类能够形成芽孢,具有复杂细胞行为的微生物 [1] 。已有研究发现,以巨大芽孢杆菌作为分泌性的基因工程宿主菌,具有遗传稳定、表达率高、发酵工艺成熟、产物可分泌等优点,因此常在工业上用于葡萄糖异构酶的生产;同时因其可分解有机磷,也被用于农业上制造磷细菌肥料 [2] [3] [4] 。纤维素(Cellulose)作为自然界中分布最广、含量最多的一种大分子多糖 [5] [6] ,由葡萄糖单体聚合而成,是植物细胞壁的主要组成成分,占了植物总生物量的50%以上 [7] [8] [9] 。纤维素来源广泛,是宝贵的天然可再生资源,然而在生产中却难以有效利用,主要是由于纤维素自身的晶体结构致密,纤维素酶难以接近内部分子,导致了分解效率的低下 [10] 。微生物工程技术的发展为纤维素的合理利用提供了新的解决思路,多种纤维素酶工程菌也陆续被研究和构建 [11] [12] 。本文研究了新分离的一株产纤维素酶细菌在纤维素分解和甲醇耐受等方面的性质。
2. 材料与方法
2.1. 耐受甲醇产纤维素酶细菌的筛选和形态观察
2.1.1. 土样
江苏盐城工业园区取样。
2.1.2. 培养基
筛选培养基:Yeast Extract (FMB):1 g;CMC(BC):10 g;KH2PO4(AR):2 g;NaCl(AR):5 g;NH4NO3(AR):5 g;MgSO4∙7H2O(AR):0.5 g;蒸馏水定容至1000 mL。M9培养基:K2HPO4(AR):12.8 g;KH2PO4(AR):3.0 g;NaCl(AR):0.5 g;NH4NO3(AR):0.5 g;蒸馏水定容至1000 mL。所用试剂购自国药集团化学试剂有限公司。
2.1.3. 菌株分离步骤
取少量土样,用适量蒸馏水进行稀释,取200 µl稀释后菌液,加入到200 mL筛选培养基中,于37℃、250 rpm条件下,摇床培养12 h。取少量菌液,分别在筛选培养基和含6%甲醇的M9培养基上平板涂布,挑取生长良好的单菌落,再分别在另一种培养基(筛选培养基或含6%甲醇的M9培养基)上平板涂布。经过多次对应涂布划线,获得纯菌。
2.1.4. 形态学观察
将分离得到的菌株在固体培养基上培养,观察菌落形态。革兰氏染色后在光学显微镜下观察菌体形态。
2.2. 分子生物学鉴定
以分离菌株基因组DNA为模板,用细菌16S rDNA的通用引物[正向引物序列为:5'-AGAGTTTGATCMTGGCTCAG-3',反向引物序列为:5'-AAGGAGGTGATCCAGCC-3',上海生工合成],通过PCR 扩增分离菌株的16S rDNA。PCR扩增用Taq 酶(TaKaRa),94℃变性5 min 后进入循环:94℃ 30 s,53℃ 1 min,72℃ 1.50 min,共30个循环;最后72℃延伸10 min。16S rDNA序列的测定以及BLAST序列对比参照文献。
2.3. 生长曲线的测定
取50 mL液体培养基于250 mL的锥形瓶中,接种5 mL生长至最大值状态的分离菌的菌液,在37℃、250 rpm恒温摇床中培养,每隔一定时间测定菌体的OD600值。
2.4. 耐受甲醇的初步验证
以大肠杆菌(E. coli)作为阴性对照,将分离菌和E. coli同时在含2%甲醇的M9培养基上培养。
2.5. 不同PH值条件下产纤维素酶活力的测定
配制4瓶50 mL筛选培养基,分别调节初始PH值为6.0、7.0、8.0、9.0。分别接种5 mL生长至最大值状态的分离菌菌液,在37℃、250 rpm恒温摇床中培养,12 h后,取5 mL菌液离心后进行DNS法酶活测定。
3. 结果与讨论
3.1. 耐受甲醇产纤维素酶细菌的分离和鉴定
采集得到的土样在含甲醇的M9培养基和含CMC的筛选培养基上的分别涂布培养,以及交叉点样,最终得到一株具有既可以产纤维素酶又可以在甲醇作为单一碳源的培养基上生长的菌株。在固体培养基上划线,恒温37℃培养12 h,进行分离纯化。
所测菌株.的16S rDNA核苷酸序列为1543 bp。将所测序列与GenBank数据库中相关菌种进行比较,构建以16S rDNA全序列为基础的系统发育树(图1)。结果表明:所测菌株与芽孢杆菌属具有较大的同源性,并且与巨大芽孢杆菌(B. megaterium)同源性最高,为99.7%。根据《伯杰氏细菌鉴定手册》,结合菌落、细胞形态可以鉴定菌株属于芽孢杆菌属。
3.2. 菌株B. megaterium sp.的革兰氏染色结果
在图2中,通过革兰氏染色发现该分离菌为革兰氏阳性菌;通过电子显微镜观察,发现该菌的形态为短杆菌。
3.3. 菌株B. megaterium sp.的生长曲线
由图3可知,B. megaterium sp.的延迟期很短,以很快的速度就进入对数期,并且只用了3 h时间就处于稳定期。


Figure 1. Phylogenetic tree based on 16S rDNA sequence
图1. 根据16S rDNA序列构建的系统发育树

Figure 2. Spheroid morphology of B. megaterium sp. (1000×)
图2. B. megaterium sp.的菌落形态(1000×)
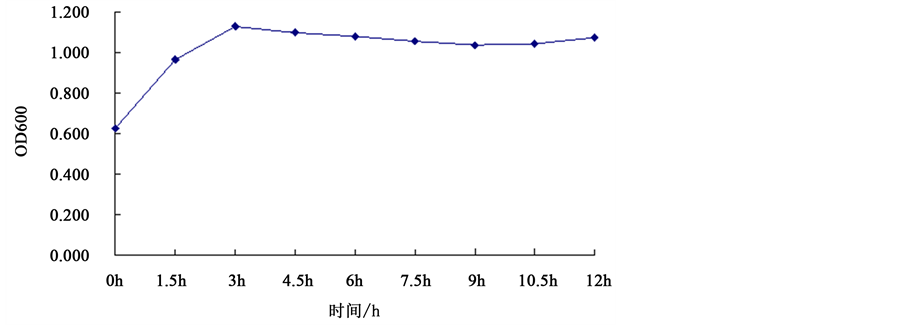
Figure 3. Growth curve of B. megaterium sp.
图3. B. megaterium sp.生长曲线
3.4. 菌株在不同PH值条件下的酶活测定
图4和图5为B. megaterium sp.在不同PH值时的对CMC的酶活力(CMCA)和对滤纸的酶活力(FPA)。可以看出,当PH值为8时,B. megaterium sp.对CMC和滤纸的降解能力最强。
3.5. 耐受甲醇菌B. megaterium sp.在含甲醇的M9培养基上生长情况
由图6可知,将E. coli作为阴性对照,将分离菌和E. coli同时在含甲醇2%的M9培养基上培养,发现分离菌(2f3区域)长势良好,而E. coli不生长。
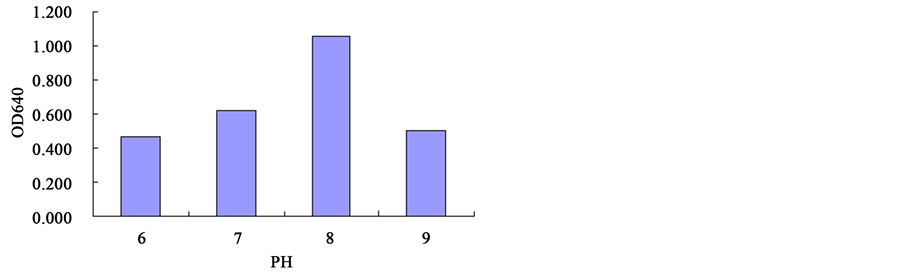
Figure 4. The CMCA of B. megaterium sp. at different PH values
图4. B. megaterium sp.在不同PH值时的CMCA
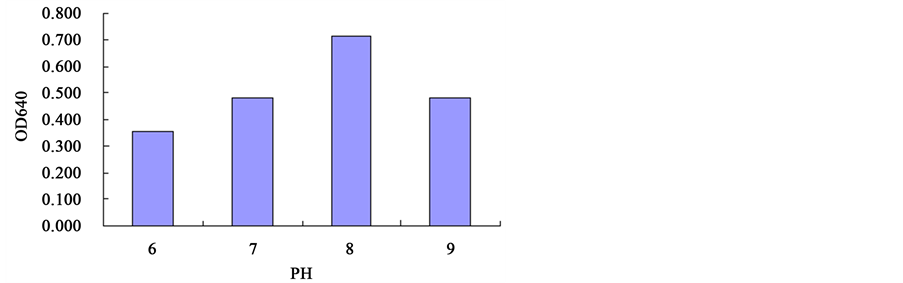
Figure 5. The FPA of B. megaterium sp. at different PH values
图5. B. megaterium sp.在不同PH值时的FPA

Figure 6. The detection of B. megaterium sp. for methanol tolerance by plate method
图6. 平板法检测B. megaterium sp.对甲醇的耐受性
4. 结论
本研究筛选出一株具有较强甲醇耐受并能产生纤维素酶的细菌,通过16S rDNA序列测定和系统发育树分析,并结合菌落、细胞形态的观察,初步鉴定该菌为巨大芽孢杆菌,并命名为B. megaterium sp.。最高甲醇耐受为11.85%,CMCA为3.1865 U/mg,FPA为3.9671 U/mg。
新分离的巨大芽孢杆菌具有的甲醇耐受性,可被用作细菌种类筛选的选择性条件,即通过加入一定浓度甲醇的选择性培养基,进行杂菌的去除和目标菌种的富集,为后期产纤维素基因工程菌的构建提供了天然性的有利条件。
能源问题是21世纪的头等问题,纤维素作为用之不竭的天然可再生资源,有着广阔的利用前景,研究表明新分离的甲醇耐受的巨大芽孢杆菌具有产生纤维素酶的能力,有成为优质工程菌的潜力。该细菌具体的降解机制还有待于进一步研究。
基金项目
上海市能源与育种重点实验室项目;上海大学生命科学学院大学生创新项目。
文章引用
嵇朝球,祁鹏飞,裴 坤,马中良. 一株产纤维素酶甲醇耐受细菌的分离与鉴定
Separation and Identification of a Bacterum Which Can Produce Cellulase and Tolerate Methanol[J]. 化学工程与技术, 2016, 06(06): 163-168. http://dx.doi.org/10.12677/HJCET.2016.66023
参考文献 (References)
- 1. 吕黎, 王蕾, 周佳敏, 罗志威, 丰来. 巨大芽孢杆菌的研究现状及应用[J]. 农业科学研究, 2014(3): 48-52.
- 2. 王效禹. 解磷巨大芽孢杆菌的筛选及产业化应用研究[D]: [硕士学位论文]. 长春: 吉林大学, 2015.
- 3. Biedendieck, R., Bunk, B., Fürch, T., Franco-Lara, E., Jahn, M. and Jahn, D. (2010) Systems Biology of Recombinant Protein Production in Bacillus megaterium. Advances in Biochemical Engineering/Biotechnology, 120, 133-161. https://doi.org/10.1007/10_2009_62
- 4. Biedendieck, R.A. (2016) Bacillus megaterium System for the Production of Recombinant Proteins and Protein Complexes. Advances in Experimental Medicine and Biology, 896, 97-113. https://doi.org/10.1007/978-3-319-27216-0_7
- 5. 张荫雷, 李莉, 戴天纭, 李蕴, 马中良. 预处理方法对玉米秸秆利用的影响[J]. 纤维素科学与技术, 2009, 17(3): 35-38.
- 6. English, J.D. and Vary, P.S. (1986) Isolation of Re-combination-Defective and UV-Sensitive Mutants of Bacillus megaterium. Journal of Bacteriology, 163, 155-160. https://doi.org/10.1128/jb.165.1.155-160.1986
- 7. Malten, M., Hollmann, R., Deckwer, W.-D. and Jahn, D. (2005) Production and Secretion of Recombinant Leuconostoc mesenteroides Dextransucrase DsrS in Bacillus megaterium. Biotechnology & Bioengineering, 89, 206-218. https://doi.org/10.1002/bit.20341
- 8. 文少白, 李勤奋, 侯宪文, 李光义, 邓晓. 微生物降解纤维素的研究概况[J]. 中国农学通报, 2010, 26(1): 231-236.
- 9. 余强, 庄新姝, 袁振宏, 亓伟, 王琼, 谭雪松, 许敬亮, 张宇, 徐慧娟, 马隆龙. 木质纤维素类生物质制取燃料及化学品的研究进展[J]. 化工进展, 2012, 31(4): 784-791.
- 10. 马中良, 李莉, 张阳奕, 宋任涛, 许政暟. 纤维素降解细菌的筛选及其纤维素酶生物学性质的研究[J]. 药物生物技术, 2009, 16(1): 43-45.
- 11. 沈雪亮, 夏黎明, 刘景晶. 纤维素酶E5基因在E. coli 中的克隆与表达[J]. 浙江大学学报, 2001, 35(6): 640-644.
- 12. Vimala Rodhe, A., Sateesh, L., Sridevi, J., Venkateswarlu, B. and Venkateswar Rao, L. (2011) Enzymatic Hydrolysis of Sorghum Straw Using Native Cellulase Produced by T. reesei NCIM 992 under Solid State Fermentation Using Rice Straw. 3 Biotech, 1, 207-215. https://doi.org/10.1007/s13205-011-0024-6
NOTES
*通讯作者。