Advances in Analytical Chemistry
Vol.07 No.02(2017), Article ID:20691,9
pages
10.12677/AAC.2017.72016
Determination of Total Flavonoids in Pomegranate Peels with a Flow Injection-Fiber Optic Spectrophotometric System
Fei Gao1, Turghun Muhammad1*, Mahinur Bakri2, Muyesser Qadir1, Munira Abuduani1, Osmanjan Yimit1
1College of Chemistry & Chemical Engineering, Xinjiang University, Key Laboratory of Oil and Gas Fine Chemical, Educational Ministry of China, Urumqi Xinjiang
2The Key Laboratory of Plant Resources and Chemistry of Arid Zone, Xinjiang Technical Institute of Physics and Chemistry, Chinese Academy of Sciences, Urumqi Xinjiang
*通讯作者。

Received: May 2nd, 2017; accepted: May 23rd, 2017; published: May 26th, 2017

ABSTRACT
A flow injection-fiber optic spectrophotometric system was applied to the determination of total flavonoids in pomegranate peels and other plants. This method was based on the reaction of phenolic hydroxyl group with AlCl3, and the product has maximum absorption at wavelength of 414 nm, the content of flavonoids in pomegranate peel, rose and other plants were determined and the optimized reaction conditions were: 1.3% of AlCl3, at 20˚C, the reaction tube was 4 m, 75% ethanol and 25% water solution as carrier with flow rate of 1 mL/min. Under the optimum experimental conditions, the method enables measurement of a single sample in 2 min, a linear calibration graph was obtained over the range 5 - 100 mg/L with the linearly dependent coefficient r = 0.9995 and RSD was 4.67%, the recovery between 95.31% and 99.90%. The proposed method was found to be simple, sensitive, rapid, reproducible, accurate and automatic method in the determination of the total flavonoids.
Keywords:Fiber-Optic Spectrophotometry, Flow Injection, Total Flavonoids, Color Development
流动注射—光纤光谱仪测定石榴皮等植物中的总黄酮
高飞1,吐尔洪·买买提1*,马依努尔·拜克力2,米叶赛·卡地1,木尼热·阿布都艾尼1, 吾斯曼江·依米提1
1新疆大学,化学化工学院石油天然气重点实验室,乌鲁木齐,中国
2中国科学院新疆理化技术研究所干旱区植物资源化学重点实验室,乌鲁木齐,中国

收稿日期:2017年5月2日;录用日期:2017年5月23日;发布日期:2017年5月26日

摘 要
自组装流动注射-光纤光谱分析仪,建立测定石榴皮、红茶等植物中总黄酮含量的方法。基于黄酮类物质中的酚羟基与AlCl3生成络合物,在414 nm波长产生特征吸收峰,测定石榴皮、玫瑰花等植物中的黄酮含量,并优化实验条件,适宜条件如下:AlCl3的体积分数为1.3%,温度为20℃,反应管长度为4 m;以75%乙醇-25%水体系为载流,流速为1 mL/min。单一样品分析时间为2 min;浓度在5~100 mg/L (r = 0.9995)范围内与吸光度呈良好的线性关系;回收率在95.31%~99.90%之间,相对标准偏差(RSD)为4.67%。本法简便快速、重现性好、准确度高,实现了植物中总黄酮类化合物检测的快速自动化分析。
关键词 :光纤光谱仪,流动注射,总黄酮,显色法

Copyright © 2017 by authors and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY).
http://creativecommons.org/licenses/by/4.0/


1. 引言
黄酮类化合物(Flavonoids)一类普遍存在于自然界具有生物活性的多酚类化合物 [1] ,是以C6-C3-C6结构为基本母核的色原烷或色原酮的衍生物 [2] ,具有良好的抗氧化性能、清除自由基的能力以及保护血管的功能 [3] 。
目前关于黄酮类化合物测定有大量报道,其中HPLC [4] [5] [6] 法广泛用于对黄酮单体进行定性和定量,但存在分析时间长、吸收基线不平、峰面积极小的问题。分光光度法简单、快速、分析范围广,在实验室普遍使用 [7] [8] [9] 。对总黄酮类化合物的检测还有荧光光度法 [10] 、流动注射化学发光法 [11] [12] 等。由黄酮类化合物其结构引起的环苯甲酰系统和环肉桂酰系统的特征吸收峰 [2] 可直接测量简单溶液中的黄酮含量。但植物中的黄酮类物质中酚羟基、甲氧基等基团类型的不同,导致来源不同的黄酮类物质吸收峰与标准物有所改变,故常使用显色方法。显色方法主要有NaNO2-Al(NO3)3-NaOH法 [13] [14] ,AlCl3法 [15] [16] ,硼酸-柠檬酸法 [17] 等。
本文利用课题组自组装流动注射-光纤光谱仪 [18] ,以AlCl3为显色剂,利用黄酮类物质中的羟基类基团与Al3+反应生成淡黄色的络合物 [12] 的原理,实现自动检测黄酮的含量,且大大节省劳动强度,为植物中总黄酮类化合物含量的测定提供了新方法。
2. 仪器与设备
光纤光谱仪系统(DH 2000光源、光纤、HR2000检测器,Z-Cell,美国海洋光学公司);定量环、蠕动泵和八通道十六孔多功能旋转阀(日本);UV-1800紫外可见分光光度计(日本岛津);KQ5200E超声波清洗器(昆山超声仪器有限公司)。
芦丁、AlCl3·6H2O、乙醇(国药集团化学试剂有限公司,分析纯);石榴皮、玫瑰花(新疆和田地区);Rayhan红茶、英国红茶、吉尔吉斯坦红茶、奶茶、迈哈姆特红茶、御尊红茶(云南);实验用水为超纯水。
3. 实验内容
3.1. 流动注射系统
如图1所示,流动注射系统主要由两台往复式柱塞泵组成,驱动载流与显色剂。样品由蠕动泵吸入定量环,通过载流驱动与显色剂混合,最后在流通池中检测吸光度。
3.2. 溶液的配制
3.2.1. 芦丁对照品储备液的配制
精密称取芦丁对照品0.025 g于50 mL容量瓶中,加75%乙醇使其溶解,制成每1 mL溶液含0.5 mg芦丁的对照品储备液。
3.2.2. 标准曲线的绘制
精密量取芦丁储备液0.1、0.2、0.6、1.0、1.6、2.0 mL,分别置于10 mL容量瓶中加75%乙醇至刻度,摇匀,放置;另一容量瓶配制空白溶液,作参比。用光纤光谱仪在414 nm处测定标准溶液的吸光度,绘制标准曲线。
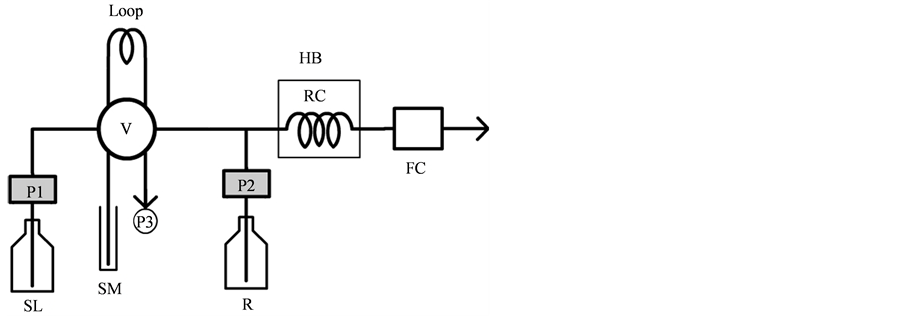
Figure 1. The flow system configuration and multifunctional valve connection scheme
图1. 流动注射系统的结构以及多功能旋转阀连接示意图
3.2.3. 测定法
取精密称定过筛后的石榴皮粗粉1.0 g于圆底烧瓶中,加入40 mL 75%乙醇-水溶液,超声提取30 min。减压过滤提取液,于100 mL容量瓶中加75%乙醇-水溶液定容。
通过蠕动泵将提取液吸入到定量环中,切换旋转阀,使泵1样品与泵2的AlCl3溶液混合,记录吸光度值,计算样品溶液中总黄酮的含量。
4. 方法与结果
4.1. 对标准品的显色
精密移取对照品溶液和提取液1 mL,分别置于10 mL容量瓶中,加入4 mL、1.3%的AlCl3溶液,用乙醇-水定容。分别配制芦丁和AlCl3空白溶液。在300~600 nm波长内扫描溶液,绘制紫外可见特征吸收曲线,如图2所示。图中可得,芦丁标准溶液和石榴皮黄酮提取液被显色后,在414 nm处有一强吸收峰 [19] ,说明提取液与标准溶液显色吸收峰一致。同时空白溶液、芦丁标准液在414 nm处的吸收均为零,表明该显色剂体系不受溶剂、试剂等的干扰。
4.2. 显色稳定性
温度为20℃,100 mg/L芦丁标准溶液与1.3% AlCl3显色剂在4 m长的反应管中混合后到达流通池时,将泵停机,如图3,此时显色产物吸光度达到最大,而后慢慢下降达到平衡。其吸光度值(变化范围(1.162~ 1.181)在之后的半小时内无明显变化。
4.3. 温度对流动注射体系的影响
将100 mg/L芦丁标准溶液以1 mL/min流速泵入到流路中,在不同温度下,4 m长的反应管中与1.3% AlCl3显色剂反应,再经过流通池。记录吸光度值,考察温度对显色反应的影响。由图4结果可知,温度
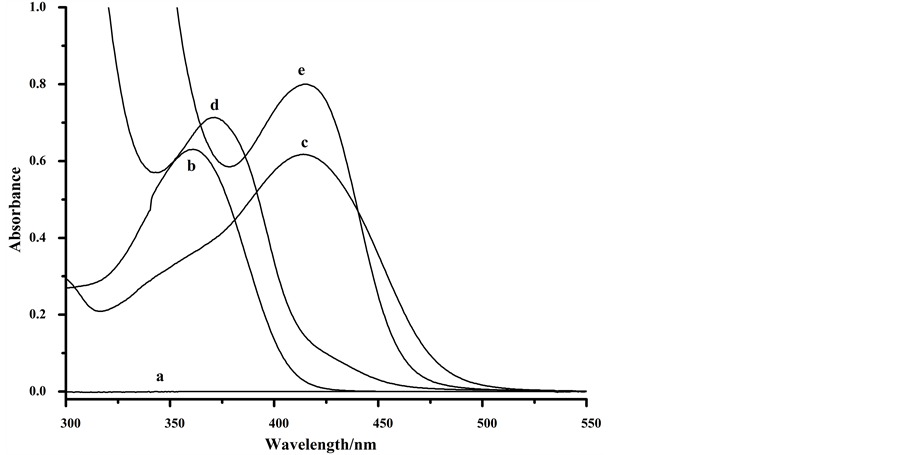
Figure 2. The absorption spectrum of the blank solution (a), standard solution (b), pomegranate extracts (d) and the color reaction of Rutin standard solution (c) and the pomegranate extracts (e)
图2. 不同溶液的吸收光谱图:空白溶液(a)、芦丁标准溶液(b)与显色后的芦丁标准溶液(c)、石榴皮提取液(d)与显色后的石榴皮提取液(e)
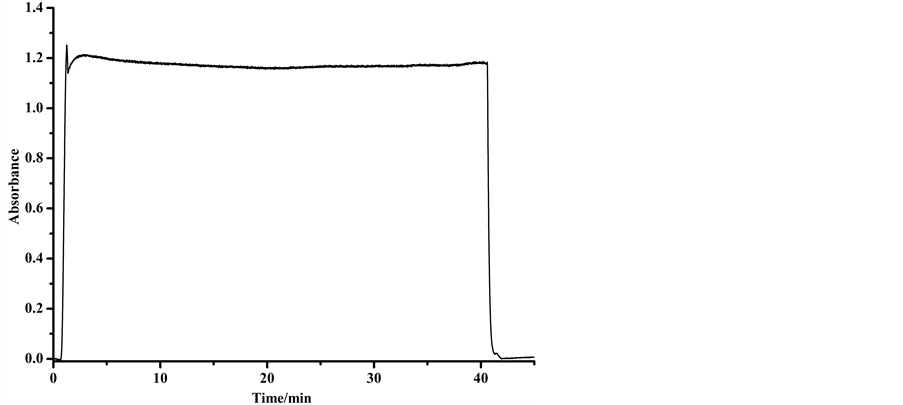
Figure 3. The stability of the compound
图3. 反应产物稳定性
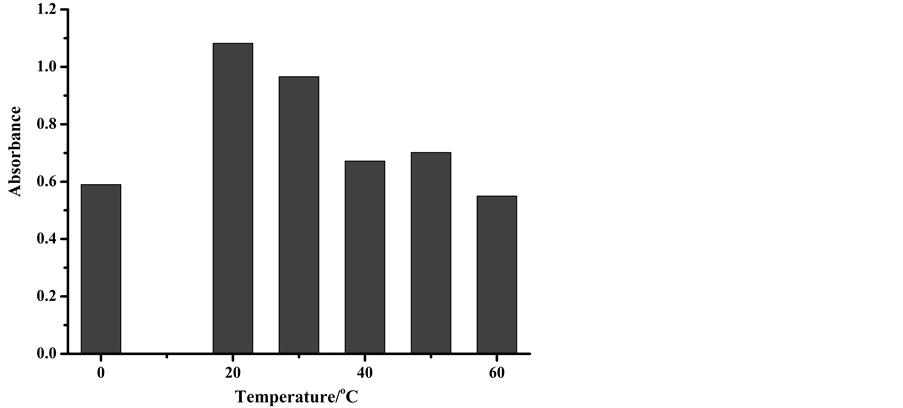
Figure 4. The absorbance of the compound at different temperature
图4. 温度对显色反应产物吸光度的影响
过高或过低改变反应产物的吸光度,对显色反应不利。在20℃下复合物的吸光度最高,因此选择20℃为最佳温度。
4.4. 反应管长度的选择
温度为20℃、流速为1 mL/min,改变反应管的长度分析100 mg/L芦丁标准溶液,结果如图5所示,在4 m长的反应管中能反应完全,因此选择4 m长的反应管进行样品分析。
4.5. 流速的选择
温度为20℃、反应管长度为4 m,流速分别设定为0.6、0.8、1.0、1.2、1.5、2.0 mL/min,分析100 mg/L芦丁标准溶液,结果如图6所示。低流速导致反应产物扩散吸收峰变宽变矮,而在较高流速下未完全反应,故选择最适宜流速为1 mL/min。
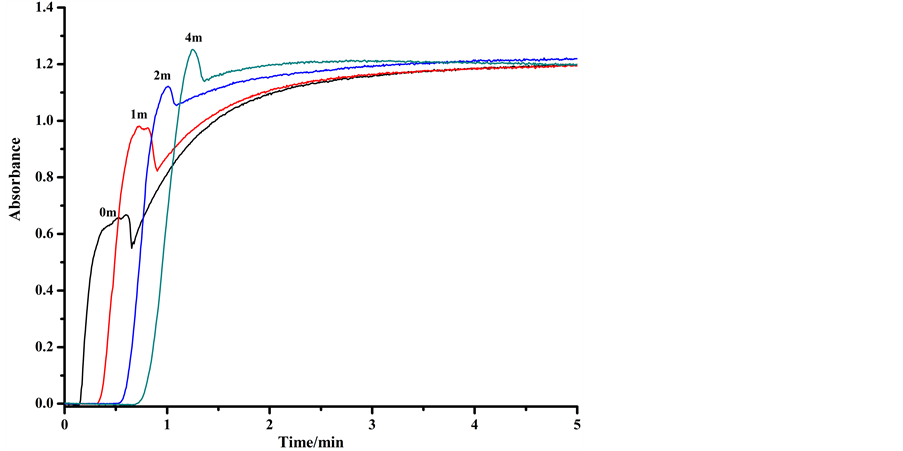
Figure 5. The absorbance of compound in different reaction tubes
图5. 不同长度反应管中产物的吸光度
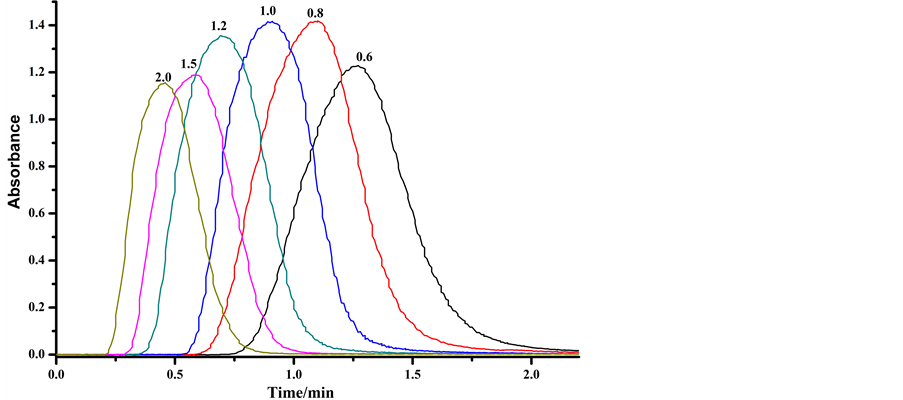
Figure 6. The change of compound spectrum at different flow rate (mL/min)
图6. 不同流速下显色反应光谱变化
4.6. 标准曲线的建立
利用4 m长的反应管,在20℃,1 mL/min的流速下分析浓度分别为0、5、10、30、50、80、100 mg/L的芦丁标准溶液,线性回归方程及反应曲线如图7,y = 0.01560 x – 0.0119,线性相关系数为0.9995;利用本体系可以在36 min内完成18个样品的分析,达到快速分析的目的。
4.7. 加标回收实验
精确称取1 g石榴皮,用75%乙醇-水超声提取30 min,提取液中分别加入1、2、3倍样品含量的标准品,进行加标回收试验,结果见表1。石榴皮中总黄酮含量的加标回收率在95.31%~99.90%之间,说明该方法准确度高,可应用于植物中总黄酮的准确测定 [20] 。
4.8. 重现性考察
准确称取1.0 g石榴皮,每个样品做6组对照试验,用75%乙醇超声提取30分钟。减压过滤提取液乙醇-水溶液稀释至100 mL。按“2.2.3”项下方法测黄酮含量,相对标准偏差为4.67%,说明重现性较好。
4.9. 几种茶中总黄酮含量的测定
准确称取1.0 g、7种茶叶,用75%乙醇超声提取30 min,减压过滤。滤液用超纯水稀释至100 mL,取1.0 mL此溶液用75%乙醇-水溶液稀释至10 mL。按“2.2.3”项下的方法测定几种茶中总黄酮的含量。几种茶类的总黄酮含量如表2所示,进一步说明本体系可以适用于不同植物中总黄酮含量的准确测定。
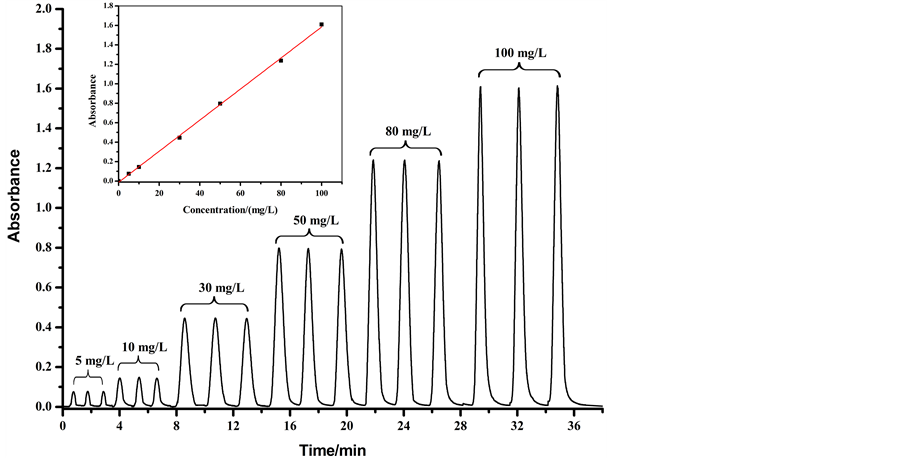
Figure 7. Standard curve
图7. 标准曲线
Table 1. Flavonoids spiked recoveries in pomegranate peel (n = 3)
表1. 石榴皮中黄酮的加标回收率(n = 3)
Table 2. Comparison of flavonoid contents in teas (n = 3)
表2. 茶类总黄酮含量的对比(n = 3)
5. 结论
运用流动注射-光纤吸收光谱仪建立石榴皮、红茶等植物中总黄酮含量的测定方法。在5~100 mg/L浓度范围内呈良好的线性关系,r为0.9995;单一样品分析时间为2 min;样品加标回收率较高,RSD为4.67%。该方法分析速度快、重现性好,降低工作强度,实现了植物中总黄酮类化合物检测的快速自动化分析,为检测黄酮含量提供了新方法。本文选用适合于本体系的检测总黄酮的方法,而中国药典 [21] [22] 收录的黄酮的检测方法因其显色过程复杂、所需时间长,应用于本系统有一定的难度,我们将进一步研究使药典方法自动化的方法,使其能普遍适用于总黄酮的检测。
基金项目
国家自然科学基金资助项目(21365020)。
文章引用
高 飞,吐尔洪•买买提,马依努尔•拜克力,米叶赛•卡地,木尼热•阿布都艾尼,吾斯曼江•依米提. 流动注射—光纤光谱仪测定石榴皮等植物中的总黄酮
Determination of Total Flavonoids in Pomegranate Peels with a Flow Injection-Fiber Optic Spectrophotometric System[J]. 分析化学进展, 2017, 07(02): 117-125. http://dx.doi.org/10.12677/AAC.2017.72016
参考文献 (References)
- 1. Jolanta, M. and Tadeusz, K. (2013) Application of Hot Platinum Microelectrodes for Determination of Flavonoids in Flow Injection Analysis and Capillary Electrophoresis. Analytica Chemical Acta, 786, 39-46.
- 2. 马陶陶, 张群林, 李俊李俊, 孟晓明, 黄成, 陈玉璞. 三氯化铝比色法测定中药总黄酮方法的探讨[J]. 时珍国医国药, 2008, 19(1): 54-56.
- 3. Kelly, E.H., Anthony, R.T. and Dennis, J.B. (2002) Flavonoid Antioxidants: Chemistry, Metabolism and Structure- Activity Relationships. The Journal of Nutritional Biochemistry, 13, 572-584.
- 4. María, M.C., Feliciano, P.C. and María, D.L.C. (2015) Development and Application of a Quan-titative Method for Determination. Talanta, No. 144, 349-355.
- 5. 张维冰, 王智聪, 张凌怡. 超高效液相色谱-二极管阵列检测-串联质谱法测定菊花中的10种咖啡酰基奎宁酸和22种黄酮类化合物[J]. 分析测试学报, 2012, 31(11): 1436-1440.
- 6. 王波, 周围, 刘小花. 基于超高效合相色谱对黄芪中5种主要黄酮类化合物的快速检测[J]. 分析化学, 2016, 44(5): 731-739.
- 7. 池玉梅, 居羚, 邓海山, 姚卫峰, 陆丹, 等. 分光光度测定总黄酮法的适用性[J]. 分析化学, 2010, 38(6): 893-896.
- 8. 罗小燕, 郭璇华. 紫外-可见分光光度法测定火龙果花中总黄酮的含量[J]. 食品研究与开发, 2014, 35(23): 108- 111.
- 9. 罗序燕, 方浩斌, 黄瑞宇, 等. 分光光度法测定甜叶菊废渣中总黄酮的研究[J]. 光谱学与光谱分析, 2015, 35(10): 2820-2824.
- 10. 穆宏磊, 郜海燕, 陈杭君, 房祥军, 葛林梅. 荧光光度法测定芦笋中总黄酮含量[J]. 中国食品学报, 2010, 10(2): 201-205.
- 11. 杨丹, 苍晶, 郝再彬, 等. 流动注射化学发光法测定大豆异黄酮[J]. 分析化学, 2006, 34(8): 1113-1115.
- 12. Du, J.X., Li, Y.H. and Lu, J.R. (2001) Flow Injection Chemiluminescence Determination of Rutin Based on Its Enhancing Effect on the Lumi-nol-Ferricyanide/Ferrocyanide. Analytical Letters, 34, 1741-1748. https://doi.org/10.1081/AL-100105357
- 13. 郭亚健, 范莉. 关于NaNO2-Al(NO3)3-NaOH比色法测定总黄酮方法的探讨[J]. 药物分析杂志, 2002, 22(2): 97-99.
- 14. 张春云, 谢伟刚, 张雅丽, 等. 黄芩总黄酮的含量测定及提取工艺优化[J]. 光谱实验室, 2011, 28(3): 1253-1257.
- 15. 元晓梅, 蒋明蔚, 胡正芝. 聚酰胺吸附-硝酸铝显色法测定山楂及山楂制品中的总黄酮含量[J]. 食品与发酵工业, 1996(4): 28-32.
- 16. 鄢又玉, 夏婷, 张育, 等. 三氯化铝比色测定火棘总黄酮方法的系统考察[J]. 食品研究与开发, 2015, 36(5): 89- 93.
- 17. 端允, 薛长晖. 硼酸-柠檬酸法测定苦荞粉中黄酮类化合物的含量[J]. 广州化工, 2010, 38(6): 163-165.
- 18. Muhammad, T., Yimit, O., Turahun, Y., et al. (2014) On-Linedetermination of 4-Nitrophenol by Combining Molecu-larly Imprinted Solid-Phase Extraction and Fiber-Optic. Journal of Separation Science, 37, 1873-1879. https://doi.org/10.1002/jssc.201400211
- 19. 苏东林, 单杨, 李高阳. 比色法测定柑桔皮中总黄酮含量的研究[J]. 中国酿造, 2008, 27(3): 69-74.
- 20. 张敏, 曹庸, 唐纯翼. Al3+芦丁二元络合物荧光光度法定银杏叶中总黄酮的含量[J]. 分析科学学报, 2005, 21(2): 188-190.
- 21. 国家药典委员会编. 中华人民共和国药典[S]. 北京: 化学工业出版社, 2015:355.
- 22. 国家药典委员会编. 中华人民共和国药典[S]. 北京: 化学工业出版社, 2015: 1418.
