Hans Journal of Agricultural Sciences
Vol.07 No.03(2017), Article ID:21165,7
pages
10.12677/HJAS.2017.73032
Determination of Four Endogenous Phytohormones in Seeds of Phellodendron amurense by High Performance Liquid Chromatography (HPLC)
Guixin Zhang, Fei Wang, Yuhong Zhang*
Key Laboratory of Forest Plant Ecology of Ministry of Education, Northeast Forestry University, Harbin Heilongjiang
*通讯作者。

Received: Jun. 7th, 2017; accepted: Jun. 20th, 2017; published: Jun. 28th, 2017

ABSTRACT
Four endogenous phytohormones: Gibberellins, indoleacetic acid, zeatin and abscisic acid in the seeds of Phellodendron amurense, were examined by High Performance Liquid Chromatography (HPLC) to provide effective and reliable methods for identification of phytohormones in plant seeds. The four analytes were extracted from P. amurense seeds by 80% methanol and C-18 solid extraction column, and then separated by Agilent C18 column, using methanol, acetonitrile, water (1:1:8, V/V/V) as mobile phases. Detection wavelength: GA was 206 nm, IAA was 225 nm, ABA and Zeatin were 254 nm. First, the HPLC preseted 206 nm (GA) and 225 nm (IAA) as detection wavelengths, and when the sample ran for 7 minutes, the detection wavelength was changed to 254 nm. This method had been applied to the determination of gibberellin, indole acetic acid, zeatin and abscisic acid in the seeds of P. amurense, and the recovery rate of 4 kinds of endogenous phytohormones was more than 93%, relative standard deviation less than 4.1%. The results showed that phytohormones was well separated, and the ideal quantitative data of phytohormones in P. amurense seeds were obtained, and this method suited the purpose of the determination for phytohormones in P. amurense seeds.
Keywords:Phellodendron amurense Seeds, HPLC, Endogenous Phytohormone
HPLC同时测定黄檗种子中4种内源植物激素
张桂鑫,王菲,张玉红*
东北林业大学森林植物生态学教育部重点实验室,黑龙江 哈尔滨

收稿日期:2017年6月7日;录用日期:2017年6月20日;发布日期:2017年6月28日

摘 要
本文以东北天然红松林重要伴生植物黄檗(Phellodendron amurense)种子为研究材料,采用高效液相色谱法对种子中的植物激素进行分析,以探讨植物种子中的植物激素测定方法。黄檗种子经80%甲醇浸提,C-18固相萃取柱萃取,反相C18柱分离,流动相:甲醇:乙腈:水 = 1:1:8 (体积比)。检测波长:GA为206 nm、IAA 225 nm、ABA与玉米素Z的检测波长为254 nm,首先在HPLC预设置206 nm (GA)和225 nm (IAA)两个波长,在样品运行7分钟时,手动更改检测波长为254 nm。利用该方法测定赤霉素、吲哚乙酸、玉米素和脱落酸4种内源植物激素的回收率在93%以上,相对标准偏差小于4.1%,精密度和重现性均较好。表明该方法适用于黄檗种子中植物激素含量的检测。
关键词 :黄檗种子,高效液色谱,内源植物激素

Copyright © 2017 by authors and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY).
http://creativecommons.org/licenses/by/4.0/


1. 引言
植物激素是由植物自身代谢产生或由植物细胞接受特定环境信号诱导产生的、低浓度时可调节植物生理反应的一类有机物质,它们在植物细胞分裂与伸长、组织与器官分化、开花与结实、休眠与萌发、成熟与衰老等整个生命过程 [1] [2] 以及离体组织培养等 [3] 方面,分别或相互协调、同时又与植物所生存的外部环境相互作用调节植物对环境的适应性 [4] [5] 。植物激素在植物体内的含量一般极低,并且性质不稳定,易被热解、光解和氧化 [6] 。因此,如何对这些在植物体内极其微量的植物激素进行简单、快速和准确的定量分析,是此研究领域的难题之一。
黄檗(Phellodendron amurense Rupr.),又叫黄菠萝、檗木(神农本草经),黄檗木(本草纲目),是芸香科(Rutaceae)黄柏属(Phellodendron)高大落叶乔木 [7] 。黄檗主要散生于我国东北林区河谷及山地中下部的针阔叶混交林中,是东北天然红松林的重要伴生树种,国家Ⅱ级保护植物,也是我国东北地区著名的“三大硬阔之一” [8] 。黄檗系第三纪古热带植物区系的孑遗植物,对研究古植物区系、古代地理及第四纪冰期气候有重要的科学价值 [9] 。但黄檗种子具有深休眠特性,导致天然黄檗资源萌生困难。相关研究表明,激素因素是与种子的休眠与萌发有着密不可分的关系,了解种子中的植物激素含量成为研究黄檗种子休眠打破至关重要环节 [10] 。而种子中与激素共存的成分非常复杂 [11] ,导致对种子中激素检测较为困难。本研究以黄檗当年生种子为材料,建立了高效液相色谱法(HPLC)测定黄檗种子中赤霉素(GA)、吲哚乙酸(IAA)、脱落酸(ABA)和细胞分裂素(玉米素,Z)等4种内源植物激素的同时检测方法。
2. 材料与方法
2.1. 实验材料与仪器
2.1.1. 实验材料
实验用黄檗种子于2016年10月采自东北林业大学城市林业示范基地40年生、长势较好的黄檗植物。采后经处理得黄檗种子,自然干燥后置于超低温冰箱中存放、备用。
2.1.2. 仪器和试剂
Waters 1525-2489高效液相色谱仪(双波长,手动进样)、Z206A型高速离心机(德国Heraeus)、AB104 型电子天平(瑞士)、UV5500PC型紫外可见分光光度计(上海元析仪器有限公司)、C-18固相萃取柱(Waters)。乙腈、甲醇为色谱纯,水为超纯水,其它试剂均为分析纯。赤霉素(GA)、生长素(IAA)、细胞分裂素(玉米素,Z)、脱落酸(ABA)等激素标准品购于上海源叶生物科技有限公司。
2.2. 流动相与标准溶液的配制
流动相的配置:将色谱纯甲醇和乙腈与超纯水按1:1:8 (体积比)的比例配置,然后用0.22 μm的微孔滤膜在溶剂过滤器里过滤,过滤后的滤液超声脱气30 min,以除去流动相混合液中溶解的气体,密封保存备用。
标准液的配置:精密称取IAA,ABA,GA,Z标准品各3 mg,分别用流动相溶液溶解,定溶于10 ml的容量瓶中。分别吸取上述标准品溶液5.0 mL,合并、摇匀,作为母液。然后从母液中分别取一定体积配制成混合溶液,其浓度分别为1 μg/ml、5 μg/ml、10 μg/ml、25 μg/ml、50 μg/ml的标准对照溶液。
2.3. 最优检测波长的确定
将4种标准液各配制成40 μg/ml进行检测,利用紫外分光光度计进行紫外全波长(200 nm~400 nm)扫描,通过空白和样品扫描后得光谱图,确定4种激素的最优紫外吸收波长。
2.4. 样品制备
称取1 g左右种子,加8 ml 80%甲醇在冰浴下研磨成匀浆,4℃浸提过夜。10,000 rpm,4℃离心15 min。残渣用甲醇悬浮,10,000 rpm,4℃ 离心15 min,重复两次,合并上清液。残渣弃去。
将上清液过C-18固相萃取柱。具体步骤是:50%甲醇冲洗平衡柱→上样→移开样品后用去离子水洗柱→80%甲醇洗脱柱→循环。将过柱后的样品转入5 mL塑料离心管中,真空浓缩至干燥,除去提取液中的甲醇,用样品稀释液定容至1.5 mL,经0.22 μm微孔滤膜过滤后进行HPLC分析。
2.5. HPLC的分析方法
利用Waters 1525-2489高效液相色谱仪(双波长,手动进样),使用安捷伦C18色谱柱(4.6 × 250 mm,5 μm);以2.2中配置的混合液为流动相,检测波长:根据3.1所确定的最优检测波长,首先在HPLC预设置两个最先出峰的两种激素的波长,在第2和第3种激素出峰间隔快速手动更改检测波长。柱温:35℃;进样量:10 μL;流速1 ml/min。
2.6. 数据分析
采用Excel 2007软件对数据进行统计分析和相对标准偏差计算。
3. 结果与分析
3.1. 最优检测波长的确定
根据对4种激素200 nm到400 nm紫外全波长扫描结果可知:GA在206 nm有较大吸收峰,IAA在225 nm有最大吸收峰,ABA在245 nm有最大吸收峰,Z在259 nm有最大吸收峰;因此,为减少操作步骤和实验便利,根据紫外吸收强度,确定GA的最优检测波长为206 nm、IAA的最优检测波长为225 nm、ABA与玉米素Z的最优检测波长为254 nm。
3.2. 色谱条件
色谱柱:安捷伦C18柱(4.6 × 250 mm,5 μm);流动相:甲醇:乙腈:水 = 1:1:8。检测波长:根据3.1所确定的最优检测波长和各激素的出峰时间,首先在HPLC预设置206 nm和225 nm两个波长,在样品运行7分钟时,手动更改检测波长为254 nm。柱温:35℃;进样量:10 μL;流速1 ml/min。在此色谱条件下,4种激素分离较好且峰形也比较好,并且分析时间也较短,4种激素保留时间合适。色谱图见图1所示。
3.3. 线性关系考察
按照3.2.的色谱条件,把配制好的标准液的梯度浓度1 μg/ml、5 μg/ml、10 μg/ml、25 μg/ml、50 μg/ml等分别进样,进行高效液相色谱分析。以样品质量浓度(μg/ml)为横坐标x,峰面积为纵坐标y作做线性回归曲线。得到4种激素的回归方程。其线性范围、线性相关系数见表1。由表1可知,4种激素标准品的质量浓度与其峰面积线性相关性较好,相关系数均在0.99以上。
 (a)
(a)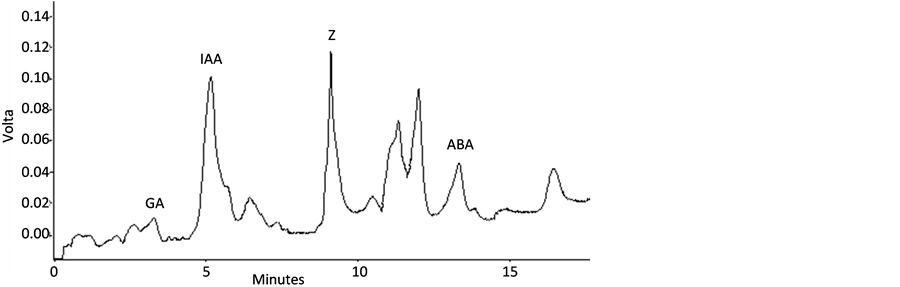 (b)
(b)
Figure 1. Chromatograms of standard (a) and sample (b) of phytohormone from P. amurense seeds
图1. 4种植物激素的标准品(a)和种子样品(b)色谱图
Table 1. The regression equation of four phytohormones
表1. 4种内源激素标准品的线性回归方程
3.4. 精密度实验
取4种激素标准品溶液按相应色谱条件重复进样5次,测得GA峰面积的积分值的相对标准偏差(RSD)为1.12%,IAA峰面积的RSD为0.82,Z峰面积的RSD为1.59%,ABA峰面积的RSD为0.53%,说明实验仪器精密度良好。
3.5. 稳定性实验
取4种激素标准品溶液,在第0 h、5 h、10 h、20 h、24 h、48 h进样,测得GA峰面积的积分值的RSD为1.89%,IAA峰面积RSD为2.01%,Z峰面积RSD为1.15%,ABA峰面积RSD为2.37%,结果表明待测物在4℃条件下,48 h内该方法稳定性较好。
3.6. 重复性实验
精密称取同一批样品,分成4份,每份1.0 g,按照上述方式制备成样品溶液,进行HPLC检测,每次进样进样10 μl,测得样品中GA含量的RSD为6.94%,IAA含量的RSD为5.69%,Z含量的RSD为5.58%,ABA含量的RSD为4.86%。结果表明,此次实验方法重复性良好。
3.7. 加样回收率实验
分别在已测得植物激素含量的黄檗种子样品中添加5、10和50 μg/g的GA、IAA、ZA和BA混合标准品溶液,按照2.3样品制备方法进行提取,HPLC进行测定,4种激素的平均回收率在93%以上,相对标准偏差均在4.1%以下(表2),说明该方法良好,可行。
3.8. 样品测定
按照本论文所建议的研究方法,对新采收的黄檗休眠种子和层积处理打破休眠后的黄檗种子中的4种植物激素含量进行测定,结果见表3。
4. 讨论
植物在协调内在遗传发育近程与对外界环境变化作出适当响应,调控其生长发育以适应特定环境,以及植物生长发育的各个阶段,包括胚胎发生、种子休眠与萌发、营养生长、果实成熟、叶片衰老等都受到多种内在植物激素信号的调控 [5] 。植物激素在植物整个生命周期都起着至关重要的作用。如何检测植物体内的激素显得尤为关键。目前对于植物内源激素的测定方法较多的是酶联免疫法和高效液相色谱法,酶联免疫法虽然较高效液相色谱法简便,但结果准确度不高,重复性差 [12] 。而高效液相色谱法由于灵敏度高、选择性强及数据处理能力好已越来越被国际上广泛应用,因此建立简单、快速、高效的植物内源激素的高效液相色谱测定方法就十分具有现实意义。
Table 2. Recovery rates of four phytohormones by HPLC
表2. HPLC测定4种植物激素的回收率
Table 3. The homone level in two types of P. amurense seeds
表3. 两种类型黄檗种子中激素含量
植物样品高效液相色谱分析的难易决定于样品中物质组成的复杂程度,植物组织,特别是种子中富含多酚类等杂质,分离较为困难。本研究应用C-18 固相萃取柱并借鉴以往文献中HPLC分析GA、IAA、Zeatin和ABA的方法,为实现4 种激素的同时测定,本研究先对各标准溶液进行紫外全波长扫描,确定最优吸收波长,利用HPLC的双波长功能,建立了可满足用于黄檗种子前处理方法和HPLC的色谱条件,不仅可以同时测定这4种植物激素,避免了多种激素多次测定的费时与繁琐,而且重现性好、回收率高,操作时间大为缩短。
本文建立了高效液相色谱同时测定黄檗种子中4种植物激素的分析方法。该方法具有简便、选择性好、分析时间短、重现性好,回收率高等优点,完全适用于植物种子样品中植物激素含量的检测。
基金项目
国家自然科学基金面上项目[This Work Was Supported by a Grant from General Program of the National Natural Science Foundation of China](No. 31370630)资助。
文章引用
张桂鑫,王 菲,张玉红. HPLC同时测定黄檗种子中4种内源植物激素
Determination of Four Endogenous Phytohormones in Seeds of Phellodendron amurense by High Performance Liquid Chromatography (HPLC)[J]. 农业科学, 2017, 07(03): 238-244. http://dx.doi.org/10.12677/HJAS.2017.73032
参考文献 (References)
- 1. 邓文红, 张俊琦. UPLC-MS/MS测定油蒿叶片中4种内源植物激素[J]. 植物学研究, 2015, 4, 1-7.
- 2. 许智宏, 李家洋. 中国植物激素研究: 过去、现在和未来[J]. 植物学通报, 2006, 23(5): 433-442.
- 3. 上官新晨, 郭春兰, 蒋艳, 等. 培养基和植物激素对青钱柳茎段和叶片愈伤组织诱导的研究[J]. 江西农业大学学报, 2006, 28(5): 678-682.
- 4. Finkelstein, R.R., Gampala, S.S. and Rock, C.D. (2002) Abscisic Acid Signaling in Seeds and Seedlings. Plant Cell, 14, 15-45.
- 5. 熊国胜, 李家洋, 王永红. 植物激素调控研究进展[J]. 科学通报, 2009, 54(18): 2718-2733.
- 6. 文静, 孔维军, 罗红梅, 等. 植物内源激素检测方法新进展[J]. 中南药学, 2014, 1, 47-52.
- 7. 张玲, 张东来. 基于化学显色反应的黄菠萝雌雄株鉴别技术研究[J]. 森林工程, 2015, 31(3): 12-14, 20.
- 8. 孙美欧, 孙虎. 凉水自然保护区森林生态系统生态服务功能评估[J]. 森林工程, 2016, 32(5): 21-26.
- 9. 国家林业局. 中国重点保护野生植物资源调查[M]. 北京: 中国林业出版社, 2009: 156-157.
- 10. 肖培根, 杨世林. 黄柏[M]. 北京: 中国中医药出版社, 2001: 10-11.
- 11. 吴倩, 王璐, 吴大朋, 等. 植物激素样品前处理方法的研究进展[J]. 色谱, 2014, 4: 319-329.
- 12. 丁广文, 李华, 何桥. 植物内源激素检测技术的研究进展[J]. 基因组学与应用生物学, 2016, 35(5): 1258-1265.
