Hans Journal of Biomedicine
Vol.
11
No.
02
(
2021
), Article ID:
42060
,
7
pages
10.12677/HJBM.2021.112015
蛋白免疫印迹和全自动蛋白质定量分析的比较研究
雷虹1,胡峰瑞1,陈妍珂2,苟兴春1*
1西安医学院基础与转化医学研究所,陕西 西安
2西安交通大学医学院,陕西 西安

收稿日期:2021年3月26日;录用日期:2021年4月20日;发布日期:2021年4月29日

摘要
目的:比较传统的蛋白免疫印迹和全自动蛋白质定量分析检测特异性蛋白质相对含量的差异,并进行方法学优化,为蛋白质定量分析提供技术参考。方法:分别使用两种系统对不同分子量的目标蛋白进行检测,比较两种系统的灵敏度、重复性和适用范围。结果:相比传统WB系统,全自动系统灵敏性、重复性和稳定性更高,并且可进行多分子同时检测,尤其在检测微量蛋白、分子量较大或较小的蛋白以及高通量方面具有优势。结论:全自动蛋白检测是一种灵敏、高效的检测特异性蛋白丰度变化的系统,值得在科研和医学检验中推广。
关键词
蛋白免疫印迹,全自动蛋白质定量分析
Comparative Study between Western Blotting and Automatic Quantitative Analysis on Protein
Hong Lei1, Fengrui Hu1, Yanke Chen2, Xingchun Gou1*
1Institute of Basic and Translational Medicine, Xi’an Medical University, Xi’an Shaanxi
2School of Medicine, Xi’an Jiaotong University, Xi’an Shaanxi

Received: Mar. 26th, 2021; accepted: Apr. 20th, 2021; published: Apr. 29th, 2021

ABSTRACT
Objective: To compare the difference between traditional Western Blotting (WB) and automatic quantitative protein analysis on specific protein relative content , and to optimize the methodology, so as to provide technical reference for protein quantitative analysis. Methods: In order to compare the sensitivity, repeatability and applicable range of the two methods. WB and automatic quantitative protein analysis are used to detect the target molecules, which with different molecular weights. Results: Compared with traditional WB, WES had higher sensitivity, repeatability and stability, and can carry out multi-molecule detection, which has high throughput especially in the detection of trace proteins or proteins with larger or smaller molecular weights. Conclusion: WES is a sensitive and efficient method to detect the changes of abundance of specific protein, which is worth popularizing in scientific research and medical examination.
Keywords:Western Blotting (WB), Automatic Quantitative Protein Analysis

Copyright © 2021 by author(s) and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY 4.0).
http://creativecommons.org/licenses/by/4.0/


1. 引言
特异性蛋白表达检测是生物和医学研究中常用的方法。传统的蛋白免疫印迹(Western Blotting, WB)一直被科研工作者使用,但其步骤多,周期长,结果不稳定。近年全自动蛋白定量分析(Automatic Quantitative Protein Analysis)以其独特的优势发展迅速。本文将传统的蛋白免疫印迹和全自动蛋白质定量分析检测进行比较,并进行方法学优化,为蛋白质定量分析提供技术参考。
Western Blotting (WB)是分析某一蛋白质相对含量的一种常用技术,它将高分辨率凝胶电泳和免疫化学杂交显影技术相结合 [1] [2]。传统的WB分析步骤包括:1) SDS-聚丙烯酰胺凝胶电泳(SDS-PAGE);2) 电转移;3) 抗体杂交和酶联免疫显影。首先,提取组织或细胞中的总蛋白质,进行BCA定量分析;然后通过SDS-PAGE电泳使得蛋白质分子按分子量大小分离;通过电转移将胶上的蛋白质转移到PVDF膜上,封闭处理后,依次与特异性抗体(一抗)和酶(或荧光染料)交联的二抗杂交。最后,经过显影处理,可以观察到目标分子的表达变化。WB检测的灵敏性受多个因素的影响,如:目标分子的含量和分子量大小、转膜的效率、抗体的亲和性等,并且由于人工操作步骤较多,实验的重复性和稳定性有限 [3] [4] [5]。
全自动蛋白质表达定量分析是近年新发展起来的一种蛋白检测技术,它将免疫印迹的制胶、蛋白电泳分离、杂交和显影集成到一个系统中,并实现全自动化。目前该系统有两种型号的检测仪器:WES和JESS,前者适用于化学发光显影,后者还兼容荧光成像。本研究中使用的是WES系统。首先,试剂盒中预制的分离胶和浓缩胶吸附到毛细管中,紫外照射后交联激活,形成蛋白质分离柱。将蛋白样品、一抗、二抗、发光液以及洗涤液分别加到孔板中,上机后它们按设定的程序依次被吸到分离柱上进行反应。这是一种对蛋白质进行原位杂交的分析方法,不需要电泳转膜,避免了转膜不充分或过度对结果的影响;并且,该方法一次最多可以检测24个样本,运行时间大约为3小时,显著提高了检测效率。本研究对这两种技术进行了系统研究,以比较两种方法的灵敏度、重复性和适用范围,为科研工作者进行蛋白质相对定量分析提供技术参考。
2. 材料与方法
2.1. 材料
1) 样本:人乳腺癌MDA-MB-231细胞,购买自ATCC细胞库。
2) 抗体:见表1。
Table 1. The information of antibody
表1. 抗体信息一览表
3) 其他试剂
RIPA蛋白裂解液(碧云天,P0013B)、BCA蛋白定量检测试剂盒(碧云天,P0010)、蛋白酶抑制剂(MCE, HY-K0010);化学放光试液(Millopore, BKLS0100)。
4) WES kit (Protein Simple):2-40KD低分子量蛋白分析kit (货号:SM-W012-1),12-230KD中分子量蛋白分析kit (货号:SM-W004-1),66-440KD高分子量蛋白分析kit (货号:SM-W006-1)。
5) 仪器
全自动蛋白质定量分析系统(Protein Simple, USA);化学发光凝胶成像仪(Bio-Rad, USA)。
2.2. 方法
1) 蛋白质样品获得:用含有10%的胎牛血清的DMEM培养基培养MDA-MB-231细胞。取生长至对数期的MDA-MB-231细胞,加入适量RIPA裂解液(含蛋白酶抑制剂),置于冰上裂解30分钟,然后12,000 rpm离心30分钟(4℃)收集上清,置于−80℃保存备用。
2) 蛋白定量:取细胞裂解液适量,5倍稀释,按照BCA试剂盒说明书进行蛋白定量。
3) WB实验条件
a) 对于分子量小于40KD的Caspase3、p-H2AX,电泳时用15%的分离胶分离;250 mA恒流转膜1 h;
b) 对于中分子蛋白的Actin、GAPDH、Ku70,选择10%的分离胶进行电泳;250 mA恒流转膜1.5 h;
c) 对于大分子量蛋白的mTOR、ATR,电泳时用6%的分离胶分离;250 mA恒流转膜6 h;
d) 蛋白转膜后,在含5%的脱脂奶粉封闭液中封闭1 h,然后加入一抗4℃过夜孵育。次日,洗涤膜3次后根据一抗的种属来源加入对应的HRP标记的二抗,室温孵育1小时。洗膜后,加入化学发光液,在凝胶成像仪上曝光,采集图像,并进行灰度分析。
4) WES主要操作步骤
首先,将蛋白样品稀释成0.5、2、8 mg/ml,按说明书操作要求取相应体积WES上样buffer和双蒸水,混合,制成样品检测液,加入到检测板的样品孔道中。然后将稀释的一抗、二抗、洗涤液分别按说明书要求加入到检测板的相应孔道中,室温2500 rpm离心检测板5 min。将检测板和预制毛细管板放入WES机箱,运行WES软件程序,进行全自动蛋白定量分析。
2.3. 结果分析
采用Graphpad prsim 8.0进行Pearson相关性分析。
3. 结果
3.1. 两种检测方法的灵敏度分析
在传统的WB分析中,分子量不同的蛋白需要的转膜条件和时间不同。因此在本研究中按分子量大小分别比较了WB和WES分析的灵敏性。
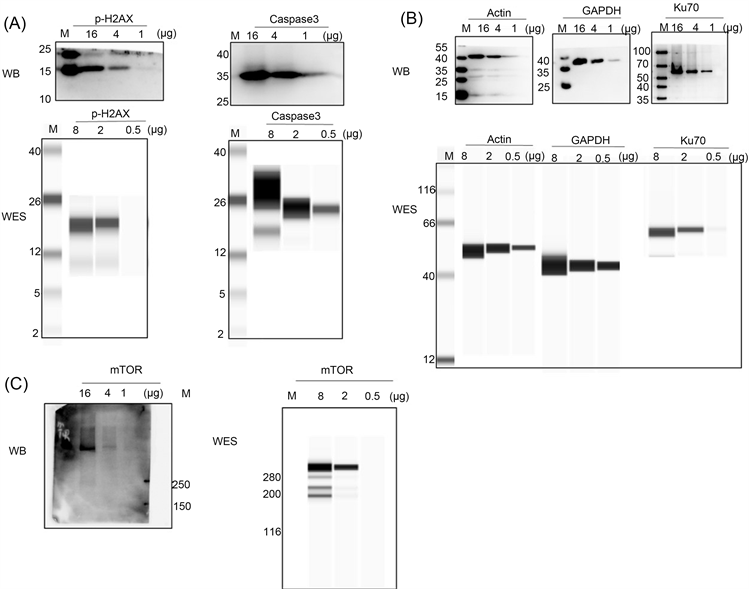
Figure 1. The proteins with different molecular weight were detected by WB and WES. (A) Low molecular weight; (B) Medium molecular weight; (C) High molecular weight
图1. 采用WB与WES两种方法检测不同分子量蛋白。(A) 低分子量蛋白;(B) 中分子量蛋白;(C) 高分子量蛋白
1) 对于分子量小于40 KD的蛋白,我们检测了Caspase3、p-H2AX两个蛋白的丰度(抗体信息见表1)。如图1(A)所示,在总蛋白量为16、4、1 µg时,WB的结果显示条带灰度与蛋白含量的相关相关系数分别是0.74和0.99。使用WES分析,在总蛋白量为8、2、0.5 µg时,WES的结果显示条带灰度与蛋白含量的相关相关系数分别是0.97和0.99。
2) 对于分子量在30~100 KD的蛋白,我们检测了Actin、GAPDH和Ku70三个蛋白的丰度(抗体信息见表1)。如图1(B)所示,在总蛋白量为16、4、1 µg时,WB的结果显示条带灰度与蛋白含量的相关相关系数分别是0.97、0.98、和0.94。使用WES分析,在总蛋白量为8、2、0.5 µg时,WES的结果显示条带灰度与蛋白含量的相关相关系数分别是0.98、0.98和0.94。
3) 对于分子量大于200 KD的蛋白质,我们检测了mTOR蛋白的丰度(抗体信息见表1)。如图1(C)所示,在总蛋白量为16、4、1 µg时,WB的结果显示条带灰度与蛋白含量的相关相关系数分别是0.99。使用WES分析,在总蛋白量为8、2、0.5 µg时,WES的结果显示条带灰度与蛋白含量的相关相关系数为0.98。
综上可以看出,用两种方法检测不同分子量的蛋白质,在一定的浓度范围内,两种方法都具有很好的相关性;与传统的WB方法相比,WES方法可以检出更低含量的蛋白质,灵敏度更高。
3.2. 采用WES的方法同时检测两种蛋白
如果检测的目标蛋白分子量差异较大,理论上可以用WES同时检测目标分子和内参。为了探究同一通道多分子的检测可能性,我们选取GAPDH、Ku70、Actin三个分子进行验证(抗体信息见表1)。将兔抗人Ku70的抗体分别和鼠抗人GAPDH抗体、鼠抗人Actin抗体等体积混合,加入同一通道。结果如图2所示:WES能够同时检测样本中Ku70和GAPDH (或Actin)的含量,与这三个分子单独杂交相比,结果无差异。因此,如果待检的蛋白质分子量差异显著,并且抗体杂交的条带特异性强,可通过WES进行多重检测,同时在一个泳道比较内参及目标分子的变化,这增加了实验结果的可信度,并节省了样本。
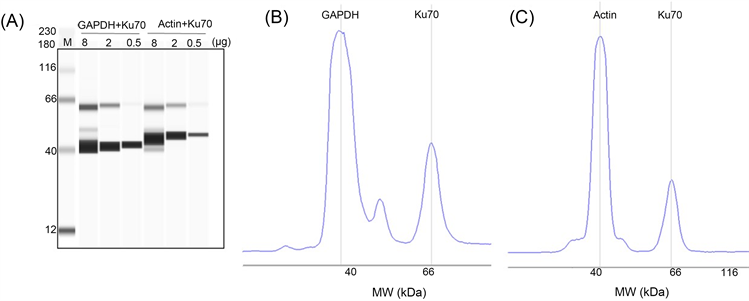
Figure 2. The two proteins were detected simultaneously by WES. (A) The lane diagrams of internal reference (GAPDH or Actin) and KU70 detected simultaneously; (B) The peak patterns of GAPDH and Ku70 detected simultaneously; (C) The peak patterns of Actin and Ku70 detected simultaneously
图2. 采用WES的方法同时检测两种蛋白。(A) 同时检测内参(GAPDH或Actin)和Ku70的泳道图;(B) 同时检测GAPDH和Ku70的峰形图;(C) 同时检测Actin和Ku70的峰形图
3.3. 重复性及准确性
WB分析的过程人工操作环节较多,研究者Angela Koller曾指出,传统WB标准差系数(Coefficient of Variance, CV)大于35%,重复性较差 [6]。为了探究WES的重复性,本研究以GAPDH分子为例,重复五次分析,结果如图3所示,其CV值约3.2%,提示WES的重复性优于传统WB。
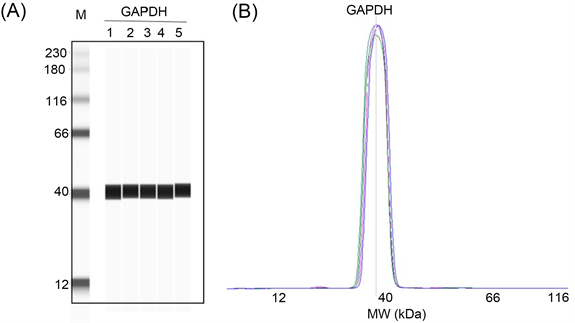
Figure 3. The accuracy and reproducibility of GAPDH expression were detected by WES. (A) The lane map with five repeats; (B) The peak pattern of five times
图3. WES检测GAPDH表达的准确性及重复性。(A) 重复五次上样的泳道图;(B) 重复五次上样的峰形图
3.4. WES能检测微量的蛋白剪切体
细胞在生理或应激状态时常发生蛋白的剪切,如在凋亡过程中多聚ADP-核糖体聚合酶(poly ADP-ribose polymerase, PARP)被Caspase-3剪切,其催化结构域和DNA结合结构域分离。我们用依托泊苷(Etoposide, 5 μM)处理人乳腺癌MDA-MB-231细胞,提取总蛋白,通过WES检测PARP分子的剪切,结果如图4所示:依托泊苷作用0.5小时后PARP就被剪切,由成像图可以直观看到剪切体的条带(图4(A)),峰形图显示了2个条带的位置(图4(B))。由此可见,WES能检测微量的蛋白剪切体。
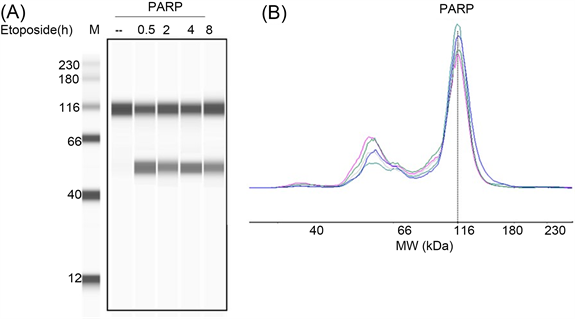
Figure 4. The splicing of PARP in human breast cancer cells MDA-MB-231 treated with Etoposide was detected by WES. (A) Lane map; (B) Peak charts
图4. WES检测依托泊苷处理人乳腺癌MDA-MB-231细胞后PARP的剪切。(A)泳道图;(B) 峰形图
4. 讨论
传统的蛋白免疫印迹(WB)是经典的蛋白检测方法,一直被科研人员所使用。检测过程包括蛋白裂解液的制备、蛋白的电泳分离及转印、封闭、一抗和二抗的杂交、化学发光显影。实验步骤多,过程繁琐,操作需要注意的细节较多。此外,传统WB在检测低分子量和高分子量蛋白质时,分离胶浓度及转膜时间对结果影响较大。对于一些分子量比较大或者比较小的蛋白质,转膜是否充分对结果影响较大:如果转膜时间过短,高分子量蛋白转膜不彻底;对小分子量蛋白质,转膜时间长则容易穿膜,而适宜的转膜条件需要反复摸索。对于一些珍贵样本(如:分选细胞、胚胎细胞、穿刺样本、激光显微切割样本等),如果蛋白含量较低,检测尤其困难。
与WB相比,WES检测中,蛋白质在凝胶柱中被电泳分离后,抗体分子与检测的抗原分子直接杂交,省去了转膜的过程,避免了转膜效率对实验结果的影响。当两种分子的分子量差异较大时,将靶蛋白和内参对照进行同时检测,结果准确性更高。WES分析中,对蛋白质的浓度和抗体的稀释度要求更高,而且WES分析的相对成本较高,为了获得理想的检测结果和节约实验成本,需要使用传统WB对抗体的使用浓度进行初步摸索,然后根据WB中的抗体的最适浓度确定WES中一抗的稀释倍数。
WES相比传统WB,无需制胶、无需转膜,安全环保;3小时左右获得结果,缩短实验优化时间;全自动化,无需值守,效率更高,可进行多重检测;可以检测低至0.5 μg的蛋白量,对于来源不易的样本,更节省样品;分子量可跨度2~440 KD;实验流程标准化,具有可重复性。由此可见,在有条件的实验室,WES检测特异性蛋白质的方法值得推广。
基金项目
国家自然科学基金项目(No. 81971330);陕西省重点研发计划(No. 2017KW-059)。
文章引用
雷 虹,胡峰瑞,陈妍珂,苟兴春. 蛋白免疫印迹和全自动蛋白质定量分析的比较研究
Comparative Study between Western Blotting and Automatic Quantitative Analysis on Protein[J]. 生物医学, 2021, 11(02): 113-119. https://doi.org/10.12677/HJBM.2021.112015
参考文献
- 1. 姜晨晨, 程军军, 黄梦昊, 等. 蛋白免疫印迹半定量分析在药理学研究中的影响因素[J]. 中国药学杂志, 2015, 50(9): 758-762.
- 2. 李晓军, 秦浚川, 武建国. 蛋白印迹技术研究进展[J]. 临床检测杂志, 2004, 3(22): 227-229.
- 3. 董燕, 张枫, 梅柱中, 等. 电转移中蛋白质的透膜现象及其对蛋白质印记结果的影响[J]. 生物化学与生物物理进展, 2002, 29(3): 449-453.
- 4. 张龙祥, 张庭芳, 李令媛. 生化实验方法和技术[M]. 第2版. 北京: 高等教育出版社, 1992: 870-873.
- 5. 卢圣栋. 现代分子生物学实验技术[M]. 北京: 高等教育出版社, 1993: 403-404.
- 6. Koller, A. and Wätzig, H. (2005) Precision and Variance Components in Quantitative Gel Electrophoresis. Electrophoresis, 26, 2470-2475. https://doi.org/10.1002/elps.200500024
NOTES
*通讯作者。
