Advances in Clinical Medicine
Vol.
14
No.
03
(
2024
), Article ID:
82856
,
11
pages
10.12677/ACM.2024.143771
免疫治疗联合化疗治疗晚期非小细胞肺癌患者的成本效用分析的系统评价
李雪莹,张华*
新疆医科大学第一附属医院肿瘤中心,新疆 乌鲁木齐
收稿日期:2024年2月19日;录用日期:2024年3月12日;发布日期:2024年3月20日

摘要
目的:本研究旨在对我国晚期非小细胞肺癌的一线治疗方案相关药物的药物经济学评价进行分析,为我国的晚期非小细胞肺癌的一线治疗方案的药物经济学提供循证参考。方法:检索中华医学网、万方、Pubmed、Embase、Web of Science等数据库,分析纳入模型、成本产出指标等相关要素。结果:共纳入9篇文献,均为英文文献,纳入的文献主要为免疫治疗联合化疗与化疗药物之间经济学对比,也有部分免疫治疗联合化疗方案之间对比,所有的疗效数据均来源于临床实验,在晚期非小细胞肺癌患者使用免疫治疗联合化疗方案与单纯化疗方案的经济学对比之间,免疫治疗联合化疗较单纯化疗更具有经济学效益,但免疫治疗联合化疗之间,可参考本研究纳入相关文献,为大家提供相关参考依据。结论:结合现有的研究结果可表明在晚期非小细胞肺癌患者中使用免疫治疗联合化疗更具有经济学效益,在所纳入的免疫治疗联合化疗治疗晚期非小细胞肺癌患者中,信迪利单抗联合化疗方案虽更具有成本效益,但目前纳入文献较少,缺乏相关实验比对,且大多数纳入均为直接医疗成本,局限性较大。因此,本研究系探讨我国对于治疗晚期非小细胞肺癌一线免疫治疗药物的成本效益以及为我国医疗保健系统提供循证参考依据。
关键词
非小细胞肺癌,成本效果分析,质量调整生命年,免疫检查点抑制剂

Systematic Evaluation of Cost-Utility Analysis of Immunotherapy Combined with Chemotherapy for the Treatment of Patients with Advanced Non-Small Cell Lung Cancer
Xueying Li, Hua Zhang*
Oncology Center of The First Affiliated Hospital of Xinjiang Medical University, Urumqi Xinjiang
Received: Feb. 19th, 2024; accepted: Mar. 12th, 2024; published: Mar. 20th, 2024

ABSTRACT
Objective: The aim of this study was to analyze the pharmacoeconomic evaluation of drugs related to the first-line treatment regimen for advanced non-small cell lung cancer in China, and to provide evidence-based reference for the pharmacoeconomics of the first-line treatment regimen for advanced non-small cell lung cancer in China. Methods: We searched the databases of China Medical Network, Wanfang, Pubmed, Embase, Web of Science, and analyzed the inclusion model, cost and output indicators and other related elements. Results: A total of nine papers were included, all of which were in English, and the included papers were mainly economic comparisons between immunotherapy-combination chemotherapy and chemotherapeutic agents, and some comparisons between immunotherapy-combination chemotherapy regimens, and all of the efficacy data came from clinical trials, and among the economic comparisons between the use of immunotherapy-combination chemotherapy regimen and the chemotherapy alone regimen in patients with advanced non-small-cell lung cancer, the immunotherapy-combination chemotherapy had more economic benefits than chemotherapy alone is more economically effective, but between immunotherapy combination chemotherapy, this study can be referred to the inclusion of relevant literature to provide a relevant reference point. Conclusion: The combination of existing research results can show that the use of immunotherapy combination chemotherapy is more economically beneficial in patients with advanced non-small cell lung cancer, in the included immunotherapy combination chemotherapy treatment of patients with advanced non-small cell lung cancer, sindilizumab combination chemotherapy regimen is more cost-effective, but the current inclusion of the literature is relatively small, lack of relevant experimental comparisons, and most of the inclusion is in direct medical costs, which is a limitation. Therefore, the present study was designed to explore the cost-effectiveness of first-line immunotherapies for advanced non-small cell lung cancer in China and to provide an evidence-based reference for the healthcare system in China.
Keywords:Non-Small Cell Lung Cancer, Cost-Effectiveness Analysis, Quality-Adjusted Life Years, Immune Checkpoint Inhibitors

Copyright © 2024 by author(s) and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY 4.0).
http://creativecommons.org/licenses/by/4.0/


1. 背景
在全球范围内,癌症发病率和死亡率逐年上升,肺癌是最常见的诊断癌症形式(占总病例的11.6%),也是全球癌症死亡的主要原因(占癌症死亡人数的18.4%),造成严重的社会负担和经济损失 [1] 。在中国,肺癌的发病率和死亡率均居所有癌症种类的第一位 [2] ,其中,非小细胞肺癌(Non-Small Cell Lung Cancer, NSCLC)是肺癌中最常见的类型,约占所有肺癌患者的85%。由于早期起病较为隐匿,约有61%的患者在确诊时疾病已进展至晚期。未接受传统化疗的晚期非小细胞肺癌患者的五年生存率仅为18% [3] 。
尽管手术、化疗和放疗等几种抗癌策略被用于治疗肺癌,但对应的5年生存率依然很低,不足5%,目前迫切需要有效的策略来治愈或管理肺癌,特别是晚期癌症 [4] 。无论组织学和驱动突变状态如何,免疫治疗都具有潜在的免疫缺陷,从而导致持续缓解,特别是对于那些表现出免疫反应的患者。癌症免疫治疗的目标是诱导(或重新诱导)细胞免疫反应,特别是T细胞介导的肿瘤特异性抗原(TSA)和肿瘤相关抗原(TAA)定向的细胞毒性,可以选择性地破坏肿瘤 [5] 。然而,在过去的几年中,由于较低的免疫反应,免疫治疗被认为不适用于肺癌患者。肺癌的免疫治疗具有很大的挑战性,因为这些细胞通过调节T细胞介导的细胞毒性、免疫抑制细胞因子的分泌和主要组织相容性复合体(MHC)表达的丢失来避免免疫监测,并降低整体免疫反应 [6] 。近些年的技术进步,可成功检测及确定肺癌免疫原性的分子量,从那时起,免疫检查点抑制剂的应用为广大肺癌患者带来了良好的生存获益 [7] 。
根据2022年中国肿瘤临床学会(Chinese Society of Clinical Oncology, CSCO)非小细胞细胞肺癌指南推荐 [8] ,晚期NSCLC一线治疗策略的除了传统双铂类药物的化疗以外,对于驱动基因突变阴性患者,指南推荐一线治疗方案除了传统的含铂双药化疗外,抗血管生成药物联合化疗,免疫检查点抑制剂(Immune Checkpoint Inhibitors, ICIs)联合化疗的广泛应用,显著提高了晚期非小细胞肺癌患者的治疗疗效、延长了患者的无病进展期和总生存期,如在非驱动基因阳性的非鳞癌非小细胞肺癌中,在中国人群开展的BEYOND研究显示,贝伐珠单抗联合组较单纯化疗组显著延长中位PFS,疾病进展风险下降,中位OS显著延长至24.3个月,并显著提高了客观缓解率(Objective Response Rate, ORR)和疾病控制率(Disease Control Rate, DCR) [9] [10] ,但昂贵的治疗费用、住院的经济负担总体仍呈现持续上升趋势 [11] ,给家庭、社会带来了沉重的医疗、经济负担。
免疫检查点抑制剂在晚期非小细胞肺癌中的使用,为患癌患者带来了福音,但如何选择相关治疗方案是本文研究目的:调查免疫联合化疗治疗晚期非小细胞肺癌相关一线治疗方案的药物经济学文献进行药物经济学分析,探讨我国对于治疗晚期非小细胞肺癌一线免疫治疗药物的成本效益以及为我国医疗保健系统提供循证参考依据。
2. 材料与研究方法
2.1. 研究对象
研究对象为局限性晚期或转移性非小细胞肺癌患者使用一线治疗方案中的免疫治疗联合化疗相关药物经济学文献。
2.2. 结局指标
增量成本–效果比(ICER)、增量–成本效用比(ICUR)等。
2.3. 文献检索
本研究利用“成本效果分析”、“成本效用分析”、“药物经济学”、“晚期非小细胞肺癌”、“免疫治疗”等组合检索词在中国知网、万方、维普等数据库检索可获得中文研究88篇,以non-small cell lung cancer, first-line treatment、ICI、cancer burden、cost-effectiveness analysis, cost-utility analysis, cost-benefit analysis, cost-minimisation analysis, economics evaluation等为检索词在Pubmed、Embase、CENTRAL等数据库进行检索,搜得相关研究885篇。
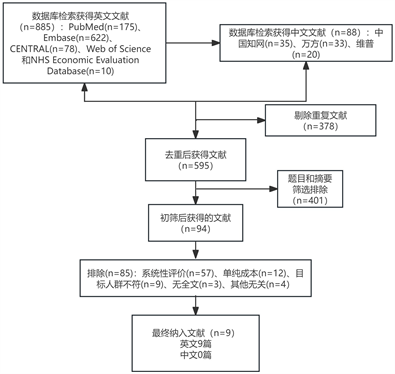
Figure 1. Literature search and screening results
图1. 文献检索及筛选结果
2.4. 纳排标准
2.4.1. 纳入标准
1) 使用一线治疗方案:帕博利珠单抗联合化疗、信迪利单抗联合化疗、卡瑞利珠单抗联合化疗治疗晚期非小细胞肺癌的药物经济学文献;2) 研究角度为医疗卫生系统/医保支付方角度;3) 研究目标人群为局部晚期或转移性NSCLC患者;4) 研究方法为成本–效果分析或成本–效用分析、成本–效益分析或最小成本分析;5) 结局指标包含成本、效果、增量成本–效果比(Incremental Cost-Effectiveness Ratio, ICER)。
2.4.2. 排除标准
1) 重复的文献;2) 不能检索到全文的文献;3) 以综述、意见或会议报告形式发表的文献;4) 除信迪利单抗联合化疗、卡瑞利珠单抗联合化疗、帕博利珠单抗联合化疗以外方案的文献;5) 仅仅进行成本分析的文献;6) 非英文或中文文献。
3. 国内外关于NSCLC治疗药物的经济学分析收集结果
3.1. 研究纳入的基本特征
共检索得到相关研究文献885篇。首先剔除重复文献378篇;经阅读题目或摘要,排除文献401篇;再次筛选后剔除不相干文献85篇:排除系统性评价57篇,单纯成本文献12篇,目标人群不符合共9篇,无全文及与本治疗方案无关共7篇,最终获得9篇相关研究试验文献,具体结果见图1。
在9篇 [12] - [20] 针对晚期NSCLC一线治疗方案的经济学评估中,有7篇 [12] - [17] [19] 采用成本效果分析方法,2篇 [18] [20] 采用成本效用分析。在纳入的9篇文献中,有2项 [12] [15] 在美国开展,有6项 [13] [14] [15] [17] [18] [20] 在中国开展,有1项 [19] 分别在美国和中国开展。相关文献纳入研究的基本特征和方法学信息分别见表1和表2。
3.2. 研究结果
NSCLC疾病类型与目标人群2项 [14] [18] 研究的目标人群为鳞状NSCLC患者,6项 [12] [13] [16] [17] [19] [20] 的目标人群为非鳞状NSCLC患者,其中1项 [15] 研究同时纳入了鳞状和非鳞状NSCLC患者。结果见表1。
3.3. 研究角度
在纳入的9项研究中,2项选择了第三方支付系统的角度 [12] [15] ,7项选择了医疗体系角度 [13] [14] [16] [17] [18] [19] [20] ,结果见表1。
Table 1. Included studies and references
表1. 纳入研究及参考文献
3.4. 治疗情况
3.4.1. 治疗阶段
根据2022年CSCO指南I级推荐方案所纳入的文献研究类型均为晚期非小细胞肺癌患者使用免疫治疗联合化疗方案主要为一线治疗。结果见表1。
3.4.2. 治疗方案
纳入研究所评价的治疗方案主要为帕博利珠单抗、信迪利单抗和卡瑞利珠单抗等3种免疫检查点抑制剂联合标准治疗。有1项研究同时评价了帕博利珠单抗和信迪力单抗的经济性 [18] ,Ralph P Insinga [15] 等研究者发现,使用帕博利珠单抗联合化疗的患者的预期寿命分别延长了1.12年和0.67年。我们可以发现,非鳞状细胞癌和鳞状细胞癌接受帕博利珠单抗联合化疗的非小细胞肺癌的患者中是具有较为显著的生存获益。产生的ICERs (158,030美元/QALY和178,387美元/QALY)低于美国人均国内生产总值的3倍门槛(195,000美元/QALY)。结合长期该试验的生存随访,在美国,帕博利珠单抗联合化疗代表在PD-L1低表达下的具有成本效益的治疗方案之一。1项 [17] 研究评价了的信迪力单抗经济性,为信迪力单抗联合标准化疗方案;对于信迪利单抗联合化疗的治疗人群中也具有明显的生存获益,根据ORIENT-12 [21] 相关临床实验中我们可以发现,信迪利单抗组的中位PFS为6.7个月,安慰剂组中位PFS为4.9个月。该临床实验分析的大多数亚组和PD-L1 TPS的所有亚组中,信迪利单抗组的PFS是优于安慰剂组。3项研究评价了卡瑞利珠单抗的经济性,均为卡瑞利珠单抗联合标准化疗方案 [14] [16] [19] ;并参考及纳入CameL大型RCT临床实验的生存曲线,中位随访时间为11.9个月 [22] 。在此中期分析中,与单独化疗相比,卡瑞利珠单抗联合化疗显著延长了PFS;相关临床试验发现晚期非小细胞肺癌患者在使用免疫治疗联合化疗可以带来明显生存获益,但我们在选择免疫治疗联合化疗时,也需要考虑到其经济适用性,能否给患者带来成本效益。纳入研究所选取的对照组多为研究所在国家或地区的标准治疗方案,如培美曲塞、紫杉醇、铂类化疗方案等。结果见表1。
3.4.3. 用药周期
在纳入的9项研究中均说明了治疗方案的用药周期。研究中治疗方案的用药周期均与相应的临床试验一致。帕博利珠单抗、信迪利单抗、卡瑞丽珠单抗的用药周期为每3周1次。结果见表1。
3.4.4. 后续治疗
一线或二线治疗效果较差时,患者往往会接受其他后续治疗,如铂类单药化疗或中药治疗。在纳入9项研究中,除1项研究未提及对后续治疗的处理外,其余8项研究均考虑了患者的后续治疗。结果见表1。
3.5. 纳入模型
模型构建
在肿瘤相关疾病中,最常用的是马尔科夫模型及生存分区模型,从Ting Chen [19] 等人相关研究发现,使用马尔科夫模型,该模型的结构由三个独立的状态组成:PFS状态、进展生存状态和死亡状态。可根据肿瘤的进展情况,计算出三种状态的5种转移概率,模型模拟结果显示,两组患者几乎均在10年后死亡。因此,本研究的时间限制设置为10年(15~17年)。该模型的输出指标为两组的成本和质量调整生命年(QALYs),然后计算增量成本系数比(ICER)。
3.6. 模型参数
3.6.1. 成本类型
在经济学评估中,药物或干预措施的总成本包括直接成本、间接成本和隐形成本三个部分。本次分析的9篇文献中仅考虑了直接医疗成本,多数包括治疗方案成本、疾病管理成本和AE成本。成本分析方法部分汇总如表1所示。纳入的9项研究其中有1项研究纳入了PD-1检测成本。在成本数据来源方面,所有研究均参考了其他文献中的相关成本数据,其中3项研究同时对成本进行了专家咨询。
3.6.2. 贴现率
在基于美国背景开展的研究中,有2项采用了3%的贴现率,1项采用了0~8%的贴现率;在基于中国背景开展的研究中,均采用了5%的贴现率。其余研究采用的贴现率见表1。
3.6.3. 健康效用值的选择
对于健康效用值的测量,9项研究采用了欧洲五维健康量表(EQ-5D)的测量方法;其中大多数研究的健康效用值来源于相关健康效用文献,但R [15] 的研究来源于临床试验,数据来自在KEY-NOTE 189 [23] 、KEY-NOTE 407 [24] 试验中登记的患者。通过患者的生存天数反映了癌症患者生活质量逐年下降。
3.6.4. AE
对于纳入的AE等级,9项研究均纳入了3级及以上的AE。此外,在成本方面,所有研究均考虑了纳入的AE的处理成本。在效用方面,3项{}研究考虑了纳入的AE导致的健康效用损失,并采用了负效用等方法量化AE带来的健康效用损失。
3.6.5. WTP
在纳入的9项研究中,均报告了WTP阈值。其中,6项采用中国的1~3倍人均GDP作为WTP阈值,2项对美国的WTP阈值则来源于美国的1~3倍人均GDP作为WTP阈值;1项基于中国和美国的研究分别采用了中国和美国1~3倍人均GDP作为WTP阈值,其产生的ICERs均低于中国/美国人均国内生产总值的3倍(180,000美元/QALY)。结果见表2。
3.7. 健康结果指标与不确定分析
纳入的9项研究均使用质量调整生命年(Quality-Adjusted Life Year, QALY)作为健康结局指标。Mingjun Rui总成本和健康结果分别进行了情景分析与基础案例分析。发现与卡瑞利珠单抗联合化疗相比,信迪利单抗联合化疗获得了0.13~0.61的额外QALY。增量成本从1099美元至5201美元不等。因此,根据基础案例分析发现,信迪利单抗的ICER值在6440美元至8454美元/QALY之间 [20] 。与卡瑞利珠单抗联合化疗作为中国局部晚期或转移性非鳞状NSCLC的一线治疗方法相比,信迪利单抗联合化疗是一种具有经济效益的选择。
敏感性分析
在纳入的9项研究中,结果均采用了敏感性分析。敏感性分析主要包括单因素敏感性分析和多因素敏感性分析。在Mingjun Rui等研究发现,与卡瑞利珠单抗联合化疗相比,信迪利单抗联合化疗获得了来自0.13~0.61的额外QALY。增量成本从1099美元至5201美元不等。因此,基本案例的收益率在6440美元至8454美元/QALY之间。单因素敏感性分析及概率性敏感性分析的ICER均表明,信迪利单抗联合化疗与卡瑞利珠单抗联合化疗相比,信迪利单抗联合化疗更加具有经济性 [20] 。而在Pingyu Chen等人相关研究中发现,对于中国晚期或转移性鳞状NSCLC患者,与帕博利珠单抗联合化疗相比,信迪利单抗联合化疗的增量AQLY为0.0183 (0.9902 vs. 1.0085),且成本较低,增量成本为24,050美元(12,321美元 vs 36,371美元)。ICER为1,341,208美元/QALY,这表明低于中国的1~3倍人均GDP作为WTP阈值(11,250美元/QALY~33,749/QALY) [18] 。此研究结果也发现疾病进展生存状态(PP)的效用、白蛋白紫杉醇的单位成本和无病进展生存状态(PFS)的效用是模型的主要驱动参数,而其他参数对模型结果的影响较小。ICER值对PP状态的效用最为敏感,说明PP效用值的变化可能导致最优策略选择。结合基础案例分析,单因素敏感性分析及概率性敏感性分析的ICER均表明,信迪利单抗联合化疗与帕博利珠单抗联合化疗相比,信迪利单抗联合化疗也更加具有经济性。
Table 2. Inclusion of selected studies from the literature
表2. 纳入文献部分研究内容情况
4. 结论
综合上述相关文献研究,我们的研究结果为我国晚期非小细胞肺癌使用帕博利珠单抗联合化疗、卡瑞利珠单抗联合化疗及信迪利单抗联合化疗等一线治疗方案提供了循证依据,以下包括:
1) 免疫治疗联合化疗在晚期非小细胞肺癌患者人群中,无论PD-L1表达与否,结合文献中纳入的相关临床试验,如ORIENT-11 [25] 、KEYNOTEE-189 [23] 及CAMEL-sq [26] 等大型临床研究可发现,其OS、PFS、ORR方面均优于标准化疗具有生存优势;
2) 对于PD-L1表达与否,本研究发现晚期非小细胞肺癌的患者使用联合方案下,相关临床试验已证实免疫治疗联合化疗在生存获益上明显优于标准化治疗,但需进一步明确其成本获益如何,我们可以从Huiqin Liu [17] 、Taihang Shao [14] 等相关研究发现,选择卡瑞利珠单抗联合化疗或信迪利单抗联合化疗相比于标准化治疗来说,是更具有经济学效益。
3) 对于晚期非小细胞肺癌患者使用帕博利珠单抗联合化疗的治疗方案中,我们需对PD-L1的表达情况进行分组,Ning Wan [13] 等人发现,联合策略在美国和中国化疗后分别产生了0.78 QALY和0.59 QALY,美国ICER为132,392/QALY,中国为92,533/QALY。在PD-L1 ≥ 1%基础病例中,美国和中国的PD-L1测试策略的ICERs分别为$ 77,754/QALY和$ 56,768/QALY。在PD-L1 ≥ 50%的基础案例中,ICERs分别为44,731美元/QALY和34,388美元/QALY,在美国的ICER为132,392/QALY,在中国为92,533/QALY。在美国和中国获得的WTP阈值为100,000美元/QALY和27,351美元/QALY时,这些发现表明帕博利珠单抗于化疗联合策略在美国和中国没有成本效益,这也并不意味着我们无法接受此治疗方案,因为在我国相关研究数量有限,纳入的成本数据较少,目前也有相关药物援助计划纳入,我们需要以中国角度来进行大量成本效益分析数据,以此来对于各位医学人士提供更多的参考依据。
5. 研究局限性
研究方法的不同,结论因此可能受到相关因素的影响。但在大多数研究中,包括一部分的前瞻性研究,虽然成本在研究治疗方案中为前瞻性研究,但相关药物管理成本是来自于回顾型数据,虽然可假设药物的管理成本是相近的,但在不同国家的药物,例如吉西他滨在许多国家通用,其药物管理成本可能有所变化,可能一部分成本被过高估计。第二、大多数成本分析仅限于与NSCLC相关的直接医疗费用。医疗费用:间接费用,如生产力损失和护理人员的工资,以及一些患者相关的隐匿性财产损失并没有包括在内。第三,由于没有收集前瞻性的效用数据,效用的表达反映了社会角度的价值,而不是相关患者的价值。这不仅在于前瞻性研究的局限性,大多数研究均有相关局限性,因此,这些局限性可能会影响相关结果的偏差。
文章引用
李雪莹,张 华. 免疫治疗联合化疗治疗晚期非小细胞肺癌患者的成本效用分析的系统评价
Systematic Evaluation of Cost-Utility Analysis of Immunotherapy Combined with Chemotherapy for the Treatment of Patients with Advanced Non-Small Cell Lung Cancer[J]. 临床医学进展, 2024, 14(03): 785-795. https://doi.org/10.12677/ACM.2024.143771
参考文献
- 1. Global Burden of Disease 2019 Cancer Collaboration, Kocarnik, J.M. and Compton, K. (2022) Cancer Incidence, Mor-tality, Years of Life Lost, Years Lived with Disability, and Disability-Adjusted Life Years for 29 Cancer Groups From 2010 to 2019: A Systematic Analysis for the Global Burden of Disease Study 2019. JAMA Oncology, 8, 420-444.
- 2. 王悠清. 2020年全球癌症统计报告[J]. 中华预防医学杂志, 2021, 55(3): 398.
- 3. Cufer, T. and Knez, L. (2014) Update on Systemic Therapy of Advanced Non-Small-Cell Lung Cancer. Expert Review of Anticancer Therapy, 14, 1189-1203. https://doi.org/10.1586/14737140.2014.940327
- 4. 韩宝惠, 李凯, 周彩存, 等. 晚期非小细胞肺癌抗血管生成药物治疗中国专家共识(2019版) [J]. 中国肺癌杂志, 2019, 22(7): 401-412.
- 5. Brueckl, W.M., Ficker, J.H. and Zeitler, G. (2020) Clinically Relevant Prognostic and Predictive Markers for Im-mune-Checkpoint-Inhibitor (ICI) Therapy in Non-Small Cell Lung Cancer (NSCLC). BMC Cancer, 20, Article No. 1185. https://doi.org/10.1186/s12885-020-07690-8
- 6. Derosa, L., Routy, B. and Thomas, A.M. (2022) Intestinal Ak-kermansia muciniphila Predicts Clinical Response to PD-1 Blockade in Patients with Advanced Non-Small-Cell Lung Cancer. Nature Medicine, 28, 315-324. https://doi.org/10.1038/s41591-021-01655-5
- 7. Lurienne, L., Cervesi, J. and Duhalde, L. (2020) NSCLC Im-munotherapy Efficacy and Antibiotic Use: A Systematic Review and Meta-Analysis. Journal of Thoracic Oncology, 15, 1147-1159. https://doi.org/10.1016/j.jtho.2020.03.002
- 8. 中国临床肿瘤学会指南工作委员会. 中国临床肿瘤学会(CSCO)非小细胞肺癌诊疗指南2022[M]. 北京: 人民卫生出版社, 2022: 186-187.
- 9. 王元花, 彭小燕, 刘晓君, 等. PD-1/PD-L1抑制剂对比常规疗法治疗癌症的有效性和安全性的Meta分析[J]. 现代肿瘤医学, 2020, 28(10): 1731-1738.
- 10. 杨雪, 赵军. 非小细胞肺癌的个体化治疗进展[J]. 中国肺癌杂志, 2022, 25(3): 219-236.
- 11. Husereau, D., Drummond, M., Petrou, S., et al. (2013) Consolidated Health Economic Evaluation Re-porting Standards (CHEERS) Statement. The European Journal of Health Economics, 14, 367-372. https://doi.org/10.1007/s10198-013-0471-6
- 12. Insinga, R.P., Vanness, D.J. and Feliciano, J.L. (2018) Cost-Effectiveness of Pembrolizumab in Combination with Chemotherapy in the 1st Line Treatment of Non-Squamous NSCLC in the US. Journal of Medical Economics, 21, 1191-1205. https://doi.org/10.1080/13696998.2018.1521416
- 13. Wan, N., Zhang, T. and Hua, S. (2020) Cost-Effectiveness Analysis of Pembrolizumab plus Chemotherapy with PD-L1 Test for the First-Line Treatment of NSCLC. Cancer Medi-cine, 9, 1683-1693. https://doi.org/10.1002/cam4.2793
- 14. Shao, T., Ren, Y. and Zhao, M. (2022) Cost-Effectiveness Analysis of Camrelizumab plus Chemotherapy as First-Line Treatment for Advanced Squamous NSCLC in China. Frontiers in Public Health, 10, Article 912921. https://doi.org/10.3389/fpubh.2022.912921
- 15. Insinga, R.P., Feliciano, J.L. and Qiao, N. (2021) Cost-Effectiveness of Pembrolizumab + Chemotherapy versus Chemotherapy and Pembrolizumab Monotherapy in First Line Treatment of NSCLC in the US—Updated Analyses with Additional Trial Follow-Up. Journal of Medical Eco-nomics, 24, 792-805. https://doi.org/10.1080/13696998.2021.1937188
- 16. Qiao, L., Zhou, Z. and Zeng, X. (2021) Cost-Effectiveness of Domestic PD-1 Inhibitor Camrelizumab Combined with Chemotherapy in the First-Line Treatment of Advanced Nonsquamous Non-Small-Cell Lung Cancer in China. Frontiers in Pharmacology, 12, Article 728440. https://doi.org/10.3389/fphar.2021.728440
- 17. Liu, H., Wang, Y. and He, Q. (2022) Cost-Effectiveness Analysis of Sintilimab plus Pemetrexed and Platinum versus Chemotherapy Alone as First-Line Treatment in Metastatic Non-Squamous Non-Small Cell Lung Cancer in China. Health Economics Review, 12, Article No. 66. https://doi.org/10.1186/s13561-022-00410-x
- 18. Chen, P., Wang, X. and Zhu, S. (2022) Economic Evaluation of Sintilimab plus Chemotherapy vs. Pembrolizumab Plus Chemotherapy for the Treatment of First-Line Advanced or Met-astatic Squamous NSCLC. Frontiers in Public Health, 10, Article 956792. https://doi.org/10.3389/fpubh.2022.956792
- 19. Chen, T., Xie, R. and Zhao, Q. (2022) Cost-Utility Analysis of Camrelizumab plus Chemotherapy versus Chemotherapy Alone as a First-Line Treatment for Advanced Nonsquamous Non-Small Cell Lung Cancer in China. Frontiers in Oncology, 12, Article 746526. https://doi.org/10.3389/fonc.2022.746526
- 20. Rui, M., Fei, Z. and Wang, Y. (2022) Cost-Effectiveness Analysis of Sintilimab + Chemotherapy versus Camrelizumab + Chemotherapy for the Treatment of First-Line Locally Advanced or Metastatic Nonsquamous NSCLC in China. Journal of Medical Economics, 25, 618-629. https://doi.org/10.1080/13696998.2022.2071066
- 21. Zhou, C., Wu, L. and Fan, Y. (2021) Sintilimab plus Plati-num and Gemcitabine as First-Line Treatment for Advanced or Metastatic Squamous NSCLC: Results from a Random-ized, Double-Blind, Phase 3 Trial (ORIENT-12). Journal of Thoracic Oncology, 16, 1501-1511. https://doi.org/10.1016/j.jtho.2021.04.011
- 22. Zhou, C., Chen, G. and Huang, Y (2021) Camrelizumab plus Car-boplatin and Pemetrexed versus Chemotherapy Alone in Chemotherapy-Naive Patients with Advanced Non-Squamous Non-Small-Cell Lung Cancer (CameL): A Randomised, Open-Label, Multicentre, Phase 3 Trial. The Lancet Respiratory Medicine, 9, 305-314. https://linkinghub.elsevier.com/retrieve/pii/s2213260020303659 https://doi.org/10.1016/S2213-2600(20)30365-9
- 23. Garassino, M.C., Gadgeel, S. and Speranza, G. (2023) Pem-brolizumab plus Pemetrexed and Platinum in Nonsquamous Non-Small-Cell Lung Cancer: 5-Year Outcomes from the Phase 3 KEYNOTE-189 Study. Journal of Clinical Oncology, 41, 1992-1998. https://doi.org/10.1200/JCO.22.01989
- 24. Novello, S., Kowalski, D.M. and Luft, A. (2023) Pembrolizumab plus Chemotherapy in Squamous Non-Small-Cell Lung Cancer: 5-Year Update of the Phase III KEYNOTE-407 Study. Journal of Clinical Oncology, 41, 1999-2006. https://ascopubs.org/doi/10.1200/jco.22.01990 https://doi.org/10.1200/JCO.22.01990
- 25. Yang, Y., Sun, J., Wang, Z., et al. (2021) Updated Overall Survival Data Andpredictive Biomarkers of Sintilimabplus Pemetrexed and Platinum as First-Line Treatment for Locally Ad-vanced or Meta-Static Nonsquamous NSCLC in the Phase 3 ORIENT-11 Study. Journal of Thoracic Oncology, 16, 2109-2120. https://doi.org/10.1016/j.jtho.2021.07.015
- 26. Ren, S., Chen, J. and Xu, X. (2022) Camrelizumab plus Carboplatin and Paclitaxel as First-Line Treatment for Advanced Squamous NSCLC (CameL-Sq): A Phase 3 Trial. Journal of Thoracic Oncology, 17, 544-557. https://doi.org/10.1016/j.jtho.2021.11.018
NOTES
*通讯作者。
