 Hans Journal of Chemical Engineering and Technology 化学工程与技术, 2013, 3, 100-104 http://dx.doi.org/10.12677/hjcet.2013.33019 Published Online May 2013 (http://www.hanspub.org/journal/hjcet.html) Synthesis of Novel Organic Conjugated Small Molecules Containing Heteroatoms (N, S) Chunyang He, Minzhao Xue*, Fan Zhang School of Chemistry and Chemical Engineering, Shanghai Jiao Tong University, Shanghai Email: *mzx@sjtu.edu.cn Received: Feb. 25th, 2013; revised: Mar. 14th, 2013; accepted: Mar. 22nd, 2013 Copyright © 2013 Chunyang He et al. This is an open access article distributed under the Creative Commons Attribution License, which permits unrestricted use, distribution, and reproduction in any medium, provided the original work is properly cited. Abstract: A series of organic conjugated small molecules containing heteroatoms (N, S) were designed and synthesized. The different alkyl chains can be introduced through reaction of the lithiated thiophene with corresponding alkyl halide at low temperature. After bromination, the resulting bromo-intermediates can be smoothly converted into corresponding Grignard reagent. Afterwards, the as-prepared Grignard reagents were treated with 1,2,4,5-tetra(S-(pyridine-2’-yl))ben- zenetetrathioate, and then reacted with hydrazine hydrate to afford the target compounds. Upon aforementioned syn- thetic strategy, the physical characters of the target molecules can be fine-tuned by efficient introduction of the different alkyl substituents in the periphery of the conjugated backbone. The UV-Vis absorption spectra of these molecules in dichloromethane solution revealed three maximum absorption peaks between 260 and 600 nm. Keywords: Heteroatoms (N, S); Alkyl Chains; Organic Conjugated Small Molecules 新型含硫氮杂原子有机共轭小分子的合成 何春阳,薛敏钊*,张 帆 上海交通大学化学化工学院,上海 Email: *mzx@sjtu.edu.cn 收稿日期:2013 年2月25 日;修回日期:2013年3月14 日;录用日期:2013年3月22日 摘 要:设计并合成了一类富含硫氮杂原子的有机共轭小分子。在低温下,利用噻吩锂化以及与对应的卤代烷 烃反应,引入不同的烷基链,进一步溴代后,制备相应格式试剂并与另一反应物1,2,4,5-四((S)-2’-吡啶酮)苯反 应,得到重要中间体,最后通过水合肼还原关环,得到目标化合物。利用上述高效、简单的制备方法,可以有 效在共轭骨架外围引入不同烷基链,实现对目标化合物物理性质的调控。二氯甲烷溶液中的紫外–可见吸收光 谱表征显示,该类分子在260~600 nm 范围有三个最大吸收峰。 关键词:硫氮杂原子;烷基链;有机共轭小分子 1. 引言 近年来,随着人们对有机光电器件越来越多的关 注,设计合成新型有机共轭分子成为开发有机光电器 件的根源所在[1]。在并苯刚性骨架中引入负电性的杂 原子来合成新型的有机 π共轭分子是人们解决这一问 题的有效方法[2,3]。对于常见的具备π共轭结构光电性 能优良的有机化合物来讲,如苝酰亚胺类,并五苯类, 聚噻吩类分子都具有大的共轭π平面,但是因其在常 用溶剂中缺乏良好的溶解性使其制备有机光电器件 中受到了一定的限制[4-6]。本文从分子设计的角度出 *通讯作者。 Copyright © 2013 Hanspub 100  新型含硫氮杂原子有机共轭小分子的合成 发,通过引入烷基链来解决有机共轭分子的溶解度问 题。本文中的合成方法可以得到一系列具有不同长度 外围烷基链取代基并且富含硫氮杂原子的有机共轭 小分子。该类分子以含氮的并苯基团作为中心核,以 噻吩基团为四个伸展臂,这种结构特点使分子具有丰 富的光电性质,以及潜在的器件应用价值[7];分子外 围的烷基链能够有效解决刚性 π共轭分子的溶解性问 题。 本文中目标分子的合成起始于廉价的均苯四甲 酸酐,参考报道两步合成得到 1,2,4,5-四((S)-2’-吡啶酮 ) 苯中间体作为关键的前驱体[8]。利用噻吩α位氢的活 泼性,在噻吩上引入烷基链修饰,进一步并溴代后, 制备得到格式试剂。再利用 1,2,4,5-四((S)-2’-吡啶酮) 苯上巯基吡啶集团的离去性与格式试剂羰基加成,得 到含硫原子和烷基链的中间体苯酮结构的1,2,4,5-四 (2’-噻吩酮)苯(3a-3b)化合物,最后采用简单的水合肼 还原关环反应引入氮原子并且得到目标分子[9]。 2. 实验部分 2.1. 试剂和仪器 试剂:均苯四甲酸酐,五氯化磷,2-巯基吡啶, 噻吩,氢氧化钠,碳酸氢钠,无水硫酸钠,正丁基锂, 1-溴代正己烷,1-溴代十二烷,1-溴代十八烷,N,N- 二甲基甲酰胺,水合肼,均购买于阿拉丁,分析纯。 本文中的溶剂四氢呋喃在使用前是经过与金属钠加 热回流用二苯甲酮作指示剂进行除水精制处理过的; 反应中使用的三乙胺是经过氢化钙加热回流除水干 燥处理过的。其他溶剂均为购买使用。 仪器:1H NMR 与13C NMR 表征图谱是使用 MERCURY plus-400型核磁共振仪进行测试的,高分 辨质谱的表征仪器是Bruker microTOF-Q-Ⅱ高分辨质 谱仪测定,熔点由JingSong X-4A 熔点仪测定。 2.2. 合成 2.2.1. 合成路线 通常人们为了解决刚性大 π共轭有机分子的溶解 度,需在分子的外围引入烷基链[10],本文的特点是从 廉价简单噻吩出发,在 α位引入烷基链,不同烷基取 代的噻吩衍生物,作为重要前驱体。图1是制备格式 试剂的关键原料–溴代烷基噻吩的合成步骤。第一步 Sn-BuLi RBr -20℃ SRNBS CH3COOH SR Br 5a:R=C6H13,90% 5b:R=C12H25,84% 5c:R=C18H37,86% 6a:R=C6H13, 88% 6b:R=C12H25,80% 6c:R=C18H37,84% Figure 1. Synthesis route of alkyl modified thienyl intermediates of 6a-6c 图1. 烷基链修饰噻吩类中间体的合成路线 锂化拔氢要注意保持冰盐浴低温进行,第二步利用 N,N-二甲基甲酰胺溴代要注意避光进行。该路线高效 简单地得到烷基修饰的噻吩衍生物 6a-6c,用于目标 化合物按设计路线顺利实施。 图2是目标分子的合成路线,参考相关报道可以 顺利合成出化合物 2[11],利用制备的格式试剂与化合 物2进行羰基加成反应得到化合物 3a-3b,该反应是 整个合成路线的关键步骤[8],将成功制备出的3a-3b 进行水合肼还原关环可以顺利得到目标分子 4a-4b。 2.2.2. 原料化合物 1和2合成 1的合成步骤:根据文献11 中的合成方法,利用 1,2,4,5-均苯四甲酸二酐和五氯化磷高温熔融条件下 的酰氯化反应可以顺利得到起始化合物 5,产量为 87%。1H NMR(400 MHz, CDCl3): δ 8.01(s, 1 H)[11]。 2的合成步骤:该步骤仍然在无水无氧条件下, 参照文献 11 中报导的合成方法,可以顺 利得到淡黄色 固体产物(3.77 g, 42.8%)。 1H NMR(400 MHz, CDCl3) δ 8.71 - 8.62(m, 2H, S-Py-H-6), 8.29(s, 1H, Ph), 7.79(qd, 4H, 3JH-H = 5.7 Hz, 4JH-H = 1.4 Hz, S-Py-H-4.5), 7.36(m, 2H, S-Py-H-3)[11]。 2.2.3. 不同烷基链修饰噻吩类衍生物 5a-5c 的合成 5a 的合成步骤:氮气氛围下,在三颈瓶中加入噻 吩(10 g, 0.119 mol)和四氢呋喃(100 ml),−20℃下逐滴 加入正丁基锂的正己烷溶液(78 ml, 1.6 M, 0.125 mol)。 自然升至室温搅拌过夜后,将反应温度降至−20 ℃, 缓慢滴加 1-溴代正己烷(20.6 g, 0.125 mol)。搅拌3 h 后加入 200 ml 水淬灭反应。用二氯甲烷萃取,合并有 机相后,无水硫酸钠干燥,旋干后减压蒸馏分离产物, 得到无色透明液体17.8 g,产率为89%。 1H-NMR(400Hz, CDCl3) δ 7.13(dd,1H,Th-H-4), 6.95(dd, 1H, Th-H-3), 6.83(dd, 1H, Th-H-2), 2.89(t, 2H, CH2), 1.73(m, 2H, CH2), 1.31 - 1.46(m, 6H, CH2), 0.96(t, 3H, CH3) 。 Copyright © 2013 Hanspub 101 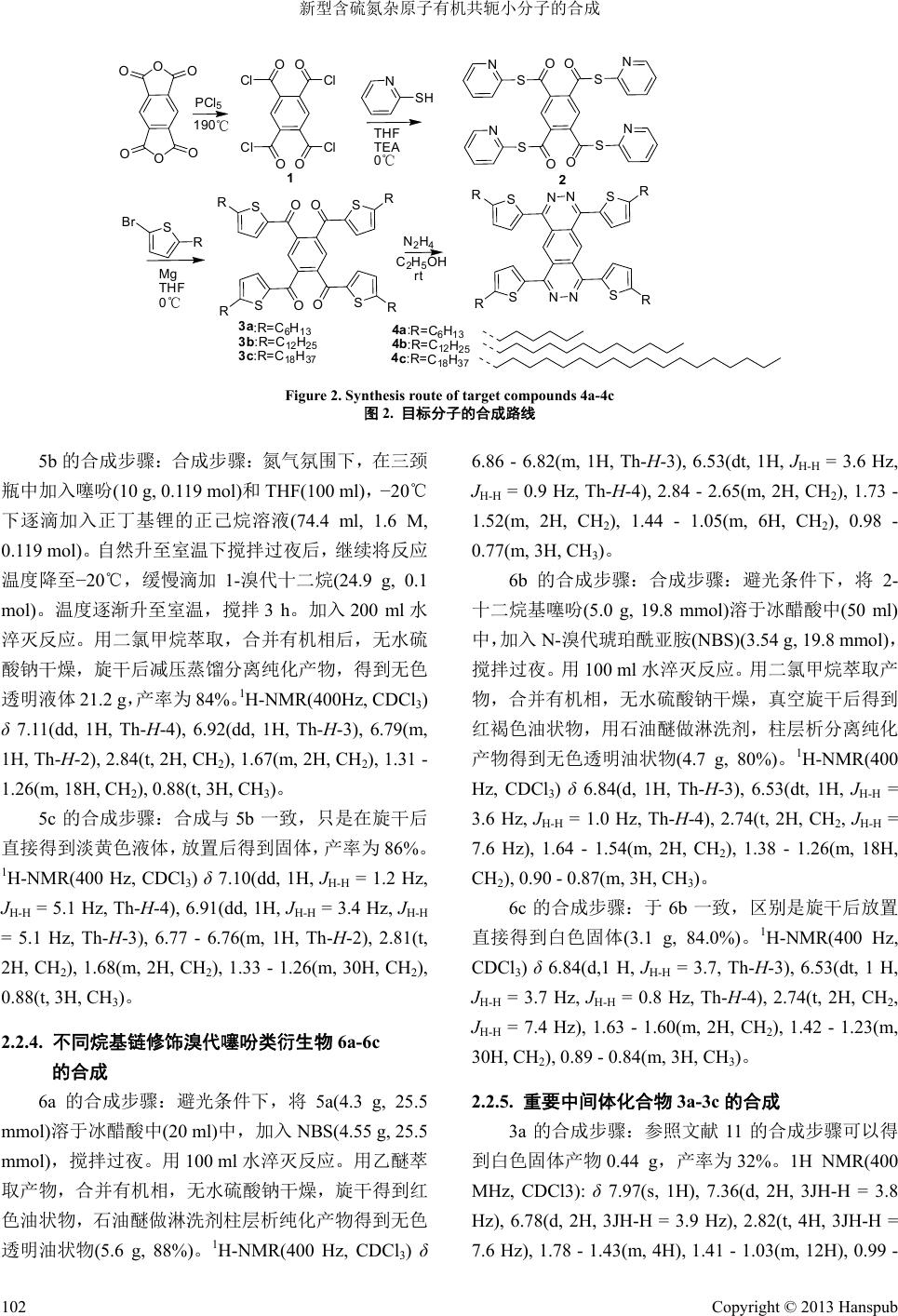 新型含硫氮杂原子有机共轭小分子的合成 Copyright © 2013 Hanspub 102 O OOO O OOO OO S S S S NN N N PCl5 190℃ OO OO Cl Cl ClCl NSH THF TEA 0℃ 12 SR Mg THF 0℃OO OO S S S S RR R RNN N NS S S S RR R R N2H4 3a:R=C 6H13 3b:R=C12H25 3c:R=C 18H37 4a:R=C 6 H 13 4b:R=C 12 H 25 4c:R=C 18 H 37 Br C2H5OH rt Figure 2. Synthesis route of target compounds 4a-4c 图2. 目标分子的合成路线 5b 的合成步骤:合成步骤:氮气氛围下,在三颈 瓶中加入噻吩(10 g, 0.119 mol)和THF(100 ml),−20℃ 下逐滴加入正丁基锂的正己烷溶液(74.4 ml, 1.6 M, 0.119 mol)。自然升至室温下搅拌过夜后,继续将反应 温度降至−20℃,缓慢滴加1-溴代十二烷(24.9 g, 0.1 mol)。温度逐渐升至室温,搅拌3 h。加入200 ml水 淬灭反应。用二氯甲烷萃取,合并有机相后,无水硫 酸钠干燥,旋干后减压蒸馏分离纯化产物,得到无色 透明液体 21.2 g,产率为84%。 1H-NMR(400Hz, CDCl3) δ 7.11(dd, 1H, Th-H-4), 6.92(dd, 1H, Th-H-3), 6.79(m, 1H, Th-H-2), 2.84(t, 2H, CH2), 1.67(m, 2H, CH2), 1.31 - 1.26(m, 18H, CH2), 0.88(t, 3H, CH3)。 5c 的合成步骤:合成与 5b一致,只是在旋干后 直接得到淡黄色液体,放置后得到固体,产率为86%。 1H-NMR(400 Hz, CDCl3) δ 7.10(dd, 1H, JH-H = 1.2 Hz, JH-H = 5.1 Hz, Th-H-4), 6.91(dd, 1H, JH-H = 3.4 Hz, JH-H = 5.1 Hz, Th-H-3), 6.77 - 6.76(m, 1H, Th-H-2), 2.81(t, 2H, CH2), 1.68(m, 2H, CH2), 1.33 - 1.26(m, 30H, CH2), 0.88(t, 3H, CH3)。 2.2.4. 不同烷基链修饰溴代噻吩类衍生物 6a-6c 的合成 6a 的合成步骤:避光条件下,将 5a(4.3 g, 25.5 mmol)溶于冰醋酸中(20 ml)中,加入NBS(4.55 g, 25.5 mmol),搅拌过夜。用100 ml 水淬灭反应。用乙醚萃 取产物,合并有机相,无水硫酸钠干燥,旋干得到红 色油状物,石油醚做淋洗剂柱层析纯化产物得到无色 透明油状物(5.6 g, 88%)。1H-NMR(400 Hz, CDCl3) δ 6.86 - 6.82(m, 1H, Th-H-3), 6.53(dt, 1H, JH-H = 3.6 Hz, JH-H = 0.9 Hz, Th-H-4), 2.84 - 2.65(m, 2H, CH2), 1.73 - 1.52(m, 2H, CH2), 1.44 - 1.05(m, 6H, CH2), 0.98 - 0.77(m, 3H, CH3)。 6b 的合成步骤:合成步骤:避光条件下,将 2- 十二烷基噻吩(5.0 g, 19.8 mmol)溶于冰醋酸中(50 ml) 中,加入 N-溴代琥珀酰亚胺(NBS)(3.54 g, 19.8 mmol), 搅拌过夜。用 100 ml 水淬灭反应。用二氯甲烷萃取产 物,合并有机相,无水硫酸钠干燥,真空旋干后得到 红褐色油状物,用石油醚做淋洗剂,柱层析分离纯化 产物得到无色透明油状物(4.7 g, 80%)。1H-NMR(400 Hz, CDCl3) δ 6.84(d, 1H, Th-H-3), 6.53(dt, 1H, JH-H = 3.6 Hz, JH-H = 1.0 Hz, Th-H-4), 2.74(t, 2H, CH2, JH-H = 7.6 Hz), 1.64 - 1.54(m, 2H, CH2), 1.38 - 1.26(m, 18H, CH2), 0.90 - 0.87(m, 3H, CH3)。 6c 的合成步骤:于 6b 一致,区别是旋干后放置 直接得到白色固体(3.1 g, 84.0%)。1H-NMR(400 Hz, CDCl3) δ 6.84(d,1 H, JH-H = 3.7, Th-H-3), 6.53(dt, 1 H, JH-H = 3.7 Hz, JH-H = 0.8 Hz, Th-H-4), 2.74(t, 2H, CH2, JH-H = 7.4 Hz), 1.63 - 1.60(m, 2H, CH2), 1.42 - 1.23(m, 30H, CH2), 0.89 - 0.84(m, 3H, CH3)。 2.2.5. 重要中间体化合物 3a-3c 的合成 3a 的合成步骤:参照文献 11 的合成步骤可以得 到白色固体产物0.44 g,产率为 32%。1H NMR(400 MHz, CDCl3): δ 7.97(s, 1H), 7.36(d, 2H, 3JH-H = 3.8 Hz), 6.78(d, 2H, 3JH-H = 3.9 Hz), 2.82(t, 4H, 3JH-H = 7.6 Hz), 1.78 - 1.43(m, 4H), 1.41 - 1.03(m, 12H), 0.99 -  新型含硫氮杂原子有机共轭小分子的合成 0.62(m, 6H); 13C NMR(100 MHz, CDCl3): δ 186.55, 158.60, 141.01, 140.90, 136.43, 129.59, 126.11, 31.70, 31.50, 30.98, 29.01, 22.69, 14.26[11], M.p. > 300℃. 3b 的合成步骤:将6b(3.7 g, 11.18 mmol)溶于 15 ml 四氢呋喃中,逐滴加入到含有碘的镁屑(0.29 g, 12.31 mmol)中制备格式试剂,电加热枪稍微加热使反 应引发后,溶液颜色渐渐变为灰色,50℃下反应3 h。 冰浴 0℃下将冷却的格式试剂缓慢滴加到 2(1.0 g,1.62 mmol)的THF(100 ml)悬浊液中,随着格式试剂的加入 溶液颜色逐渐接近无色继而又变为红褐色,搅拌反应 过夜后有沉淀析出。用 10%盐酸(200 ml)来淬灭反应, 氯仿萃取,有机相用氢氧化钠溶液(2 M)和蒸馏水洗至 中性。无水硫酸钠干燥,真空旋蒸后用氯仿/乙醚重结 晶,得到微黄色固体 0.63 g,产率为 33.2%。1H NMR(400 MHz, CDCl3, ppm): δ 7.98(s, 1 H), 7.36(d, 2H, 3JH-H = 4.0 Hz), 6.79(d, 2H, 3JH-H = 4.0 Hz), 2.82(t, 4H, 3JH-H = 7.6 Hz), 1.71 - 1.65(m, 4H), 1.63 - 1.57(m, 36H), 0.90 - 0.86(m, 6H). 13C NMR(100 MHz, CDCl3): δ 186.61, 158.68, 141.05, 140.92, 136.53, 126.17, 32.15, 31.57, 31.03, 29.89, 22.93, 14.37. M.p.166℃~168℃。 3c 的合成步骤:与 3b 一致,得到白色固体,产 率为 39.3%。 1HNMR(400 MHz, CDCl3): δ 7.98(s, 1H), 7.36(d, 2H, 3JH-H = 4.0 Hz), 6.79(d, 2H,3JH-H = 4.0 Hz), 2.82(t, 4H, 3JH-H = 7.6 Hz), 1.71 - 1.67(m, 4H), 1.65 - 1.20(m, 60H), 0.90 - 0.86(m, 6H). 13C NMR(100 MHz, CDCl3): δ 186.59, 158.66, 141.03, 140.91, 136.51, 129.69, 126.15, 32.16, 31.58, 31.03, 29.94, 22.94, 14.37. M.p.149℃~151℃。 2.2.6. 目标分子 4a-4c 的合成 4a 的合成步骤:该步骤可参考文献 11 可以得到 0.61 g 橘红色固体产物,产率为 62.0%。1H NMR(400 MHz, CDCl3): δ 9.81(s, 1H, Ph), 7.69(d, 2H, 3JH-H = 3.7 Hz, Th-H-3), 6.98(dt, 2 H, 3JH-H = 3.6, 4JH-H = 0.8 Hz, Th-CH-4), 2.94(t, 4H, 3JH-H = 7.6 Hz, CH2), 1.54 - 1.43(m, 4H, CH2), 1.40 - 1.32(m, 8H, CH2), 1.31 - 1.21(m, 6H, CH3); 13C NMR(100 MHz, CDCl3): δ 152.24, 151.93, 136.09, 130.66, 126.31, 125.64, 31.82, 30.66, 29.92, 29.12, 22.83, 14.33; HRMS-ESI m/z: [M + H] calcd. For C50H63N4S4, 847.3936; found, 847.3930. M. p. 193℃~195℃[11]。 4b 的合成步骤:干燥体系后,在氮气条件下,将 3b(0.5 g, 0.42 mmol)和水合肼(0.17 g, 3.36 mmol)置于 乙醇(50 ml)中,在常温下搅拌过夜后通大气,加热回 流搅拌 12 h,悬浊液颜色逐渐变为橙黄色。旋蒸除去 溶剂,直接得到0.45 g 黄色固体,产率为 90.5%。1H NMR(400 MHz, CDCl3): δ 9.85(s, 1H, Ph), 7.71(d, 2H, 3JH-H = 3.7Hz, Th-H-3), 6.97(d, 2 H, 3JH-H = 3.7, Th-CH-4), 2.89(d, 4H, 3JH-H = 6.8 Hz, CH2), 1.75 - 1.69(m, 4H, CH2), 1.77 - 1.27(m, 36H, CH2), 0.90 - 0.85(m, 6H, CH3); 13C NMR(100 MHz, CDCl3): δ 152.32, 151.00, 136.07, 130.68, 126.40, 125.70, 32.16, 31.92, 30.69, 29.93, 29.85, 29.69, 29.60, 29.49, 22.93, 14.37. HRMS-ESI m/z: [M + Na] calcd. For C74H110 N4S4, 1205.7511; found, 1205.7529.M. p. 153℃~15 5℃。 4c 的合成步骤:与 4b 一致,得到橙色固体,产 率为 86.3%。1H NMR(400 MHz, CDCl3): δ 9.84(s, 1H, Ph), 7.71(d, 2H, 3JH-H = 3.8 Hz, Th-H-3), 6.99(d, 2H, 3JH-H = 3.8, Th-CH-4), 2.95(t, 4H, 3JH-H = 7.6 Hz, CH2), 1.84 - 1.80(m, 4H, CH2), 1.64 - 1.25(m, 60H, CH2), 0.89 - 0.85(m, 4H, CH3);由于不溶于 CDCl3未得到 13C NMR 图谱。HRMS-ESI m/z: [M+H] calcd. For C98H158N4S4, 1520.1448; found, 1520.1515. M.p. 124℃~ 126℃。 3. 目标分子的紫外–可见吸收光谱表征 从化合物 4a-4c的紫外–可见吸收光谱中可以发 现,这 3种烷基增长的化合物在 260~600 nm均存在 三个最大吸收峰:462 nm,363 nm,299 nm。其中可 见光区 462 nm左右出现的很强的最大吸收峰是由分 子内 D(donor)-A(acceptor) 共轭结构引起的电子转移 [7]。从图3中看到,分子4a-4c 的最大吸收峰的摩尔 消光系数都在跃迁范围内的104 M−1·cm−1数量级,并 且从 4a-4c 的紫外–可见吸收光谱中可以发现:尽管 烷基链取代基的增长了,这并不会影响化合物在吸收 峰上大的变化。 4. 结果与讨论 本文设计并实施了一种简单、高效合成硫氮掺杂 有机共轭小分子的制备策略,并且通过引入不同长度 烷基链来改变分子的物理性质。根据所获结果做出如 下总结:1) 目标化合物在甲苯、二氯甲烷和四氢呋喃 Copyright © 2013 Hanspub 103  新型含硫氮杂原子有机共轭小分子的合成 Copyright © 2013 Hanspub 104 Figure 3. The UV-visible absorption spectra of 4a-4c in dichloro- methane (1 × 10−5 M) 图3. 化合物 4a-4c在二氯甲烷溶液(1 × 10−5 M) 的紫外–可见吸收光谱 等常用溶剂中都具有较高溶解度,相对来讲,当烷基 链的长度从 6个碳增加到 18碳的过程中,烷基链越 长目标化合物在二氯甲烷中的溶解度会有所降低:在 2 ml二氯甲烷溶液中最大可溶4a-4c 的质量分别为: 20 mg, 12 mg, 6 mg;2) 随着烷基链的增长,重要中间 体易于结晶,其纯化手段可以重结晶方法为主;3) 相 对于烷基链为6个碳原子的目标分子来讲,烷基链为 12 和18 个碳原子的分子的产率较高,副反应较少; 4) 随着烷基链长度的增加,目标分子的颜色由橙红色 变为淡黄色,分子的熔点依次下降;5) 该类化合物具 备良好的光学吸收性,在460 nm左右可见光区有很 大的吸收,烷基链的增长对化合物的紫外–可见吸收 光谱影响不大。总之,根据本文研究发现烷基链对有 机共轭分子的多种物理性质有显著影响。 参考文献(References) [1] L. Schmidt-Mende, A. Fechtenkötter, K. Müllen, et al. Self-or- ganized discotic liquid crystals for high-efficiency organic pho- tovoltaics. Science, 2001, 293(5532): 1119-1122 [2] F. R. Tverskoy, A. Peters, H. J. Himmel and U. H. F. Bunz. An efficient synthesis of tetraazapentacenes. Angewandte Chemie International Edition, 2011, 50(15): 3557-3560. [3] Z. Liang, Q. Tang, R. Mao, D. Liu, J. Xu and Q. Miao. The posi- tion of nitrogen in N-heteropentacenes matters. Advanced Mate- rials, 2011, 23(46): 5514-5518. [4] 王洪宇, 彭波, 韦玮. 含苝酰亚胺衍生物太阳电池材[J]. 化 学进展(Progress in Chemistry), 2008, 20(11): 1751-1760. [5] A. Rao, M. W. B. Wilson, J. M. Hodgkiss, et al. Exciton fission and charge generation via triplet excitons in pentacene/C60 bilay- ers. Journal of the American Chemical Society, 2010, 132(36): 12698-12703. [6] F. Zhang, D. Wu, Y. Xu, et al. Thiophene-based conjugated oli- gomers for organic solar cells. Journal of Materials Chemistry, 2011, 21(44): 17590-17600. [7] R. P. Ortiz, J. Casado, V. Hernandez, et al. Thiophene-diazine molecular semiconductors: Synthesis, structural, electrochemical, optical, and electronic structural properties; Implementation in organic field-effect transistors. Chemistry—A European Journal, 2009, 15: 5023-5039. [8] R. H. L. Kiebooms, P. J. A. Adriaensens, D. J. M. Vanderzande, et al. Grignard reactions on ortho dicarboxylic arene derivatives. Synthesis of 1,3-dithienylisothianaphthene compounds. The Jour- nal of Organic Chemistry, 1997, 62(5): 1473-1480. [9] C. J. Wharton, R. Wrigglesworth. Synthesis and reactions of 2,3- dihydro-oxazolo[2,3-a]isoindol-5(9bH)-ones. Journal of the Che- mical Society, Perkin Transactions, 1985, 1: 809-813. [10] A. J. Zucchero, P. L. McGrier and U. H. F. Bunz. Cross-conju- gated cruciform fluorophores. Accounts of Chemical Research, 2009, 43(3): 397-408. [11] Y. Liu, F. Zhang, C. He, et al. Efficient synthesis and physical properties of novel H-shaped 2,3,7,8-tetraazaanthracene-based conjugated molecules. Chemical Communications, 2012, 48(35): 4166-4168. |