 Advances in Environmental Protection 环境保护前沿, 2013, 3, 25-27 http://dx.doi.org/10.12677/aep.2013.32004 Published Online June 2013 (http://www.hanspub.org/journal/aep.html) Toxicity of Oil Polluted Water on Wheat (Triticum aestivum)* Yaning Li1, Wei Liu1, Chun Chen2, Guodong Li1# 1Department of Environmental Science and Engineering, Nankai University Binhai College, Tianjin 2Key Laboratory of Production Environment and Agro-Product Safety of Ministry of Agriculture/Tianjin Key Laboratory of Agro-Environment and Agro-Product Safety, Agro-Environmental Protection Institute of Ministry of Agriculture, Tianjin Email: #gd_liww@126.com Received: Feb. 22nd, 2013; revised: Mar. 21st, 2013; accepted: Mar. 30th, 2013 Copyright © 2013 Yaning Li et al. This is an open access article distributed under the Creative Commons Attribution License, which permits unre- stricted use, distribution, and reproduction in any medium, provided the original work is properly cited. Abstract: The toxic effects of oil polluted water on the content of CHL and the superoxide dismutases (SOD) activity of wheat (Triticum aestivum) were examined in this study. The results indicated that after the 7-day exposure, the CHL content in wheat leaves among all the treatments was significantly (P < 0.01) decreased compared with the control. And it decreased as the oil polluted water concentrations increased. On the contrary, the SOD activity in wheat leaves was induced significantly (P < 0.01). Furthermore, the SOD activity increased with the increasing oil polluted water con- centrations. These results indicated that both the CHL content and SOD activity could be recognized as good bio- markers for evaluating the effects of oil polluted water exposure. Keywords: Oil Polluted Water; Wheat (Triticum aestivum); Chlorophyll (CHL); Superoxide Dismutases (SOD) 石油污染水对小麦的毒性胁迫* 李亚宁 1,刘 伟1,陈 春2,李国东 1# 1南开大学滨海学院环境科学与工程系,天津 2农业部环境保护科研监测所,农业部产地环境与农产品安全重点开放实验室/天津农业环境与农产品安全重点开放实验室,天津 Email: #gd_liww@126.com 收稿日期:2013 年2月22 日;修回日期:2013年3月21日;录用日期:2013年3月30日 摘 要:为了探明石油污染水的毒理效应,通过实验室人工控制毒理实验,研究了石油污染水暴露对小麦叶片 叶绿素(CHL)和超氧化物歧化酶(SOD)活性的影响。结果显示:染毒 7 d 后,各浓度组小麦叶片的CHL 含量均被 显著(P < 0.01)抑制,并随着石油污染水稀释程度的降低而逐渐降低。相反小麦叶片的 SOD 酶活性被显著(P < 0.01) 诱导,但是,同样随着石油污染水稀释程度的降低,而呈现逐渐降低的趋势。综上,CHL 和SOD 均可作为石 油污染水对植物毒理效应影响的生物标志物。 关键词:石油污染水;小麦(Triticum aestivum);叶绿素(CHL);超氧化物歧化酶(SOD) 1. 引言 近年来,伴随着我国经济的快速发展和对能源需 求的增加,石油的应用范围越来越广,消耗量也日趋 增大。在原油的开采、加工以及运输过程中,由于工 艺水平和处理技术的限制,大量含石油类物质的污水 不可避免地排入水体,随之产生的环境污染问题也越 来越严重。石油在水环境中的大量存在对水体生态系 统造成了严重的危害,并可直接通过鱼类等水生生物 或是间接通过污水灌溉进入庄稼等陆生植物,进而进 *基金项目:南开大学滨海学院科研启动金项目;稀土催化剂新产 品研发项目。 #通讯作者。 Copyright © 2013 Hanspub 25  石油污染水对小麦的毒性胁迫 入食物链,危害人类的生活与生存[1]。 高等植物是生态系统的基本组成部分,在污染胁 迫下其生长状况可反映生态系统的健康水平。小麦是 陆生生态系统的重要环节,又是人类重要的食物之 一,已经被广泛用于生态毒理效应方面的研究[2]。目 前,以小麦作为模式生物,探索具代表性的石油污染 水对陆生生物的生态毒理效应尚未见报导,并且污染 物对农作物的生态毒性也是人们关注的热点之一,为 此本文探讨了石油污染水胁迫对小麦幼苗的叶绿素 (CHL)以及超氧化物歧化酶(SOD) 活性变化的影响,以 期得到更为全面的毒理学数据[3]。 2. 材料和方法 2.1. 仪器与试剂 Hettich 32R低温高速冷冻离心机(德国Hettich 公 司),TU-1901 双光束紫外可见分光光度计(北京普析 通用仪器有限责任公司)。石油污染水采自中海油的海 上采油平台。L-甲硫氨酸、氯化硝基四氮唑蓝、核黄 素均购自 Sigma公司,纯度在 97%~99%之间,其他 酶反应试剂均为分析纯。 2.2. 实验方法 于直径 90 mm 的培养皿中放入 2层滤纸,并用去 离子水润湿,此过程要避免气泡产生。加入经稀释的 石油污染水溶液,挑选籽粒饱满的小麦种子置于基质 表面,放置种子时,保持种子凹面朝下,且种子胚根 末端和生长方向呈一直线,每个培养皿中放置 10 粒 种子[4]。稀释倍数分别为 1000、1500、2000,同时设 空白对照,每个浓度 3次重复。将小麦置于光照恒温 培养箱中25℃ ± 1℃下培养,7 d后采样。 2.3. CHL含量测定 按照 Hegedüs 等[5]提出的经典方法测定小麦 CHL 含量,单位为mg·g−1鲜重。 2.4. 酶液提取 培养结束后,称取 0.5 g左右小麦叶片,以 1:10 的比例加入 50 mM pH 7.8磷酸缓冲溶液 5 mL。研磨 匀浆后,4℃下 15,000 r·min−1离心 15 min,上清液用 于酶活性的测定。 2.5. SOD活性测定 采用氮蓝四唑光化还原法[6]。以每单位时间内抑 制光化还原 50%的氮蓝四唑为 1个酶活力单位。 2.6. 数据处理 试验结果采用SPSS 统计软件进行分析,用平均 数±标准偏差表示。用 One-Way ANOVA 对组间的数 据进行差异显著性分析,P < 0.05 表明差异显著,P < 0.01 表明差异极显著,P > 0.05 表明差异不显著。 3. 结果与讨论 3.1. 石油污染水对小麦叶片 CHL 含量的影响 染毒 7 d 后,小麦叶片的CHL 含量变化如图 1所 示,随着石油污染水稀释程度的降低,小麦叶片中 CHL 的含量逐渐降低。当稀释1500 和1000 倍时,小 麦叶片中 CHL 的含量显著低于对照组。而稀释 2000 倍时,小麦叶片的 CHL含量降低并不显著。由此可 见,小麦叶片的 CHL含量对石油污染水的毒性反应 比较敏感,并呈现一定的剂量–效应关系。 植物叶绿素含量与光合作用密切相关,是植物生 理生化及生态调查中的一个重要测量参数。因为光合 作用是植物生产的原动力,任何影响植物生理活动的 因素必然影响光合作用过程,叶绿素含量是影响光合 作用的物质基础,其变化必然影响植株的正常发育[7]。 从四溴双酚-A 的毒性效应研究获得的结果证明 CHL 含量的降低可以作为小麦受到污染胁迫后生长受到 损伤的指示[3]。本研究的结论同样证明了这一点。随 着石油污染水稀释度的降低,CHL含量显著降低。小 麦叶片中叶绿素含量的高低取决于叶绿素合成与降 解的动态平衡。在本研究中叶绿素的生物合成出现了 障碍,影响了叶绿素的合成,从而引起叶绿素含量的 降低[8]。 3.2. 石油污染水对小麦叶片 SOD 活性的影响 由图 2可以看出,经过 7 d的暴露,随着石油污 染水稀释程度的降低,小麦叶片的 SOD活性也呈现 逐渐降低的趋势。但是与对照组相比,各处理组 SOD 活性均被显著诱导,稀释倍数为 2000 时SOD 的活性 诱导达到最大,约为对照组的 1.7 倍,此时,小麦体 内产生了大量的活性氧自由基,SOD 作为这些氧化性 Copyright © 2013 Hanspub 26 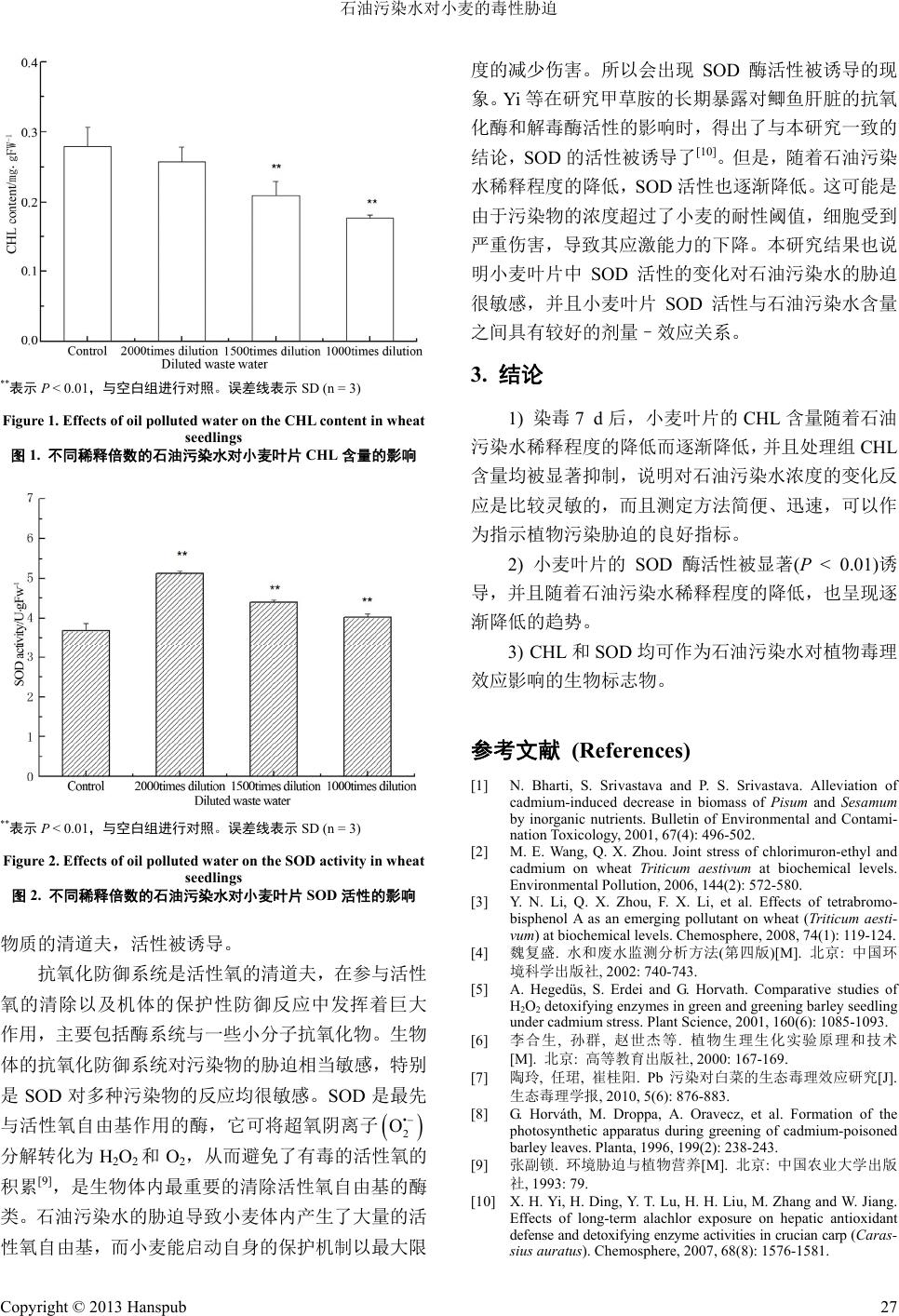 石油污染水对小麦的毒性胁迫 Copyright © 2013 Hanspub 27 度的减少伤害。所以会出现 SOD酶活性被诱导的现 象。Yi 等在研究甲草胺的长期暴露对鲫鱼肝脏的抗氧 化酶和解毒酶活性的影响时,得出了与本研究一致的 结论,SOD的活性被诱导了[10]。但是,随着石油污染 水稀释程度的降低,SOD 活性也逐渐降低。这可能是 由于污染物的浓度超过了小麦的耐性阈值,细胞受到 严重伤害,导致其应激能力的下降。本研究结果也说 明小麦叶片中 SOD 活性的变化对石油污染水的胁迫 很敏感,并且小麦叶片 SOD 活性与石油污染水含量 之间具有较好的剂量–效应关系。 3. 结论 **表示 P < 0.01,与空白组进行对照。误差线表示SD (n = 3) 1) 染毒 7 d后,小麦叶片的 CHL 含量随着石油 污染水稀释程度的降低而逐渐降低,并且处理组 CHL 含量均被显著抑制,说明对石油污染水浓度的变化反 应是比较灵敏的,而且测定方法简便、迅速,可以作 为指示植物污染胁迫的良好指标。 Figure 1. Effects of oil polluted water on the CHL content in wheat seedlings 图1. 不同稀释倍数的石油污染水对小麦叶片CHL含量的影响 2) 小麦叶片的SOD 酶活性被显著(P < 0.01)诱 导,并且随着石油污染水稀释程度的降低,也呈现逐 渐降低的趋势。 3) CHL和SOD 均可作为石油污染水对植物毒理 效应影响的生物标志物。 参考文献 (References) [1] N. Bharti, S. Srivastava and P. S. Srivastava. Alleviation of cadmium-induced decrease in biomass of Pisum and Sesamum by inorganic nutrients. Bulletin of Environmental and Contami- nation Toxicology, 2001, 67(4): 496-502. **表示 P < 0.01,与空白组进行对照。误差线表示SD (n = 3) [2] M. E. Wang, Q. X. Zhou. Joint stress of chlorimuron-ethyl and cadmium on wheat Triticum aestivum at biochemical levels. Environmental Pollution, 2006, 144(2): 572-580. Figure 2. Effects of oil polluted water on the SOD activity in wheat seedlings 图2. 不同稀释倍数的石油污染水对小麦叶片 SOD活性的影响 [3] Y . N. Li, Q. X. Zhou, F. X. Li, et al. Effects of tetrabromo- bisphenol A as an emerging pollutant on wheat (Triticum aesti- vum) at biochemical levels. Chemosphere, 2008, 74(1): 119-124. 物质的清道夫,活性被诱导。 [4] 魏复盛. 水和废水监测分析方法(第四版)[M]. 北京: 中国环 境科学出版社, 2002: 740-743. 抗氧化防御系统是活性氧的清道夫,在参与活性 氧的清除以及机体的保护性防御反应中发挥着巨大 作用,主要包括酶系统与一些小分子抗氧化物。生物 体的抗氧化防御系统对污染物的胁迫相当敏感,特别 是SOD 对多种污染物的反应均很敏感。SOD 是最先 与活性氧自由基作用的酶,它 可将超 氧阴离 子 [5] A. Hegedüs, S. Erdei and G. Horvath. Comparative studies of H2O2 detoxifying enzymes in green and greening barley seedling under cadmium stress. Plant Science, 2001, 160(6): 1085-1093. [6] 李合生, 孙群, 赵世杰等. 植物生理生化实验 原理和技术 [M]. 北京: 高等教育出版社, 2000: 167-169. [7] 陶玲, 任珺, 崔桂阳. Pb污染对白菜的生态毒理效应研究[J]. 生态毒理学报, 2010, 5(6): 876-883. [8] G. Horváth, M. Droppa, A. Oravecz, et al. Formation of the photosynthetic apparatus during greening of cadmium-poisoned barley leaves. Planta, 1996, 199(2): 238-243. • 2 O 分解转化为 H2O2和O2,从而避免了有毒的活性氧的 积累[9],是生物体内最重要的清除活性氧自由基的酶 类。石油污染水的胁迫导致小麦体内产生了大量的活 氧自由基,而小麦能启动自身的保护机制以最大限 [9] 张副锁. 环境胁迫与植物营养[M]. 北京: 中国农业大学出版 社, 1993: 79. [10] X. H. Yi, H. Ding, Y. T. Lu, H. H. Liu, M. Zhang and W. Jiang. Effects of long-term alachlor exposure on hepatic antioxidant defense and detoxifying enzyme activities in crucian carp (Caras- sius auratus). Chemosphere, 2007, 68(8): 1576-1581. 性 |