Advances in Analytical Chemistry
Vol.07 No.02(2017), Article ID:20727,8
pages
10.12677/AAC.2017.72018
Determination of IAA and ABA in Plant Tissue by the GPC-HPLC/MS/MS
Liu Yang1, Shuai Liu1, Zongyi Wang2, Qingqin Cao3, Jianli Wang1, Yu Xing1, Ling Qin1*
1Beijing Key Laboratory of New Technology in Agricultural Application, College of Plant Science and Technology, Beijing University of Agriculture, Beijing
2Beijing Key Laboratory of Safety Detection and Control on Harmful Microbes and Pesticide Residues in Agricultural Products, Beijing University of Agriculture, Beijing
3College of Biological Science and Engineering, Beijing University of Agriculture, Beijing Collaborative Innovation Center for Eco-Environmental Improvement with Forestry and Fruit Trees, Beijing University of Agriculture, Beijing
*通讯作者。

Received: May 8th, 2017; accepted: May 24th, 2017; published: May 27th, 2017

ABSTRACT
The effectiveness and efficiency of the plant hormone detection is a prerequisite for plant research. The sample was purified with the GPC system, and the method employed HPLC-MS/MS for multiple reaction monitoring of concentrations of IAA, ABA, and deuterated IAA and ABA analogs. The condition of extraction and purification of hormones were optimized by orthogonal design. The results show that the composite of 0.5 g samples, 80% methanol extraction solvent, concentration temperature 35˚C and C18 cartridge column for solid-phase extraction (SPE), were optimal extraction procedure for each type of plant tissue. The contents of IAA and ABA as high as 20.34 ng/g and 789.3 ng/g were achieved by this method, respectively; the detectable limits were 2.36 ng/g and 31.95 ng/g; the recoveries were 70.43% and 80.17%; the RSD were 1.87% and 2.26%.
Keywords:Liquid Chromatography-Mass Spectrometry, Purifying-Quantitative-Concentrated More Online System, Internal Standard Method, Indole-3-Acetic, Abscisic Acid
GPC-HPLC-MS/MS测定植物组织中IAA与ABA的方法
杨柳1,刘帅1,王宗义2,曹庆芹3,王建立1,邢宇1,秦岭1*
1农业应用新技术北京市重点实验室·北京农学院植物科学技术学院,北京
2农产品有害微生物及农药残留检测与控制北京市重点实验室,北京
3北京农学院生物科学与工程学院·北京林果业生态环境功能提升协同创新中心,北京

收稿日期:2017年5月8日;录用日期:2017年5月24日;发布日期:2017年5月27日

摘 要
植物激素检测的有效性和高效性是开展植物研究的前提。本试验采用净化-定量-浓缩多联机系统(GPC)纯化样品、利用HPLC-MS/MS检测以及内标法定量测定植物组织内源IAA和ABA含量。通过正交试验设计优化适于激素提取和纯化的条件,结果表明:取样量0.5 g、80%甲醇提取液、浓缩温度35℃和C18 SPE柱为最优组合。IAA和ABA的含量分别为20.34 ng/g和789.93 ng/g;最低检出限分别为2.36 ng/g和31.95 ng/g;回收率为70.43%和80.17%;变异系数分别为1.87%和2.26%。
关键词 :液相色谱-质谱联用仪(HPLC-MS/MS),净化-定量-浓缩多联机系统(GPC),内标法,吲哚乙酸,脱落酸

Copyright © 2017 by authors and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY).
http://creativecommons.org/licenses/by/4.0/


1. 引言
IAA和ABA是植物体中两种重要的激素,许多研究都涉及到含量的测定,因此建立合理实用的定量分析方法,对研究植物的生长发育具有重要意义。植物激素测定首要工作是从植物材料中将激素充分提取出来,选择提取溶剂尤为重要,常用的有甲醇、丙酮、丙醇及其水溶液。甲醇由于分子量小,渗透性较强,在提取过程中可以渗透到细胞中,被广泛地用于植物激素的提取(Barkawi, 2008) [1] 。植物粗提物中含有大量的植物次生代谢产物,为了降低或消除其干扰,需对激素进行纯化和富集,常用的萃取方式有液相萃取和固相萃取。目前在线SPE/凝胶净化/定量浓缩多联机系统(GPC)的产生,完善了提取纯化过程,曾见于植物体中农药的残留(王耀, 2011) [2] 、土壤及食品中有毒物质(魏冬旭, 2009) [3] 的前处理过程,在植物激素测定的方法中未见报道。
目前植物内源激素的分析方法主要有放射免疫法(RIA)、酶联免疫法(ELISA)、气相色谱(GC),高效液相色谱法(HPLC)、气质联用法(GC-MS)和液质联用法(LC-MS)等。RIA具有较高的灵敏度,可以检测出微量物质,但是需要放射性同位素,由于同位素的不稳定以及对操作人身体的影响,RIA现已很少使用。ELISA (Ross, 2004) [4] 是用某些酶对免疫原(激素)进行标记,避免使用放射性物质,具有很高的灵敏度和安全性,但是植物激素提取物中含有同系物、前体、类似物等,使免疫分析法的特异性降低、重复性较差。GC分析速度快,可用于分析测定所有的植物激素,但是待测激素必须形成易挥发的衍生物,衍生过程繁琐并且具有一定的危险性。HPLC用于分析检测除乙烯外的所有植物激素,其结果准确性和灵敏度较高,与GC相比前处理简单,对所测激素结构无破坏,但是HPLC所采用的紫外和荧光检测器,不能满足超低含量植物激素定性定量分析的要求。LC-MS在很大程度上克服了传统色谱技术在植物激素定性和定量分析方面的不足(Vilaró, 2006) [5] 、(Zhang, 2008) [6] ,不需目标物衍生处理,操作简便,而且灵敏度高、选择性和特异性好(Cao, 2006) [7] 。
现在的测定方法仍存在流程繁琐、费时长、杂质含量高等问题,本试验根据正交试验设计,在GPC系统处理后,LC-MS/MS进行测定,并利用同位素(D5-IAA,D6-ABA)内标法定量。本试验目的在于,使植物组织内源激素的提取纯化过程自动化、批量化,节省时间并减少人为因素的干扰,为研究植物内源激素的测定提供方法。
2. 材料与方法
2.1. 材料
试材选自怀柔板栗试验站种植的燕山红栗(Castanea mollissima)雄花序及坚果、北京农学院科技园实验基地种植的海棠(Malus spectabilis)果实、草莓(Fragaria × ananassa)叶片及果实,放入液氮中冷冻,然后置于−80℃冰箱保存,用于激素测定。
2.2. 仪器
高效液相色谱-质谱联用仪(Agilent1200型液相色谱仪-Agilent 6410型串联四极杆质谱);净化-定量-浓缩多联机系统GPC (LCTech, GmbH);离心机(SIGMA, 3K15)。
2.3. 试剂
IAA内标(Toronto Research Chemicals Inc, D5-IAA);ABA内标(Toronto Research Chemicals Inc, D6-ABA);C18柱(Cleanert S C18-SPE, 500 mg/3mL);阴离子交换柱(Cleanert SAX-SPE, 500 mg/3mL);纤维素柱(Agilent Bond Elut-Cellulose, 500 mg/3mL);二乙基二硫代氨基甲酸钠(BHJ);交联聚乙烯吡咯烷酮(PVPP);甲醇(色谱纯);超纯水为实验室提供;氨水、盐酸和醋酸均为分析纯。
2.4. 试验设计
采用L9(34)3水平4因素的正交试验设计方法,样品量选2.0、1.0、0.5 g,提取液甲醇浓度选0%、80%、70%,浓缩温度选35℃、40℃、35℃,固相萃取柱选取C18、阴离子交换、纤维素柱(见表1)。
2.5. 样品制备
对Vine的方法(Vine, 1987) [8] 进行改进,应用在线SPE/凝胶净化/定量浓缩多联机系统辅助处理样品,具体流程如图1所示。
2.5. 色谱条件
色谱柱:ZORBAX SB-C18柱:3.5 um,2.1 mm × 150 mm;流速:0.3 mL/min;柱温:30℃;进样量:5 uL;流动相A,水(0.1%乙酸水溶液),流动相B,甲醇;梯度洗脱:0 min,90% A;5 min,25% A;8 min,50% A;10 min,35% A;13 min,90% A。
2.6. 质谱条件
ESI离子源,正负离子检测方式,MRM模式。离子源条件为干燥气温度(gas temp) 350℃,干燥气流量(gas flow) 10 L/min,雾化器压力(nebulizer) 20 psi,毛细管电压(capillary),4000 V,最优碎裂电压(frag)均为105 V,最优碰撞能量(CE)为30 V。
Table 1. L9(34) orthogonal design of experiment table 3 level 4 factors
表1. L9(34) 3水平4因素的正交试验设计表
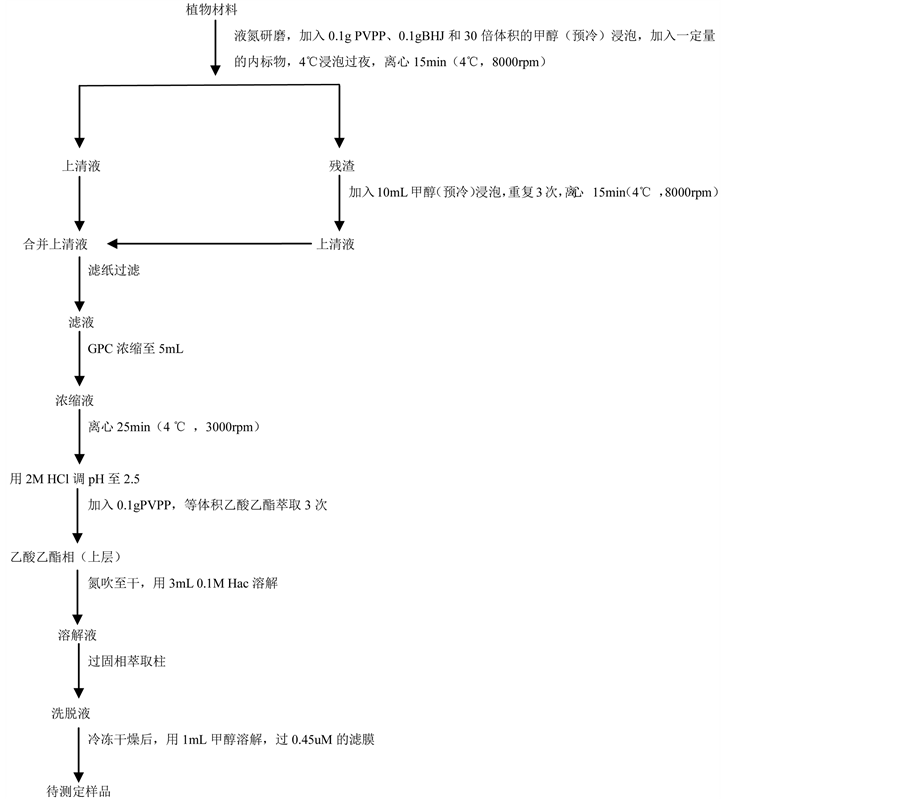
Figure 1. Plant hormone extraction and purification steps
图1. 植物激素提取和纯化步骤
2.7. 净化-定量-浓缩多联机系统条件
2.7.1. 浓缩条件
水加热温度(Temperature water heating):35℃;浓缩枪底部温度(Temperature bottom cone):35℃;吸液速度(Suction speed):20 ml/min;定容溶液(Constant volume solution):超纯水。
2.7.2. 固相萃取条件
吸液速度(Suction speed):20 ml/min;加样速度(Dispending speed):20 ml/min;甲醇和0.1M醋酸对SPE柱进行活化、洗柱和洗脱。
2.8. IAA与ABA含量的计算
对得到的内源激素与内标物的峰面积,应用内标法按照以下公式计算内源激素ABA、IAA的浓度,试验结果使用Excel2007和SPSS软件进行数据处理和统计分析。
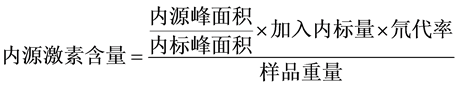
式中: ,D5-IAA的加入量为100 ng,氘代率为98%;
,D5-IAA的加入量为100 ng,氘代率为98%;
 ,D6-ABA的加入量为500 ng,氘代率为100%。
,D6-ABA的加入量为500 ng,氘代率为100%。
3. 结果与讨论
3.1. 特征离子的选择
选择IAA和ABA的特征离子,选择m/z为176、263的两个离子为IAA和ABA的定量离子,选择m/z为130、215的两个碎片离子为IAA和ABA的定性离子,如表2所示。
3.2. 标样与样品的全谱图
在设定的色谱条件下,IAA和ABA能与其他成分很好地分离。从图2中可以看出,标样IAA、D5-IAA、ABA和D6-ABA保留时间分别为:9.089 min,9.123 min,9.514 min,9.539 min。样品中IAA、D5-IAA、ABA和D6-ABA的保留时间与标样一致。
3.3. 提取纯化条件筛选
以板栗果实为实验试材,通过L9(34)3水平4因素正交试验设计,在不同处理条件下得到板栗果实中IAA、ABA的含量(表3)。对表3中数据进行极差分析,各因素对IAA提取纯化的影响程度依次为:固相萃取柱 > 浓缩温度 > 取样量 > 溶剂浓度,即固相萃取柱对IAA提取纯化的影响程度最大,选择三种固相萃取柱,分别是纤维素柱、阴离子交换柱和C18柱,这三种柱子适合吸附pH为2~3的物质,纯化效果依次为C18 > 阴离子交换柱 > 纤维素柱,使用纤维素柱未能检测到IAA。考察各因子水平值发现,IAA最适的提取纯化条件为:固相萃取柱以第一水平C18为最优、浓缩温度以第三水平35℃为最优、取样量以第三水平0.50g为最优、甲醇浓度以第二水平80%为最优。各因素对ABA提取纯化的影响程度依次为:取样量 > 固相萃取柱 > 浓缩温度 > 溶剂浓度,即取样量对ABA提取纯化的影响程度最大。考察各因子水平值,ABA最适的提取纯化条件为:取样量以第三水平0.50 g为最优、固相萃取柱以第一水平C18为最优、浓缩温度以第三水平35℃为最优、甲醇浓度以第二水平80%最优。由此得出,IAA和
Table 2. The choice of ABA, IAA and corresponding internal standard product characteristics of the ions
表2. ABA、IAA及相应内标产物的选择特征离子
Table 3. IAA and ABA content in different processing conditions of chestnut fruit
表3. 不同处理条件板栗果实中IAA、ABA含量
注:表中数值为3次重复测定的平均数±标准误。大写字母表示在0.01水平下差异显著,小写字母表示在0.05水平下差异显著。“—”为未检出。

 (a) (b)注:(a)为IAA和ABA标样及内标的色谱图;(b)为IAA和ABA内标及样品的色谱图
(a) (b)注:(a)为IAA和ABA标样及内标的色谱图;(b)为IAA和ABA内标及样品的色谱图
Figure 2. HPLC chromatogram of chestnut seeds samples and hormone standards
图2. 板栗果实样品及激素标准样的色谱图
ABA最适的提取纯化条件相同,即表3、表4中处理8,取样量为0.50 g、甲醇浓度为80%、固相萃取柱为C18、浓缩温度为35℃。
3.4. 精密度与回收率
采用同位素内标法定量计算回收率,用样品中内标的峰面积与标样的峰面积之比(百分比)为回收率,重复3次,其结果如表4所示,处理8的提取纯化方法有较高的回收率,IAA和ABA的回收率分别为70.43%和80.17%;同时处理8的变异系数较低。此测定方法回收率、符合微量分析要求,说明本方法稳定性较好。
3.5. 方法的应用
3.5.1. 检出限
在处理8的基础上,逐渐降低样品量,分别取0.10 g、0.20 g、0.30 g、0.40 g、0.50 g板栗果实进行IAA和ABA含量的测定。经计算IAA和ABA的最低检出限分别是2.36 ng/g和31.95 ng/g。结果如表5所示,测定结果表明如果单独检测IAA,样品量不低于0.30 g;单独检测ABA,样品量可用0.10 g;两种激素同时测定,最适样品量是0.50 g。
3.5.2. 其它植物器官验证
采用已建立的前处理方法和测定方法,对不同植物器官进行研究。叶选取草莓叶片、花选取板栗雄花序、果实选取聚复果的草莓和仁果的海棠,以优化出的方法(处理8),分别对其进行IAA和ABA含量的测定(表6),从表6可见,可以从这些植物材料中检测出IAA和ABA的含量。
Table 4. Several parameters of endogenous hormone in plant tissue analysis
表4. 植物组织中内源激素分析的若干参数
注:“—”为未检出。
Table 5. Different sample weight chestnut fruit of IAA and ABA content
表5. 不同样品量板栗果实的IAA和ABA含量
注:表中数值为3次重复测定的平均数 ± 标准误。“—”为未检出。
Table 6. Different plant tissues of IAA and ABA content
表6. 不同植物组织的IAA和ABA的含量
注:表中数值为3次重复测定的平均数 ± 标准误。
4. 结论
本试验利用GPC系统的固相萃取(SPE)和定量浓缩(EVA)功能,自动完成SPE净化过程,且EVA由真空、加热、氮吹三位一体构成,三道红外传感器可精确定容,具有多种溶剂转换、蒸发至干、自动稀释、定量转移等功能。采用GPC代替传统旋转蒸发的方式,仪器自动进样、自动浓缩,减少人工换样的过程。采用红外定量浓缩,修正旋蒸中目测液面高度的误差,增加准确性。GPC代替传统的固相萃取过程,浓缩后的样品即可在线进行固相萃取。减少操作过程中的误差,实现了实验的自动化。每24小时可完成36个样品的浓缩,每24小时可以完成24个样品的固相萃取过程。加快了实验进程,实现前处理的批量化。
试验的最低检出限低,测定IAA含量需要0.3 g样品,0.1 g样品即可以完成ABA含量的测定,本方法可以满足少量样品的测定。
基金项目
北京市属高等学校创新团队建设与教师职业发展计划项目(IDHT20140509);农业应用新技术北京市重点实验室2013年度开放课题项目(KF2013002)。
文章引用
杨 柳,刘 帅,王宗义,曹庆芹,王建立,邢 宇,秦 岭. GPC-HPLC-MS/MS测定植物组织中IAA与ABA的方法
Determination of IAA and ABA in Plant Tissue by the GPC-HPLC/MS/MS[J]. 分析化学进展, 2017, 07(02): 131-138. http://dx.doi.org/10.12677/AAC.2017.72018
参考文献 (References)
- 1. Barkawi, L.S.,Tam, Y.Y., Tillman, J.A.,et al. (2008) A High-Throughput Method for the Quantitative Analysis of Indole-3-Acetic Acid and Other Auxins from Plant Tissue. Analytical Biochemistry, 372, 177-188.
- 2. 王耀, 张汉霞, 邹潍力, 等. ASE萃取/GPC-SPE净化/GC-MS法测定茶叶中的有机磷残留[J]. 食品研究与开发, 2011, 31(3): 128-131.
- 3. 魏冬旭, 江连洲, 郭伟, 等. ASE-GPC-GC法测定大豆及豆制品中六六六、滴滴涕农药残留[J]. 食品科学, 2009, 30(24): 351-354.
- 4. Ross, A.R.S., Ambrose, S.J., Cutler, A.J., et al. (2004) Determination of Endog-enous and Supplied Deuterated Abscisic Acid in Plant Tissues by High-Performance Liquid Chromatog-raphy-Electrospray Ionization Tandem Mass Spectrometry with Multiple Reaction Monitoring. Analytical Biochemistry, 329, 324-333.
- 5. Vilaró, F., Canela-Xandri, A. and Canela, R. (2006) Quantification of Abscisic Acid in Grapevine Leaf (Vitis Vinifera) by Isotope-Dilution Liquid Chromatography-Mass Spectrometry. Analytical and Bioanalytical Chemistry, 386, 306- 312. https://doi.org/10.1007/s00216-006-0664-2
- 6. Zhang, F.J., Jin, Y.J., Xu, X.Y., et al. (2008) Study on the Extraction, Purification and Quantification of Jasmonic Acid,Abscisic Acid and Indole-3-Acetic Acid in Plants. Phytochemical Analysis, 19, 560-567. https://doi.org/10.1002/pca.1085
- 7. Cao, J., Murch, S.J., O’Brien, R., et al. (2006) Rapid Method for Accurate Analysis of Melatonin, Serotonin and Auxin in Plant Samples Using Liquid Chromatography-Tandem Mass Spectrom-etry. Journal of Chromatography A, 1134, 333-337.
- 8. Vine, J.H., Noiton, D., Plummer, J.A., et al. (1987) Simulta-neous Quantitation of Indole 3-Acetic Acid and Abscisic Acid in Small Samples of Plant Tissue by Gas Chromatog-raphy-Mass Spectrometry/Selected Ion Monitoring. Plant Physiology, 85, 419-422. https://doi.org/10.1104/pp.85.2.419
