 Botanical Research 植物学研究, 2013, 2, 79-86 http://dx.doi.org/10.12677/br.2013.23014 Published Online July 2013 (http://www.hanspub.org/journal/br.html) Analysis of Phenolic Compounds in Developing Seeds of Brassica napus* Yanlin Shao, Yanan Gao, Yueqin Kong, Jinjin Jiang, Youping Wang# College of Bioscience and Biotechnology, Yangzhou University, Jiangsu Yangzhou Email: #wangyp@yzu.edu.cn Received: Apr. 10th, 2013; revised: Apr. 20th, 2013; accepted: May 4th, 2013 Copyright © 2013 Yanlin Shao et al. This is an open access article distributed under the Creative Commons Attribution License, which permits unrestricted use, distribution, and reproduction in any medium, provided the original work is properly cited. Abstract: Phenolics are abundant in seeds of Brassica napus, mainly including hydroxycinnamic acid de- rivatives, proanthocyanidins (PAs) and flavonoid derivatives. Different research methods have been reported by researchers. In this research, both chemical analysis and HPLC-ESI/MS2 analysis were conducted to compare the different compositions of soluble phenolics in embryo and seed coat of B. napus. The extraction parameters were also optimized by comparing single factors like extraction temperature and solvent. And the results showed that room temperature and solvent of 80% acetone yielded the maximum phenolics. Further comparison showed that total phenolics and flavonoids in seed coat were much higher than in embryo of im- mature seeds. Among the identified phenolics, flavonoid and proanthocyanidin in seed coat were higher than in embryo, whereas derivatives of hydroxyl-cinnamic acid were lower accumulated in seed coat than embryo. Sinapine, as the most abundant phenolics, was mainly existed in embryo. And epicatechin was abundant in seed coat, which was well known as the most abundant flavonoids. Keywords: Brassica napus L.; Phenolics; Extraction Efficiency; HPLC-ESI/MS2; Proanthocyanidins; Flavonoids 甘蓝型油菜未成熟种子多酚的研究* 邵彦林,高亚楠,孔月琴,蒋金金,王幼平# 扬州大学生物科学与技术学院,扬州 Email: #wangyp@yzu.edu.cn 收稿日期:2013 年4月10 日;修回日期:2013 年4月20 日;录用日期:2013 年5月4日 摘 要:甘蓝型油菜种子含有大量的多酚物质,主要是羟基苯丙烯酸衍生物、原花色素和类黄酮衍生 物,不同研究者对多酚物质的研究方法各异。本文使用化学分析和HPLC-ESI/MS2分析,首先研究了 不同溶液在不同温度下对油菜籽多酚物质萃取效率的影响,发现 80%的丙酮水溶液在室温条件下对油 菜籽多酚的萃取效率最高。进一步对未成熟种子种皮和胚多酚物质进行研究,发现总酚和总类黄酮含 量种皮明显高于胚。多酚物质中,种皮类黄酮和原花色素的含量要高于胚,但羟基苯丙烯酸衍生物的 含量要低于胚。芥子碱是油菜籽中含量最丰富的多酚物质,主要存在于胚当中。而表儿茶素是含量最 丰富的类黄酮物质,主要存在于种皮当中。 关键词:甘蓝型油菜;多酚物质;萃取效率;HPLC-ESI/MS2;原花色素;类黄酮 *基金项目:国家自然科学基金(31171581)和高等学校博士学科点专项科研项目(20123250110009)资助。 #通讯作者。 Copyright © 2013 Hanspub 79  甘蓝型油菜未成熟种子多酚的研究 Copyright © 2013 Hanspub 80 1. 引言 甘蓝型油菜(Brassica napus L.)是重要的油料作 物,面积仅次于大豆[1]。油菜饼粕是重要的蛋白质来 源,可作为动物饲料,含有大量氨基酸、蛋白质和糖 类,但同时也含有大量的多酚物质,多酚物质的存在 会导致油菜种皮变黑,油菜饼粕具有苦味和涩味,从 而影响油菜饼粕的营养价值[2]。油菜种子中存在的羟 基苯丙烯酸衍生物主要有芥子酸、芥子碱、阿魏酸和 咖啡酸等,以及它们形成的糖苷[3-5]。原花色素是由黄 烷醇类物质通过碳–碳键相连聚合而成的低聚体和 多聚体,油菜中的原花色素都是由表儿茶素聚合而来 [6],我们实验室 Jiang 等[7]发现油菜籽中的可溶性原花 色素主要是表儿茶素的二聚体和三聚体。类黄酮是一 类植物次生代谢产物,一般具有抗氧化活性、抗致癌 性和抗诱变作用[8-10]。油菜籽中常见的类黄酮主要有 黄酮醇类和黄烷醇类。黄酮醇类(主要是槲皮素、山萘 酚和异鼠李素)主要以糖基化和酰基化的衍生物存在。 连接的糖主要是葡萄糖和槐糖,连接的酰基主要是芥 子酰、阿魏酰和咖啡酰等[6,11]。黄烷醇类主要是表儿 茶素,它们比较特殊,一般不会形成糖苷,单体分子 常常聚合形成种皮中的主要色素相关物质——原花 色素[12]。此外,油菜籽中还含有其它一些多酚物质, 如没食子酸、原儿茶酸和羟基苯甲酸等[13]。 对于植物组织多酚物质的提取,不同植物使用不 同的溶剂和温度。如Jasinski等[14]使用80%甲醇水溶 液在室温条件下提取蒺藜苜蓿叶片中的类黄酮,Nie 等[15]使用 80%的乙醇水溶液在80℃条件下提取桑树 叶片的总类黄酮,Sarina等[16]使用80%丙酮水溶液在 室温条件下提取金缕梅叶片的总酚,Augar 等[6]使用 甲醇/丙酮/水的混合溶液在 4℃条件下提取发育过程 中油菜种皮的类黄酮物质,而刘秦等[5]使用甲醇水溶 液在室温条件下提取成熟油菜籽多酚物质。不同的萃 取溶液和萃取温度都会影响多酚物质的萃取效率,因 此寻找合适的萃取溶液和萃取温度对于油菜籽多酚 物质的研究十分重要。 为了选育多酚含量低的优质油菜,需要对种子胚 和种皮中多酚物质的含量和种类进行分析。目前对于 油菜种子胚和种皮多酚的研究大多集中在成熟种子 (去皮油菜饼粕和籽壳),但成熟种子多酚物质往往和 蛋白、多糖等结合形成不溶性物质[17],这对成熟种子 多酚物质的萃取和研究带来一定的困难。Auger 等[6] 首次研究了黑籽油菜发育过程中种皮原花色素和类 黄酮含量的变化。本文首先通过对油菜籽多酚物质萃 取条件进行比较研究,通过化学分析法和 HPLC-ESI/ MS2分析法,研究了未成熟油菜种子胚和种皮多酚物 质的组成差异。 2. 材料和方法 2.1. 实验材料 将甘蓝型油菜“扬油 6号”(黑籽)种植在扬州大 学实验田中,授粉 5周后采集角果(Jiang 等[7]的研究 结果表明授粉 5周后的油菜籽总酚含量达到最大,并 且这一时期种皮与胚的分离较为容易),每株采集 3~5 个角果,手工剥离种子,准确称量1 g 种子(湿重种子)。 2.2. 化学试剂 甲醇、乙醇、丙酮、碳酸钠、单宁酸、氢氧化钠、 亚硝酸钠和六水合氯化铝均为分析纯,购自上海生工 生物工程有限公司。Folin-Ciocalteu 试剂、表儿茶素、 Procyanidin B2和异鼠李素-3-O-葡萄糖苷购自美国 Sigma 公司。甲酸、乙氰为色谱纯,购自美国Tedia 公司。水为Milli-Q 系统纯化的水。 2.3. 实验方法 2.3.1. 样品多酚物质的提取 多酚物质的提取参考 Auger 等[6]的方法略有改 动。取准确称量的 1 g样品置于研钵中,研磨5 min 后加入 5 mL萃取溶液(分别为:80%的甲醇水溶液、 80%的乙醇水溶液、80% 的丙酮水溶液和甲醇/丙酮/ 水(40:40:20, v/v/v),在特定温度下(室温和80℃水浴) 超声波裂解 15 min。然后室温离心(19,000 g, 5 min)并 收集上清,将沉淀重悬于5 mL上述溶液中,放置在 摇床上 25℃过夜(200 rpm),然后再次室温离心(19,000 g, 5 min),合并 2次上清液,氮吹除去有机溶剂,用 水定溶至4 mL(以下称为多酚物质提取液),储存在 −70℃待测。每个样品重复 3次。为了研究超声裂解 温度对萃取效率的影响,不同溶液的超声裂解分别在 2种不同温度(室温和 80℃水浴)条件下进行。为了研 究未成熟种子种皮和胚多酚物质的差异,分别取 1 g 分离的种皮和胚,提取各自的多酚物质。  甘蓝型油菜未成熟种子多酚的研究 2.3.2. 可溶性总酚含量的测定 多酚萃取液中总酚含量的测定使用 Folin-Cio- calteu 分析法,参考 Eynck 等[18]的方法略有改动。取 上述多酚物质提取液 100 μL,加入 300 μL的水和 400 μL的Folin-Ciocalteu 试剂,室温反应3 min后加入 400 μL (1 mol/L)的碳酸钠水溶液,震荡、混匀,室温放置 45 min,然后取上述反应溶液 1 mL,用水稀释 10倍, 使用 752型紫外可见分光光度计在 725 nm下测定吸 光度。用单宁酸做标准曲线,求出每克湿重种子所含 可溶性总酚的毫克数,可溶性总酚的含量用等量的单 宁酸表示。 2.3.3. 可溶性总类黄酮含量的测定 可溶性总类黄酮含量的测定参考Faudale等[19]的 方法。取 1 mL的多酚物质提取液加入5 mL的水和 0.3 mL 5%的亚硝酸钠水溶液,室温反应 6 min,然后 加入 0.6 mL 10%的六水氯化铝水溶液,室温反应 5 min,最后加入 2 mL(1 mol·L−1)的氢氧化钠水溶液, 用水定溶至 10 mL,用752 型紫外可见分光光度计在 510 nm 下立即测定吸光度。用表儿茶素标准品做标准 曲线,求出每克湿重种子所含可溶性总类黄酮的毫克 数,可溶性总类黄酮的含量用等量的表儿茶素表示。 2.3.4. HPL C-ESI/MS 2分析 Table 1. The chromatographic elution gradient 表1. 色谱洗脱梯度 时间(min) T(min) 流动相 A(%) Mobile phase A(%) 流动相 B(%) Mobile phase B(%) 0 94 4 40 80 20 60 65 35 61 0 100 76 0 100 77 94 4 86 96 4 性多酚物质首先在全扫描模式下检测,为了进一步确 定化合物的结构,挑选特定质荷比的离子进行二级质 谱分析,碰撞气为氮气,根据分子大小设置碰撞电压 在15~40 V 之间。仪器控制软件为 Agilent Masshunter Workstation Data Acquisition,数据分析软件为 Agilent Masshunter Qualitative Analysis。化合物分子离子峰 ([M−H]−和[M+H]+)提取离子色谱图(EIC)的峰面积被 用作定量分析。为了比较种皮多酚物质和胚多酚物质 含量的差异,求出每克湿重种皮所含多酚和胚多酚的 微克数。 3. 结果与分析 3.1. 不同溶剂和不同温度对油菜种子多酚物质 萃取效率的影响 在HPLC-ESI/MS2分析前先将提取液用聚四氟乙 烯滤膜(0.45 μm)过滤。高效液相色谱仪为 Agilent 1200,色谱仪包括在线脱气装置(G1322A)、级联泵 (G1311A)、自动进样器(G1329A) 和DAD 检测装置 (G1315D)。10 μL样品通过 C18 保护柱(2.0 × 4 mm, 3.5 μm;Phenomenex)在XB-C18 色谱柱(2.1 × 150 mm, 3.5 μm; Welch, Ultimate)中进行分离。流速为 0.3 mL·min−1, 柱温箱为30℃,DAD检测波段为 190~800 nm。流动 相A为0.1%的甲酸水溶液,流动相B为0.1%的甲酸 乙氰溶液。洗脱梯度见表 1。 本实验设计了 2个不同温度,即室温和 80℃,在 每个温度段都进行了 4种溶液萃取效率的比较。从图 1可以看出,在室温条件下,丙酮水溶液对油菜种子 多酚物质的萃取效率要明显高于甲醇和乙醇的水溶 液,萃取效率略低于混合溶液。而在 80℃条件下,丙 酮水溶液的萃取效率明显高于其它 3种溶液。而对于 种子类黄酮的萃取,无论是在室温条件还是在 80℃条 件,丙酮水溶液的萃取效率都明显高于其它 3种溶液 的萃取效率(图1(b))。在 高温(80℃)条件下,丙酮水溶 液对总酚和总类黄酮的萃取效率都有所增加,但甲 醇、乙醇和混合溶液的萃取效率反而降低。太高的温 度有可能会导致类黄酮等多酚物质的氧化,反而会降 低萃取效率;同时,高温条件下有机溶剂的挥发也是 一个不能忽略的问题。 质谱分析仪使用Agilent 6460三重串联四级杆质 谱仪,离子源为电喷雾离子源(ESI),在正负离子模式 下检测。仪器参数如下:干燥气温度为 300℃,干燥 气流量为10 L·min−1,雾化器压力为 15 psi,鞘气(使 用N2作为鞘气)流速为 7 L·min−1,鞘气温度为 250℃, 毛细管电压为4000 V,喷雾电压为 500 V,全扫描质 荷比(m/z)在90~2000范围,扫描时间为 500 ms。可 溶 在室温条件下,丙酮水溶液的萃取效率明显高于 Copyright © 2013 Hanspub 81 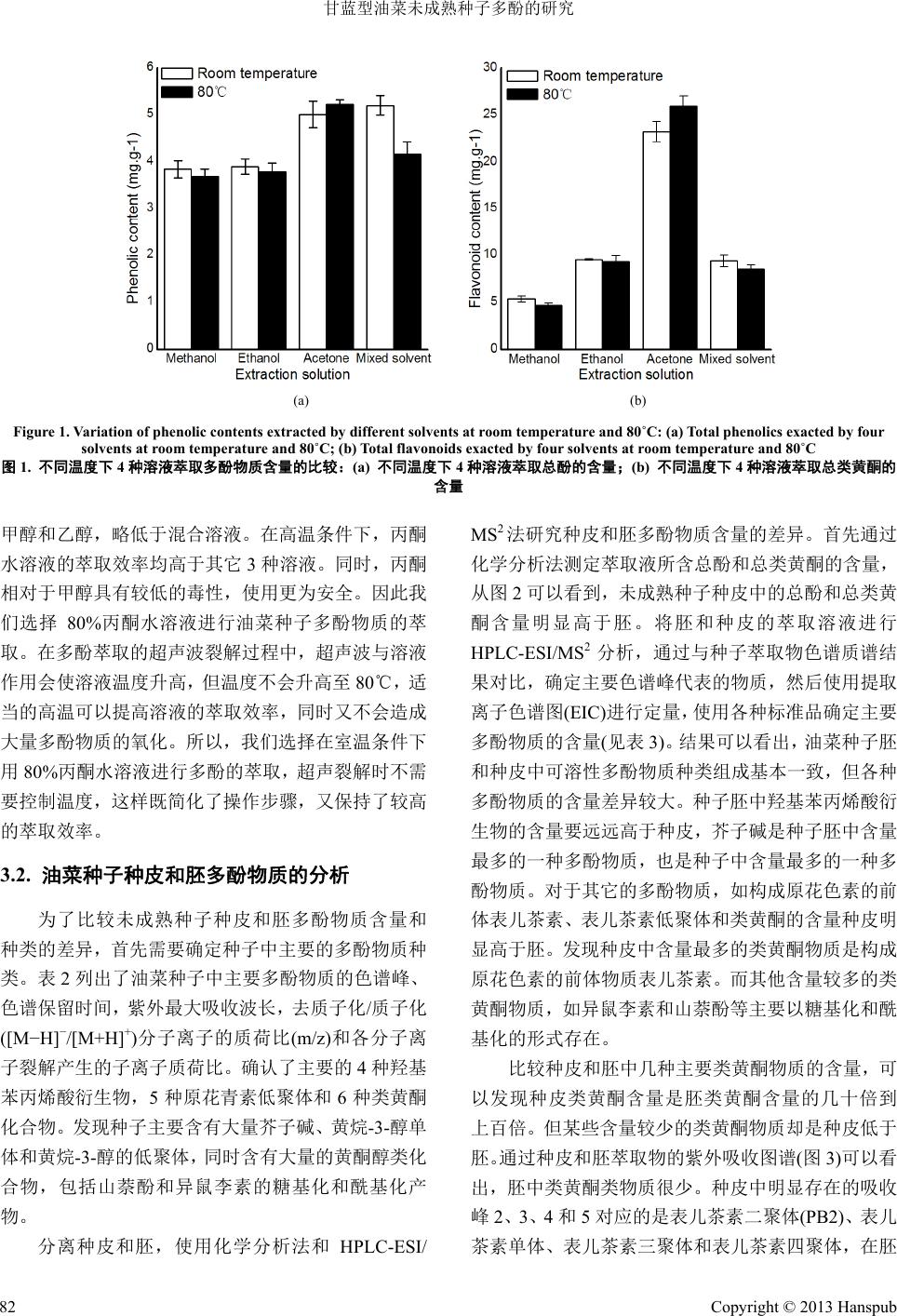 甘蓝型油菜未成熟种子多酚的研究 Copyright © 2013 Hanspub 82 (a) (b) Figure 1. Variation of phenolic contents ex tracted by different solvents at room temperature and 80˚C: (a) Total phenolics exacted by four solvents at room temperature and 80˚C; (b) Total flavonoids exacted by four solvents at room temperatu re and 80˚C 图1. 不同温度下 4种溶液萃取多酚物质含量的比较:(a) 不同温度下 4种溶液萃取总酚的含量;(b) 不同温度下 4种溶液萃取总类黄酮的 含量 甲醇和乙醇,略低于混合溶液。在高温条件下,丙酮 水溶液的萃取效率均高于其它 3种溶液。同时,丙酮 相对于甲醇具有较低的毒性,使用更为安全。因此我 们选择 80%丙酮水溶液进行油菜种子多酚物质的萃 取。在多酚萃取的超声波裂解过程中,超声波与溶液 作用会使溶液温度升高,但温度不会升高至80℃,适 当的高温可以提高溶液的萃取效率,同时又不会造成 大量多酚物质的氧化。所以,我们选择在室温条件下 用80%丙酮水溶液进行多酚的萃取,超声裂解时不需 要控制温度,这样既简化了操作步骤,又保持了较高 的萃取效率。 3.2. 油菜种子种皮和胚多酚物质的分析 为了比较未成熟种子种皮和胚多酚物质含量和 种类的差异,首先需要确定种子中主要的多酚物质种 类。表 2列出了油菜种子中主要多酚物质的色谱峰、 色谱保留时间,紫外最大吸收波长,去质子化/质子化 ([M−H]−/[M+H]+)分子离子的质荷比(m/z)和各分子离 子裂解产生的子离子质荷比。确认了主要的 4种羟基 苯丙烯酸衍生物,5种原花青素低聚体和 6种类黄酮 化合物。发现种子主要含有大量芥子碱、黄烷-3-醇单 体和黄烷-3-醇的低聚体,同时含有大量的黄酮醇类化 合物,包括山萘酚和异鼠李素的糖基化和酰基化产 物。 分离种皮和胚,使用化学分析法和 HPLC-ESI/ MS2法研究种皮和胚多酚物质含量的差异。首先通过 化学分析法测定萃取液所含总酚和总类黄酮的含量, 从图 2可以看到,未成熟种子种皮中的总酚和总类黄 酮含量明显高于胚。将胚和种皮的萃取溶液进行 HPLC-ESI/MS2分析,通过与种子萃取物色 谱质谱 结 果对比,确定主要色谱峰代表的物质,然后使用提取 离子色谱图(EIC)进行定量,使用各种标准品确定主要 多酚物质的含量(见表3)。结果可以看出,油菜种子胚 和种皮中可溶性多酚物质种类组成基本一致,但各种 多酚物质的含量差异较大。种子胚中羟基苯丙烯酸衍 生物的含量要远远高于种皮,芥子碱是种子胚中含量 最多的一种多酚物质,也是种子中含量最多的一种多 酚物质。对于其它的多酚物质,如构成原花色素的前 体表儿茶素、表儿茶素低聚体和类黄酮的含量种皮明 显高于胚。发现种皮中含量最多的类黄酮物质是构成 原花色素的前体物质表儿茶素。而其他含量较多的类 黄酮物质,如异鼠李素和山萘酚等主要以糖基化和酰 基化的形式存在。 比较种皮和胚中几种主要类黄酮物质的含量,可 以发现种皮类黄酮含量是胚类黄酮含量的几十倍到 上百倍。但某些含量较少的类黄酮物质却是种皮低于 胚。通过种皮和胚萃取物的紫外吸收图谱(图3)可以看 出,胚中类黄酮类物质很少。种皮中明显存在的吸收 峰2、3、4和5对应的是表儿茶素二聚体(PB2)、表 儿 茶素单体、表儿茶素三聚体和表儿茶素四聚体,在胚  甘蓝型油菜未成熟种子多酚的研究 Table 2. Main phenolic compounds identified by HPLC-ESI/MS2 analysis in seeds of B. napus 表2. HPLC-ESI /M S2分析油菜种子萃取物确定的主要多酚物质 分子离子质荷比 (m/z) Mass spectrum (m/z) 紫外峰 Peak 化合物名称 Compound names 保留时间 (min) Rt(min) 最大紫外 吸收波长(nm) UV(nm) [M−H]− [M+H]+ 子离子质荷比(m/z) MS2 [M−H]− (m/z) 子离子质荷比(m/z) MS2 [M+H]+ (m/z) 1 芥子碱 21.601 240, 330 310.2 - 119,175, 207,251 2 Procyanidin B2 23.405 202, 280 577 407, 289, 425, 451, 125 - 3 表儿茶素 25.772 204, 217, 280 289 203, 109, 245, 205, 125, 151 - 4 表儿茶素三聚体 29.602 202, 281 865.3 577, 695, 424, 287, 451, 739 - 5 表儿茶素四聚体 31.405 202, 281 1153.4 287, 414, 125, 577, 983 - - 顺是芥子酸 33.126 - 223 149, 193, 121, 164, 207 - 8 异鼠李素二己糖苷 34.144 202, 269, 350 639.2 315, 477 - - 山奈酚二己糖苷 35.643 - 609 319, 429, 284 - - 反式芥子酸 36.001 - 223 149, 193, 121, 164, 207 - - 山奈酚芥子 酰三己糖苷 37.164 - 977 653, 285, 477, 191, 353, 815 - - 异鼠李素芥子 酰三己糖苷 37.773 - 1007 477, 315, 683, 353, 845 - 15 Procyanidin B5 39.294 202, 281 577 407, 424, 289, 451 - 17 表儿茶素三聚体 40.120 202, 281 865.3 587, 287, 695, 407, 451, 739 - - 异鼠李素己 糖苷硫酸酯 40.772 - 557 477, 315 - - 1,2-二芥子酰葡萄糖 51.595 - 591.2 223, 367, 205 - Figure 2. Content of total phenolics and total flavonoids in seed coat and embryo 图2. 种皮和胚中总酚与总类黄酮的含量 Copyright © 2013 Hanspub 83  甘蓝型油菜未成熟种子多酚的研究 Table 3. The content of phenoli c compounds in embryo and seed coat of Brassica napus 表3. 多酚物质在胚和种皮中的含量 酚类化合物 Phenolic compounds 种皮中含量(μg·g−1) Seed coat content(μg·g−1) 胚中含量(μg·g−1) Embryo content(μg·g−1) 芥子碱 427.56 ± 221.37 3368.64 ± 204.96 顺式芥子酸 1.47 ± 0.12 1.59 ± 0.51 反式芥子酸 8.34 ± 2.37 21.03 ± 3.93 1,2-二芥子酰葡萄糖 2.13 ± 0.24 10.98 ± 0.66 表儿茶素 1448.85 ± 100.62 83.97 ± 12.57 表儿茶素二聚体(PB2) 414.21 ± 4.23 4.53 ± 1.23 表儿茶素三聚体(保留时间短) 325.95 ± 16.02 10.29 ± 4.77 表儿茶素四聚体 107.04 ± 16.86 3.9 ± 0.75 表儿茶素三聚体(保留时间长) 62.16 ± 13.83 3.51 ± 1.83 表儿茶素二聚体(PB5) 91.47 ± 1.71 4.98 ± 2.97 异鼠李素二己糖苷 58.77 ± 9.75 4.62 ± 0.69 山奈酚芥子酰三己糖苷 3.48 ± 0.24 11.43 ± 0.81 异鼠李素芥子酰三己糖苷 6.57 ± 1.65 1.29 ± 1.11 山奈酚二己糖苷 1.71 ± 0.3 59.73 ± 2.97 异鼠李素己糖硫酸酯 55.47 ± 14.25 1.59 ± 0.36 Figure 3. UV chromatogram of soluble phenolics in seed coat and embryo: (a) UV chromatogram of soluble phenolics in seed coat; (b) UV chroma- togram of s ol uble phenolics in embryo 图3. 种皮和胚可溶性多酚物质的紫外吸收图谱:(a) 种皮可溶性多酚物质的紫外吸收图谱;(b) 胚可溶性多酚物质的紫外吸收图谱 中几乎没有这几种物质的紫外吸收,说明这几种物质 在胚中的含量很少。一些未知的色谱峰(6、7、9),通 过DAD 检测、二级质谱分析,初步确定为类黄酮的 紫外吸收特性(图4),它们在 202 nm和280 nm处都 有强的紫外吸收峰。这些物质在种皮中大量存在,但 在胚中含量很少。胚中大量存在的芥子碱对应紫外吸 衍生物,例如6、7和9三个峰都有典型的原花色素收峰 1,可以看到种皮中相应保留时间的吸收峰很小。 Copyright © 2013 Hanspub 84  甘蓝型油菜未成熟种子多酚的研究 190 200 210 220 230 240 250 260 270 280 290 300 310 320 0 200 400 600 800 1000 1200 mUV Wavelength (nm) 6 9 PB2 7 Figure 4. UV absorption characteristics of chrom a tograms of chemical 6, 7, 9 and Procyanidin B2 (PB2) 图4. 色谱峰 6、7、9及标准品 Procyanidin B2(PB2)的紫外吸收特性 以上实验结 量和总类黄酮种皮明显高于胚,未成熟种子中不同 的多 4. 结论 剂和不同温度对甘蓝型油菜未成熟 进行比较,获得了 80%丙酮水溶液在室 温条 [1] R. Scarth, J. Tang. Modification of Brassica oil using conven- idi, M. Naczk. An overview of the phenolics of canola y and nutritional implications. Society, 1992, 69: 917-924. [3] 何兰, 姜志宏. 天然产物资源化学[M]. 北京: 科学出版社, isolate: Characterization of sinapic acid derivates d apus L.). Food Chemistry, 2012, 135(2): 616- ping seeds of Brassica na- . Flavonoid profiling and gene expression in developing ntion with natural compounds. Seminar in Oncol- n and antioxi- eissenbock and J. F. Bornman. Dif- 715. 果表明,授粉5周后的油菜种子总酚 参考文献 (References) 含 酚物质在种皮和胚中的分布存在很大差异。种皮 中存在的主要是类黄酮和原花色素,并且含量远远高 于胚中的含量,其中含量最高的是表儿茶素。胚中主 要存在的是羟基苯丙烯酸衍生物,其中含量最多的芥 子碱也是种子中含量最多的多酚物质。因此,我们在 分析发育过程中油菜种子色素合成相关物质(类黄酮 和原花色素)的含量与种类变化时,没必要进行种皮与 胚的剥离,这样不仅避免了类黄酮物质氧化和流失, 也能缩短实验流程。但在测定种子多酚物质总含量和 芥子碱含量时,不能忽略种皮多酚物质和芥子碱的存 在,因为它们在种皮中也有一定量的存在。 通过不同溶 种子萃取效率 件下超声裂解萃取多酚物质为最优萃取条件。通 过获得的最优萃取条件,研究了油菜种子发育过程中 种皮和胚多酚物质的差异。发现发育过程中的油菜种 皮总酚和总类黄酮含量高于胚。通过色谱分离的优 化,使用 HPLC-ESI/MS2分析,得出类黄酮和原花色 素的含量种皮高于胚,但羟基苯丙烯酸衍生物的含量 低于胚。 tional and transgenic approaches. Crop Science, 2006, 46(3): 1225-1236. [2] F. Shah apand reseed: Chemical, sensor Journal of American Oil Chemists 2008: 340-372. [4] U. Thiyam, P. Claudia, U. Jan and B. Alfred. De-oiled rapeseed and a protein by HPLC-DAD and LC-MS. European Food Research and Technology, 2009, 229(5): 825-831. [5] Q. Liu, L. Wu, H. M. Pu, C. Y. Li and Q, H. Hu. Profile an distribution of soluble and insoluble phenolics in Chinese rape- seed (Brassica n 622. [6] B. Auger, N. Marnet, V. Gautier, A. Maia-Grondard, F. Leprince, M. Renard, S. Guyot, N. Nesi and R. Jean-Marc. A detailed sur- vey of seed coat flavonoids in develo pus L. Journal of Agriculture and Food Chemistry, 2010, 58(10): 6246-6256. [7] J. J. Jiang, Y. L. Shao, A. M. Li, C. L. Lu, Y. T. Zhang and Y. P. Wang seeds of yellow- and black-seeded Brassica napus. Journal of Integrative Plant Biology, 2013, 55(6): 537-551. [8] N. P. Gullett, A. R. Ruhul, S. Bayraktar, J. M. Pezzuto, D. M. Shin, F. R. Khuri, B. B. Aggarwal, Y. J. Surh and O. Kucuk. Cancer preve ogy, 2010, 37(3): 258-281. [9] F. Ferreres, C. Sousa, P. Valentao, R. M. Seabra, J. A. Pereira and P. B. Andrade. Tronchuda cabbage (Brassica oleracea L. var. costata DC) seeds: Phytochemical characterizatio dant potential. Food Chemistry, 2007, 101(2): 549-558. [10] C. A. Williams, R. J. Grayer. Anthocyanins and other flavonoids. Natural Product Reports, 2004, 21(4): 539-573. [11] L. C. Olsson, M. Veit, G. W ferential flavonoid response to enhanced UV-B radiation in Brassica napus. Phytochemistry, 1998, 49(4): 1021-1028. [12] F. Sosulski. Organoleptic and nutritional effects of phenolics. Jour- nal of American Oil Chemists Society, 1979, 56(8): 711- Copyright © 2013 Hanspub 85  甘蓝型油菜未成熟种子多酚的研究 [13] A. Frolov, A. Henning and C. Bottcher. An UPLC-MS/MS me- thod for simultaneous identification and quantitation of cell wall nd M. extraction from mul- . Koopmann P. P. Karlovsky and A. V. Tiedemann. mistry, 2008, 56(6): 1912-1920. phenolics in Brassica napus seeds. Journal of Agriculture and Food Chemistry, 2013, 61(6): 1219-1227. [14] M. Jasinski, P. Kachlicki, P. Rodziewicz, M. Figlerowicz a Stobiecki. Changes in the profile of flavonoid accumulation in Medicago truncatula leaves during infection with fungal patho- In gen Phoma medicaginis. Plant Physiology and Biochemistry, 2009, 47(9): 847-853. [15] K. Nie, Z. H. Tang, X. Wu, X. N. Xu, Y. Z. Liang, H. Li and L. Q. Rao. Optimization of total flavonoids berry leaf using an ethanol-based solvent system. Journal of Me- dicinal Plants Research, 2012, 6(12): 2373-2380. [16] M. D. Sarina, C. S. Florian. Investigation on the phenolic consti- tuents in Hamamelis virginiana leaves by HPLC-DAD and LC- MS/MS. Analytical and Bioanalytical Chemistry, 2011, 401(2): 677-688. [17] M. Naczk, R. Amarowicz, D. Pink and F. Shahidi. Insoluble tannins of canola/rapeseed. Journal of Agriculture and Food Che- mistry, 2000, 48(5): 1758-1762. [18] C. Eynck, B ternal resistance in winter oilseed rape inhibits systemic spread of the vascular pathogen Verticillium longisporum. Phytopa- thology, 2009, 99(7): 802-811. [19] M. Faudale, F. Viladomat, J. Bastida, F. Poli and C. Codina. Antioxidant activity and phenolic composition of wild, edible, and medicinal fennel from different mediterranean countries. Jour- nal of Agriculture and Food Che Copyright © 2013 Hanspub 86 |