 Advances in Environmental Protection 环境保护前沿, 2013, 3, 111-114 http://dx.doi.org/10.12677/aep.2013.34019 Published Online October 2013 (http://www.hanspub.org/journal/aep.html) Analysis and Investigation of Benzoic Acid in Food* Xiaoyu Li, Na Jiang, Shongtao Niu, Hui Wang, Guanghao Li# Dalian Nationalities University, Dalian Email: #lghao@dlnu.edu.cn Received: Jul. 4th, 2013; revised: Aug. 2nd, 2013; accepted: Aug. 10th, 2013 Copyright © 2013 Xiaoyu Li et al. This is an open access article distributed under the Creative Commons Attribution License, which permits unre- stricted use, distribution, and reproduction in any medium, provided the original work is properly cited. Abstract: In the paper, based on the situations nowadays, with the common preservative-benzoic acid as the inspection object and ginseng extract/ginseng beard as raw material, the content of benzoic was detected rapidly by means of solid phase extraction-HPLC. The optimal chromatographical conditions to detect benzoic in ginseng extract and ginseng beard were confirmed. The analytical method of solid phase extraction-HPLC to detect benzoic acid in ginseng extract and ginseng beard was investigated. The linear relationship was satisfying with the correlation coefficient ≥ 0.9994, and the detection limit of this method was 0.039 µg/mL, which meets the requirement of the inspection of benzoic acid con- tent in ginseng extract and ginseng beard. Keywords: Food; Preservatives; Benzoic Acid 食品中防腐剂苯甲酸的研究与分析* 李小玉,姜 娜,牛松涛,王 慧,李光浩# 大连民族学院,大连 Email: #lghao@dlnu.edu.cn 收稿日期:2013 年7月4日;修回日期:2013年8月2日;录用日期:2013年8月10日 摘 要:本文以目前最常用的防腐剂——苯甲酸作为检测对象,运用固相萃取–高效液相色谱–质谱联用法对 苯甲酸进行定量定性的快速分析研究。实验确定了检测食品防腐剂苯甲酸的最佳色谱条件,并用于实际样品人 参膏及人参须中苯甲酸的分析检测。苯甲酸分离效果较好,线性关系良好,相关系数 ≥ 0.9994,其检出限为 0.039 µg/mL,能够满足食品防腐剂苯甲酸含量检测的要求。 关键词:食品;防腐剂;苯甲酸 1. 引言 随着防腐剂使用过量的情况日益严重,由此引发 的食品安全问题受到了人们的越来越广泛的关注[1-3]。 因此发展可靠、快速及灵敏的防腐剂检测技术,对于 保证人类健康有着极其重大的意义,也成为环境监测 和食品检验的重要研究课题。 食品防腐剂是指为食品防腐和食品加工、储运的 需要,加入食品中的化学合成物质或天然物质,以防 止食品因微生物引起的腐败变质,使食品在一般的自 然环境中具有一定的保存期。苯甲酸及苯甲酸钠是我 国目前使用最广泛的防腐剂,其防腐机理是苯甲酸进 入细胞体内电离酸化细胞内的碱储,并抑制细胞的呼 吸酶系的活性,阻止乙酰辅酶 A缩合反应,从而达到 食品防腐的目的。但超量的苯甲酸具有一定的毒性, 应限量使用。 *基金项目:国家级大学生创新创业训练计划项目资助。 #通讯作者。 Copyright © 2013 Hanspub 111  食品中防腐剂苯甲酸的研究与分析 目前,检测防腐剂苯甲酸的方法主要有分光光度 法、薄层色谱法[4]、毛细管电泳[5]、气相气谱法[6]、高 效液相色谱法[7]等。分光光度法和薄层色谱法所用的 分析时间长、准确度差;毛细管电泳法尚没有得到普 及。本文主要研究建立了固相萃取–高效液相色谱– 质谱联用的苯甲酸定量定性分析方法,并通过该方法 对实际人参膏样品中苯甲酸进行了检验。实验结果表 明,该方法具有分离效果好、回收率高、操作简单、 快速等特点,完全能够满足对食品防腐剂苯甲酸检测 的要求。 2. 实验部分 2.1. 实验仪器 高效液相色谱/紫外/质谱仪:LC-20AB 系列,配 有双泵系统、在线真空脱气装置、UV/MS 检测器、5 µL 六通阀进样器以及 CMB-20A 色谱工作站,日本 Shimadzu 公司。 高效液相色谱柱:250 mm × 4.6 mm ID,5 µm C18 填料,配有保护柱,北京艾杰尔科技有限公司。 十二管柱固相萃取装置:固相萃取(SPE)SCX 强 阳离子交换柱。迪马(DIKMA)公司。 离心机:Primo R台式高速冷冻离心机,德国贺 利氏仪器公司。 2.2. 实验试剂 苯甲酸标准品;甲醇;正己烷。色谱纯,美国Fisher 公司。 苯甲酸标准溶液(1000 µg/mL):称取适量苯甲酸 标准品,用无水甲醇配制成 1000 µg/mL标准贮备溶 液,根据需要用色谱级甲醇配制成适合质量浓度的标 准工作溶液。 乙酸铵溶液(0.02 mol/L):称取 0.7710 g 乙酸铵, 用超纯水溶解,定容至 500 mL容量瓶中,使用前用 0.22 µm 微孔滤膜过滤。 超纯水,实验用水均为超纯水仪Milli-Q 制得。 2.3. 实验方法 2.3.1. 仪器工作条件 液相色谱条件:检测波长 225 nm;流动相:(甲 醇:0.02 mol/L乙酸铵为 50%:50%);流动相流速0.5 mL/ m in ;柱温:30℃;进样体积:5 µL。 质谱条件:电子轰击(EI)离子源温度为 250℃;质 量器温度为 200℃;检测器电压 1.50 KV;离子源电 压4.5 KV。使用离子全扫描模式检测,质量扫描范围 是m/z 50~1000,载气为氮气。 2.3.2. 实验方法 在最佳仪器工作条件下测定和绘制 10 µg/m~250 µg/m 标准溶液的工作曲线,并对该方法准确度和精密 度进行测量考察;实际样品分析:称取2.0 克样品冷 干粉碎后加入20 mL 甲醇溶液重复超声溶解两次,每 次30 min。再经 9500 r/min 离心 30 min,取其上清液 10 mL 过固相萃取(SPE)交换柱,最后过 0.22 µm 滤膜 供高效液相色谱–质谱定量定性分析。 20 µg/mL 苯甲酸标准样品的高效液相色谱图以 及质谱图如图1、2所示。 3. 结果与讨论 3.1. 液相色谱条件优化 3.1.1. 流动相的选择 在高效液相色谱中,常用的极性溶剂有甲醇、乙 腈等。分别选择甲醇–水、乙腈–水、甲醇–乙酸铵、 乙腈–乙酸铵为流动相。试验结果表明,甲醇–乙酸 铵作为流动相分离效果和灵敏度最佳。 3.1.2. 流动相流速的选择 流动相流速加大虽然能缩短实验分析时间,但得 不到理想的分离;流速过小会使分析时间加长,也不 能获得理想的峰形。实验研究了 0.2 mL/min、0.5 mL/ m in 、1.0 mL/min 三种流动相流速对分离效果的影 响。从色谱图来看,当流速为 0.5 mL/min 时,样品中 苯甲酸在 8.5 分钟之内达到完全分离,而且能够获得 很好的峰形。 3.2. 固相萃取的选择 3.2.1. 固相萃取柱填料的选择 实验研究比较了不同的固相填料(C18、SCX)的吸 附保留能力。将样品用超声处理并离心后取 10 mL 上 清液分别过C1 8 、SCX 柱富集净化,然后进行液相色 谱分析。同时将样品添加 2.0 µg 苯甲酸的标准样品, 其样品添加回收率。实验结果表明,选定 SCX作 测 Copyright © 2013 Hanspub 112 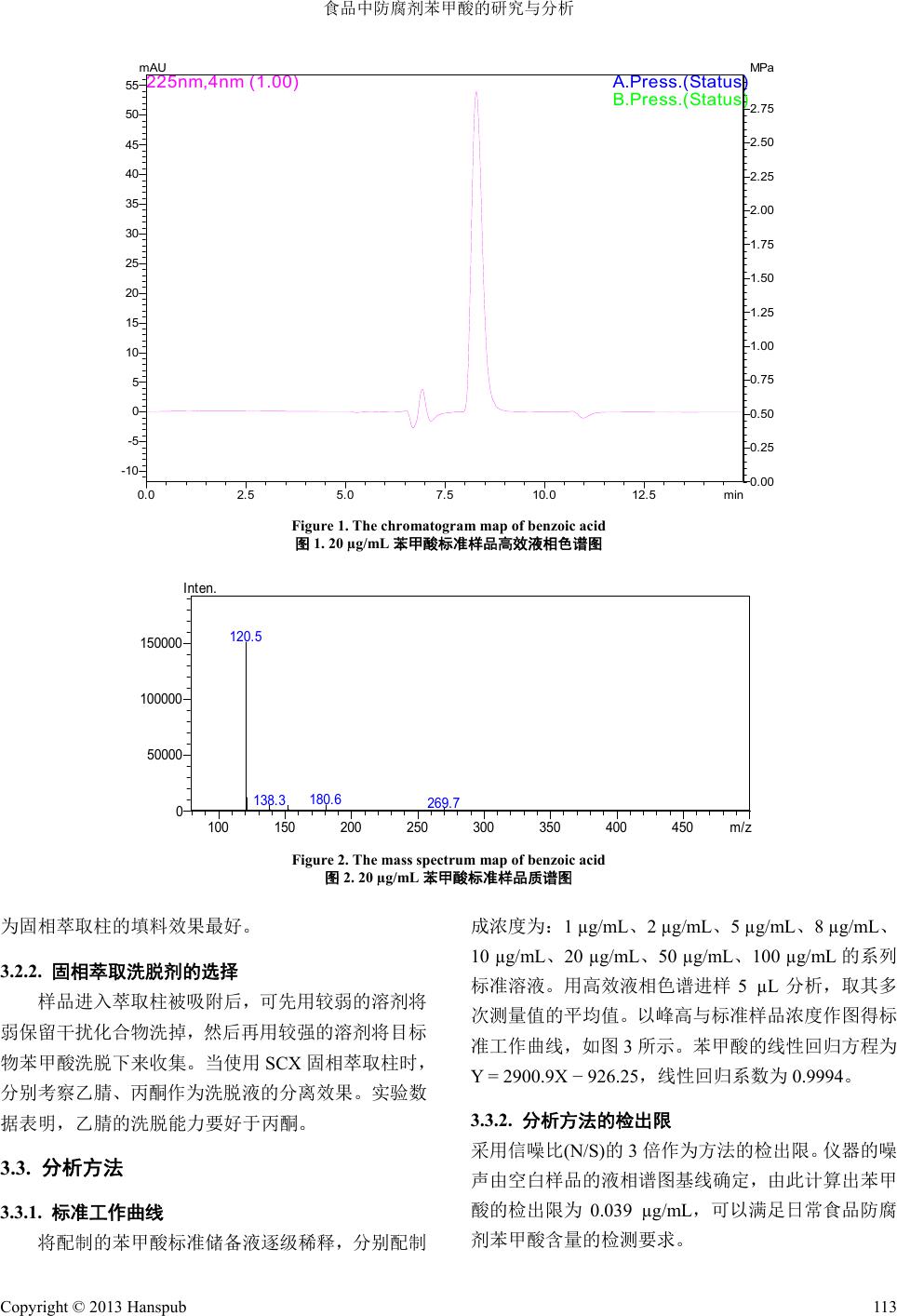 食品中防腐剂苯甲酸的研究与分析 Copyright © 2013 Hanspub 113 0.0 2.5 5.0 7.510.012.5 min -10 -5 0 5 10 15 20 25 30 35 40 45 50 55 mAU 0.00 0.25 0.50 0.75 1.00 1.25 1.50 1.75 2.00 2.25 2.50 2.75 MPa B.Pre ss.( Status) A.Pre ss.( Status) 225nm,4nm (1.00) Figure 1. The chromatogram map of benzoic acid 图1. 20 µg/mL苯甲酸标准样品高效液相色谱图 100 150 200 250 300350 400 450m/z 0 50000 100000 150000 Inten. 120.5 180.6 138.3 269.7 Figure 2. The mass spectrum map of benzoic acid 图2. 20 µg/mL苯甲酸标准样品质谱图 为固相萃取柱的填料效果最好。 3.2.2. 固相萃取洗脱剂的选择 样品进入萃取柱被吸附后,可先用较弱的溶剂将 弱保留干扰化合物洗掉,然后再用较强的溶剂将目标 物苯甲酸洗脱下来收集。当使用 SCX 固相萃取柱时, 分别考察乙腈、丙酮作为洗脱液的分离效果。实验数 据表明,乙腈的洗脱能力要好于丙酮。 3.3. 分析方法 3.3.1. 标准工作曲线 将配制的苯甲酸标准储备液逐级稀释,分别配制 成浓度为:1 µg/mL、2 µg/mL、5 µg/mL、8 µg/mL、 10 µg/mL、20 µg/mL、50 µg/mL、100 µg/mL的系列 标准溶液。用高效液相色谱进样5 µL分析,取其多 次测量值的平均值。以峰高与标准样品浓度作图得标 准工作曲线,如图 3所示。苯甲酸的线性回归方程为 Y = 2900.9X − 926.25,线性回归系数为 0.9994。 3.3.2. 分析方法的检出限 采用信噪比(N/S)的3倍作为方法的检出限。仪器的噪 声由空白样品的液相谱图基线确定,由此计算出苯甲 酸的检出限为 0.039 µg/mL,可以满足日常食品防腐 剂苯甲酸含量的检测要求。  食品中防腐剂苯甲酸的研究与分析 Figure 3. The standard curve of benzoic acid 图3. 苯甲酸标准曲线图 3.3.3. 分析方法的回收率和精密度 取实际样品两份,测定其样品中苯甲酸的含量, 再分别添加 2 µg/g和50 µg/g两个浓度水平的苯甲酸 标准样品检验其分析方法的准确度(回收率)。同时每 个浓度水平重复测定 5次,计算其分析方法的精密度 (RSD)(如表 1)。 4. 实际样品分析 从工厂分别采集成品人参膏、原料人参根须及提 取剂乙醇三种样品,预处理后分别测定三种样品的苯 甲酸含量。结果如表 2所示。 分析结果表明,三种样品中,原料人参须中苯甲 酸含量未检出,而人参膏中检出苯甲酸66.52 µg/g, 同时提取剂乙醇中也有苯甲酸被检出78.33 µg/g,均 已超过国家标准规定的苯甲酸含量(60 µg/g)。由此推 断成品人参膏中苯甲酸含量超标来源于提取剂乙醇 中含有杂质苯甲酸。 5. 结语 本文不但建立了一种快速、简单、准确、灵敏度 的高效液相色谱–质谱法的进出口商品检测防腐剂 苯品,获得了较高的回收率和精密度。同时应用于食 Table 1. Results for precision and recovery of benzoic acid in gin- seng (n = 5) 表1. 人参样品的添加回收率和精密度(n = 5) 样品编号 浓度(µg/mL) 精密度(%) 回收率(%) 2 3.8 91.76 1 50 1.3 97.23 2 2.8 92.57 2 50 1.6 94.98 Table 2. Analytical data of benzoic acid in sample 表2. 人参样品的分析结果 样品 1 (µg/g)2 (µg/g) 3 (µg/g) 平均 (µg/g) 人参膏 65.55 67.75 66.26 66.52 人参根须 0 0 0 0 乙醇 78.45 77.38 79.15 78.33 品样品分析,解析了某市出产的人参膏因防腐剂苯甲 酸含量超标的原因在于提取剂乙醇中含有苯甲酸杂 质,导致产品人参膏中苯甲酸含量超标。 参考文献 (References) [1] M. H. Lee, N. W. Su, M. H. Yang, M. L. Wang and Y. M. Choong. A rapid method for determination of free cholesterol in liquids. Journal of the Chinese Agricultural Chemical Society, 1997, 36: 123-133. [2] M. L. Wang, M. H. Lee. Simple and rapid method for the deter- mination of caffeine in beverages. Journal of the Chinese Agri- cultural Chemical Society, 1995, 33: 114-123. [3] R. Hajkova, P. Solich, M. Pospisilova, et al. Determination of benzoic and sorbic acids in Brazilian food. Analytica Chimica Acta, 2002, 467: 91. [4] M. Thomassin, E. Cavalli, Y. Guillaume, et al. Comparison of quantitative high performance thin layer chromatography and the high performance liquid chromatography of parabens. Jour- nal of Pharmaceutical and Biomedical Analysis, 1997, 15: 831- 838. [5] 方明, 李勇. 饮料、酱菜中苯甲酸含量的高效毛细管电泳检测 方法[J]. 中国食品添加剂, 2005, 8: 156-158. [6] 殷德荣. 毛细管气相色谱法同时测定食品中多种防腐剂[J]. 实用预防医学, 2005, 12(1): 168-171. [7] 邓小锋. 食品中苯甲酸和山梨酸的分离分析[J]. 食品与发酵 工业, 2005, 31(9): 88-90. Copyright © 2013 Hanspub 114 |