 Hans Journal of Medicinal Chemistry药物化学, 2013, 1, 9-13 http://dx.doi.org/10.12677/hjmce.2013.12003 Published Online November 2013 (http://www.hanspub.org/journal/hjmce.html) A Method for Monitoring the Process of Synthetic Reaction of Alfacalcidol by IR and UV Min Wang, Minggang Wa ng Qingdao Chiatai Haier Pharmaceutical Co., Ltd., Qingdao Email: wangmin.zdhr@haier.com, wangmg@haier.com Received: Jul. 9th, 2013; revised: Jul. 23rd, 2013; accepted: Jul. 28th, 2013 Copyright © 2013 Min Wang, Minggang Wang. This is an open access article distributed under the Creative Commons Attribution License, which permits unrestricted use, distribution, and reproduction in any medium, provided the original work is properly cited. Abstract: Objective: This paper is about synthetizing alfacalcidol, monitoring the reaction process and determining the end of the reaction. Method: Monitoring the process of the synthetic reaction of alfacalcidol by IR and UV. Results: This is an effective method to monitor the synthesis process and avoid the incomplete reaction or the overreaction, which can lead to the increase of the side product. Furthermore, the method increases the yield of the reaction and improves the good reproducibility. The yield is stable. Conclusion: The method is easy, rapid and accurate. It is suitable for the pharmaceutical manufacture. Keywords: Alfacalcidol; IR and UV; Monitor 以IR 及UV 法监测阿法骨化醇合成反应进程 王 敏,王明刚 青岛正大海尔制药有限公司,青岛 Email: wangmin.zdhr@haier.com, wangmg@haier.com 收稿日期:2013 年7月9日;修回日期:2013 年7月23 日;录用日期:2013 年7月28 日 摘 要:目的:合成阿法骨化醇,准确监测反应进程并判定反应终点。方法:以 IR 及UV 法监测阿法骨化醇合 成反应进程。结果:以IR 及UV法能准确有效的监测阿法骨化醇合成反应进程,避免了反应不完全或过度反应 导致副产物增加的弊端,提高了反应收率,且重现性好,收率稳定。结论:本方法操作简单、迅速、准确、有 效,适合于工业化生产。 关键词:阿法骨化醇;IR 及UV;监测 1. 引言 阿法骨化醇(alfacalcidol,1)化学名为 9,10-开环胆 甾-5Z,7E,10(19)-三烯-1,3-二醇。它是 VD3的一种重 要活性代谢物,口服后由小肠吸收,经肝脏中的 25- 羟化酶作用,迅速转化为骨化三醇而起作用。临床主 要用于治疗骨质疏松症、佝偻病、骨软化症及各种肾 性骨病[1-7]。 根据文献方法[8-12],阿法骨化醇合成反应过程的 检测、终点的判定采用的都是薄层层析(TLC)法,该 方法对试验条件要求简单,只需要一个层析缸及一些 硅胶板即可,且操作方便,易于掌握,因而被广泛用 于化学合成反应的过程监测及终点的判定。 但由于阿法骨化醇的合成反应较激烈,反应时间 短,副反应较多,且副产物与主成分的极性很接近, 如果采用常规的TLC 方法来检测反应进程的话,会遇 到两个很大的麻烦:1) 因反应副产物与主成分的极性 Open Access 9  以IR 及UV 法监测阿法骨化醇合成反应进程 很接近,故用 TLC 方法很难完全分开,这就很难准确 对反应进程进行监测;2) 因TCL 一般都需要 5~10分 钟才能出结果,这往往不能即时反映合成反应的进 程,从而会导致反应过度,以至于产生较多的副产物。 因此,必须找到一种更加迅速及准确的监测反应进程 及终点的方法。 2. 方法 2.1. 合成路线 本研究采用 IR 及UV 法来监测阿法骨化醇合成反 应进程,结果证明能更加准确地判断合成反应进程, 提高了反应收率。总收率约为 20%,合成路线见图 1。 2.2. 实验仪器 红外吸收光谱采用 Lmpact410 型红外分光光度 计。紫外吸收光谱采用 Shimadzu-265 紫外吸收光谱仪。 2.3. 实验方法 2.3.1. 维生素 D3 对甲苯磺酸酯(2)的合成 用IR 监测反应的进程: 红外光谱吸收峰中会出现 1350 cm−1(s)为S=O 吸 收峰,918 cm−1(s)为−S−O−吸收峰。而 VD3的−OH峰 (3310 cm−1)则会逐步减弱直至消失。当 VD3的−OH 峰 (3310 cm−1)完全消失后即是反应终点。 将维生素D3 10 g和对甲苯磺酸酰氯12 g 一起加 入反应瓶中,以50 mL 吡啶溶解完全,混匀后置于冰 箱(2~4℃)中放置 48 h。 反应完成后,加入100 mL 饱和碳酸氢钠溶液,搅 拌15 min 以分解过量的对甲苯磺酰氯。以1500 mL 乙 酸乙酯萃取。有机层分别以 3%稀盐酸(500 mL × 2), 饱和碳酸氢钠溶液(500 mL × 1)和饱和氯化钠溶液(500 mL × 1)洗涤,然后以无水硫酸镁脱水,过滤。滤液减 压浓缩至干,得浅黄色固体即粗品VD3对甲苯磺酸酯 13.5 g,收率97.0%,此粗品可直接用于下步反应。 2.3.2. 3,5-环合维生素 D3 (3)的合成 用IR 及UV监测反应的进程: 红外光谱吸收峰中:会出现醚的 C-O 峰[1090 cm−1(s)],而磺酸酯的特征峰(1350 cm−1和918 cm−1) 会逐步减弱直至消失。 紫外光谱原共轭双键峰会逐步减弱直至消失,仅 VD3 2 3 4 5 1 Figure 1. Synthetic route of Alfacalcid o l 图1. 阿法骨化醇的合成路线 在λ = 204 nm 处有吸收。 此时即是反应终点。 在3000 mL 的三口瓶中加入化合物 2(13.0 g)、碳 酸氢钠 32.5 g 及甲醇 2500 mL,55℃搅拌 8 h。 反应完成后,减压回收甲醇,用1500 mL 乙酸乙 酯萃取。酯层水洗至中性,以无水硫酸镁脱水,过滤, 滤液减压浓缩至干,得浅黄色油状物即3,5-环合维 生素 D3 9.4 g,收率97.5%,此粗品可直接用于下步反 应。 2.3.3. 1-OH-3,5-环合维生素 D3 (4)的合成 用IR 监测反应的进程: 红外光谱吸收峰中:会出现越来越强的 OH峰 (3400 cm−1),同时以用 TLC 辅助检测反应的进行: 硅胶 HF254。 展开剂乙酸乙酯–正戊烷(3:7)。 待原料点完全消失后即是反应终点。 在3000 mL的三口瓶中加入化合物3 (9.3 g),二 氧化硒 0.65 g,过氧化叔丁醇 12.8 mL及二氯甲烷 2500 mL,室温搅拌 50 min。 反应液依次以10 %氢氧化钠溶液(200 mL × 2),水 (400 mL × 2)洗涤,有机层以无水硫酸镁脱水,过滤, 滤液减压浓缩至干得黄色油状物。柱层析[柱层层析硅 胶,乙酸乙酯-环己烷(1:10)为洗脱剂]分离提纯,减 压浓缩后得浅黄色油状物即1-OH-3,5-环合 VD3纯 品4.2 g,收率43.4%。 2.3.4. 1-OH维生素 D3-3-乙酸酯(5)的合成 用IR 监测反应的进程: Open Access 10  以IR 及UV 法监测阿法骨化醇合成反应进程 红外光谱吸收峰中:会出现越来越强的 3β-乙酸 酯中羰基峰(1740 cm−1),而醚的C-O 峰(1090 cm−1(s)) 会逐步减弱直至消失。 待醚的 C-O峰(1090 cm−1(s))完全消失后即是反应 终点。 在250 mL的三口瓶中加入化合物 4 (4.2 g)及冰 醋酸 120 mL,55℃搅拌15 min。 反应完成后减压浓缩至干,得浅黄色泡沫状物 质,柱层析(柱层层析硅胶,乙酸乙酯–环己烷(1:8) 为洗脱剂)分离纯化,减压浓缩后得白色泡沫状物质即 1-OH 维生素D3-3-乙酸酯 2.4 g,收率53.5%。 2.3.5. 1-OHVD3 (1)的合成 用IR 监测反应的进程: 红外光谱吸收峰中:会出现越来越强的 1α, 3β-OH 峰(3400 cm−1),而羰基峰(1740 cm−1)会逐步减 弱直至消失。待羰基峰(1740 cm−1)完全消失后即是反 应终点。 在500 mL的三口瓶中加入化合物 4 (2.4 g),5% 的氢氧化钠甲醇溶液 20 mL及甲醇 200 mL,室温搅 拌3 h。反应液以 1500 mL乙酸乙酯萃取,有机层水 洗至中性后以无水硫酸镁脱水,过滤,减压浓缩至干 得浅黄色固体,以乙酸乙酯-正己烷(1:3)重结晶,滤 集结晶,40℃真空干燥2 h得白色针状结晶1.7 g,收 率78.3%。 3. 实验数据结果 3.1. 熔点测定(见表 1) 仪器:XT6 型显微熔点测定仪(北京泰克仪器有限 公司) 条件:样品真空干燥后测。 熔点与文献值相符。 3.2. 紫外吸收光谱和解析(见表2) 仪器:Shimadzu-2401 PC 紫外吸收光谱仪。 溶剂:无水乙醇。 试液浓度:15 μg/ml。 紫外吸收光谱表明,本品在265 nm 和211 nm波 长处有最大吸收,在227 nm波长处有最小吸收,与 文献值相符,说明分子中存在共轭双键,与阿法骨化 醇分子结构相一致。 Table 1. Melting point determination data 表1. 熔点测定数据对照表 样品值 文献值 熔点(℃) 138℃~139℃ 137℃~140℃ Table 2. UV absorption spectr um analytical table 表2. 紫外吸收光谱解析表 样品 文献 λmax 265 nm 265 nm λmax 211 nm 210 nm λmin 227 nm 227 nm ε (max) 17,469 17,400 3.3. 红外吸收光谱图及解析(见表 3) 仪器:Perkin-Elmer 983 型红外分光光度计。 测定条件:KBr 压片。 红外吸收光谱表明,本品在 3399 cm−1附近有强 吸收峰,说明分子结构中存在羟基,在2869 cm−1附 近有弱吸收峰,在 1640 cm−1附近有中等强度的吸收 峰,说明分子结构中存在C=C 双键,这与阿法骨化醇 的分子结构相一致。 3.4. 质谱图及各峰解析对照表(见表 4) 仪器:AEI MS-50 质谱仪。 条件:EI 70Ev。 质谱数据表明,分子离子峰与阿法骨化醇分子量 相符,碎片离子符合阿法骨化醇的结构。 3.5. 1H 和13C核磁共振谱及解析(见表 5和表 6) 仪器:日本SEOL 公司 AL-300NMR。 溶剂:DMSO。 内标:TMS。 通过 1HNMR 和13CNMR 谱成功地找到了 1HNMR 中H质子和 13CNMR 谱中 C核的归属。这与阿法骨 化醇的分子结构相符合。 4. 讨论 阿法骨化醇的合成反应较激烈,反应时间短,副 反应较多,且副产物与主成分的极性很接近,如果采 用常规的TLC 方法来检测反应进程的话,会遇到两个 Open Access 11 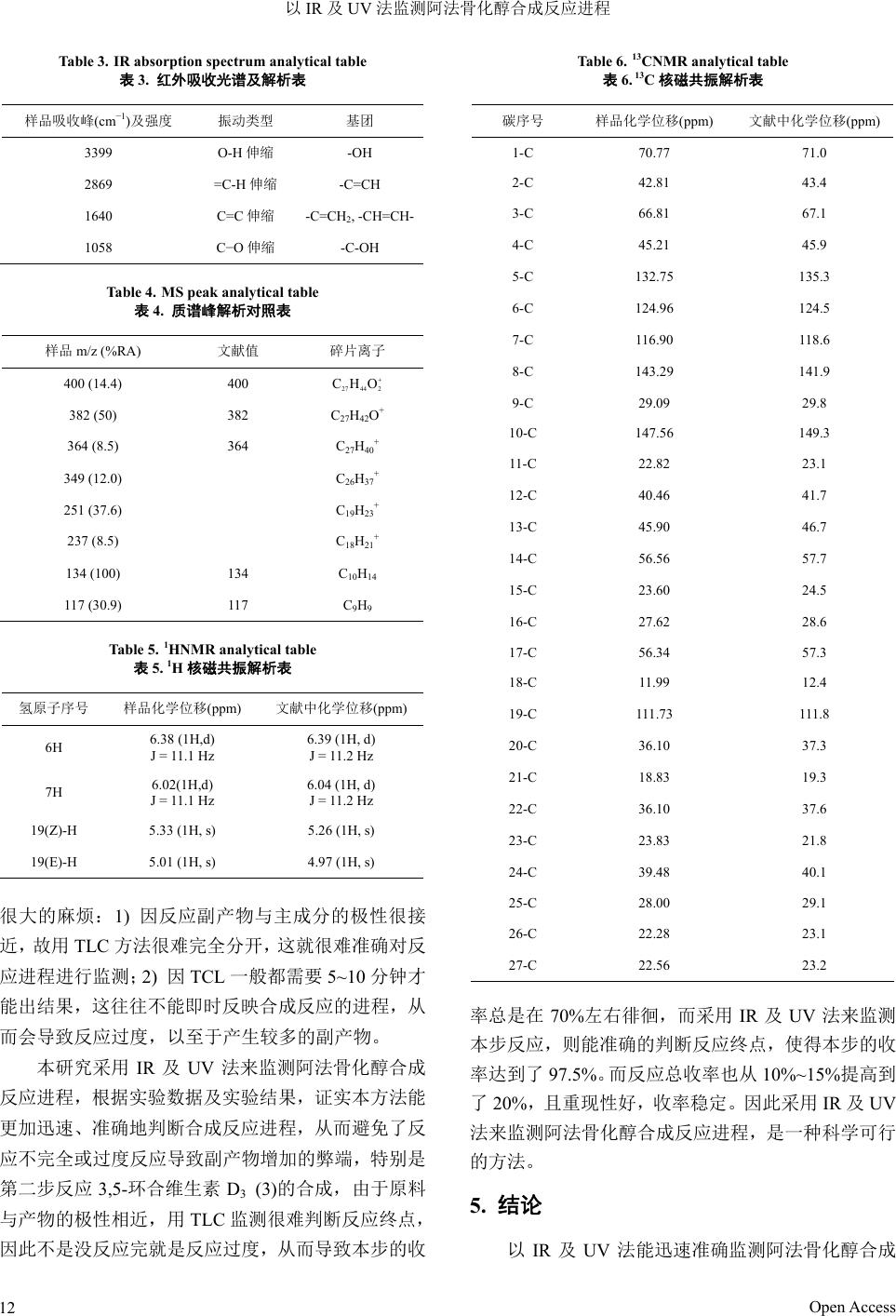 以IR 及UV 法监测阿法骨化醇合成反应进程 Table 3. IR absorption spectrum analytical table 表3. 红外吸收光谱及解析表 样品吸收峰(cm−1)及强度 振动类型 基团 3399 O-H 伸缩 -OH 2869 =C-H 伸缩 -C=CH 1640 C=C 伸缩 -C=CH2, -CH=CH- 1058 C−O伸缩 -C-OH Table 4. MS peak analytical table 表4. 质谱峰解析对照表 样品 m/z (%RA) 文献值 碎片离子 400 (14.4) 400 2744 2 CHO 382 (50) 382 C27H42O+ 364 (8.5) 364 C27H40+ 349 (12.0) C26H37+ 251 (37.6) C19H23+ 237 (8.5) C18H21+ 134 (100) 134 C10H14 117 (30.9) 117 C9H9 Table 5. 1HNMR analytical table 表5. 1H核磁共振解析表 氢原子序号 样品化学位移(ppm) 文献中化学位移(ppm) 6H 6.38 (1H,d) J = 11.1 Hz 6.39 (1H, d) J = 11.2 Hz 7H 6.02(1H,d) J = 11.1 Hz 6.04 (1H, d) J = 11.2 Hz 19(Z)-H 5.33 (1H, s) 5.26 (1H, s) 19(E)-H 5.01 (1H, s) 4.97 (1H, s) 很大的麻烦:1) 因反应副产物与主成分的极性很接 近,故用 TLC 方法很难完全分开,这就很难准确对反 应进程进行监测;2) 因TCL 一般都需要 5~10分钟才 能出结果,这往往不能即时反映合成反应的进程,从 而会导致反应过度,以至于产生较多的副产物。 本研究采用 IR及UV 法来监测阿法骨化醇合成 反应进程,根据实验数据及实验结果,证实本方法能 更加迅速、准确地判断合成反应进程,从而避免了反 应不完全或过度反应导致副产物增加的弊端,特别是 第二步反应 3,5-环合维生素 D3 (3)的合成,由于原料 与产物的极性相近,用TLC 监测很难判断反应终点, 因此不是没反应完就是反应过度,从而导致本步的收 Table 6. 13CNMR analytical table 表6. 13C核磁共振解析表 碳序号 样品化学位移(ppm) 文献中化学位移(ppm) 1-C 70.77 71.0 2-C 42.81 43.4 3-C 66.81 67.1 4-C 45.21 45.9 5-C 132.75 135.3 6-C 124.96 124.5 7-C 116.90 118.6 8-C 143.29 141.9 9-C 29.09 29.8 10-C 147.56 149.3 11-C 22.82 23.1 12-C 40.46 41.7 13-C 45.90 46.7 14-C 56.56 57.7 15-C 23.60 24.5 16-C 27.62 28.6 17-C 56.34 57.3 18-C 11.99 12.4 19-C 111.73 111.8 20-C 36.10 37.3 21-C 18.83 19.3 22-C 36.10 37.6 23-C 23.83 21.8 24-C 39.48 40.1 25-C 28.00 29.1 26-C 22.28 23.1 27-C 22.56 23.2 率总是在 70%左右徘徊,而采用IR 及UV 法来监测 本步反应,则能准确的判断反应终点,使得本步的收 率达到了97.5%。而反应总收率也从10%~15%提高到 了20%,且重现性好,收率稳定。因此采用IR 及UV 法来监测阿法骨化醇合成反应进程,是一种科学可行 的方法。 5. 结论 以IR 及UV法能迅速准确监测阿法骨化醇合成 Open Access 12  以IR 及UV 法监测阿法骨化醇合成反应进程 Open Access 13 反应进程,避免了反应不完全或过度反应导致副产物 增加的弊端,提高了反应收率,且重现性好,收率稳 定。本方法操作简单、迅速、准确、有效,适合于工 业化生产。 参考文献 (References) [1] Posner GH and Kahraman M. (2003) Organic chemistry of vita- min D analogues (deltanoids). European Journal of Organic Chemistry, 20, 3889- 3895. [2] Babina M, Krautheim M, Grutzkau A, et al. (2000) Human leukemic mast cells (HMC-1) are responsive to 1-alpha, 25- dihydroxyvitamin D3: Selective promotion of ICAM- 3 ex- pression and constitutive presence of vitaminD3 receptor. Bio- chemical and Biophysical Research Communications, 273, 1104- 1110. [3] Li XY, Boudjelal M, Xiao JH, et al. (1999) 1, 25-di- hydroxyvitamin D3 increase nuclear vitamin D receptors by blocking ubiquitin/proteasome-mediated degradation in human skin. Molecular Endocrinology, 13, 1686-1694. [4] Chen TC, Schwartz GG, Burnstein KL, et al. (2000) The in vitro evaluation of 25-hydroxyvitamin D3 and 19-nor-1,25-dihydroxy- vitamin D2 as therapeutic agents for prostate cancer. Clinical Cancer Research, 6, 901-908. [5] Brown AJ. (2001) Therapeutic uses of vitamin D analogues. American Journal of Kidney Diseases, 38, 3-19. [6] Goltzman D, Miao DS, Panda DK, et al. (2004) Effect of cal- cium and the vitamin D system on skeletal and calcium homeo- stasis: lessons from genetic models. The Journal of Steroid Bio- chemistry and Molecular Biology, 89-90, 485-489. [7] Yamada S, Shimizu M and Yamamoto K. (2003) Structure- function relationships of vitamin D including ligand recognition by the vitamin D receptor. Medicinal Research Reviews, 23, 89- 115. [8] Enrico G. Baggiolini, Jerome A. Iacobelli and Bernard M. (1986) Hennessy, stereocontrolled total synthesis of 1, 25-dihydroxy- cholecalciferol and 1, 25-Dihydroxycholecalciferol. The Journal of Or ganic Chemistry, 51, 3098-3105. [9] William S. Johnson, John D. Elliott and Gunnar J. (1984) Hanson asymmetrie synthesis via acetal templates.6.a stereo- selective approach to a key intermediate for the preparation of vitamin D metabolites. Journal of the American Chemical So- ciety, 106, 1138-1139. [10] Paaren HE, Deluca HF and Schnoes HK. (1980) Direct C(1) hy- droxylation of vitamin D3 and related compounds. The Journal of Organic Chemistry, 45, 3253-3258. [11] Tadashi Sato, Hiroshi yamauchi and Yoshitake Ogata. (1978) Studies on 1-hydroxyl derivatives of vitamin D3. I. syntheses of 1-hydroxyvitamin D3 and 1,25-dihydroxyvitamin D3. Chemical and Pharmaceutical Bulletin, 25, 2983-2940. [12] DeLuca. (1985) Method for preparing 1-hydroxyvitamin D compounds. US 4554106. |