Advances in Clinical Medicine
Vol.
13
No.
03
(
2023
), Article ID:
62648
,
8
pages
10.12677/ACM.2023.133555
GABA受体激动剂在干眼模型中对炎症反应的调节作用及对眼表修复的影响
张德馨1,2,周子微1,2,郑恒瑞2,王谦2*
1青岛大学医学部,山东 青岛
2青岛大学附属医院,山东 青岛
收稿日期:2023年2月15日;录用日期:2023年3月10日;发布日期:2023年3月17日

摘要
目的:观察GABA A型受体激动剂Muscimol对干眼模型鼠眼中TNF-α、IL-1β表达的调节作用及对眼表修复的影响。方法:选用SPF级雌性C57BL/6小鼠(7~8周龄),用3 mg/mL东莨菪碱溶液皮下注射,同时模拟干燥环境建立干眼症模型,14天后给予3 mg/mL Muscimol溶液结膜下注射。于1、3、5天行泪液分泌量测定及荧光素钠染色,同时制备眼表组织切片,采用苏木素–伊红染色法评估角膜组织形态学变化。分别采用PCR、ELISA方法检测小鼠结膜组织中TNF-α和IL-1β的mRNA及蛋白的表达。结果:在使用Muscimol处理后的第1、3天各项临床指标均有恢复趋势,第5天后的泪液分泌量显著增加(P < 0.01),角膜荧光素钠染色分级减轻(P < 0.01)。角膜组织切片的HE染色结果显示,Muscimol处理组角膜上皮规整,相应损伤有所减轻。Muscimol处理组TNF-α和IL-1β的mRNA及蛋白的表达均呈下降趋势,第5天差别具有统计学意义(均P < 0.01)。结论:Muscimol结膜下注射可抑制干眼模型小鼠结膜中炎症因子的表达,促进眼表损伤的修复。
关键词
蝇蕈醇,干眼症,抗炎

Anti-Inflammatory and Promoting Ocular Surface Effects of GABAAR Agonists in DED Mice
Dexin Zhang1,2, Ziwei Zhou1,2, Hengrui Zheng2, Qian Wang2*
1Department of Medicine, Qingdao University, Qingdao Shandong
2The Affiliated Hospital of Qingdao University, Qingdao Shandong
Received: Feb. 15th, 2023; accepted: Mar. 10th, 2023; published: Mar. 17th, 2023

ABSTRACT
Objective: To investigate the regulation of GABA type A receptor agonist Muscimol to the expressions of TNF-α and IL-1β and the effect on ocular surface repair in mice dry eye models. Methods: Female C57BL/6mice (7~8 weeks) were injected subcutaneously with scopolamine solution (3 mg/mL) in a dry environment. After 14 days, the mice were injected subconjunctivally with Muscimol solution (3 mg/mL). Tear secretion, fluorescein staining score, and HE staining were examined on the 1st, 3rd, 5th day. PCR and ELISA quantified the mRNA and protein expressions of TNF-α and IL-1β. Results: All the clinical indexes demonstrated a recovery trend after Muscimol treatment. Tear secretion increased significantly (P < 0.01), and fluorescein staining score decreased (P < 0.01) on the 5th day. HE staining showed that the corneal epithelium damage had repaired in the Muscimol treated group. The mRNA and protein expressions of TNF-α and IL-1β in the Muscimol treated group decreased significantly (P < 0.01 for all) on the 5th day. Conclusion: The application of Muscimol can inhibit the expression of inflammatory factors in the conjunctiva of dry eye model mice, and promote the repair of ocular surface.
Keywords:Muscimol, DED, Anti-Inflammatory

Copyright © 2023 by author(s) and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY 4.0).
http://creativecommons.org/licenses/by/4.0/


1. 引言
干眼症是一种常见的多因素引起的眼表疾病,可导致眼部不适、视力障碍和泪膜不稳定等症状,并可能对眼表造成损害,严重的情况下,患者会出现干眼相关的眼部并发症,包括角膜上皮损伤、鳞状上皮化生和新生血管形成 [1] 。在50岁以上的人群中干眼症的患病率在5%到30%之间 [2] ,随着电子产品的普及、彩妆、隐形眼镜、环境污染等影响,干眼症患者人数持续上升,并趋于年轻化。
干眼症的发病机制尚未完全阐明,但眼表免疫炎症反应作为发病机制的焦点已越来越受到关注。外在刺激和内在失衡导致了干眼症的炎症起始和免疫调节功能障碍的恶性循环 [3] 。由于人们普遍认为炎症在干眼症的发病机制中具有重要作用,加重了眼表的损害和刺激症状,因此目前有许多抗炎治疗来缓解干眼症。这些药物抑制眼表炎症介质的表达,进而恢复泪液的分泌并减少相应的体征和症状 [4] 。有研究证实,对于常规治疗无法改善的严重干眼症患者,每天给与两次以上的环孢素点眼是有效的治疗方法 [5] [6] ;另外一项研究证实外用免疫抑制剂他克莫司包括软膏及滴眼液剂型,可以改善慢性移植物抗宿主病、干燥综合征中的干眼症状 [7] [8] 。但是药物治疗通常只能减轻而不能彻底消除干眼症状,或者对于眼表有较强的刺激,因此,进一步研究干眼症的免疫炎症机制,并寻找有效的治疗药物具有重要意义。
γ-氨基丁酸(GABA)和GABA受体(GABA-Rs)形成大脑中的主要抑制性神经递质系统。许多类型的免疫细胞都具有神经递质GABA的受体,并且这些受体的激活通常具有抗炎活性 [9] [10] 。口服GABA可改善1型糖尿病(T1D)、多发性硬化症和类风湿性关节炎小鼠模型中的自身免疫 [11] [12] 。GABA-Rs激动剂也已被观察到可以限制急性肺损伤,降低SARS-CoV-2感染小鼠的肺炎严重程度 [13] [14] 。因此GABA-Rs可能作为一种新的药物靶标,具有治疗干眼症的潜力。
2. 实验材料
2.1. 实验对象
购自济南朋悦实验动物繁育有限公司SPF级雌性C57BL/6小鼠(7~8周龄),经检疫均合格。适应性饲养一周后,开始进行实验。实验前检查小鼠全身情况并于裂隙灯下检查眼部情况确保眼部健康。所有动物使用均符合中国科学技术部实验动物的人道待遇指导(vgkfcz-2006-398)的有关伦理要求和相关规定。
2.2. 实验主要相关耗材
2.2.1. 构建动物模型所需的实验耗材与试剂
微量注射器(10 μl),瑞士Hamilton公司;眼科专用手术显微器械,上海眼科耗材中心;8%水合氯醛,青岛大学附属医院提供;1 ml注射器,山东新华安得医疗用品有限公司;东莨宕碱,上海麦克林生化有限公司。
2.2.2. 实验用药
蝇蕈醇氢溴酸盐(Muscimol),美国Sigma-Aldrich公司。
2.2.3. RT-PCR及Elisa相关试剂及耗材
RNAiso Plus,日本TaKaRa公司;氯仿,青岛捷隆化工有限公司;TBGeen,大连宝生物工程有限公司;Prime Script RT reagent kit,日本TaKaRa公司。小鼠的TNF-α及IL-1β酶联免疫吸附测定试剂盒,美国Biolegend公司。
2.3. 实验方法
2.3.1. 小鼠干眼模型的建立与处理
将干燥应激环境(Desiccating Stress, DS)设定为恒温(24℃ ± 2℃)、恒湿(30% ± 5%)、恒定风速(2.5 ± 0.5 km/s)。给予小鼠3 mg/mL东莨菪碱溶液颈背部皮下注射,每天4次(10点、13点、15点、19点),每只每次0.2 mL,并置于干燥应激环境。14天后,给予实验组小鼠3 mg/mL Muscimol溶液结膜下注射,每日1次,每眼每次10 ul。于1、3、5天检测各组小鼠的各项指标及留取样本。
2.3.2. 泪液量测定
每次测量时间点为16点。气麻下,软头镊将小鼠下眼睑夹起,然后将酚红棉线的折叠一端置于小鼠结膜囊内30秒,位置在距外眦约三分之一,取出酚红棉线,放在标尺上以mm为单位测量润湿长度。在治疗前和治疗后第3天、第5天进行测量。
2.3.3. 角膜荧光素钠染色
腹腔注射8%水合氯醛3.5 mL/kg麻醉,用生理盐水将试纸橙红色荧光素钠部分蘸湿,将蘸湿部分轻轻接触小鼠的结膜。用生理盐水冲洗眼部1分钟以去除眼部多余荧光素,裂隙灯生物显微镜钴蓝光下观察。在治疗前和治疗后第3天、第5天进行测量。角膜分为4个象限,每个象限单独计分。4个象限的评分相加得到最后的得分(总分16分)。分级见表1:
Table 1. Scoring criteria for corneal epithelial fluorescein staining
表1. 角膜上皮荧光素钠染色评分标准
2.3.4. RT-PCR实验方法
小鼠结膜组织的总RNA通过RNAiso plus试剂提取,并通过NanoDrop ND-1000分光光度法(Thermo Fisher Scientific)定量。按照PrimeScript RT试剂盒说明书逆转录合成cDNA。将SYBR Premix Ex Tap 10 ul、引物1 ul、cDNA模板2 ul、DEPC水7 ul混合进行扩增反应。PCR反应条件:95℃ 30 s (预变性);95℃ 45 s (变性);60℃ 30 s;95℃ 15 s (退火、延伸);60℃ 30 s;95℃ 15 s (溶解)。CT数用于分析样本mRNA的相对表达量。引物序列见表2。
Table 2. Primer sequences used for RT-PCR
表2. RT-PCR实验中所用的引物序列
F: Forward; R: Reverse.
2.3.5. Elisa实验方法
按照制造商的说明对小鼠结膜TNF-α和IL-1β进行双夹心ELISA,以评估TNF-α和IL-1β的蛋白质水平。将组织匀浆于4℃,5000 g,离心5分钟后取上清液立即进行实验,每个样品100 ul重复测定。在450 nm、570 nm处测量光密度值。根据OD值,绘制标准品浓度曲线并计算各样品的蛋白浓度。
2.3.6. 苏木素-伊红染色法
小鼠眼球(n = 3/组/次)在4℃的4%多聚甲醛溶液中固定3天,包埋在石蜡中,并切成5 um厚的连续组织切片。切片依次用苏木素和伊红染色。酒精脱水后,切片固定并在光学显微镜下以原始放大倍数×40拍照。
2.4. 统计学方法
使用GraphPad Prism 9对实验数据进行统计学分析和处理。两组间比较使用未配对双尾t检验(Student’s t-test),多组间比较使用SPSS-单因素方差分析(ANOVA)。P < 0.05表示差异具有统计学意义。计量资料以x ± SEM表示。
3. 结果
3.1. 建模成功
经东莨宕碱及干燥应激环境处理后,建模14天组小鼠角膜上皮出现粗点状及小片状染色,评分较正常组显著升高(图1(b),P < 0.01),泪液分泌量显著减少(图1(c),P < 0.01)。角膜荧光素钠染色的代表性图片见图1(a)。

Figure 1. Related indicators in dry eye model mice
图1. 干眼症小鼠模型相关检测指标
3.2. GABAAR在正常小鼠结膜组织中的表达
选取正常小鼠结膜组织,通过Western blot和免疫组织化学染色检测GABAAR在结膜组织中的表达和定位。结果显示结膜组织中存在GABAAR蛋白的阳性信号(图2(a)),GABAAR蛋白(棕色着色)主要分布在小鼠结膜复层鳞状上皮中(图2(b))。
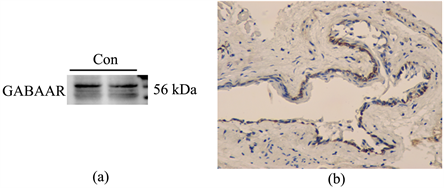
Figure 2. The expression of GABAAR in mouse conjunctival tissue. (a): Western blot was utilized to detect the expression of GABAAR protein in conjunctiva. (b): Representative immunohistochemical staining pictures of the conjunctiva (brown: GABAAR positive cells). Mag, 400×
图2. GABAAR在小鼠结膜组织中的表达。(a):Western blot检测结膜中GABAAR蛋白的表达。(b):结膜的代表性免疫组织化学染色图像用GABAAR抗体(棕色:GABAAR阳性细胞)染色,并用光学显微镜(放大倍数,400×)获得
3.3. GABAAR激动剂(Muscimol)对小鼠干眼症的治疗作用
建立干眼症小鼠模型,Muscimol处理后,酚红棉线法检测各组小鼠泪液的分泌量,角膜荧光素钠染色检测各组小鼠的眼表损伤情况。使用裂隙灯在钴蓝光下进行角膜拍照并摘取角膜行HE染色。结果显示,模型对照组小鼠泪液产生量明显减少,角膜荧光素钠染色阳性;经Muscimol处理后的小鼠泪液分泌量增加,角膜临床评分降低,以处理5天组最为显著(图3(a)和图3(b),均P < 0.01)。角膜组织切片的HE染色显示,Muscimol处理的角膜(图3(e))上皮表面平滑,基质无水肿;模型对照组(图3(d))上皮细胞排列紊乱,上皮基底层细胞出现空泡,局部基质水肿,可见炎性细胞浸润。以上结果表明,Muscimol显著减轻了小鼠干眼症的严重程度。
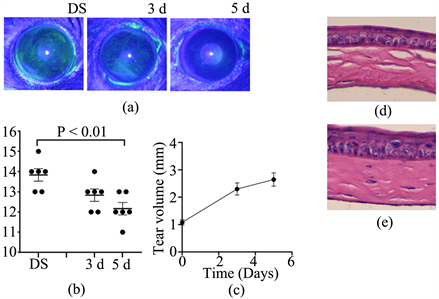 注:(a) Muscimol处理组小鼠角膜的代表性荧光素钠染色图像;(b) 小鼠角膜荧光素钠染色评分;(c) 小鼠泪液分泌检测结果;(d) 建模后第14天,小鼠角膜的代表性HE染色图像;(e) Muscimol处理后第5天,小鼠角膜的代表性HE染色图像(n = 6/组)。
注:(a) Muscimol处理组小鼠角膜的代表性荧光素钠染色图像;(b) 小鼠角膜荧光素钠染色评分;(c) 小鼠泪液分泌检测结果;(d) 建模后第14天,小鼠角膜的代表性HE染色图像;(e) Muscimol处理后第5天,小鼠角膜的代表性HE染色图像(n = 6/组)。
Figure 3. The clinical manifestations and clinical scores of Muscimol in the treatment of dry eye in mice
图3. Muscimol治疗小鼠干眼症的临床表现及临床评分
3.4. Muscimol抑制干眼症小鼠结膜中炎症细胞因子的表达
建立干眼症小鼠模型,Muscimol处理后,收集小鼠结膜并测定结膜中炎症因子的mRNA及蛋白表达水平。RT-PCR的结果显示,处理5天组的小鼠结膜中炎症因子TNF-α (图4(a))、IL-1β (图4(b))的表达都较模型对照组有显著下调。ELISA的实验结果在蛋白水平显示,Muscimol下调了模型对照组中升高的相关炎症因子如TNF-α、IL-1β (图4(c)、图4(d)),差别具有统计学意义,进一步验证了Muscimol的抗炎作用。
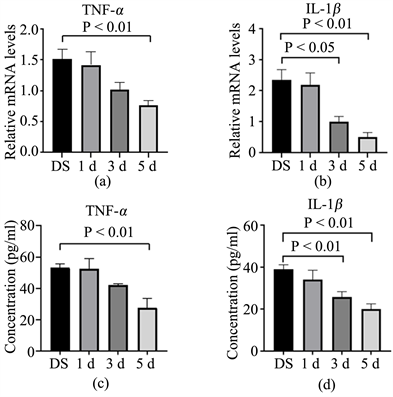
Figure 4. The mRNA and protein expression of TNF-α and IL-1β in conjunctival tissue of mice after treatment of Muscimol
图4. Muscimol各处理组小鼠结膜组织TNF-α和IL-1β的mRNA及蛋白表达
4. 讨论
DED是眼表免疫反应调节失衡的结果 [15] 。干燥应激诱导的眼表抗原呈递细胞(APC)的激活会刺激引流淋巴结中的幼稚T淋巴细胞。随后,Th1和Th17细胞会在眼表分泌细胞因子和基质金属蛋白酶(MMP),引起损伤并促进慢性炎症 [16] [17] 。无论DED最初的病因是什么,一旦发展起来,炎症就会成为眼表损伤的关键机制 [18] [19] 。研究结果表明,DED的临床症状可能取决于T细胞活化和由此产生的自身免疫性炎症,随后多项研究也证明了促炎细胞因子和基质金属蛋白酶(MMP)在DED发病机制中的作用。其中白细胞介素IL-1是研究最广泛的促炎因子之一。在DED患者的泪膜中发现了促炎形式的IL-1 (IL-1α和成熟的IL-1β)的增加和无生物学活性的前体IL-1β的减少,这项研究结果还证实了,与正常眼相比,IL-1β、IL-6、IL-8和TNF-α的表达在干燥综合征相关干眼症中上升 [20] 。另外在DED患者中还发现了部分应激通路的激活,这导致了应激相关基因,主要是MMP-9转录的上调,进一步刺激了炎性细胞因子的产生 [21] 。因此,在DED的治疗中,抑制炎症反应中的免疫细胞过度激活,降低炎症因子的过度表达至关重要。
本项研究表明了GABAAR在小鼠结膜组织中的表达。GABAAR表达的研究包括检测存在于气道杯状细胞中的GABAARβ2和β3亚基的蛋白质。在气道上皮中,自分泌或旁分泌的GABA能系统地被认为通过介导细胞中阴离子流出和膜的去极化来增强上皮细胞的增殖和粘液的产生 [22] 。GABA能系统调节不同细胞活动中发挥的非神经元介质的作用。因此,我们提出GABAAR在干眼症小鼠治疗中发挥的作用可能是非神经元的,类似于其在改善干燥综合征、急性肺损伤等疾病中的功能。
促炎细胞因子TNF-α和IL-1β在DED患者的泪液和眼表中升高,参与趋化炎性细胞浸润,激活抗原呈递细胞,诱导淋巴细胞释放更多的炎症因子,是描述眼表炎症的良好指标 [20] [23] 。研究发现人类T细胞和抗原呈递细胞表达GABAAR,它们的活性受GABAAR激动剂和拮抗剂的调节 [11] [24] [25] [26] 。基于GABAAR激动剂在改善自身免疫性疾病模型中的有效性,我们认为Muscimol可能为DED的治疗提供新的选择。在本实验研究中,Muscimol有效抑制了干眼症小鼠结膜中炎症因子(TNF-α、IL-1β)的表达,表明Muscimol具有一定的抗炎作用。不仅如此,Muscimol治疗组相对于模型对照组小鼠泪液分泌量显著升高,角膜临床评分显著改善,表明Muscimol促进了眼表修复,在干眼的治疗方面发挥积极作用。在自身免疫性疾病和癌症模型中已经深入研究了GABA对免疫细胞细胞因子和趋化因子分泌的影响,针对于GABA能系统地治疗会使它们向预计有益的方向移动,这与我们的实验结果相一致。
综上所述,GABAAR激动剂Muscimol可以减轻小鼠干眼症的严重程度,抑制干眼症小鼠结膜中炎症因子的表达,促进泪液分泌、减轻角膜损伤。以上结果表明,Muscimol能有效抑制TNF-α、IL-1β的表达,有利于修复眼表组织,最终为泪膜稳定的恢复、眼表健康的改善创造有力条件。后期我们将把Muscimol作为一种有潜力的治疗DED的靶点,继续深入探讨其作用的具体机制。
文章引用
张德馨,周子微,郑恒瑞,王 谦. GABA受体激动剂在干眼模型中对炎症反应的调节作用及对眼表修复的影响
Anti-Inflammatory and Promoting Ocular Surface Effects of GABAAR Agonists in DED Mice[J]. 临床医学进展, 2023, 13(03): 3875-3882. https://doi.org/10.12677/ACM.2023.133555
参考文献
- 1. Pflugfelder, S.C., Solomon, A. and Stern, M.E. (2000) The Diagnosis and Management of Dry Eye—A Twen-ty-Five-Year Review. Cornea, 19, 644-649. https://doi.org/10.1097/00003226-200009000-00009
- 2. Smith, J.A., Albeitz, J., Begley, C., et al. (2007) The Epidemiology of Dry Eye Disease: Report of the Epidemiology Subcommittee of the International Dry Eye Workshop (2007). Ocular Surface, 5, 93-107. https://doi.org/10.1016/S1542-0124(12)70082-4
- 3. Yu, L.F., Yu, C.J., Dong, H., et al. (2021) Recent Develop-ments about the Pathogenesis of Dry Eye Disease: Based on Immune Inflammatory Mechanisms. Frontiers in Pharma-cology, 12, Article ID: 732887. https://doi.org/10.3389/fphar.2021.732887
- 4. Hessen, M. and Akpek, E.K. (2014) Dry Eye: An Inflammatory Ocular Disease. Journal of Ophthalmic and Vision Research, 9, 240-250.
- 5. Gupta, A., Sadeghi, P.B. and Akpek, E.K. (2009) Occult Thyroid Eye Disease in Patients Presenting with Dry Eye Symptoms. American Journal of Ophthalmology, 147, 919-923. https://doi.org/10.1016/j.ajo.2008.12.007
- 6. Dastjerdi, M.H., Hamrah, P. and Dana, R. (2009) High-Frequency Topical Cyclosporine 0.05% in the Treatment of Severe Dry Eye Refractory to Twice-Daily Regimen. Cornea, 28, 1091-1096. https://doi.org/10.1097/ICO.0b013e3181a16472
- 7. Ryu, E.H., Kim, J.M., Laddha, P.M., et al. (2012) Therapeu-tic Effect of 0.03% Tacrolimus Ointment for Ocular Graft versus Host Disease and Vernal Keratoconjunctivitis. Korean Journal of Ophthalmology, 26, 241-247. https://doi.org/10.3341/kjo.2012.26.4.241
- 8. Tam, P.M., Young, A.L., Cheng, L.L., et al. (2010) Topical 0.03% Tacrolimus Ointment in the Management of Ocular Surface Inflammation in Chronic GVHD. Bone Marrow Transplan-tation, 45, 957-958. https://doi.org/10.1038/bmt.2009.249
- 9. Tian, J., Chau, C., Hales, T.G., et al. (1999) GABA(A) Receptors Me-diate Inhibition of T Cell Responses. Journal of Neuroimmunology, 96, 21-28. https://doi.org/10.1016/S0165-5728(98)00264-1
- 10. Zhang, B.H., Vogelzang, A., Miyajima, M., et al. (2021) B Cell-Derived GABA Elicits IL-10(+) Macrophages to Limit Anti-Tumour Immunity. Nature, 599, 471. https://doi.org/10.1038/s41586-021-04082-1
- 11. Bhandage, A.K., Jin, Z., Korol, S.V., et al. (2018) GABA Reg-ulates Release of Inflammatory Cytokines from Peripheral Blood Mononuclear Cells and CD4(+) T Cells and Is Immu-nosuppressive in Type 1 Diabetes. Ebiomedicine, 30, 283-294. https://doi.org/10.1016/j.ebiom.2018.03.019
- 12. Paul, A.M., Branton, W.G., Walsh, J.G., et al. (2014) GABA Transport and Neuroinflammation Are Coupled in Multiple Sclerosis: Regulation of the GABA Transporter-2 by Ganax-olone. Neuroscience, 273, 24-38. https://doi.org/10.1016/j.neuroscience.2014.04.037
- 13. Meng, J.X., Xin, X., Liu, Z., et al. (2016) Propofol Inhib-its T-Helper Cell Type-2 Differentiation by Inducing Apoptosis via Activating Gamma-Aminobutyric Acid Receptor. Journal of Surgical Research, 206, 442-450. https://doi.org/10.1016/j.jss.2016.08.041
- 14. Tian, J., Dillion, B.J., Henley, J., et al. (2022) A GABA-Receptor Agonist Reduces Pneumonitis Severity, Viral Load, and Death Rate in SARS-CoV-2-Infected Mice. Frontiers in Immu-nology, 13, Article ID: 1007955. https://doi.org/10.3389/fimmu.2022.1007955
- 15. Pflugfelder, S.C. and De Paiva, C.S. (2017) The Pathophysiol-ogy of Dry Eye Disease: What We Know and Future Directions for Research. Ophthalmology, 124, S4-s13. https://doi.org/10.1016/j.ophtha.2017.07.010
- 16. Reins, R.Y., Lema, C., Courson, J., et al. (2018) MyD88 Defi-ciency Protects against Dry Eye-Induced Damage. Investigative Ophthalmology & Visual Science, 59, 2967-2976. https://doi.org/10.1167/iovs.17-23397
- 17. Schaumburg, C.S., Siemasko, K.F., De Paiva, C.S., et al. (2011) Ocular Surface APCs Are Necessary for Autoreactive T Cell-Mediated Experimental Autoimmune Lacrimal Keratoconjunctivitis. The Journal of Immunology, 187, 3653-3662. https://doi.org/10.4049/jimmunol.1101442
- 18. Bandeen-Roche, K., Muñoz, B., Tielsch, J.M., et al. (1997) Self-Reported Assessment of Dry Eye in a Population-Based Setting. Investiga-tive Ophthalmology & Visual Science, 38, 2469-2475.
- 19. Moss, S.E., Klein, R. and Klein, B.E. (2000) Prevalence of and Risk Factors for Dry Eye Syndrome. Archives of Ophthalmology, 118, 1264-1268. https://doi.org/10.1001/archopht.118.9.1264
- 20. Solomon, A., Dursun, D., Liu, Z., et al. (2001) Pro- and An-ti-Inflammatory Forms of Interleukin-1 in the Tear Fluid and Conjunctiva of Patients with Dry-Eye Disease. Investigative Ophthalmology & Visual Science, 42, 2283-2292.
- 21. Pflugfelder, S.C., De Paiva, C.S., Tong, L., et al. (2005) Stress-Activated Protein Kinase Signaling Pathways in Dry Eye and Ocular Surface Disease. The Ocular Surface, 3, S154-S157. https://doi.org/10.1016/S1542-0124(12)70244-6
- 22. Xiang, Y.Y., Wang, S., Liu, M., et al. (2007) A GABAergic System in Airway Epithelium Is Essential for Mucus Overproduction in Asthma. Nature Medicine, 13, 862-867. https://doi.org/10.1038/nm1604
- 23. Rashid, S., Jin, Y., Ecoiffier, T., et al. (2008) Topical Omega-3 and Omega-6 Fatty Acids for Treatment of Dry Eye. Archives of ophthalmology, 126, 219-225. https://doi.org/10.1001/archophthalmol.2007.61
- 24. Alam, S., Laughton, D.L., Walding, A., et al. (2006) Human Peripheral Blood Mononuclear Cells Express GABAA Receptor Subunits. Molecular Immunology, 43, 1432-1442. https://doi.org/10.1016/j.molimm.2005.07.025
- 25. Mendu, S.K., Bhandage, A., Jin, Z., et al. (2012) Different Subtypes of GABA-A Receptors Are Expressed in Human, Mouse and Rat T Lymphocytes. PLOS ONE, 7, e42959. https://doi.org/10.1371/journal.pone.0042959
- 26. Prud’homme, G.J., Glinka, Y., Hasilo, C., et al. (2013) GABA Protects Human Islet Cells against the Deleterious Effects of Immunosuppressive Drugs and Exerts Immunoinhibitory Effects Alone. Transplantation, 96, 616-623. https://doi.org/10.1097/TP.0b013e31829c24be
NOTES
*通讯作者。
