Advances in Clinical Medicine
Vol.
14
No.
01
(
2024
), Article ID:
79670
,
10
pages
10.12677/ACM.2024.141153
黄荧光染色技术联合1H-MRS治疗脑胶质瘤的临床疗效
袁启友,张晓东*,蒿玉兴,陈为为,代兴亮,叶雷
安徽医科大学第一附属医院神外科,安徽 合肥
收稿日期:2023年12月23日;录用日期:2024年1月16日;发布日期:2024年1月23日

摘要
目的:探讨氢质子磁共振波谱(1H-MRS)联合黄荧光染色技术在脑胶质瘤手术中的作用。方法:回顾性分析2020年1月到2022年12月于安徽医科大学第一附属医院行手术切除的90例脑胶质瘤的临床资料。术前所有的病人行氢质子磁共振波谱(1H-MRS)检查。其中32例采用1H-MRS + 黄荧光染色技术(以下称为实验组),58例为常规手术组。42例患者的肿瘤距离脑室小于1 cm,32例位于额部,34例位于颞部,7例位于顶部,8例位于脑室,6例位于枕部,3例位于小脑,术中均采用神经电生理监测或术中唤醒麻醉技术。比较高低级别胶质瘤1H-MRI实质区域Cho/NAA,Cho/Cr,NAA/Cr。结果:高级别胶质瘤患者和低级别胶质瘤患者肿瘤实质区域Cho/NAA,Cho/Cr,NAA/Cr差异有统计学意义(P < 0.05),高级别胶质瘤Cho/NAA,Cho/Cr高于低级别胶质瘤,低级别胶质瘤NAA/Cr高于高级别胶质瘤;实验组和常规组全切率(54.5%和45.5%)差异有统计学意义(P < 0.001);距离脑室 < 1 cm,实验组和常规组全切率(65.9%和41.3%)差异有统计学意义(P < 0.05)。结论:1H-MRS联合黄荧光染色技术对于胶质瘤的治疗,可以缩短肿瘤切除时间,提高肿瘤切除程度同时减少围手术期并发症的发生。
关键词
脑胶质瘤,黄荧光染色技术,1H-MRS

Clinical Efficacy of Yellow Fluorescence Staining Combined with 1H-MRS in the Treatment of Brain Glioma
Qiyou Yuan, Xiaodong Zhang*, Yuxing Hao, Weiwei Chen, Xingliang Dai, Lei Ye
Department of Neurology, The First Affiliated Hospital of Anhui Medical University, Hefei Anhui
Received: Dec. 23rd, 2023; accepted: Jan. 16th, 2024; published: Jan. 23rd, 2024

ABSTRACT
Objective: To investigate the role of hydrogen proton magnetic resonance spectroscopy (1H-MRS) combined with yellow fluorescence staining in glioma surgery. Methods: The clinical data of 90 cases of glioma surgically removed in the First Affiliated Hospital of Anhui Medical University from January 2020 to December 2022 were retrospectively analyzed. All patients were examined by hydrogen proton magnetic resonance spectroscopy (1H-MRS) before operation. Among them, 32 cases were treated with 1H-MRS + yellow fluorescence staining technique (hereinafter referred to as the experimental group), and 58 cases were treated as the conventional operation group. The tumor distance of 42 patients was less than 1 cm from the ventricle, 32 cases were located in the forehead, 34 cases were located in the temporal part, 7 cases were located in the top part, 8 cases were located in the ventricle, 6 cases were located in the occipital part, and 3 cases were located in the cerebellum. Intraoperative neuroelectrophysiological monitoring or awake anesthesia was used in all patients. To compare Cho/NAA, Cho/Cr, NAA/Cr in 1H-MRI of high and low grade gliomas. Results: There were statistically significant differences in Cho/NAA, Cho/Cr, NAA/Cr in tumor parenchyma between high-grade glioma patients and low-grade glioma patients (P < 0.05). Cho/NAA and Cho/Cr in high-grade glioma were higher than those in low-grade glioma, and NAA/Cr in low-grade glioma was higher than those in high-grade glioma. There was significant difference between experimental group and conventional group (54.5% and 45.5%) (P < 0.001). When the distance to the ventricle was < 1 cm, the total resection rate of the experimental group and the conventional group (65.9% and 41.3%) was significantly different (P < 0.05). Conclusion: 1H-MRS combined yellow fluorescence staining can shorten the time of tumor resection, improve the degree of tumor resection and reduce the occurrence of perioperative complications in the treatment of glioma.
Keywords:Brain Glioma, Yellow Fluorescence Staining Technique, 1H-MRS

Copyright © 2024 by author(s) and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY 4.0).
http://creativecommons.org/licenses/by/4.0/


1. 引言
脑胶质瘤是指起源于脑神经胶质细胞的肿瘤,是最常见的原发性颅内肿瘤,2021年第五版世界卫生组织(WHO)中枢神经系统肿瘤分类将脑胶质瘤分为1~4级,1、2级为低级别脑胶质瘤(low-grade glioma, LGG),3~4级为高级别脑胶质瘤(high-grade glioma, HGG) [1] 。恶性脑胶质瘤患者的生存率较低,世界卫生组织(WHO)分级中III级者的5年生存率为24%,IV级者为4%。由于脑胶质瘤的生物学特性,术中常规显微镜白光下对肿瘤边缘的确定具有一定难度。近年来,术中指导脑胶质瘤切除的各种辅助方法相继问世,并得到迅速发展,比如神经导航、可视化荧光染色技术,术中MRI,术中CT,术中超声,术中唤醒麻醉及神经电生理监测等,使肿瘤的全切除率得到提高 [2] 。黄荧光染色技术主要是利用荧光素钠(sodium fluorescein, FL)可通过开放的血脑屏障使肿瘤染色,在特殊光线照射下肿瘤组织产生荧光,有助于区分正常脑组织、水肿及肿瘤组织,指导术者在术中较清楚地分辨瘤脑边界 [3] 。氢质子磁共振波谱(1H-magnetic resonance spectroscopy, 1H-MRS)能够对脑部肿瘤细胞的代谢产物浓度进行精准检测,同时具有无创性 [4] 。本文回顾性分析安徽医科大学第一附属医院神经外科于2020年1月至2022年12月采用手术治疗、经病理学证实的90例脑胶质瘤患者的临床资料,探讨联合运用1H-MRS和术中黄荧光染色技术在脑胶质瘤切除术中的作用。
2. 资料和方法
2.1. 临床资料
纳入的90例患者中,男50例(55.5%),女40例(44.5%);年龄为14~80岁。42例患者的肿瘤距离脑室小于1 cm,32例位于额部,34例位于颞部,7例位于顶部,8例位于脑室,6例位于枕部,3例位于小脑,I级,II级有23例,III级,IV级63例。所有患者均经术后病理学证实为脑胶质瘤。根据手术方式分为黄荧光染色技术组(32例,简称荧光组)和不使用黄荧光染色技术组(58例,简称常规手术组)。两组患者的性别、年龄、术前Karnofsky功能状态评分(KPS),以及WHO III、IV级者及肿瘤部位患者所占的比率差异均无统计学意义(均P > 0.05);荧光组中,距离脑室直径 ≤ 1 cm患者所占的比率低于常规手术组,差异有统计学意义(P < 0.05)。所有患者或家属对治疗知情同意并签署知情同意书。
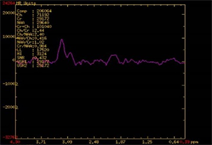
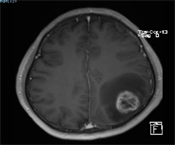
 (a) (b)(c)
(a) (b)(c)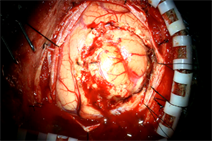

 (d) (e)(f)(a) 高级别胶质瘤患者术前1H-MRS;(b) 高级别胶质瘤患者术前增强MRI显示肿瘤呈囊实性改变,实质部分强化明显,瘤周水肿明显;(c) 高级别胶质瘤患者术后复查增强MRI显示肿瘤完全切除;(d) 普通光源模式下图像;(e) 荧光模式下图像;(f) 病理标本在荧光下图像。
(d) (e)(f)(a) 高级别胶质瘤患者术前1H-MRS;(b) 高级别胶质瘤患者术前增强MRI显示肿瘤呈囊实性改变,实质部分强化明显,瘤周水肿明显;(c) 高级别胶质瘤患者术后复查增强MRI显示肿瘤完全切除;(d) 普通光源模式下图像;(e) 荧光模式下图像;(f) 病理标本在荧光下图像。
Figure 1. Preoperative and postoperative images of high-grade glioma patients
图1. 高级别胶质瘤病例手术前后影像
2.2. 检查方法
采用GE3.0T磁共振扫描仪进行检测,受检者先行常规MRI扫描,后行1H-MRS。常规MRI:患者平躺于检测床上,采用头颈联合线圈,定位头扫描,定位像选择T2W1横,矢,冠状位,扫描时尽量包括对侧脑组织进行比较。扫描完成后,进行处理分析,得到波谱、解剖叠加图,对肿瘤实质区、周围水肿区进行采样、分析,绝对值测量法检测N-乙酰天门冬氨酸(N-acetyl asparticacid, NAA)、胆碱(choline, Cho)、肌酸(creatine, Cr)浓度,并计算NAA/Cr、Cho/Cr、NAA/Cho值。该步骤由两名科室中高资历影像医师共同诊断确定,出现分歧时需再次进行测量分析。
2.3. 黄荧光染色
术前1 h 30 min先行荧光素钠过敏试验,监测生命体征以及有无皮疹发生,如无异常,于术前1 h将浓度为20%的荧光素钠按2.5 mg/kg剂量进行静脉推注,再次监测生命体征以及有无皮疹发生。常规开颅,剪开硬脑膜,悬吊硬脑膜,充分显露脑胶质瘤,使用装有YELLOW 560 nm滤片的KINEVO900显微镜(德国蔡司公司)进行镜下观察和手术操作。根据黄荧光染色情况判断肿瘤边界,肿瘤邻近正常组织时黄染逐渐减弱、消退,对肿瘤边界的判定以术中首次观察到的黄染程度变化为准。当术中黄荧光标记肿瘤区域与术前神经导航标记区域存在差异时,需结合术前影像学检查定位,综合考虑确定肿瘤位置。当肿瘤临近功能区时,两组均使用神经电生理监测和(或)术中唤醒麻醉技术。切除过程中交替使用显微镜的普通模式和荧光模式。脑胶质瘤切除后,于白光条件下行硬膜和切口的缝合,术后神经外科ICU监护至少24小时,同时在24~72小时内进行术后增强MRI检查,评估肿瘤切除程度以及残留肿瘤体积。
3. 术后治疗
患者术后进行4周的放疗 + 替莫唑胺同步化疗,同时按时随访复查至少12个月。通过比较病人术前,术后影像学以及术中手术视野,术后病理情况,如图1。
4. 统计学方法
本研究所有数据采用SPSS 25.0软件进行统计分析,计量资料大于50例时行Kolmogorov-Smirmoy正态性检验,当计量资料小于50例时行ShaPiro-Wilk正态性检验,若数据呈正态分布用均数士标准差( )表示,两组间比较采用独立样本t检验,若数据呈非正态分布则用中位数(四分位数) M (P25, P75)表示,两组间比较采用Mamn-Whitney U检验,计数资料用频数(%)表示,组间比较采用卡方检验,所有统计检验均为双侧检验,采用单因素和多因素logistic回归分析方法分析肿瘤切除程度的影响因素。以P < 0.05为差异具有统计学意义。
5. 结果
1) 高级别胶质瘤患者和低级别胶质瘤患者肿瘤实质区域差异(P < 0.05),高级别胶质瘤Cho/NAA,Cho/Cr高于低级别胶质瘤,低级别胶质瘤NAA/Cr高于高级别胶质瘤。如表1。
Table 1. Analysis of metabolite indexes in tumor parenchyma of patients in the two groups
表1. 两组肿瘤患者肿瘤实质区代谢物指标分析
经Kolmogorov-Smirmoy正态性检验,NAA/Cr、Cho/Cr、Cho/NAA呈非正态分布则用中位数(四分位数) M (P25, P75)表示,两组间比较采用Mamn-Whitney U检验,P < 0.05为差异具有统计学意义。
2) 两组手术切除程度比较结果(表2):术后影像学证实,使用黄荧光组中肿瘤全切占75% (24/32),未使用黄荧光组中肿瘤全切占34.5% (20/58),差异均有统计学意义(均P < 0.05)。两组患者的手术时间、距离脑室 < 1 cm,术前KPS统计学意义(P < 0.05)。
Table 2. Comparison of clinical data of glioma patients between the two groups [cases (%)], M (P25, P75)
表2. 两组胶质瘤患者临床资料对比[例(%)]、M (P25, P75)
注:a为c2值,b为t值,c为Z值;经Kolmogorov-Smirmoy正态性检验,年龄、手术时间呈非正态分布则用中位数(四分位数) M (P25, P75)表示,两组间比较采用Mamn-Whitney U检验,计数资料用频数(%)表示,组间比较采用卡方检验,P< 0.05 为差异具有统计学意义。
3) 影响脑胶质瘤患者切除程度的相关分析结果:如表3可见,全切除组中,使用黄荧光占54.5% (24/44),非全切组中,使用黄荧光占17.4% (8/46)。全切除组中,距离脑室 < 1 cm占65.9% (29/44),非全切除组中,距离脑室 < 1 cm占41.3% (19/46)。差异具有统计学意义(均P < 0.05)。
Table 3. Comparison of experimental data between the two groups with or without tumor resection [example (%)], M (P25, P75)
表3. 是否肿瘤切除两组实验资料比较[例(%)]、M (P25, P75)
注:a为c2值,b为t值,c为Z值;经Kolmogorov-Smirmoy正态性检验,年龄、手术时间呈非正态分布则用中位数(四分位数) M (P25, P75)表示,两组间比较采用Mamn-Whitney U检验,计数资料用频数(%)表示,组间比较采用卡方检验,P < 0.05为差异具有统计学意义。
4) 影响距离脑室 < 1 cm脑胶质瘤患者全切程度的相关分析结果:如表4可见,在距离脑室 < 1 cm脑胶质瘤患者中,全切除组中使用黄荧光占比40% (6/15),非全切组中使用黄荧光占比11.1% (3/27)。差异具有统计学意义(均P < 0.05)。
Table 4. Comparison of experimental data between the two groups for tumor resection < 1 cm away from ventricle [example (%)], M (P25, P75)
表4. 距离脑室 < 1 cm是否肿瘤切除两组实验资料比较[例(%)]、M (P25, P75)
注:a为c2值,b为t值,c为Z值;经ShaPiro-Wilk正态性检验,年龄、手术时间呈非正态分布则用中位数(四分位数) M (P25, P75)表示,两组间比较采用Mamn-Whitney U检验,计数资料用频数(%)表示,组间比较采用卡方检验,P < 0.05为差异具有统计学意义。
6. 讨论
脑胶质瘤在恶性颅脑肿瘤中所占比例最大 [5] ,侵袭性和致死率较高 [6] 。近年来,临床癌症研究取得了很大的进展。尽管如此,总生存率(OS)仍然很低 [7] 。目前的治疗方案包括根治性手术切除、放疗和化疗。然而,这些传统的方法在治疗这种恶性疾病方面存在许多局限性,具有较高的复发风险。此外,放疗和化疗可导致其他重要器官的毒性,从而导致患者的生活质量下降 [8] [9] 。
随着我们对脑胶质瘤病理学知识的增加,传统的MRI在我们的临床工作中透露出许多不足,尤其是在随访和鉴别高级别胶质瘤的放射性坏死、假性进展和肿瘤进展方面。除了常规的结构序列外,在这些肿瘤的诊断和随访中,其他的序列应该提供关于胶质瘤病理更多的信息 [10] 。MRS是一种特殊的磁共振技术,用于量化组织的体素(体积像素)中的不同代谢物。在临床工作中,常使用氢或者质子磁共振波谱,1H-MRS的主要代谢物是N-乙酰天冬氨酸(NAA)、胆碱(Cho)和肌酸(Cr),它们是常用于临床诊断和随访各种脑病变 [11] ,同时也是目前唯一的能够进行无创探测活体化合物含量的技术。由于不同原子核所处的内环境不同,其共振频率有所差异,产生的磁共振强度也不同,使得不同的代谢产物在不同的位置形成特异波峰,该峰的面积代表共振的质子数,反映代谢物的浓度,因此可以做到精准定位。在本实验中,所检测患者Cho/NAA最大值为7.56,最低值为1.03,其中低级别胶质瘤的Cho/NAA平均值为2.14,高级别胶质瘤的Cho/NAA平均值为6.31。检测患者Cho/Cr最大值为6.83,最低值为1.48,其中低级别胶质瘤的Cho/Cr平均值为2.18,高级别胶质瘤的Cho/Cr平均值为4.71。检测患者NAA/Cr最大值为2.34,最低值为0.34,其中低级别胶质瘤的NAA/Cr平均值为1.36,高级别胶质瘤的NAA/Cr平均值为0.47。Porto等认为在判断恶性肿瘤的最佳指标是NAA/Cho比值。与低级别胶质瘤相比,高级别胶质瘤的NAA减少,Cho增加 [12] 。本文结果显示,高级别胶质瘤Cho/NAA,Cho/Cr高于低级别胶质瘤,低级别胶质瘤NAA/Cr高于高级别胶质瘤(P < 0.05),这一结果进一步诠释了术前行1H-MRS必要性。根据常规MRI,术前胶质瘤的分级是困难的,特别是在没有明显水肿或增强的情况下。即使是在高级别胶质瘤中,这也是一个常见的诊断难题。在诊断不确定的情况下,可以使用MRS获得额外的信息。联合影像组学特征和Cho/NAA预测胶质瘤分级,并将模型可视化为影像组学列线图,校准曲线显示出良好的分级诊断效力 [13] 。Toyooka也报道,在脑胶质瘤中,一般的规则是NAA和Cr降低,其他代谢物随着肿瘤分级的升高而增加,以及肌醇的存在来预测较低分级的病变 [14] 。此外,有研究表明,还可利用1H-MRS对脑膜瘤,脑转移瘤,脑胶质瘤进行鉴别诊断,脑膜瘤组织中几乎不存在NAA,脑转移瘤NAA,Cho变化不如脑胶质瘤 [15] 。部分胶质瘤患者首发症状为癫痫,尤其是颞叶高级别胶质瘤 [16] ,有研究表明,海马硬化的患者也可出现癫痫,往往海马硬化的患者NAA水平显著降低 [17] 。MRS在术后随访中很重要,特别是在高级别胶质瘤中。如前所述,MRS被用作脑胶质瘤的诊断和随访的一种有价值的工具 [18] 。脑照射后可观察到肿瘤残留的体积或肿瘤复发。此外,肿瘤切除后,经过规律的放化疗后,会出现放射性坏死,假性进展和肿瘤复发这三种情况。放射性坏死被认为是放射治疗后坏死脑组织的发展,约20%的GBM患者在放射治疗后3个月至1年出现,特别是在接受过高放射剂量的放疗 [19] 和过度化疗后 [20] 。假性进展被定义为一种短暂的和自限的体积增加,约20%化疗放疗的患者在放疗开始后2~5个月出现,它被认为是治疗反应和血脑屏障崩溃的混合效应。由于与复发性肿瘤的鉴别困难,建议采用频繁的MRI密切监测,以免误诊假性进展和肿瘤复发 [21] 。假性进展和肿瘤复发之间的区别一直是临床工作的困难,单独使用常规MRI很难区分,但我们在使用1H-MRS可利用Cho/NAA和Cho/Cr比值的增加与肿瘤复发相对应 [22] 。假性进展可根据MRS上的脂质信号升高来诊断。最近一些研究小组希望进一步分类胶质瘤,以此预测肿瘤复发的潜力。Galijašević研究表明,随着MGMT和EGFR状态的变化的GBM的能量代谢物的差异,无论MGMT状态如何,在MGMT甲基化和EGFR扩增肿瘤中细胞繁殖更快,在EGFR扩增肿瘤中有更高的凋亡活性 [23] 。
黄荧光染色所使用的荧光素钠是一种低分子的有机物,具有荧光特性 [24] 。因为脑肿瘤的缘故,大脑原有的血脑屏障受到破坏,此时荧光素钠可通过血脑屏障进入肿瘤组织,并且在肿瘤组织中蓄积,在显微镜下用黄色560 nm滤镜下,荧光素钠充分染色肿瘤,同时保留周围的实质,从而在肿瘤和正常的大脑之间形成一个可区分的边界,手术显微镜与专门的滤镜有助于肿瘤大体全切除,并通过术后MRI得到验证。在给药过程中没有发现与荧光素钠相关的并发症或任何不良副作用。Jesper研究表明,使用荧光素钠定位和切除肿瘤的可用性很高,手术并发症最小,切除率和生存率均符合国际标准,尤其是高级别胶质瘤,荧光素钠是外科医生在荧光引导手术下切除胶质母细胞瘤和脑转移瘤的一个有效和有用的工具 [25] 。Jared F等认为,比较了胶质母细胞瘤(GBM)患者样本的荧光素钠(SF)和术中超声(IOUS)作为术中成像方式,SF的平均切除范围(94% ± 11%)显著高于IOUS (87% ± 20%; P = 0.032) [26] 。部分胶质瘤与脑脓肿具有相似的影像,但肿瘤组织高代谢特性,染色更加明显,可减少误诊可能 [27] 。
脑室旁的胶质瘤由于其位置较深以及与重要的神经和血管结构的关系,对患者来说具有极高的手术风险,对神经外科医生来说是一个巨大的挑战 [28] 。在现代,随着对功能神经解剖学、神经成像和显微外科技术的理解的提高,尤其是黄荧光显微镜的使用,神经外科医生可以成功对脑室旁的胶质瘤进行手术,尤其是高级别胶质瘤 [29] 。但不可避免的会出现各种手术并发症,总的来说,最常见的术后并发症是癫痫发作,其他包括脑积水,伤口部位感染,脑室内感染,脑出血等。在我们的研究中,使用黄荧光的情况下,全切除组中,距离脑室 < 1 cm占65.9% (29/44),非全切除组中,距离脑室 < 1 cm占41.3% (19/46),差异具有统计学意义(均P < 0.05)。通过黄荧光染色,可以提高肿瘤全切率,同时降低癫痫发作的可能性。如患者术后出现癫痫发作,予以丙戊酸钠缓释片或左乙拉西坦片,或者两者联用,同时术后一年内无癫痫发作,复查脑电图未见异常才考虑停药。
7. 总结
综上所述,1H-MRS可在术前评估胶质瘤的分级,同时监测术后肿瘤的假性进展和肿瘤进展,联合使用黄荧光染色技术,可使肿瘤与正常脑组织分界清晰,具有手术高效性和高安全性,大大提高肿瘤的切除率,改善患者的预后。神经外科医生有多种术中神经成像方式,包括术中MRI、术中CT、术中超声和术中荧光成像(荧光素钠)。每种方法都有自己的好处和局限性,对于哪种模式更好,仍然没有共识。选择通常是基于外科医生的偏好和资源可用性。在我们研究小组,对于高级别胶质瘤,尤其是距离脑室 < 1 cm,通过术前完善1H-MRS,术中使用荧光素钠,可以最大程度切除肿瘤,同时降低手术并发症的发生,将治疗效果最大化,值得推广。
文章引用
袁启友,张晓东,蒿玉兴,陈为为,代兴亮,叶 雷. 黄荧光染色技术联合1H-MRS治疗脑胶质瘤的临床疗效
Clinical Efficacy of Yellow Fluorescence Staining Combined with 1H-MRS in the Treatment of Brain Glioma[J]. 临床医学进展, 2024, 14(01): 1059-1068. https://doi.org/10.12677/ACM.2024.141153
参考文献
- 1. 国家卫生健康委员会医政医管局, 中国抗癌协会胶质瘤专业委员会. 脑胶质瘤诊疗指南(2022版) [J]. 中华神经外科杂质, 2022, 38(8): 757-777.
- 2. 吴劲松, 周良辅. 脑胶质瘤的外科手术近代观点[J]. 复旦大学学报, 2017, 44(6): 724-732.
- 3. 田海龙, 祖玉良, 何伟. 磁共振波谱联合荧光素钠导航显微手术切除幕上高级别胶质瘤的随访结果和临床意义[J]. 中国医学科学院学报, 2017, 39(5): 643-648.
- 4. 卢玉花, 申晓俊, 朱羽苑. 弥散张量纤维束成像联合氢质子此工作波谱对脑胶质瘤病理分级的诊断价值[J]. 癌症进展, 2023, 21(11): 1208-1211.
- 5. Davis, M.E. (2018) Epidemiology and Overview of Gliomas. Seminars in Oncology Nursing, 34, 420-429. https://doi.org/10.1016/j.soncn.2018.10.001
- 6. Ostrom, Q.T., Bauchet, L., Davis, F.G., et al. (2014) The Epide-miology of Glioma in Adults: A “State of the Science” Review. Neuro-Oncology, 16, 896-913. https://doi.org/10.1093/neuonc/nou087
- 7. Lim, M., Xia, Y., Bettegowda, C., et al. (2018) Current State of Im-munotherapy for Glioblastoma. Nature Reviews Clinical Oncology, 15, 422-442. https://doi.org/10.1038/s41571-018-0003-5
- 8. 李德培, 陈忠平. 脑胶质瘤治疗现状与进展[J]. 实用医学杂质, 2021, 37(18): 2312-2316.
- 9. Wu, H., Wei, M., Li, Y., et al. (2022) Research Progress on the Regulation Mecha-nism of Key Signal Pathways Affecting the Prognosis of Glioma. Frontiers in Molecular Neuroscience, 15, Article ID: 910543. https://doi.org/10.3389/fnmol.2022.910543
- 10. Duc, N.M., Huy, H.Q., Nadarajan, C., et al. (2020) The Role of Predictive Model Based on Quantitative Basic Magnetic Resonance Imaging in Differentiating Medulloblastoma from Ependymoma. Anticancer Research, 40, 2975-2980. https://doi.org/10.21873/anticanres.14277
- 11. Durmo, F., Rydelius, A., Baena, S.C., et al. (2018) Multivoxel 1H-MR Spectroscopy Biometrics for Preoprerative Differentiation between Brain Tumors. Tomography, 4, 172-181. https://doi.org/10.18383/j.tom.2018.00051
- 12. Porto, L., Kieslich, M., Franz, K., et al. (2011) MR Spectroscopy Differentiation between High and Low Grade Astrocytomas: A Comparison between Paediatric and Adult Tumours. Eu-ropean Journal of Paediatric Neurology, 15, 214-221. https://doi.org/10.1016/j.ejpn.2010.11.003
- 13. 宋静, 宗会迁, 张娅, 等. 磁共振波谱联合减影技术在高级别胶质瘤影像组学分级预测的研究[J]. 磁共振成像, 2023, 14(6): 59-65.
- 14. Toyooka, M., Kimura, H., Uematsu, H., et al. (2008) Tissue Characterization of Glioma by Proton Magnetic Resonance Spectroscopy and Perfusion-Weighted Magnetic Resonance Imaging: Glioma Grading and Histological Cor-relation. Clinical Imaging, 32, 251-258. https://doi.org/10.1016/j.clinimag.2007.12.006
- 15. 郭鹏, 袁晓婷, 等. 氢质子磁共振波谱对脑膜瘤, 脑胶质瘤及脑转移瘤的鉴别诊断价值[J]. 中国实用医刊, 2021, 48(24): 72-75.
- 16. 蒿玉兴, 陈为为, 张晓东. 影响成人高级别胶质瘤患者预后因素分析[J]. 医药前沿, 2022, 12(36): 4-7.
- 17. 来青伟, 等. 颞叶癫痫患者海马区1H-MRS代谢物与外周血T淋巴细胞亚群、细胞因子的相关性分析[J]. 中华行为医学与脑科学杂志, 2021, 30(12): 1095-1101.
- 18. Gülin, Ö.Z. (2014) Clinical Proton MR Spectroscopy in Central Nervous System Disorders. Radiology, 270, 658-679.
- 19. Ruben, J.D., Dally, M., Bailey, M., et al. (2006) Cerebral Radiation Necrosis: Incidence, Outcomes, and Risk Factors with Emphasis on Radiation Parameters and Chemotherapy. International Journal of Radiation Oncology Biology Physics, 65, 499-508. https://doi.org/10.1016/j.ijrobp.2005.12.002
- 20. Chamberlain, M.C., Glantz, M.J., Chalmers, L., et al. (2006) Early Necrosis Following Concurrent Temodar and Radiotherapy in Patients with Glioblastoma. Journal of Neu-ro-Oncology, 82, 81-83. https://doi.org/10.1007/s11060-006-9241-y
- 21. Easaw, J.C., et al. (2011) Canadian Recommendations for the Treatment of Recurrent or Progressive Glioblastoma Multiforme. Practice Guideline Series, 18, 126-136. https://doi.org/10.3747/co.v18i3.755
- 22. Amin, A., Moustafa, H., Ahmed, E., et al. (2011) Glioma Residual or Recurrence versus Radiation Necrosis: Accuracy of Pentavalent Technetium-99m-Dimercaptosuccinic Acid [Tc-99m (V) DMSA] Brain SPECT Compared to Proton Magnetic Resonance Spectroscopy (1H-MRS): Initial Results. Journal of Neuro-Oncology, 106, 579-587. https://doi.org/10.1007/s11060-011-0694-2
- 23. Galijašević, M., Steiger, R., Radović, I., et al. (2021) Phospho-rous Magnetic Resonance Spectroscopy and Molecular Markers in IDH1 Wild Type Glioblastoma. Cancers, 13, Article No. 3569. https://doi.org/10.3390/cancers13143569
- 24. Pogue, B.W., Gibbs-Strauss, S.L., Valdés, P.A., et al. (2010) Review of Neurosurgical Fluorescence Imaging Methodologies. IEEE Journal of Selected Topics in Quantum Electronics, 16, 493-505. https://doi.org/10.1109/JSTQE.2009.2034541
- 25. Bömers, J.P., Danielsen, M.E., Schulz, M.K., et al. (2020) So-dium Fluorescein Shows High Surgeon-Reported Usability in Glioblastoma Surgery. The Surgeon, 18, 344-348. https://doi.org/10.1016/j.surge.2020.01.003
- 26. Sweeney, J.F., Rosoklija, G., Sheldon, B.L., et al. (2022) Com-parison of Sodium Fluorescein and Intraoperative Ultrasonography in Brain Tumor Resection. Journal of Clinical Neu-roscience, 106, 141-144. https://doi.org/10.1016/j.jocn.2022.10.019
- 27. 向琰, 秦逊, 李瑶, 等. 荧光引导下脑脓肿切除术的临床应用研究[J]. 临床神经外科杂志, 2023, 20(5): 549-555.
- 28. Elwatidy, S.M., Albakr, A.A., Al Towim, A.A., et al. (2020) Tumors of the Lateral and Third Ventricle: Surgical Management and Outcome Analysis in 42 Cases. Neurosciences, 22, 274-281. https://doi.org/10.17712/nsj.2017.4.20170149
- 29. Di Carlo, D.T., Cagnazzo, F., Anania, Y., et al. (2019) Post-Operative Morbidity Ensuing Surgery for Insular Gliomas: A Systematic Review and Meta-Analysis. Neurosurgi-cal Review, 43, 987-997. https://doi.org/10.1007/s10143-019-01113-4
NOTES
*通讯作者。
