Advances in Clinical Medicine
Vol.
12
No.
01
(
2022
), Article ID:
47887
,
9
pages
10.12677/ACM.2022.121017
真实世界中表皮生长因子受体酪氨酸激酶 抑制剂(吉非替尼或埃克替尼)在非小细胞 肺癌患者术后辅助治疗中的临床疗效分析
王化锋*,艾江山,胡世宇#
青岛大学附属医院,山东 青岛
收稿日期:2021年12月11日;录用日期:2022年1月1日;发布日期:2022年1月12日

摘要
目的:探讨接受第一代表皮生长因子受体酪氨酸激酶抑制剂(吉非替尼或埃克替尼)作为术后辅助治疗的非小细胞肺癌患者的预后以及影响预后的因素。方法:纳入2015-4月至2020-6月于我院胸外科行完全切除的表皮生长因子受体突变阳性的非小细胞肺癌患者,共纳入108名患者,43名接受埃克替尼作为辅助治疗,65名接受吉非替尼作为辅助治疗,主要研究目的为中位无病生存期、2年无病生存率以及药物相关不良反应发生率,次要研究目的为探究影响接受表皮生长因子受体酪氨酸激酶抑制剂作为辅助治疗的非小细胞肺癌患者的预后因素。结果:总体人群的中位无病生存期为42.7个月,接受吉非替尼治疗的患者中位无病生存期为41.2个月,接受埃克替尼治疗的患者中位无病生存期为42.7个月(p = 0.73; HR = 0.90 (0.49~1.65)),两组差异无统计学意义;2年无病生存率:86% vs 81% (p = 0.51; HR = 1.42 (0.50~4.03)),差异无统计学意义,吉非替尼相比于埃克替尼在不良反应发生率方面无统计学差异(70.8% vs 60.5%; p = 0.27),19-Del相比于21-L858R中位无病生存期无统计学差异(42.7 vs 41.2; p = 0.28; HR = 1.39 (0.76~2.54));有无肺气肿个人史以及有无恶性肿瘤家族史对接受表皮生长因子受体酪氨酸激酶抑制剂的患者预后无影响(41.9 vs 42.7; p = 0.68; HR = 1.16 (0.58~2.31))、(42.7 vs 41.9; p = 0.74; HR = 1.11 (0.52~2.09))。结论:在表皮生长因子受体突变阳性的完全切除的非小细胞肺癌患者中,与既往研究相比,接受表皮生长因子受体酪氨酸激酶抑制剂(吉非替尼或埃克替尼)治疗的患者相比于接受化疗的患者有更长的无病生存期,吉非替尼与埃克替尼相比在无病生存期以及药物不良反应发生率方面无统计学差异,推荐吉非替尼或埃克替尼应用于表皮生长因子受体突变阳性的完全切除的非小细胞肺癌患者的术后辅助治疗。
关键词
表皮生长因子受体酪氨酸激酶抑制剂,非小细胞肺癌,辅助治疗,真实世界研究

The Clinical Efficacy of EGFR-TKIs (Gefitinib or Icotinib) in Adjuvant Therapy for Patients with NSCLC in the Real World
Huafeng Wang*, Jiangshan Ai, Shiyu Hu#
The Affiliated Hospital of Qingdao University, Qingdao Shandong
Received: Dec. 11th, 2021; accepted: Jan. 1st, 2022; published: Jan. 12th, 2022

ABSTRACT
Purpose: To investigate the clinical efficacy and prognostic factors in patients with NSCLC receiving first generation EGFR-TKIs (Gefitinib or Icotinib) as adjuvant therapy in the real world. Method: A total of 108 patients with EGFR mutation-positive (Exon 19-deletions or Exo-n 21-Leu858Arg) NSCLC who underwent R0 resection between April 2014 and June 2020 were included. 65 patients received gefitinib, and 43 patients received icotinib. Primary objectives were median disease-free survival, 2-year disease-free survival, and incidence of drug-related adverse reactions. Secondary objectives were to explore prognostic factors affecting patients with NSCLC who received epidermal growth factor receptor tyrosine kinase inhibitors as adjunctive therapy. Result: The median disease-free survival of a total of 108 patients was 42.7 months; Icotinib (n = 43) was non-inferior to gefitinib (n = 65) in terms of median disease-free survival (42.7 vs 41.2; p = 0.73; HR = 0.90 (0.49~1.65)); 2-year disease-free survival (DFS) rate was not statistically different (86% vs 81%; p = 0.51; HR = 1.42 (0.50~4.03)), as well as incidence rate of adverse events (70.8% vs 60.5%; p = 0.27). There was no statistical difference between Exon 19-deletions and Exon 21-Leu 858 Arg in median disease free survival (42.7 vs 41.2; p = 0.28; HR = 1.39 (0.76~2.54)); emphysema and family history of malignancy had no effect on the prognosis in patients receiving EGFR-TKIs as adjuvant therapy with NS-CLC (41.9 vs 42.7; p = 0.68; HR = 1.16 (0.58~2.31)), (42.7 vs 41.9; p = 0.74; HR = 1.11 (0.52~2.09)). Conclusion: In patients with EGFR mutation-positive NSCLC who underwent R0 resection, compared with previous studies whose patients received standard chemotherapy, patients who received gefitinib or icotinib as adjuvant therapy had longer disease-free survival, and there was no statistical difference in patients receiving gefitinib or icotinib in terms of disease-free survival and Incidence rate of adverse events. It is recommended that gefitinib or icotinib be used as adjuvant therapy in patients with EGFR mutation-positive NSCLC who underwent R0 resection.
Keywords:EGFR-TKIs, NSCLC, Adjuvant Therapy, Real-World Study

Copyright © 2022 by author(s) and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY 4.0).
http://creativecommons.org/licenses/by/4.0/


1. 引言
在2020年,肺癌发病率位居全球第二(11.4%),仍然是癌症相关死亡的主要原因 [1],手术治疗是早期及局部晚期非小细胞肺癌的最佳治疗方式 [2] [3] [4],但仅占非小细胞肺癌总数的20%~25%,完整切除的NSCLC患者接受含铂双药化疗可使生存进一步获益 [4] [5] [6],但是化疗相关的药物不良反应严重影响患者的生活质量 [4]。因此更多的术后辅助治疗策略需要被探索,表皮生长因子受体(epidermal growth factor receptor, EGFR)是广泛分布于哺乳动物上皮细胞表面的一种糖蛋白受体,在肿瘤的发生、发展过程中发挥了重要作用,表皮生长因子受体酪氨酸激酶抑制剂(epidermal growth factor receptor tyrosine kinase inhibitors, EGFR-TKIs)通过选择性结合表皮生长因子受体细胞内酪氨酸激酶域的ATP结合位点,进而达到抑制酪氨酸激酶活化及阻断信号转导途径的效果,从而抑制肿瘤的发生发展 [7]。
近些年来,EGFR-TKIs在非小细胞肺癌的患者中得到了广泛应用,在晚期EGFR突变阳性的非小细胞肺癌患者中,第一代EGFR-TKIs (吉非替尼、厄洛替尼、埃克替尼)在生存获益以及不良反应发生率方面均优于标准化疗方案,OPTIMAL等研究 [8] [9] [10] 将厄洛替尼用于晚期EGFR突变阳性的非小细胞肺癌的患者中,与标准化疗方案相比,厄洛替尼对EGFR突变阳性的晚期非小细胞肺癌患者具有明显的无进展生存优势,并与更好的耐受性有关,提示厄洛替尼在晚期EGFR突变阳性的非小细胞肺癌患者的一线治疗占据重要地位,其他几项关于吉非替尼和埃克替尼在晚期非小细胞肺癌中的应用得出了类似的结果 [11] [12]。ICOGEN研究则比较了吉非替尼和埃克替尼在晚期EGFR突变阳性的非小细胞肺癌患者中的应用:埃克替尼与吉非替尼相比在生存获益方面相似,但埃克替尼的药物相关不良反应发生率低于吉非替尼(p = 0.046)。
在EGFR突变阳性的非小细胞肺癌患者术后辅助治疗中,ADJUVANT等研究 [13] [14] [15] 证明第一代EGFR-TKIs在无病生存期方面同样优于标准化疗方案,且不良反应发生率较低,但EGFR-TKIs能否使患者总生存期获益存在争议,目前仅有EVAN研究得出了阳性结果。目前几项随机对照研究已经证明EGFR-TKIs在术后辅助治疗中的生存获益,但由于随机对照研究严格的入组标准,结果需要在真实世界中进一步验证,而且部分EGFR突变阳性人群无法从辅助EGFR-TKIs中获益,因此本研究探讨接受第一代EGFR-TKIs (吉非替尼或埃克替尼)作为术后辅助治疗的非小细胞肺癌患者的预后以及影响预后的因素。
2. 研究对象及方法
2.1. 研究对象
本研究回顾性纳入在2015年4月至2020年6月于青岛大学附属医院胸外科接受肺癌根治术的非小细胞肺癌患者108例,所有患者术前均行PET-CT或者胸部增强CT、上腹部增强CT、颅脑MRI、全身骨显像,全身浅表淋巴结超声等辅助检查以排除转移可能。肺癌分期在术后进行,依据国际肺癌研究学会(IASLC)第8版肺癌TNM分期。入组标准:1) 均行根治性肺癌切除术(包括系统性淋巴结清扫),术后病理学证实切缘阴性(R0)且确诊为II~IIIA期的非小细胞肺癌;2) 病理标本行ARMAS-PCR法基因检测或NGS基因检测存在EGFR常见突变,包括Exon 19-deletions or Exon 21-Leu858Arg;3) 患者术后恢复顺利,无严重术后并发症且进一步行靶向治疗(吉非替尼或者埃克替尼)。排除标准:合并严重基础性疾病,如半年内心肌梗死、心绞痛或间质性肺炎病史;既往存在恶性肿瘤,既往接受放疗。允许患者术后接受辅助化疗,允许患者行肺段切除或楔形切除。本研究这根据“赫尔辛基人体医学研究伦理原则宣言”进行且经过青岛大学附属医院医学伦理委员会审核批准。
2.2. 治疗方案及临床随访
患者接受吉非替尼250 mg/qd,或埃克替尼125 mg/tid口服。所有患者均根据药物不良反应程度调整用药剂量、中断、终止用药直至病情进展。治疗前对患者行PET-CT或者胸部增强CT、上腹部增强CT或腹部超声、颅脑MRI、骨扫描,浅表淋巴超声等辅助检查以排除潜在的转移,术后前2年每6个月随访1次、3~5年每1年随访一次1次;复发转移及药物相关不良反应的信息通过电话随访或门诊复查的形式收集,患者每次复查行胸部CT、上腹部CT扫描或腹部超声检查以及血液学检验(血常规、肝肾功能及肿瘤标志物等),无症状时,颅脑MRI、全身骨显像每年复查一次,若出现颅脑或骨骼转移症状时加做颅脑MRI或全身骨显像检查,并进行全身评估。依据美国国立癌症研究所通用不良事件术语标准5.0版本(CTCAE5.0)将不良事件分为0~5级,≥3级为严重不良反应。
2.3. 统计学分析
主要研究终点为无病生存期,2年无病生存率,以及药物相关不良反应发生率,次要研究终点为总生存期,采用IBM SPSS 26.0软件进行生存分析,采用Kaplan-Meier方法计算生存中位数以及95%可信区间、绘制生存曲线,HR值估计协变量对生存的影响,p < 0.05为差异有统计学意义(双尾),采用卡方检验比较生存率之间的差异,利用R语言绘制无病生存期的亚组分析的森林图。
3. 结果
3.1. 基线特征
在2015-4月至2020-6月,共纳入108名II~IIIA期、EGFR突变阳性的完全切除的非小细胞肺癌患者,接受吉非替尼治疗的患者共65人,接受埃克替尼治疗的患者共43人,总体中位随访时间是36.5个月,接受吉非替尼治疗的患者中位随访时间是36.6个月,接受埃克替尼治疗的患者中位随访时间为38.2个月,总体人群中位治疗时间24个月(IQR: 17.0~34.8),吉非替尼组的中位治疗时间25个月(IQR: 16.5~34.0),埃克替尼组的中位治疗时间24个月(IQR: 17~35),吉非替尼组5人进行了术后辅助化疗,4人完成4周期辅助化疗,1人完成1周期化疗;埃克替尼组10人进行术后辅助化疗,9人完成了4周期化疗,1人完成了2周期化疗。除辅助化疗外(p = 0.027),两组基线特征平衡,详见表1。
Table 1. The baseline data of the two groups were compared
表1. 比较两组基线资料
3.2. 生存分析
总体人群的中位无病生存期为42.7个月,吉非替尼组的患者中位无病生存期41.2个月,埃克替尼组的患者无病生存期42.7个月(p = 0.73; HR = 0.90 (0.49~1.65)),两者差异无统计学意义;2年无病生存率:86% vs 81% (p = 0.51; HR = 1.42 (0.50~4.03)),差异无统计学意义。亚组分析:19-Del相比于21-L858R中位无病生存期无统计学差异(42.7 vs 41.2; p = 0.28; HR = 1.39 (0.76~2.54));无肺气肿个人史与有肺气肿个人史的患者中位无病生存期无统计学差异(41.9 vs 42.7; p = 0.68; HR = 1.16 (0.58~2.31)),有无恶性肿瘤家族史对接受EGFR-TKIs的患者预后无影响(42.7 vs 41.9; p = 0.74; HR = 1.11 (0.52~2.09))。生存曲线详见图1,亚组分析详见图2。
 (a)
(a)
 (b)
(b)
 (c)
(c)
 (d)
(d)
Figure 1. Survival curve of patients receiving EGFR-TKIs. (a) Survival curve of gefintinb and icotinib; (b) Survival curve of 19-del and 21-l858r; (c) Survival curve of emphysema (yes or no); (d) Survival curve of family history of malignance (yes or no)
图1. 接受EGFR-TKIs治疗的患者的生存曲线。(a) 吉非替尼和埃克替尼;(b) 19-del和21-l858r;(c) 有无肺气肿个人史;(d) 有无恶性肿瘤家族史
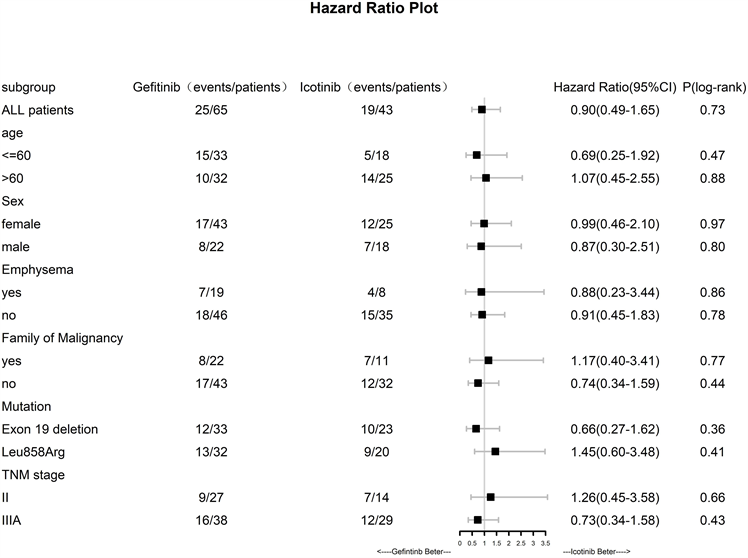
Figure 2. Subgroup analyses of disease-free survival
图2. 无病生存期的亚组分析森林图
3.3. 药物相关不良事件
埃克替尼组26人(60.5%)发生任何级别的不良事件,最常见的不良事件是皮疹,共17人(39.5%),1人出现3级以上的皮疹,5人出现任意级别的口腔溃疡(11.6%),其中1人出现3级以上的口腔溃疡,6人出现腹泻(14.0%),6人出现转氨酶升高(14.0%);吉非替尼组46人发生任何级别的不良事件(70.8%),最常见的不良事件是皮疹,共36人(55.4%),9人出现了3级以上的AE,11人出现了任意级别的口腔溃疡(17%),18人出现任意级别的腹泻(27.7%),2人出现了3级以上的腹泻,12人出现了转氨酶升高(18.9%),7人出现了白细胞减少(10.8%)。无药物相关性死亡及间质性肺炎发生,详见表2。
Table2. Adverse events
表2. 不良事件
3.4. 复发风险
到截止日期共44人出现复发:吉非替尼组25人出现复发事件,埃克替尼组19人出现复发事件,埃克替尼组:1人出现单纯局部复发(吻合器残端复发),13人出现了远处复发,其中2人同时伴有中枢神经系统转移,5人仅存在脑转移转移,吉非替尼组:3人出现了局部复发,1人为单纯右肺门淋巴结转移,1人同时伴脑转移,1人同时伴骨转移,15人出现了远处转移,其中一人伴中枢神经系统转移,8人仅出现脑转移。将复发或转移的部位定义为3种(局部复发:支气管残端或原发肿瘤叶内复发,或在肺门、同侧纵隔或隆突下淋巴结内复发;远处转移(除中枢神经系统转移):对侧纵隔、对侧肺门、同侧或对侧斜角肌或锁骨上淋巴结转移,其他同侧叶或对侧叶、胸膜、心包、肝、骨、肾上腺和脾脏等处的转移;中枢神经系统转移:存在脑转移的患者) [16]。只记录首次复发的部位和日期。复发部位可以是一个、两个或多个。局部复发合并远处转移的患者仅在远处转移组记录。颅外和中枢神经系统合并转移的患者仅记录在中枢神经系统转移组。详见表3。
Table 3. Tumor recurrences in different anatomic sites
表3. 位于不同部位的肿瘤复发
4. 讨论
EGFR-TKIs在EGFR突变阳性的非小细胞肺癌患者中得到了广泛的应用,相比于标准化疗方案,更长的生存获益以及更低的药物相关不良反应发生率是EGFR-TKIs一大优势,但并不是所有接受EGFR-TkIs的EGFR突变阳性的NSCLC患者都可以获得生存获益,不同的人群存在不同的临床结局。
本研究是一个单中心的回顾性研究,纳入本中心共108名接受EGFR-TKIs作为辅助治疗的非小细胞肺癌患者,中位无病生存期与标准化疗方案相比显著提高,与EVAN研究(42.4个月)以及EVDIENCE研究的中位无病生存期相似(47个月),高于ADJUVANT研究的中位无病生存期(28.7个月),原因未知,而且跨试验的比较不可信。
在晚期EGFR突变阳性的非小细胞肺癌患者中,ICOGEN研究 [17] 证明吉非替尼与埃克替尼相比生存获益相当,但接受埃克替尼治疗的患者药物相关不良反应发生率优于接受吉非替尼治疗的患者(p = 0.046),而在Liang等人的研究 [18] 中比较了在EGFR突变阳性的非小细胞肺癌患者中接受第一代EGFR-TKIs (吉非替尼、埃克替尼、厄洛替尼)治疗的效果,结果证明三种EGFR-TKIs效果相当,生存获益无统计学差异(p = 0.22),而本研究中吉非替尼与埃克替尼相比,生存获益以及药物相关不良反应发生率均无统计学差异,但接受吉非替尼治疗的患者药物相关性腹泻的发生人数高于接受埃克替尼治疗的患者(27.7% vs 14%; p = 0.09),原因可能与本研究是个回顾性的小样本研究有关。在亚组分析方面,EGFR突变类型、有无肺气肿个人史,以及有无恶性肿瘤肿瘤家族史对于接受EGFR-TKIs作为术后辅助治疗的非小细胞肺癌患者的预后无影响,但有研究 [19] [20] 表明在晚期NSCLC中19-del的生存获益优于21-L858R,而造成这一差异的原因可能与分子结构、EGFR共突变、肿瘤的TMB、突变丰度和肿瘤的生物学行为有关 [21],在复发事件方面:总体人群中共44人出现复发,最常见的复发转移部位为颅外远处转移(25人),而在Xu等人研究 [15] [16] 接受EGFR-TKIs治疗的患者最常见的复发部位为脑转移,造成这种差异的原因可能与本研究是一个回顾性的研究,存在一定的选择偏倚,预后较好的患者容易入组,而脑转移的患者与较差的预后有关 [22],在晚期非小细胞肺癌患者中,Wu等研究 [23] 证明接受奥希替尼组的中枢神经系统的中位无进展生存期显著优于化疗组(11.7个月vs 5.6个月(HR = 0.32; p = 0.004)),而在接受奥希替尼作为术后辅助治疗的非小细胞肺癌患者中表现出了类似的中枢神经系统的获益(HR = 0.18; 95% CI = 0.10~0.33) [24],奥希替尼可显著降低脑转移的发生率。
本研究是一个小样本量的回顾性研究,存在不可避免的混杂偏倚,在基线特征方面,埃克替尼组接受术后辅助化疗的患者多于吉非替尼组接受辅助化疗的患者,可能会对结果产生一定的影响,Wu等人研究 [25] 表明在晚期非小细胞肺癌中,接受靶向治疗加化疗的患者相比于仅接受靶向治疗的患者,显著提高了无进展生存期、总生存期以及客观反应率,同时增加了化疗相关的不良反应发生率,但是不良反应耐受性良好,临床可控,但在Li等人的研究 [26] [27] 中表明在接受EGFR-TKIs作为术后辅助治疗的非小细胞肺癌患者中,辅助化疗并无额外的生存获益,可能与晚期的非小细胞肺癌和早期非小细胞肺癌在肿瘤的生物学行为上存在差异。本研究结果应该谨慎解释。与既往研究中的标准化疗方案相比,EGFR-TKIs在非小细胞肺癌患者的术后辅助治疗中优于标准化疗方案,吉非替尼和埃克替尼在生存获益以及药物相关不良反应发生率方面无统计学差异,均可成为非小细胞肺癌患者一种有效的辅助治疗策略。
文章引用
王化锋,艾江山,胡世宇. 真实世界中表皮生长因子受体酪氨酸激酶抑制剂(吉非替尼或埃克替尼)在非小细胞肺癌患者术后辅助治疗中的临床疗效分析
The Clinical Efficacy of EGFR-TKIs (Gefitinib or Icotinib) in Adjuvant Therapy for Patients with NSCLC in the Real World[J]. 临床医学进展, 2022, 12(01): 95-103. https://doi.org/10.12677/ACM.2022.121017
参考文献
- 1. Sung, H., et al. (2021) Global Cancer Statistics 2020: GLOBOCAN Estimates of Incidence and Mortality Worldwide for 36 Cancers in 185 Countries. CA: A Cancer Journal for Clinicians, 71, 209-249. https://doi.org/10.3322/caac.21660
- 2. Heon, S. and Johnson, B.E. (2012) Adjuvant Chemotherapy for Surgically Resected Non-Small Cell Lung Cancer. The Journal of Thoracic and Cardiovascular Surgery, 144, S39-S42. https://doi.org/10.1016/j.jtcvs.2012.03.039
- 3. Datta, D. and Lahiri, B. (2003) Preoperative Evaluation of Patients Undergoing Lung Resection Surgery. Chest, 123, 2096-2103. https://doi.org/10.1378/chest.123.6.2096
- 4. Remon, J., et al. (2013) Adjuvant Treatment in Resected Non-Small Cell Lung Cancer: Current and Future Issues. Critical Reviews in Oncology/Hematology, 88, 375-386. https://doi.org/10.1016/j.critrevonc.2013.05.017
- 5. Osarogiagbon, R.U., et al. (2016) Prevalence, Prognostic Implications, and Survival Modulators of Incompletely Resected Non-Small Cell Lung Cancer in the U.S. National Cancer Data Base. Journal of Thoracic Oncology, 11, e5-e16. https://doi.org/10.1016/j.jtho.2015.08.002
- 6. Steger, V., et al. (2009) Trimodal Therapy for Histologically Proven N2/3 Non-Small Cell Lung Cancer: Mid-Term Results and Indicators for Survival. The Annals of Thoracic Surgery, 87, 1676-1683. https://doi.org/10.1016/j.athoracsur.2009.03.068
- 7. 庞书菊, 陈公琰. 表皮生长因子受体酪氨酸激酶抑制剂在可手术非小细胞肺癌新辅助及辅助治疗中的研究进展[J]. 肿瘤学杂志, 2021, 27(3): 175-179.
- 8. Zhou, C., et al. (2011) Erlotinib versus Chemotherapy as First-Line Treatment for Patients with Advanced EGFR Mutation-Positive Non-Small-Cell Lung Cancer (Optimal, Ctong-0802): A Multicentre, Open-Label, Randomised, Phase 3 Study. The Lancet Oncology, 12, 735-742. https://doi.org/10.1016/S1470-2045(11)70184-X
- 9. Rosell, R., et al. (2012) Erlotinib versus Standard Chemotherapy as First-Line Treatment for European Patients with Advanced EGFR Mutation-Positive Non-Small-Cell Lung Cancer (EURTAC): A Multicentre, Open-Label, Randomised Phase 3 Trial. The Lancet Oncology, 13, 239-246. https://doi.org/10.1016/S1470-2045(11)70393-X
- 10. Wu, Y.L., et al. (2015) First-Line Erlotinib versus Gemcitabine/Cisplatin in Patients with Advanced EGFR Mutation-Positive Non-Small-Cell Lung Cancer: Analyses from the Phase III, Randomized, Open-Label, ENSURE Study. Annals of Oncology, 26, 1883-1889. https://doi.org/10.1093/annonc/mdv270
- 11. Mitsudomi, T., et al. (2010) Gefitinib versus Cisplatin plus Docetaxel in Patients with Non-Small-Cell Lung Cancer Harbouring Mutations of the Epidermal Growth Factor Receptor (WJTOG3405): An Open Label, Randomised Phase 3 Trial. The Lancet Oncology, 11, 121-128. https://doi.org/10.1016/S1470-2045(09)70364-X
- 12. Shi, Y.K., et al. (2017) First-Line Icotinib versus Cisplatin/Pemetrexed plus Pemetrexed Maintenance Therapy for Patients with Advanced EGFR Mutation-Positive Lung Adenocarcinoma (CONVINCE): A Phase 3, Open-Label, Randomized Study. Annals of Oncology, 28, 2443-2450. https://doi.org/10.1093/annonc/mdx359
- 13. Zhong, W.Z., et al. (2018) Gefitinib versus Vinorelbine plus Cisplatin as Adjuvant Treatment for Stage II-IIIA (N1-N2) EGFR-Mutant NSCLC (ADJUVANT/CTONG1104): A Randomised, Open-Label, Phase 3 Study. The Lancet Oncology, 19, 139-148. https://doi.org/10.1016/S1470-2045(17)30729-5
- 14. Yue, D., et al. (2018) Erlotinib versus Vinorelbine plus Cisplatin as Adjuvant Therapy in Chinese Patients with Stage IIIA EGFR Mutation-Positive Non-Small-Cell Lung Cancer (EVAN): A Randomised, Open-Label, Phase 2 Trial. The Lancet Respiratory Medicine, 6, 863-873. https://doi.org/10.1016/S2213-2600(18)30277-7
- 15. He, J., et al. (2021) Icotinib versus Chemotherapy as Adjuvant Treatment for Stage II-IIIA EGFR-Mutant Non-Small-Cell Lung Cancer (EVIDENCE): A Randomised, Open-Label, Phase 3 Trial. The Lancet Respiratory Medicine, 9, 1021-1029. https://doi.org/10.1016/S2213-2600(21)00134-X
- 16. Xu, S.T., et al. (2019) The Unique Spatial-Temporal Treatment Failure Patterns of Adjuvant Gefitinib Therapy: A Post Hoc Analysis of the ADJUVANT Trial (CTONG 1104). Journal of Thoracic Oncology, 14, 503-512. https://doi.org/10.1016/j.jtho.2018.11.020
- 17. Shi, Y., et al. (2013) Icotinib versus Gefitinib in Previously Treated Advanced Non-Small-Cell Lung Cancer (ICOGEN): A Randomised, Double-Blind Phase 3 Non-Inferiority Trial. The Lancet Oncology, 14, 953-961. https://doi.org/10.1016/S1470-2045(13)70355-3
- 18. He, Q., et al. (2021) Comparison of First-Generation EGFR-TKIs (Gefitinib, Erlotinib, And Icotinib) as Adjuvant Therapy in Resected NSCLC Patients with Sensitive EGFR Mutations. Translational Lung Cancer Research, 10, 4120-4129. https://doi.org/10.21037/tlcr-21-649
- 19. Zhang, Y., et al. (2014) Patients with Exon 19 Deletion Were Associated with Longer Progression-Free Survival Compared to Those with L858R Mutation after First-Line EGFR-TKIs for Advanced Non-Small Cell Lung Cancer: A Meta-Analysis. PLoS ONE, 9, e107161. https://doi.org/10.1371/journal.pone.0107161
- 20. Kuan, F.C., et al. (2015) Overall Survival Benefits of First-Line EGFR Tyrosine Kinase Inhibitors in EGFR-Mutated Non-Small-Cell Lung Cancers: A Systematic Review and Meta-Analysis. British Journal of Cancer, 113, 1519-1528. https://doi.org/10.1038/bjc.2015.356
- 21. Li, W.Q. and Cui, J.W. (2020) Non-Small Cell Lung Cancer Patients with ex19del or Exon 21 L858R Mutation: Distinct Mechanisms, Different Efficacies to Treatments. Journal of Cancer Research and Clinical Oncology, 146, 2329-2338. https://doi.org/10.1007/s00432-020-03296-6
- 22. Peters, S., et al. (2016) The Impact of Brain Metastasis on Quality of Life, Resource Utilization and Survival in Patients with Non-Small-Cell Lung Cancer. Cancer Treatment Reviews, 45, 139-162. https://doi.org/10.1016/j.ctrv.2016.03.009
- 23. Wu, Y.L., et al. (2018) CNS Efficacy of Osimertinib in Patients with T790M-Positive Advanced Non-Small-Cell Lung Cancer: Data from a Randomized Phase III Trial (AURA3). Journal of Clinical Oncology, 36, 2702-2709. https://doi.org/10.1200/JCO.2018.77.9363
- 24. Wu, Y.L., et al. (2020) Osimertinib in Resected EGFR-Mutated Non-Small-Cell Lung Cancer. The New England Journal of Medicine, 383, 1711-1723. https://doi.org/10.1056/NEJMoa2027071
- 25. Wu, Q., et al. (2021) First-Generation EGFR-TKI plus Chemotherapy versus EGFR-TKI Alone as First-Line Treatment in Advanced NSCLC With EGFR Activating Mutation: A Systematic Review and Meta-Analysis of Randomized Controlled Trials. Frontiers in Oncology, 11, Article ID: 598265. https://doi.org/10.3389/fonc.2021.598265
- 26. Li, F., et al. (2021) No Benefit of Chemotherapy in Osimertinib-Treated Postoperative Non-Small Cell Lung Cancer Patients. Translational Lung Cancer Research, 10, 3689-3693. https://doi.org/10.21037/tlcr-21-640
- 27. Wen, M., et al. (2020) Optimal Adjuvant Therapy in Resected Stage IIIA-N2 Non-Small-Cell Lung Cancer Harboring EGFR Mutations. Oncology Research and Treatment, 43, 686-693. https://doi.org/10.1159/000506692
