Bioprocess
Vol.06 No.01(2016), Article ID:17076,9
pages
10.12677/BP.2016.61002
Effects of Different Gluconacetobacter xylinus Strains on Yield and Properties of Bacterial Cellulose
Shaorui Zhang1, Lin Chen1, Chunyan Zhong2, Feng Hong1*
1Group of Microbiological Engineering and Industrial Biotechnology, College of Chemistry, Chemical Engineering and Biotechnology, Donghua University, Shanghai
2Hainan Guangyu Biotechnology Co. Ltd., Haikou Hainan

Received: Feb. 13th, 2016; accepted: Mar. 1st, 2016; published: Mar. 4th, 2016
Copyright © 2016 by authors and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY).
http://creativecommons.org/licenses/by/4.0/



ABSTRACT
Gluconacetobacter xylinus is an important bacterial cellulose (BC) producing bacterium. Effects of five strains of G. xylinus on cellulose production and properties were investigated by using D-glu- cose as carbon source. The initial concentration of glucose was 40 g/L. X-ray diffraction analysis, scanning electron microscopy and universal material testing machine were used to characterize the bacterial cellulose. The volume yield of bacterial cellulose by the five strains of G. xylinus was as follows: DHU-ZCY-1 (3.9 g/L) > DHU-ATCC-1 (2.62 g/L) > DHU-ZGD-1 (2.34 g/L) > DHU-YQ-1 (1.72 g/L) > ATCC23770 (0.61 g/L). The highest volume yield was around 7 times higher than the lowest one. Tensile strength of bacterial cellulose of the five strains was as follows: DHU-ZGD-1 > DHU-ZCY-1 > DHU-YQ-1 > DHU-ATCC-1 > ATCC23770. The results showed that unremarkable morphological difference of bacterial cellulose was found among the five strains. And there was no obvious difference in water content and crystallinity of BC obtained by the five strains. The fiber diameters were in the range between 65 nm and 91 nm.
Keywords:Bacterial Cellulose, Gluconacetobacter xylinus, Effect of Strain Type

木葡糖酸醋杆菌株型对细菌纤维素产量与性能的影响
张少瑞1,陈琳1,钟春燕2,洪枫1*
1东华大学,化学化工与生物工程学院,微生物工程与工业生物技术研究组,上海
2海南光宇生物科技有限公司,海南 海口

收稿日期:2016年2月13日;录用日期:2016年3月1日;发布日期:2016年3月4日

摘 要
木葡糖酸醋杆菌是重要的细菌纤维素生产菌。该课题以40 g/L葡萄糖为碳源,研究了静态培养时5株菌种对细菌纤维素产量与性能的影响。采用扫描电镜、X射线衍射和万能材料测试机分别对细菌纤维素进行了形貌观察、结晶度表征以及力学性能测试。研究结果表明:细菌纤维素的产量排序依次为DHU-ZCY-1 (3.9 g/L) > DHU-ATCC-1 (2.6 g/L) > DHU-ZGD-1 (2.3 g/L) > DHU-YQ-1 (1.7 g/L) > ATCC23770 (0.6 g/L);株型对细菌纤维素的含水率和结晶度基本无影响;不同菌株产的细菌纤维素湿膜的断裂拉伸强度大小依次如下:DHU-ZGD-1 (350 KPa) > DHU-ZCY-1 (150 KPa) > DHU-YQ-1 (68 KPa) > DHU-ATCC-1 (56 KPa) > ATCC23770 (35 KPa);菌株对细菌纤维素的微观结构影响甚微,纤维直径大都分布在65~91 nm之间。
关键词 :细菌纤维素,木葡糖酸醋杆菌,菌株影响

1. 引言
木葡糖酸醋杆菌(Gluconacetobacter xylinus)是目前已知合成纤维素能力最强的好氧型革兰氏阴性细菌,也是应用最广和研究最多的细菌纤维素(bacterial cellulose, BC)生产菌[1] 。通常,木葡糖酸醋杆菌在光学显微镜下呈现椭圆或杆状,菌体之间单个或成对存在,菌体大小约为0.6~0.8 µm × 1.0~4.0 µm,其最适生长温度为25℃~30℃,最适生长pH为5~6。木葡糖酸醋杆菌不同种间的生理生化特征不同 [2] ,因此生产出的BC的特性也不同。BC作为一种新型生物材料,具有许多优秀特性 [1] ,譬如极强的持水性、高聚合度和结晶度、高的湿强度,以及良好的生物相容性和无过敏反应性等,在美容用品 [1] 、创伤敷料 [3] 、人工血管 [4] 、纺织 [5] 、造纸 [6] 、先进功能材料 [7] 等各个领域均有很好的应用前景。性质决定应用,不同的应用对BC的性能需求也不相同。
本实验室选育了四株生产性能优异的木葡糖酸醋杆菌,但是尚未在静态培养条件下与木葡糖酸醋杆菌模式菌ATCC23770进行产量及产物性能之间的比较。为此,本文在葡萄糖浓度为40 g/L和培养周期21 d的条件下,详细比较研究了5株菌种在BC产量和理化性质方面的差异,为今后不同木葡糖酸醋杆菌的工业化生产和应用提供理论依据。
2. 材料与方法
2.1. 菌种
木葡糖酸醋杆菌ATCC23770、DHU-ZCY-1、DHU-ZGD-1、DHU-ATCC-1和DHU-YQ-1为实验室保藏菌种。
2.2. 培养基
种子培养基:葡萄糖25 g/L、胰蛋白胨5 g/L、酵母粉3 g/L,用柠檬酸调pH至5.0。加入琼脂至20 g/L可制备斜面固体培养基。发酵培养基:葡萄糖为40 g/L,其它成分同种子培养基。所有培养基配制后都在121℃灭菌20 min。
2.3. 菌种培养及细菌纤维素的制备
菌株活化:从冰箱中将冷藏保存的木葡糖酸醋杆菌斜面转接到新的斜面培养基上,在30℃恒温培养箱中培养48~72 h。
种子培养:挑取活化后的斜面菌株接种到液体种子培养基中,放入摇床在30℃,转速160 rpm培养24 h。
发酵培养:以40 g/L葡萄糖作为培养基碳源,五株木葡糖酸醋杆菌制备细菌纤维素;种子培养基以5% (v/v)的接种量接入发酵培养基中,放入恒温培养箱30℃条件下静置培养21 d。
2.4. 细菌纤维素的纯化
将培养瓶中的细菌纤维素膜取出,用蒸馏水多次冲洗后,置于0.5% (w/v) NaOH的水溶液中,80℃处理2 h,以去除膜中的菌体和残留培养基,多次反复处理至膜呈乳白色半透明。用蒸馏水多次冲洗直到pH为7.0。
2.5. 发酵历程中参数的测定
培养基中葡萄糖浓度的测定采用3,5-二硝基水杨酸法(DNS测糖法)。糖消耗量(%)按照公式(1)计算,平均耗糖率(g∙[L∙d]−1)按照公式(2)计算;
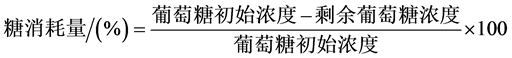 (1)
(1)
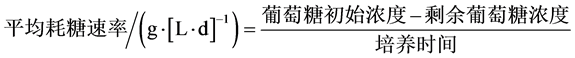 (2)
(2)
培养基中溶液的pH采用PHS-4A型pH计测定。
将经纯化的BC膜置于105℃的烘箱内烘至恒重,经分析天平称重即得到BC绝干重。BC产率(g∙[L∙d]−1)按照公式(3)计算;BC转化率(g∙g−1)为单位质量糖耗的BC产量,如公式(4)所示
 (3)
(3)
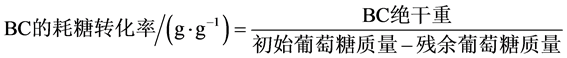 (4)
(4)
2.6. 细菌纤维素的表征
BC的含水率按照公式(5)计算:
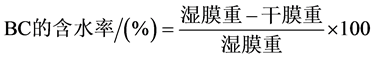 (5)
(5)
测定了纯化后的细菌纤维素膜的X射线衍射图(日本Rigaku D/Max-2550PC),用Segal [8] 的方法计算样品的结晶度。
将纯化后的细菌纤维素湿膜裁成5 cm × 1 cm标准样品,用万能材料测试仪(英国Hounsfield公司,H5KS)测定湿膜拉伸强度,每个样品做10个平行。测试条件:夹距30 mm,拉伸速度10 mm/min,传感器10 N和1000 N。
将经过冷冻干燥后的细菌纤维素膜镀金后,采用日本JEOL公司的扫描电子显微镜(SEM,JSM-5600LV)观察细菌纤维素的微观结构。
3. 结果与讨论
3.1. 不同菌株培养历程比较
3.1.1. 培养历程中的pH、还原糖的变化
培养历程中,5株木葡糖酸醋杆菌的培养液pH值在头3天内急剧下降,随后转变为缓慢下降趋势直至培养终止(如图1(a)所示)。该变化趋势与文献报道的以葡萄糖为碳源木葡糖酸醋杆菌产纤维素时的pH变化过程一致 [9] 。五株细菌中,ATCC23770培养液的pH值从初始5.0迅速降低至3 d后的3.6,随后下降趋势变慢,至21 d培养终止时为3.2。在整个培养历程中,该菌株的pH值均高于其余4株菌。实验室选育的其它4株菌的培养历程pH值变化曲线较为接近,其中DHU-ZGD-1培养液中的pH值不仅在3 d内快速降至3.2,而且随后缓慢降至2.5 (21 d),为所有菌株中最低水平。以葡萄糖为碳源时,木葡糖酸醋杆菌首先利用细胞膜上的葡萄糖脱氢酶及酮基葡萄糖酸脱氢酶将胞外培养基中的葡萄糖转化为(酮基)葡糖酸,以提供大量的还原氢供给菌体生长繁殖所需的能量,这使得培养基中的pH迅速下降 [10] 。Yang发现以葡萄糖为唯一碳源时,木葡糖酸醋杆菌在延迟及生长期中倾向利用葡萄糖转为(酮基)葡糖酸用于细胞增殖及代谢,而后利用(酮基)葡糖酸进一步生产纤维素及其它代谢产物 [11] 。培养3 d后,pH值变化趋缓,这是由于(酮基)葡糖酸转化完全后,木葡糖酸醋杆菌的多种产酸代谢途径利用葡萄糖及(酮基)葡糖酸产生的多种有机酸在培养基中逐步累积,使得pH值进一步缓慢下降 [12] 。
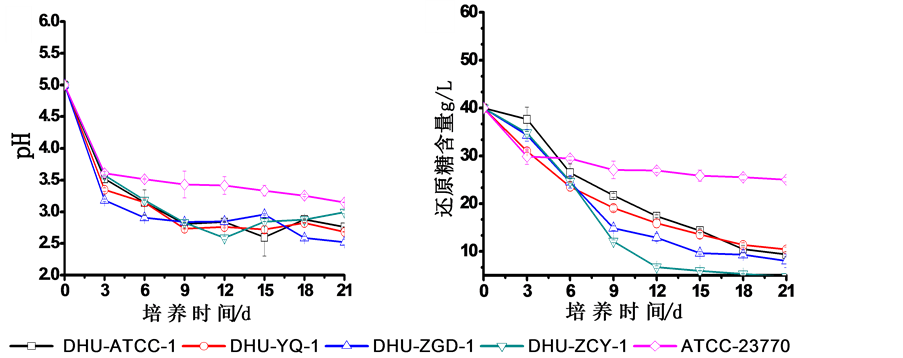 (a) (b)
(a) (b)
Figure 1. Changes of pH and reducing sugar in the cultivation of five strains of G. xylinus
图1. 不同菌株培养过程中pH和还原糖的变化
五株菌培养过程中的残糖变化如图1(b)所示,培养基中残糖浓度呈现逐步下降趋势。培养头3 d内,ATCC23770和DHU-YQ-1的耗糖降幅最大,说明初期耗糖速率明显高于其它3株菌。而在3 d后,ATCC23770培养液中的残糖浓度下降速度迅速变慢,残糖浓度曲线呈现平缓但稳定地下降。ATCC23770菌株在培养终止时的糖消耗率仅为37.5% (如表1所示),远远低于其它菌株。ATCC23770糖代谢利用水平低于其它菌株的情况,与其pH变化所反映的该菌株远低于其它菌株的代谢产酸水平的情况相一致。而DHU-YQ-1在3 d后的残糖浓度仍保持较高的糖消耗速率,消耗速率随着残糖浓度的减少逐步降低。除ATCC23770外,其它四株菌在9-12 d内均能够保持较高的糖消耗速率。菌株DHU-ATCC-1在初始3 d内的糖消耗降幅较低,3 d糖浓仅下降了2.0 g/L,明显低于其它菌株,但随后的糖消耗情况类似于其它菌株,保持了较高的糖消耗速率。
总体上,21 d培养过程中,菌株DHU-ZCY-1的日均耗糖速率最高,为平均每天1.68 g/L (见表1),21 d的总消耗量达到了88.3%;其次是菌株DHU-ZGD-1,每天1.52 g/L,消耗量达到80.0%;而ATCC23770的糖耗速率最低,平均每天仅0.73 g/L,21 d后糖浓由最初的40 g/L降到25 g/L,利用率仅占总添加量的37.5%。耗糖量与平均耗糖速率由高到低依次排序为DHU-ZCY-1 > DHU-ZGD-1 > DHU-ATCC-1 > DHU-YQ-1 > ATCC23770。其中DHU-ZCY-1的糖利用率是ATCC23770的近2.5倍。以上结果表明,以40 g/L初始糖浓培养生产细菌纤维素,相比于对照标准菌ATCC23770,自选育的4株菌能够更充分利用培养基中的葡萄糖,具有更高的葡萄糖利用率(利用率达74%~88%)。
3.1.2. 培养历程中细菌纤维素产量的变化
图2(a)为细菌纤维素产量随培养时间的变化趋势。从图2(a)可知,5株菌株的BC产量均呈现典型的微生物产物增长曲线,即随着培养时间的延长BC产量逐步累积增加,增加幅度随着接近最终稳定期而逐步减少,直至达到稳定。其中ATCC23770的BC产量远低于其它四株菌,BC产量在前12 d中均仅少许增加,直到12 d后才出现小幅提升,在18 d接近稳定期。而另外4株菌的BC产量均在前3 d内增加缓慢,随后开始迅速增加。其中DHU-ZCY-1的纤维素合成速率最快,增长期持续时间最长,直到15 d后纤维素产量才基本不再增加,最终产量达3.9 g/L。该变化趋势与糖消耗过程中(图1(b))的糖浓下降过程高度一致。其余3株自选育菌株的BC增长曲线比较接近,在3 d缓慢增长后,能快速提升,最后的产量增速虽不及DHU-ZCY-1,但仍然能持续增长,与其葡萄糖消耗情况也非常吻合。
图2(b)为各菌株培养历程中BC的耗糖转化率随着培养历程的变化。其中,菌株ATCC23770的BC耗糖转化率总是最低的,随着培养进行逐步增加,直至稳定。这是由于通常菌株在培养初期,消耗糖的目的主要用于菌体自身的生长繁殖 [13] ,而并不用于BC的生产,在培养的中后期葡萄糖代谢才逐步转向纤维素合成路径进行BC生产。但值得注意的是,自选育菌株DHU-ATCC-1在BC累计耗糖转化率的最高水平出现在其培养初期第3天,随着培养进行累计糖转化率水平逐步下降至稳定水平。这表明DHU-ATCC-1在培养初期就将所消耗的葡萄糖大量用于纤维素的合成,但随着菌体的增殖,用于纤维素生产的葡萄糖占总糖消耗的比例反而大幅降低。
Table 1. Total consumption and daily average consumption of glucose in the 21-d cultivation of G. xylinus
表1. 培养21 d内的葡萄糖消耗率和日平均消耗速率
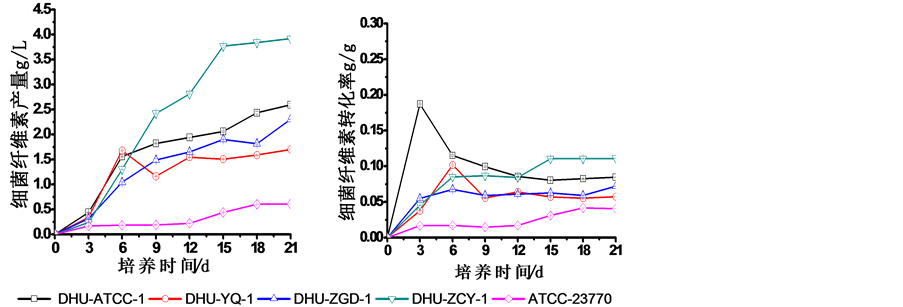 (a) (b)
(a) (b)
Figure 2. Changes of BC yield and BC conversion rate from glucose during the cultivation of five strains of G. xylinus
图2. 不同菌株培养过程中细菌纤维素产量和产物耗糖转化率的变化
3.1.3. 不同菌株培养结果的比较
从各菌株培养结束后的结果来看(如表2显示),培养21 d后各菌株BC产量由高到低依次排序为:DHU-ZCY-1 (3.91 g/L) > DHU-ATCC-1 (2.62 g/L) > DHU-ZGD-1 (2.34 g/L) > DHU-YQ-1 (1.72 g/L) > ATCC23770 (0.61 g/L),与葡萄糖消耗率排序一致。从最终BC产率来看,葡萄糖用于纤维素生产的产率由高到低的依次排序为:DHU-ZCY-1 (0.19 g·(L∙d)−1) > DHU-ATCC-1 (0.12 g·(L∙d)−1) > DHU-ZGD-1 (0.11 g·(L∙d)−1) > DHU-YQ-1 (0.08 g·(L∙d)−1) > ATCC23770 (0.03 g·(L∙d)−1),与BC总产量、葡萄糖消耗率均一致。其中ATCC23770菌株的产率不到其它菌株的一半。各菌株获得的BC膜的含水率均达到99%以上,即木葡糖酸醋杆菌不同菌株对BC含水率基本没影响。总的来看,所研究的5株木葡糖酸醋杆菌中,DHU-ZCY-1、DHU-ATCC-1和DHU-ZGD-1属于具备较高BC产量性能的菌株,更能够较彻底地利用培养基中葡萄糖,并且所耗糖中用于纤维素生产的比例也更高。
3.2. 不同菌株生产的细菌纤维素性能比较
3.2.1. 细菌纤维素微结构比较
由于结构类似,这里每一菌株仅各呈现一张SEM显微照片作为代表。如图3所示,A-E分别依次代表菌株DHU-ATCC-1、DHU-ZGD-1、DHU-YQ-1、DHU-ZCY-1和ATCC23770。这些照片显示各菌株的每个样品均呈现BC典型的致密纳米纤维网络结构,不同菌株生产的BC膜间,其微观结构并无显著差异。通过对纤维随机取100处测量的结果显示,木葡糖酸醋杆菌5株菌种之间生产的细菌纤维素的平均直径有差异,平均直径在67~91 nm之间,且DHU-ATCC-1、DHU-ZGD-1、DHU-YQ-1、DHU-ZCY-1获得的细菌纤维素的平均直径比标准菌株ATCC23770的大。
3.2.2. 细菌纤维素结晶度比较
表3显示5株木葡糖酸醋杆菌生产的BC都具有较高的结晶度,其中DHU-ZGD-1生产的BC结晶度最高,为83.5%,DHU-ATCC-1生产的BC结晶度最低,为78.5%。另外,木葡糖酸醋杆菌DHU-ZCY-1、DHU-YQ-1和ATCC23770生产的BC结晶度分别为80.5%、79.1%和78.8%。以上结果表明以葡萄糖为碳源,五种木葡糖酸醋杆菌生产的BC的结晶度差异不大。
3.2.3. 拉伸性能比较
用万能材料测试机测定细菌纤维素湿膜的拉伸强度,结果如表3所示。菌株DHU-ZGD-1所生产的
Table 2. Comparison of the cultivation results with the different strains of G. xylinus
表2. 不同菌株培养结果比较
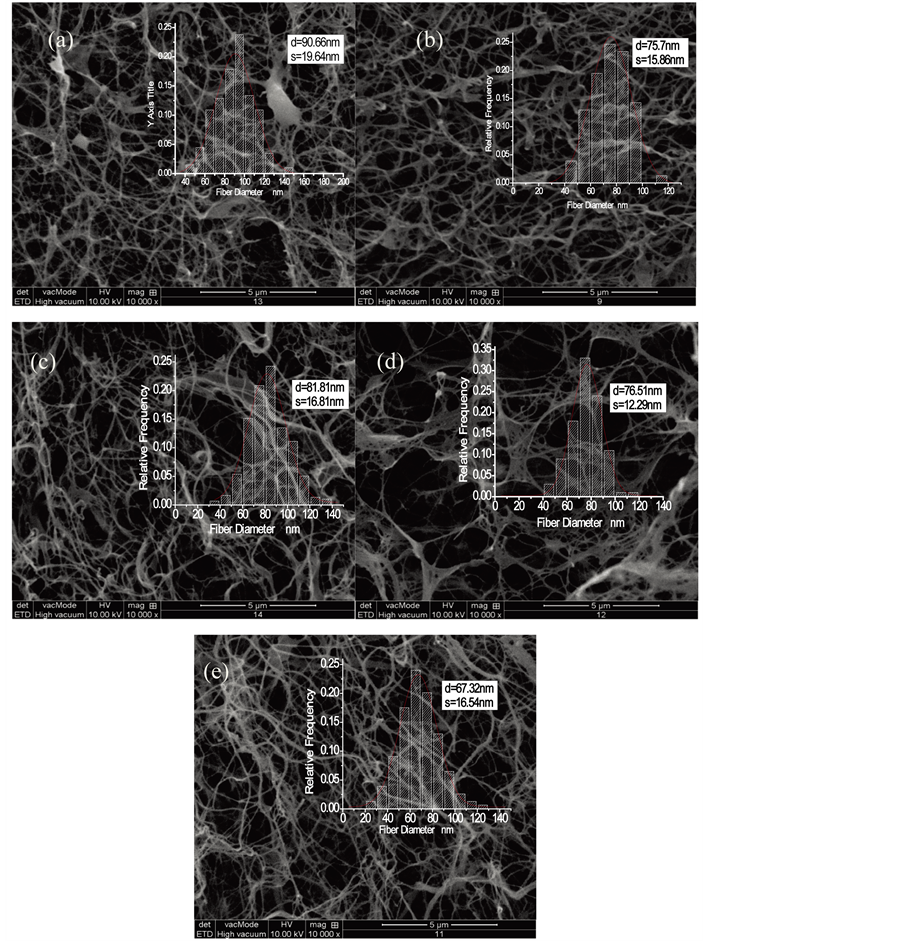 (a): DHU-ATCC-1, (b): DHU-ZGD-1, (c): DHU-YQ-1, (d): DHU-ZCY-1, (e): ATCC23770
(a): DHU-ATCC-1, (b): DHU-ZGD-1, (c): DHU-YQ-1, (d): DHU-ZCY-1, (e): ATCC23770
Figure 3. Scanning electron microscopy (SEM) images and fiber diameter distribution of BC
图3. 细菌纤维素膜的扫描电镜照片(10,000×)和纤维直径分布图
Table 3. Effects of strain types of G. xylinus on the crystallinity and tensile properties of BC
表3. 不同菌株对细菌纤维素拉伸性能和结晶度的影响
BC膜的机械性能最好,杨氏模量及拉伸断裂应力可以分别达到10和350 KPa,是其它几株菌制备的BC膜的2~4倍,且该膜的断裂伸长率也是所有菌株中最大的(41.7 mm/mm)。DHU-ZCY-1生产的BC的拉伸强度虽然仅次于DHU-ZGD-1,达150.4 KPa,但其断裂伸长率却低于DHU-ATCC-1和DHU-YQ-1,仅为29.0 mm/mm。ATCC23770生产的BC膜的最大断裂拉伸应力为35.4 KPa,断裂伸长率为14.5 mm/mm,为所有菌株中最弱。对于DHU-ATCC-1所生产的BC,虽然在断裂应力上高于ATCC23770,但其杨氏模量仅为2.4 KPa,为所有菌株中最低。BC膜的强度受到其微观结构、结晶度、含水率、纤维直径等多方面因素影响 [14] 。由于DHU-ZGD-1所生产的BC的结晶度是所有菌株中最高的,且纤维直径分布最集中,整体纤维网络分布最均匀(如图3(b)),因此具备更高的机械强度。
4. 结论
细菌纤维素独特的理化性质,使得它在多个领域具有较大的应用潜力。本研究结果表明:木葡糖酸醋杆菌的不同菌株生产获得的BC的产量和性能有较大差异。菌株BC产量依次排序如下:DHU-ZCY-1 (3.91 g/L) > DHU-ATCC-1 (2.62 g/L) > DHU-ZGD-1 (2.34 g/L) > DHU-YQ-1 (1.72 g/L) > ATCC23770 (0.61 g/L);菌株DHU-ZCY-1、DHU-ZGD-1和DHU-ATCC-1的BC产率远远高于ATCC23770,最大的产率比最低的高出约6倍;菌株DHU-ZCY-1、DHU-ATCC-1、DHU-ZGD-1和DHU-YQ-1获得的BC转化率明显高于ATCC23770;拉伸强度最大的BC湿膜生产菌是DHU-ZGD-1,比拉伸强度最弱的ATCC23770菌高10倍;ATCC23770是研究BC的模式菌株,它生产BC的能力明显弱于实验室筛选的菌株。DHU-ATCC-1和DHU-YQ-1的生产特性和获得的产物性能介于几株菌株中间,DHU-ATCC-1的BC转化率最高,DHU-YQ-1的日平均糖消耗速率基本一致,纤维素产量日平均增加速率相差无几;DHU-ZCY-1制备的BC产量和BC产率最高,它对糖的利用率比较高,生产BC的速率快;不同菌株生产的细菌纤维素的平均直径在65~91 nm之间,其中DHU-ZGD-1获得的纤维丝的分布也最均匀;但是不同菌株获得的细菌纤维素的结晶度和持水能力没有明显差异。
基金项目
国家自然科学基金(51373031);教育部新世纪优秀人才支持计划项目(NCET-12-0828);上海市科委项目(15520720800);中央高校基本科研业务费专项资金资助项目。
文章引用
张少瑞,陈琳,钟春燕,洪枫. 木葡糖酸醋杆菌株型对细菌纤维素产量与性能的影响
Effects of Different Gluconacetobacter xylinus Strains on Yield and Properties of Bacterial Cellulose[J]. 生物过程, 2016, 06(01): 8-16. http://dx.doi.org/10.12677/BP.2016.61002
参考文献 (References)
- 1. Bielecki, S., Krystynowicz, A., Turkiewicz, M., et al. (2002) Bacterial Cellulose. Biopolymers (Polysaccharides I: Po-lysaccharides from Prokaryotes) Wiley-VCH Verlag GmbH, Weinheim.
- 2. 冯静, 施庆珊, 欧阳友生, 等. 葡糖醋杆菌的研究进展[J]. 化学与生物工程, 2009(5): 10-13.
- 3. Wei, B., Yang, G. and Hong, F. (2011) Preparation and Evaluation of a Kind of Bacterial Cellulose Dry Films with Antibacterial Properties. Carbohydrate Polymers, 84, 533-538. http://dx.doi.org/10.1016/j.carbpol.2010.12.017
- 4. Tang, J., Bao, L., Li, X., et al. (2015) Potential of PVA-Doped Bacterial Nano-Cellulose Tubular Composites for Artificial Blood Vessels. Journal of Materials Chemistry B, 3, 8537-8547. http://dx.doi.org/10.1039/C5TB01144B
- 5. Lu, X., Tang, S., Huang, B., et al. (2013) Preparation and Characterization of Bacterial Cellulose/Hydroxypropyl Chitosan Blend As-Spun Fibers. Fibers and Polymers, 14, 935-940. http://dx.doi.org/10.1007/s12221-013-0935-4
- 6. Klemm, D., Heublein, B., Fink, H.P., et al. (2005) Cellulose: Fascinating Biopolymer and Sustainable Raw Material. Angewandte Chemie International Edition, 44, 3358-3393. http://dx.doi.org/10.1002/anie.200460587
- 7. Jiang, G., Zhang, J., Qiao, J., et al. (2015) Bacterial Nanocellulose/Nafion Composite Membranes for Low Temperature Polymer Electrolyte Fuel Cells. Journal of Power Sources, 273, 697-706. http://dx.doi.org/10.1016/j.jpowsour.2014.09.145
- 8. Segal, L., Creely, J.J., Martin, A.E., et al. (1959) An Em-pirical Method for Estimating the Degree of Crystallinity of Native Cellulose Using the X-Ray Diffractometer. Textile Re-search Journal, 29, 786-794. http://dx.doi.org/10.1177/004051755902901003
- 9. 张硕, 杜倩雯, 兰水, 等 七种糖类对木醋杆菌和红茶菌的影响[J]. 纤维素科学与技术, 2014, 22(4): 18-27.
- 10. De Wulf, P., Joris, K. and Vandamme, E.J. (1996) Improved Cellulose Formation by an Acetobacter xylinum Mutant Limited in (Keto)gluconate Synthesis. Journal of Chemical Technology & Biotechnology, 67, 376-380. http://dx.doi.org/10.1002/(SICI)1097-4660(199612)67:4<376::AID-JCTB569>3.0.CO;2-J
- 11. Yang, Y.K., Park, S.H., Hwang, J.W., et al. (1998) Cellulose Production by Acetobacter xylinum BRC5 under Agitated Condition. Journal of Fermentation and Bioengineering, 85, 312-317. http://dx.doi.org/10.1016/S0922-338X(97)85681-4
- 12. Hu, W., Chen, S., Yang, J., et al. (2014) Functionalized Bacterial Cellulose Derivatives and Nanocomposites. Carbohydrate Polymers, 101, 1043-1060. http://dx.doi.org/10.1016/j.carbpol.2013.09.102
- 13. Fu, L., Zhang, J. and Yang, G. (2013) Present Status and Applications of Bacterial Cellulose-Based Materials for Skin Tissue Repair. Carbohydrate Polymers, 92, 1432-1442. http://dx.doi.org/10.1016/j.carbpol.2012.10.071
- 14. Rambo, C.R., Recouvreux, D.O.S., Carminatti, C.A., et al. (2008) Template Assisted Synthesis of Porous Nanofibrous Cellulose Membranes for Tissue Engineering. Materials Science and Engineering: C, 28, 549-554. http://dx.doi.org/10.1016/j.msec.2007.11.011
*通讯作者。
