World Journal of Cancer Research
Vol.4 No.02(2014), Article ID:13274,6 pages
DOI:10.12677/WJCR.2014.42004
The Expression and Promoter Hypermethylation Status of MGMT, RASSF1A in Gastric Cancer
Xinli Ju1, Junqian Huang2, Mingquan Song2, Xiangjun Jiang2*
1Dalian Medical University, Dalian
2The Second Department of Gastroenterology, The Municipal Hospital of Qingdao, Qingdao
Email: juxinli123@163.com, *drjxj@163.com
Copyright © 2014 by authors and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY).
http://creativecommons.org/licenses/by/4.0/



Received: Feb. 11th, 2014; revised: Feb. 21st, 2014; accepted: Feb. 27th, 2014
Objective: To investigate the functions of hypermethylation of MGMT and RASSF1A genes in human gastric cancer. Methods: Methylation status of the MGMT and RASSF1A genes in 60 gastric carcinoma tissues and 60 paired surgical marginal normal gastric tissues were detected using methylation-specific PCR. Real-time RT-PCR was used to detect the expression of MGMT and RASSF1A, and immunohistochemistry was used to detect the expression of MGMT and RASSF1A proteins in the above samples. Results: The positive rates of promoter methylation of the MGMT and RASSF1A genes were significantly higher in gastric cancer than those in normal tissue (both P < 0.05). The positive rates of MGMT and RASSF1A mRNA expression in gastric cancer were significantly lower than those in normal tissues (both P < 0.05). The expression of MGMT and RASSF1A proteins were significantly higher in gastric cancer than those in normal tissue. Conclusion: Hypermethylation of CpG island and loss of the expression in MGMT and RASSF1A genes were existed in gastric cancer, and it possibly plays a key role in carcinogenesis of gastric cancer.
Keywords:Gastric Cancer; Methylation-Specific PCR; MGMT Gene; RASSF1A Gene

胃癌组织中MGMT、RASSF1A基因启动子区甲基化研究
鞠昕丽1,黄俊谦2,宋明全2,姜相君2*
1大连医科大学,大连
2青岛市市立医院消化内二科,青岛
Email: juxinli123@163.com, *drjxj@163.com
收稿日期:2014年2月11日;修回日期:2014年2月21日;录用日期:2014年2月27日

目的:探讨MGMT、RASSF1A启动子甲基化状况在胃癌发生、发展中的作用。方法:用甲基特异性聚合酶扩增链式反应(methylation specific PCR, MSP)检测60例胃癌组织及相应癌旁正常组织MGMT、RASSF1A基因启动子的甲基化状况,用实时荧光定量逆转录–多聚合酶链反应(real-time RT-PCR)和免疫组织化学SP法分别检测基因MGMT、RASSF1A的mRNA和蛋白的表达情况。结果:胃癌组织中MGMT、RASSF1A基因的甲基化阳性率较正常组织明显升高(P < 0.05)。胃癌组织中MGMT和RASSF1A mRNA阳性表达率明显低于正常组织(P < 0.05)。胃癌组织MGMT、RASSF1A蛋白表达明显低于正常组织。结论:胃癌组织中存在一定程度的MGMT、RASSF1A基因启动子高甲基化和蛋白表达缺失,是胃癌发生的重要途径之一。
胃癌;甲基化特异性PCR;MGMT;RASSF1A

胃癌是一种常见的恶性肿瘤,其发生发展是一个多步骤、多阶段的有序过程,环境中烷化剂所致的DNA损伤是肿瘤发生的重要原因之一[1] ,其中DNA甲基化是表观遗传学的重要内容,可使抑癌基因的表达失活,促进肿瘤的发生[2] 。6-氧-甲基鸟嘌呤-DNA甲基转移酶(O6-methvlguanine DNA methvltransferase, MGMT)是一种普遍存在的DNA修复酶,能够将烷化剂使DNA鸟嘌呤O6位发生烷基化,从而形成O6-鸟嘌呤加合物而在DNA上移除。如果DNA损伤不被修复,在DNA复制过程中O6-mG可与胸腺嘧啶(T)错配,导致G:C-A:T突变(G→A转换),使细胞发生癌性转化。Ras相关区域家族1A(ras-association domain family 1A, RASSFlA)基因启动子区域的异常甲基化是抑癌基因失活的主要机制之一。本研究分析了胃癌及癌旁正常组织中MGMT、RASSFl基因启动子甲基化状态及蛋白表达情况,以探讨MGMT、RASSFl基因甲基化与其蛋白失活及胃癌发生的关系。
2.1. 材料
60例胃癌组织标本取自青岛市立医院普外科2012年7月至2013年8月间经胃镜检查确诊为胃癌的手术患者,术前未行任何抗肿瘤治疗。患者年龄为35~80岁(中位年龄57岁),男33例,女27例;伴有淋巴结转移38例,不伴有淋巴结转移22例。癌组织均取自肿瘤中央非坏死区域,癌旁正常组织取自相应距肿瘤边缘5 cm以上的黏膜。所有标本取2份,1份立即放入RNA保存液中,转运于−70℃冰箱冻存备用,1份用甲醛固定、石蜡包埋后保存,用于免疫组化。所有标本均经病理检查,确认手术标本切缘为阴性。
2.2. 方法
2.2.1. DNA提取和亚硫酸钠修饰
用DNA提取试剂盒对上述组织进行DNA提取,操作步骤按说明书进行。DNA提取后用紫外分光光度仪测浓度计算其含量,取l ug DNA用亚硫酸氢钠修饰试剂盒进行修饰(操作步骤按说明书进行),使DNA序列中非甲基化胞嘧啶(C)转变为尿嘧啶U(而甲基化的胞嘧啶则不变),在随后的PCR反应中U变为T。
2.2.2. 甲基化特异性PCR(MSP)
取修饰后DNA,根据试剂盒(北京天根)的说明书进行PCR反应。MGMT、RASSF1A引物设计由上海生工合成,PCR反应体系为25 μL: perfectshotTMTaq(loading dye mix)(TaKaRa公司)12.5 μL,引物各0.5 μL,修饰后的DNA2 μL, dd H2O补足至25 μL。PCR反应条件设定为95℃预变性15 min,94℃变性30 s,甲基化64℃/非甲基59℃退火50 s,72℃延伸45 s,共35个循环,72℃延伸10 min。取PCR产物5 μL,1.5%琼脂糖凝胶电泳,紫外线下观察拍照分析。
2.2.3. RNA提取及逆转录–多聚合酶链反应
取组织100 mg研磨棒充分研磨,加入RNA提取试剂(日本TakaRa公司)1 mL,并严格按照试剂说明书进行操作。提取的RNA经l.0%琼脂糖凝胶电泳检测完整性,核酸蛋白分析仪测其浓度及A值,测得1.80 < A260/280 < 2.00,符合纯度要求,−80℃冻存备用。取1 μg RNA严格按照逆转录试剂盒(日本TaKaRa公司)说明书合成cDNA,−20℃保存备用。以β-actin作为内参进行PCR扩增,其上游引物5'-CTGCTCGCTTCGCTACTTGCA-3',下游引物5'-CGGCACCTGTCCTACGAGTTG-3';MGMT上游引物5'-GGAAGCTGCTGAAGGTTGTG-3',下游引物5'-GCTGCTGCAGACCACTCTGT-3';RASSF1A上游引物5'-ACT TGC GGA AGC TGT TGG A-3',下游引物5'-CGCTGC AGG ATA CGT AGG A A-3'。PCR反应体系为25 μL,体系中含SYBR® Premix Ex TaqTMⅡ(×2)12.5 μL(日本TaKaRa公司),上下游引物各1.0 μL,cDNA模板2 μL,ROX Reference Dye(×50) 0.5 μL,dH2O 8.0 μL;反应参数:94℃ 30 s预变性;94℃ 5 s、55℃ 30 s、72℃ 45 s共40个循环。ABI 7300 Real-time PCR仪实时检测扩增过程中产生的荧光信号,扩增结束后自动分析溶解曲线。采用2−∆∆Ct法分析数据结果,样品中Ct值 < 30视为阳性表达。
2.2.4. 免疫组织化学SP法
常规石蜡包埋,组织蜡块4 µm厚连续切片,常规脱蜡水化,3% H2O2 37℃孵育15 min,消除内源性过氧化物酶活性,95℃微波15 min修复抗原后,按照SP试剂盒说明书进行操作。SP试剂盒购自北京博奥森生物技术有限公司,一抗工作液浓度为1:100。采用PBS代替一抗作阴性对照,已知的MGMT、RASSF1A阳性的正常标本作阳性对照。每张切片随机选取5个视野,每个视野计数200个细胞,MGMT、RASSF1A阳性表达部位主要在腺体细胞的胞浆中,部分细胞核中也有表达。采用半定量积分法判断结果,阳性细胞密度< 5%为0分,6%~25%为1分,26%~50%为2分,5l%~75%为3分,>75%为4分;免疫组织化学显色强度以多数细胞呈色反应为准,淡黄色为1分,棕黄色为2分,棕褐色为3分两积分相乘,0分为阴性(−),l~4分为弱阳性(+),5~8分为阳性(++),9~12分为强阳性(+++),将阴性与弱阳性视为阴性表达,阳性与强阳性视为阳性表达。
2.2.5. 统计学处理
数据采用SPSS17.0统计软件进行统计学处理,方差齐性检验后,组间均数的比较采用方差分析或t检验,两样本率的比较采用χ2检验,P < 0.05为差异有统计学意义。
3.1. 胃癌组织与正常组织中MGMT、RASSF1A启动子区的甲基化状态
胃癌组织中MGMT启动子区甲基化率为45% (27/60),明显高于正常组织8.33% (5/60),差异有统计学意义(P < 0.05)。胃癌组织中RASSF1A启动子区甲基化率为64.70% (37/60),明显高于正常组织6.67% (4/60),差异有统计学意义(P < 0.05)。
3.2. 胃癌组织与正常组织中MGMT、RASSF1A的mRNA表达状态
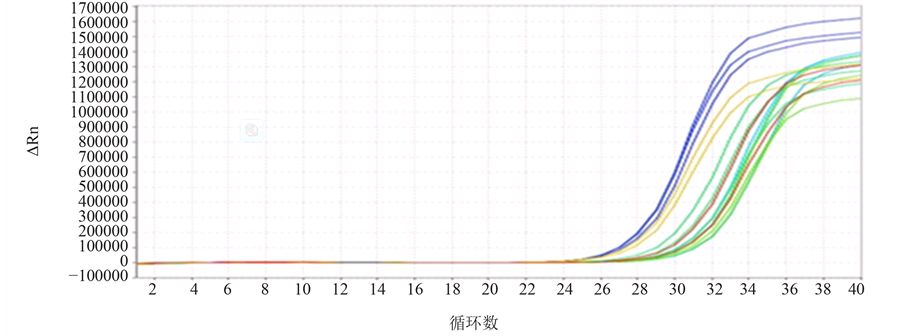
胃癌组织中MGMT、RASSF1A mRNA表达阳性率分别为38.3%(23/60)、20%(12/60),明显低于正常组织96.67%(58/60)、100%(60/60),差异有统计学意义(P均 < 0.05)(图1)。荧光定量PCR的扩增曲线呈典型的S型,融解曲线表现为单峰,可以排除引物二聚体及非特异性扩增,得到的Ct值可信(图2)。
3.3. 胃癌组织与正常组织中MGMT、RASSF1A基因蛋白表达情况
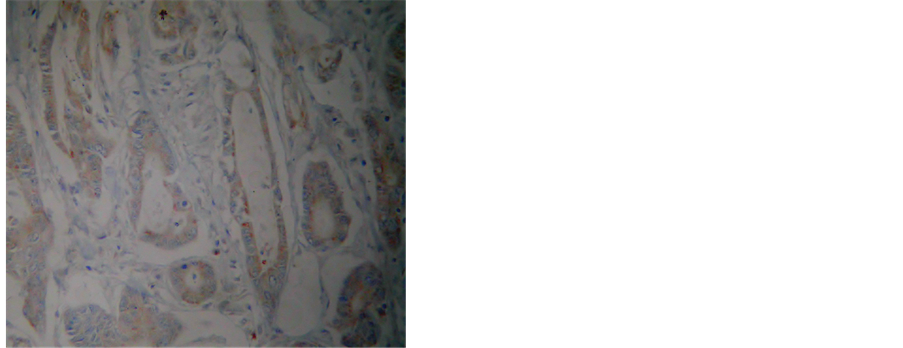
MGMT蛋白主要表达于细胞核或细胞质中,在癌旁组织中的阳性率为90.00%(54/60),明显高于胃癌组织的31.61%(19/60),差异有统计学意义(P < 0.05)。RASSF1A蛋白主要表达于细胞核或细胞质中,在癌旁组织中的阳性率为91.67%(55/60),明显高于胃癌组织的30.00%(18/60),差异有统计学意义(P < 0.05)(图3)。
肿瘤的形成是一个多基因、多阶段的过程,癌基因的激活和抑癌基因的失活在肿瘤的发生中起着重要的作用。抑癌基因的失活除了由基因突变、纯和性或杂合性缺实等导致,表观遗传学的改变如基因5’端CpG岛甲基化也是一个非常重要的机制。DNA甲基化是指具有胞嘧啶甲基转移活性的DNA甲基转移酶催化的,可以在转录水平调节基因的表达调控,是抑癌基因失活的重要机制,异常甲基化抑制肿瘤相关基因表达的过程是可逆的,因此去甲基化制剂可抑制癌基因的甲基化水平,抑制肿瘤细胞的生长[3] 。
MGMT蛋白是MGMT基因编码的由207个氨基酸组成的含磷蛋白,该基因定位于10q26上,被I-kilohase mRNA编码起抵抗细胞毒的作用主要定位于肽链145位上的半胱氨酸位点,是一种普遍存在的DNA修复酶[4] ,特异性修复环境致癌物造成的DNA甲基化损伤的O6-甲基鸟嘌呤[5] ,当基因异常表达水平降低,可导致肿瘤的发生发展[6] 。基于以上提示,本研究用MSP方法检测60例胃癌及癌旁正常组织手术标本,结果显示胃癌组织中甲基化率为45%明显高于正常组织8.33 %,RT-PCR法检测mRNA表达阳性率38.3%明显低于正常组织96.67%,免疫组织化学显示蛋白表达明显低于正常组织,可能由于蛋白表达过低不足以修复烷化剂导致的DNA损伤,最终导致细胞癌变,蔡健春[7] 等报道MGMT甲基化与
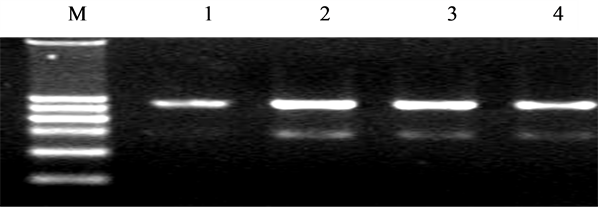
Figure 1. Electrophoretogram of RNA. Note: 2, 3: normal tissues; 1, 4: gastric cancer
图1. RNA电泳图谱 注:2、3:正常组织;1、4:胃癌组织
 (a)
(a)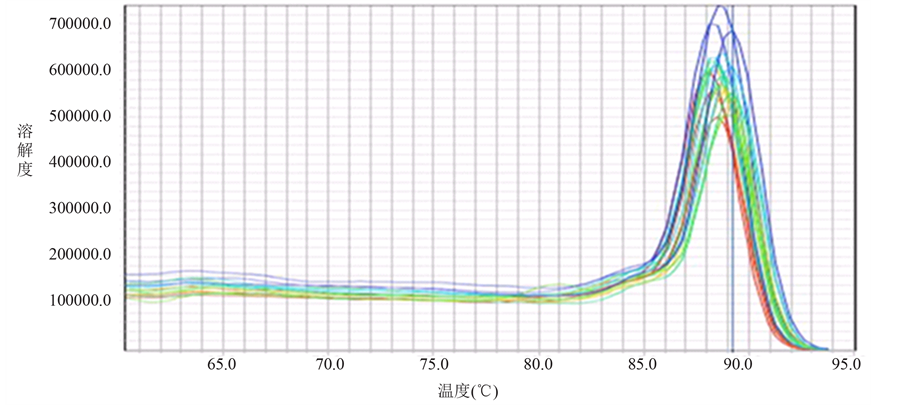 (b)
(b)
Figure 2. Amplification curves (a) and solubility curves (b) from real-time PCR
图2. 荧光定量RT-PCR目的基因扩增曲线(a)及溶解曲线(b)
胃癌pTNM有关。本实验表明MGMT基因启动子区甲基化可以使表达缺失,与胃癌的发生有关,也可能是其较早期的分子事件。有实验研究认为MGMT的甲基化异常在胃癌、结肠癌、黑色素瘤和脑胶质瘤等肿瘤组织中均有发生[8] [9] ,且其甲基化与判断胃癌的预后相关[10] 。
在基因家族中,转录本之间有协调表达,如果协调被打破,就会出现细胞不正常增殖[11] 。RASSFlA基因是2000年报道的从3号染色体短臂中克隆出来的新型候选抑癌基因。是一种Ras效应分子,通过Ras介导的信号通道发挥多种生物学效应,与Ras-GTP结合,诱导细胞凋亡[12] 。抑癌基因RASSF1A在正常组织中可见广泛表达,但在人类组织癌变时RASSF1A基因经常失活,以至启动子区5’GpG岛高甲基化[13] ,致使肿瘤发生,其启动子区甲基化与胃癌的发生相关[14] 。基于以上提示本研究用MSP方法检测60例胃癌及癌旁正常组织手术标本,结果显示胃癌组织中甲基化率为64.7%明显高于正常组织6.67%,RT-PCR法检测mRNA表达阳性率20%明显低于正常组织100%,免疫组织化学显示蛋白表达明显低于正常组织,细胞最终出现癌变,故考虑甲基化是胃癌早期发展的一个步骤。本结果显示与年龄、性别、有无淋巴结转移及分期无明显关系,Byun等[15] 在胃癌的报道中发现RASSF1A的甲基化水平与肿瘤分期有关,考虑与选择样本的年龄、种族和实验条件差异等导致,并需进一步扩大样本量来证明。
 (a)
(a)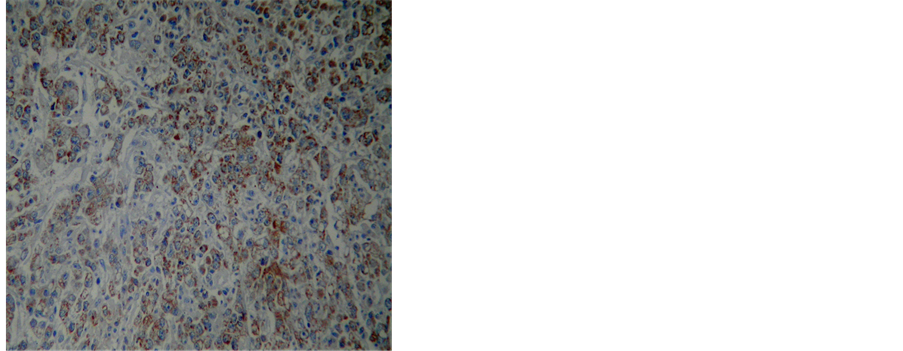 (b)
(b) (c)
(c)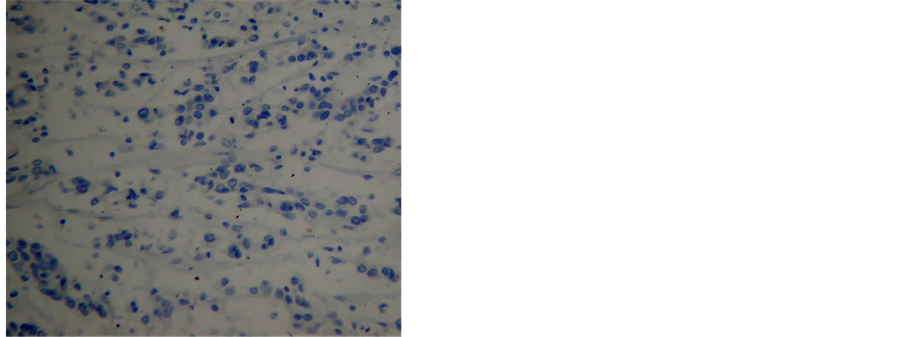 (d)
(d)
Figure 3. (a) (b) The expression of MGMT protein in normal tissue and gastric cancer; (c) (d) The expression of RASSF1A protein in normal tissue and gastric cancer
图3. (a) (b) MGMT在正常组织与胃癌组织中的表达;(c) (d) RASSF1A在正常组织与胃癌组织中的表达
人类组织中抑癌基因MGMT、RASSF1A基因甲基化导致其转录异常,继而可能引起细胞异常增殖,对该基因的进一步研究如干预其表达有可能在胃癌的防治中起一定作用,并且对胃癌的早期筛查及诊断有一定的帮助。
青岛市科技局资助项目(2012-1-3-1-(10)-nsh)。
- [1] Peedicayil, J. (2007) The role of epigenetics in mental disorders. Indian Journal of Medical Research, 126, 111.
- [2] Balin, S.B. and Ohm, J.E. (2006) Epigenetic gene silencing in cancer—A mechanism for early oncogenic pathway addiction. Nature Reviews Cancer, 2, 107-116.
- [3] Aniel, F.I., Cherubini, K., Yurgel, L.S., et al. (2011) The role of epigenetic transcription repression and DNA methyltransferases in cancer. Cancer, 117, 677-687.
- [4] Hibi, K., Sakata, M., Yokomizo, K., et al. (2010) Methylation of the MGMT gene is frequently detected in advanced gastric carcinoma. British Journal of Cancer, 102, 704-712.
- [5] Wang, L., Liu, H., Zhang, Z., et al. (2006) Association of genetic variants of 06-methylguanine-DNA methyltransferase with risk of lung cancer in non-Hispanic Whites. Cancer Epidemiology, Biomarkers & Prevention, 15, 2364-2369.
- [6] 张晖, 梁寒, 战忠利, 等 (2007) MGMT与hMLHl在胃癌组织中的表达及其临床相关性研究. 中华肿瘤防治杂志, 8, 819-821.
- [7] 蔡建春, 刘棣, 张海萍, 等 (2007) 胃癌组织中相关肿瘤抑制基因启动子区甲基化状态. 中华医学杂志, 14, 978-981.
- [8] Parkinsen, J.F., Wheeler, H.R., Clarkson, A., et al. (2008) Variation of O6-methylguanine-DNA methyltransferase (MGMT) promoter rmethylation in serial samples in gliobhstoma. Journal of Neuro-Oncology, 87, 71-78.
- [9] Verena, V., Annie-Claire, D., Alexandre, M., et al. (2008) Infrequent promoter methylation of the MGMT gene in liver metastases from uveal melanoma. International Journal of Cancer, 123, 1215-1218.
- [10] Shi, J., Zhang, G., Yao, D., et al. (2012) Prognostic significance of aberrant gene methylation in gastric cancer. Cancer Research, 2, 116-129.
- [11] Chen, H., Suzuki, M., Nakamura, Y., et al. (2006) Aberrant methylation of RASGFR2 and RASSFlA in human non-small cell lung cancer. Oncology Reports, 15, 1281-1285.
- [12] Vos, M.D., Dallol, A., Eckfeld, K., et al. (2006) The RASSFIA tumor suppressor activates Bax via MOAP-1. The Journal of Biological Chemistry, 281, 4557-4563.
- [13] Guo, W., Dong, Z., Chen, Z., et al. (2009) Aberrant CpG island hypermethylation of RASSFlA in gastric cardia adenocarcinoma. Cancer Investigation, 27, 459-465.
- [14] Ye, M., Xia, B., Guo, Q., et al. (2007) Association of diminished expression of RASSF1A with promoter methylation in primary gastric cancer from patients of central China. BMC Cancer, 7, 120.

*通讯作者。