Botanical Research
Vol.3 No.05(2014), Article ID:14046,6 pages
DOI:10.12677/BR.2014.35024
Study on Microscopy Techniques for Identifying Lignin Distribution in the Stem of Sorghum
1Analysis and Testing Center, Beijing Forestry University, Beijing
2College of Nature Conservation, Beijing Forestry University, Beijing
3College of Biological Sciences and Technology, Beijing Forestry University, Beijing
Email: *lpqmq@bjfu.edu.cn
Copyright © 2014 by authors and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY).
http://creativecommons.org/licenses/by/4.0/



Received: Jul. 10th, 2014; revised: Aug. 9th, 2014; accepted: Aug. 18th, 2014
ABSTRACT
Distribution of lignin in the stem of sorghum [Sorghum bicolor (L.) Moench] was examined by the visible light microscopy coupled with the Wiesner and Mäule color reactions and by autofluorescence microscopy to provide effective and reliable methods for identification of lignin distribution in gramineous plants. Transverse sections stained with Wiesner reaction and safranin both showed that epidermic cells, mechanical tissue, vascular bundle sheaths and vascular bundles were lignified. The middle lamella and cell corner appeared to contain more lignin than the secondary wall. Fluorescence microphotographs of sections stained with safranin and unstained demonstrated not only the tissues above contained lignin, but parenchyma cells showed bright autofluorescence. Mäule reagent staining showed that lignin in secondary walls of vascular bundle sheaths was rich in syringyl lignin, whereas middle lamellae and cell corner of vascular bundle sheaths and xylem cells lacked syringyl. The present study suggested that Wiesner reaction and safranin staining may be effectively applied in determining the distribution of lignin in cell walls of sorghum. Mäule reaction provides a rapid and sensitive estimate of syringyl lignin distribution. Autofluorescence examination under blue light excitation was sensitive and effective technique for total lignin distribution in cell walls of gramineous plants.
Keywords:Cell Wall, Fluorescence, Lignin, Sorghum, Staining

高粱茎杆中木质素分布的显微技术研究
邓建华1,2,管梦灵1,3,刘美芹1*
1北京林业大学公共分析测试中心,北京
2北京林业大学自然保护区学院,北京
3北京林业大学生物科学与技术学院,北京
Email: *lpqmq@bjfu.edu.cn
收稿日期:2014年7月10日;修回日期:2014年8月9日;录用日期:2014年8月18日

摘 要
本文以禾本科植物高粱[Sorghum bicolor (L.) Moench]为研究材料,采用Wiesner反应、Mäule反应、番红染色及三种自发荧光信号对茎秆中的木质素进行定位,以探讨禾本科植物组织中的木质素鉴定方法。观察结果显示,Wiesner反应结果与番红染色的可见光观察结果一致,即木质素主要分布在高粱茎的表皮、机械组织、木质部和维管束鞘的细胞壁中,在细胞水平上主要分布在胞间层和角隅处。番红染色的荧光信号和自发荧光也都显示上述部位有较高的木质素含量,而且薄壁细胞壁的荧光信号比上述染色的可见光信号更清楚。Mäule反应结果显示紫丁香木质素主要沉积在维管束鞘的外层细胞的次生壁,而不是内层细胞及导管的胞间层和细胞角隅处。以上结果表明,进行禾本科植物高粱中总木质素鉴定,可取的染色方法是Wiesner反应与番红染色,结果准确且操作简单;自发荧光方法应采用蓝光激发产生的绿色荧光信号进行鉴定,能排除酚类物质的干扰;Mäule反应能有针对性的鉴定紫丁香基木质素。
关键词
细胞壁,荧光,木质素,高粱,染色

1. 引言
木质素是构成植物细胞壁的主要成分之一,是地球上仅次于纤维素的天然有机物。在细胞开始成熟和次生壁增厚的过程中,木质素在细胞壁上不断沉积。木质素是一种具有芳香特性的三维高分子化合物,根据其聚合单体不同,木质素主要分为三类:紫丁香基木质素(syringyl lignin, S-木质素),愈创木基木质素(guaiacyl lignin,G-木质素)和对–羟基苯基木质素(hydroxy-phenyl lignin,H-木质素)。不同植物细胞壁中的木质素组成和含量不同,裸子植物主要为愈创木基木质素(G),双子叶植物主要含愈创木基–紫丁香基木质素(G-S),单子叶植物则为愈创木基–紫丁香基–对–羟基苯基木质素(G-S-H)。
近年来对植物组织的木质化过程和木质素在细胞壁上分布的研究,已经受到越来越多的重视。研究方法涉及到各种显微技术,包括组织化学染色,荧光显微镜技术和共聚焦拉曼显微镜及透射电子显微镜等。其中组织染色方法,由于其简单快捷的特点,在进行植物组织中木质素定位方面得到了大量应用,尤其是在木材、竹材的研究中,已经有较多应用,但有关禾本科植物中木质素分布的鉴定方法研究,目前未见报道。因此,本文以最有潜力的能源作物之一的高粱为研究材料,运用不同的组织染色方法及荧光显微技术,对茎秆中木质素的分布进行研究,探讨禾本科植物组织中木质素分布的鉴定方法,为定向改良植物细胞木质素含量,培育生物质能源植物提供理论和技术支持。
2. 材料与方法
2.1. 实验材料
实验材料高粱[Sorghum bicolor (L.) Moench]取自于苗圃中诸多植株中的健康植株,在种子成熟时,取茎秆的第二节,切成5毫米长的茎段,用FAA溶液固定48小时以上,振动切片机进行切片,切片厚度为50微米。
2.2. 方法
2.2.1. 组织化学染色
1) Mäule反应:切片用0.5%高锰酸钾溶液染色5分钟后,用蒸馏水漂洗2分钟;在12%盐酸中浸泡1分钟后,蒸馏水漂洗1分钟;用29%氨水封片后,显微镜(Leica DMI4000B)下可见光观察并拍照。
2) Wiesner反应:将切片置于载玻片上,滴加2%的间苯三酚酒精(95%)溶液数滴,稍待片刻,再加12%的盐酸几滴,封片后直接用可见光观赏拍照。
3) 番红染色反应:将切片浸入1%番红水溶液中约2小时后,分别用蒸馏水和75%的乙醇溶液漂洗,50%的甘油封片,于显微镜下做可见光观察,同时用绿光作为激发光源进行荧光观察拍照。
2.2.2. 自发荧光观察
将切片直接用50%甘油封片。在荧光显微镜(Leica DMI4000B)下分别用紫外、蓝光、绿光三种光作为激发光源,观察荧光信号并拍照。
3. 观察结果
成熟期高粱茎由外至内依次为表皮、机械组织、薄壁组织和维管束。维管束由厚壁细胞(纤维)构成的维管束鞘包围着,内部是木质部和韧皮部(见图1)。
3.1. Wiesner反应染色结果
Wiesner反应即盐酸–间苯三酚染色反应。本文的Wiesner反应结果显示,靠近表皮的机械组织、导管及维管束鞘均为正反应,细胞壁呈现鲜艳的红色,说明这些组织有较多的木质素分布;而薄壁组织和韧皮部细胞壁红色很浅,有的细胞甚至没有红色呈现,说明这些细胞壁中木质素沉积很少或没有(图1Ⅰ)。呈现鲜艳红色的木质化细胞壁中以胞间层与细胞角隅颜色最深,次生壁颜色较浅(图1Ⅰ),说明胞间层及细胞角隅处木质素沉积最多,到次生壁相对较少;从组织上看,靠近维管束内部的厚壁细胞壁红色较深,外部颜色较浅(图1Ⅰ),说明木质素沉积是从维管鞘内部向外进行的。
3.2. Mäule反应染色结果
细胞壁中的紫丁香基木质素经Mäule反应后呈红色。从高粱茎的染色结果(图1Ⅱ)中可以看出,不同组织的细胞壁上呈现的颜色存在明显差异,从黄色到棕红色不等,说明S-木质素的含量逐渐增加。着色较深的是机械组织和维管束鞘,颜色呈棕红色,说明其中含有S-木质素。其中颜色最深的是包围维管束鞘的最外层细胞壁,可见其中的紫丁香基木质素的沉积较多。有趣的是,细胞水平上染色最深的部位是维管束鞘的最外层细胞的次生壁,而不是胞间层和细胞角隅处,说明S-木质素主要沉积在次生壁中。
3.3. 番红染色结果
番红是组织学上应用广泛的一种染料,能将植物的木质化和角质化细胞染成红色。从图1Ⅲ可见高粱茎秆的表皮、机械组织、维管束鞘及木质部的细胞壁均被染成红色,说明这些细胞壁发生了角质化或


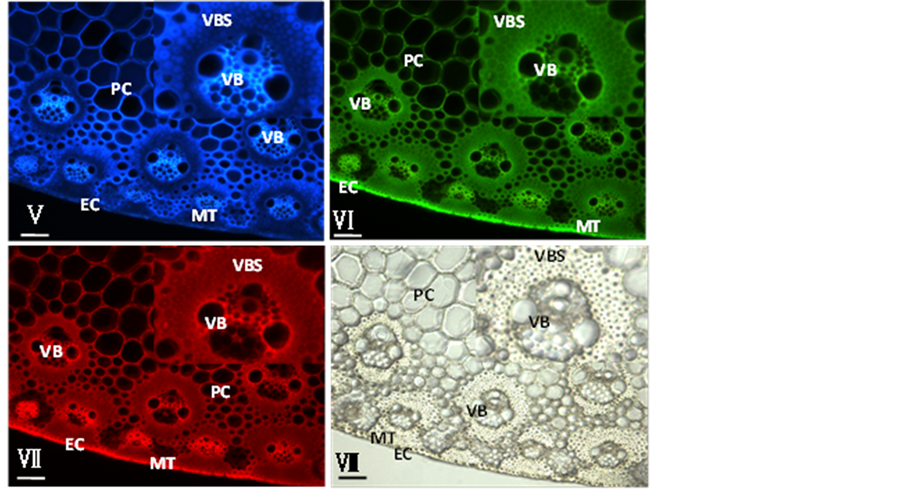
Figure 1. Histochemistry and autofluoresence micrographs for identifying lignin distribution in cell walls of sorghum (Sorghum bicolor) stem. I, Section stained with Wiesner reagent; II, Section stained with Mäule reagent; III, Section stained with safranin and viewed by light microscopy; IV, Section stained with safranin and viewed by fluorescence microscopy; V, Blueautofluorescence under UV light excitation; VI, Green autofluorescence under blue light excitation; VII, Red autofluorescence under green light excitation; VIII, Visible light micrograph. MT: mechanical tissue; VBS: vascular bundle sheath; VB: vascular bundles; PC: parenchyma cells; EC: epidermic cell. The bars represent 50 µm in length
图1. 组织染色与自发荧光进行高粱茎秆中木质素分布鉴定图。Ⅰ, Wiesner反应结果;Ⅱ, Mäule反应结果;Ⅲ, 番红染色的可见光结果;Ⅳ, 番红染色的荧光结果;Ⅴ, 紫外光激发后发出的蓝色自发荧光图;Ⅵ, 蓝光激光后发出的绿色自发荧光图;Ⅶ, 绿光激发后发出的红色自发荧光图;Ⅷ, 可见光图片。MT:机械组织;VBS:维管束鞘;VB:维管束;PC:薄壁细胞;EC:表皮细胞。标尺显示为50微米
木质化。其中染色较深较鲜艳的部位是机械组织和维管束鞘细胞的胞间层和细胞角隅,说明这些部位的胞间层的木质素沉积较多,而次生壁相对较少。维管束鞘内层的细胞壁红色较鲜艳,外围颜色较浅(图1Ⅲ),这与Wiesner反应的染色结果一致。
番红除了用作植物木质素可见光定位观察外,还可用作植物木质素的荧光定位。含有木质素的细胞壁经番红染色后经绿光激光能发出红色荧光。荧光信号较强的区域通常有较高的木质素含量,而颜色较浅的区域则是木质素含量较少的部位[1] 。高粱茎秆经番红染色后,能发出较强红色荧光的部位是机械组织、木质部和维管束鞘(图1Ⅳ),说明这些部位含有较高的木质素;其中荧光信号最强的部位仍是机械组织和维管束鞘细胞的胞间层和角隅处。这些结果与番红染色的可见光结果一致。但值得注意的是经番红染色后,薄壁组织的细胞壁能发出红色荧光,比可见光的信号清晰,这可能由于其中含有薄壁细胞壁的自发红色荧光信号。
3.4. 自发荧光结果
不同类型的细胞中,木质素的相对含量可以通过荧光显微镜直接进行观察。荧光信号强说明木质素含量高[2] 。本文采用不同波段的激发光即紫外、蓝光和绿光分别对高粱茎的横切面切片进行激发,并分别采集了自发荧光图片和可见光图片(图1Ⅴ-Ⅶ)。
由荧光图(图1Ⅴ-Ⅶ)可以看出,经紫外、蓝光和绿光激发后,能发出蓝色、绿色和红色荧光的部位基本相同,大多数细胞的细胞壁都有自发荧光,只是在荧光信号的强弱上存在明显差异。绿色(图1Ⅵ)和红色荧光(图1Ⅶ)的发光部位很相似,荧光较强的组织都是表皮、机械组织、维管束鞘、木质部和薄壁细胞,其中荧光最强的组织是木质部。而在所有发绿色和红色荧光的细胞壁中,信号最强的发光部位是胞间层与细胞角隅处。
经紫外激发后发出的蓝色荧光信号的组织是薄壁组织和维管束,而厚壁细胞如机械组织和维管束鞘细胞壁的蓝色荧光很弱,这与发红色及绿色荧光的组织存在明显差异。同样在发蓝色荧光的细胞壁中,信号最强的发光部位是次生壁,而不是胞间层(图1Ⅴ),这与红色及绿色荧光的最强发光部位也不同。
4. 讨论
通常木质素主要分布在木质部的管状分子、厚壁细胞、特定类型表皮细胞的细胞壁中;在细胞壁内部的分布规律是:胞间层和细胞角隅处的木质素含量最高,细胞内部浓度减少,次生壁内层又增高[3] 。从本文采用的多种方法对高粱茎中木质素分布的研究结果看,只有Wiesner反应结果与番红染色后的可见光结果与上述规律完全一致,即高粱茎的表皮、机械组织、木质部和维管束鞘的细胞壁呈强阳性反应,被染成鲜艳的红色,说明有较高的木质素沉积;其它部位如薄壁细胞、韧皮部则染色很浅或呈阴性反应。而自发荧光和番红染色后的荧光信号都显示除了上述呈阳性反应的部位外,薄壁细胞也有明显荧光信号。薄壁细胞出现这种差异,一方面这可能是由于酚酸类物质的存在使薄壁细胞壁具有自发荧光[4] ,另一方面可以说明荧光信号更敏感,少量的木质素也能被检测到。
Mäule反应的染色结果与Wiesner反应及番红染色结果也存在差异,主要表现在颜色最深的部位是维管束鞘的最外层细胞的次生壁,而不是内层细胞及导管的胞间层和细胞角隅处。这是由于Mäule反应是将细胞壁中的S-木质素染成红色,染色较深的区域只能表示该部位有较高的S-木质素的沉积。有报导称被子植物的胞间层中G-木质素沉积较多,而次生壁中是G-木质素与S-木质素混合沉积[2] ,所以Mäule反应后颜色最深的部位是次生壁。
从自发荧光结果看,蓝色自发光的发光部位与绿色及红色自发光的发光部位也存在明显差异。绿色及红色荧光的最强发光部位与Wiesner反应的阳性区域一致,即表皮、机械组织、木质部和维管束鞘的荧光信号相对较强。虽然薄壁细胞也有绿色、红色自发荧光,但比表皮、木质部和维管束鞘的信号弱。而薄壁细胞的蓝色自发荧光则强于表皮、机械组织和维管束鞘内层细胞的蓝色自发光。从细胞水平来看,绿色及红色自发荧光信号最强的部位是胞间层和细胞角隅处,而蓝色自发光信号最强的部位是次生壁。出现上述差异可能是由于薄壁细胞中的酚酸类物质在紫外激发下发出的蓝色荧光信号更强所致。
虽然上述方法在检测高粱茎中木质素分布过程中出现了差异,但这些方法在其它植物材料的研究中都得到了应用。其中Wiesner反应是最常用的鉴定组织中木质素分布的方法,在桦木、黄杨[5] 、拟南芥[6] 、短柄草[7] 及茶秆竹、毛竹[4] [8] 等植物中都有应用,是公认的木质素鉴定方法。Mäule反应是最常用的针对其中一种木质素单体,即S-木质素的染色方法,应用也很多,尤其是在进行木质素合成相关基因的研究中有不可替代的作用[7] [9] 。而且这两种反应通常会同时使用,以鉴定木质素的组织及微区分布[7] -[9] 。番红染色同样是鉴别细胞壁中木质素成分的常用方法,不管是可见光[10] 还是荧光[1] 的显微检测都有研究报导,所得结果也与本文的研究结果一致。
通过检测自发荧光鉴定木质素的分布比上述染色方法更简单,不需要任何染料,可以直接在显微镜下观察。目前应用较多的是通过检测紫外激发的蓝色荧光信号[9] [10] ,或检测蓝光激发的绿色荧光[2] [11] 信号,根据自发荧光信号的强弱,判断木质素含量的高低。但从本文的研究结果中可以明显看出,紫外激发后发出蓝色荧光的部位与蓝光激发后发绿色荧光的部位并不一致,而由此得出的木质素分布及含量的结论也会不一致。到底哪种荧光更能代表木质素呢,目前并没有研究提及该问题。但有报导称,细胞壁中经紫外激发后能发出蓝色自发荧光的物质除了木质素还有酚类物质[12] [13] 。而禾本科植物的细胞壁中存在阿魏酸、对–香豆酸等酚类物质[4] ,因此可以说本文中看到的蓝色自发光是木质素与酚类物质共同发出的荧光信号。所以在禾本科植物中,绿色自发荧光更能反映木质素的分布与含量。但这并不能否认采用蓝色自发荧光鉴定木质素的研究报导,因为那些研究是对双子叶植物苜蓿[9] 、花白蜡、香桃木、粘胶乳香树[10] 中的木质素进行鉴定,这些植物的细胞壁中的蓝色自发荧光主要是由于木质素存在。用绿色激发产生红色荧光进行木质素鉴定的研究很少。
综上所述,进行禾本科植物高粱中总木质素鉴定,比较可取的染色方法是Wiesner反应与番红染色,操作简单,结果准确;自发荧光方法建议采用蓝光激发产生的绿色荧光信号进行鉴定,能排除酚类物质的干扰。要进行S-木质素鉴定,Mäule反应会有可靠的结果。
基金项目
中央高校基本科研业务费专项资金资助(YX2013-08)。
参考文献 (References)
- [1] Bond, J., Donaldson, L., Hill, S., Hitchcock, K., et al. (2008) Safranine fluorescent staining of wood cell walls. Biotechnic & Histochemistry, 83, 161-171.
- [2] Donaldson, L.A. (2001) Lignification and lignin topochemistry—An ultrastructural view. Phytochemistry, 57, 859-873.
- [3] 蒋挺大 (2009) 木质素. 化学工业出版社, 北京.
- [4] 贺新强, 李素文, 胡玉熹等 (1999) 毛竹细胞壁自发荧光的显微荧光分光光度分析. 植物学报, 41, 711-714.
- [5] Yoshizawa, N., Watanabe, N., Yokota, S., et al. (1993) Distribution of guaiacyl and syringyllignins in normal and compression wood of Buxusmicrophylla var. insularis Nakai. IAWA Journal, 14, 139-151.
- [6] Zhong, R., Ripperger, A. and Ye, Z. (2000) Ectopic deposition of lignin in the pith of stems of two Arabidopsis mutants. Plant Physiology, 123, 59-69.
- [7] 杨淑敏, 任海青, 费本华等 (2010) 竹材木质素在细胞壁中的微区分布. 林产化学与工业, 30, 19-24.
- [8] Nakashima, J., Chen, F., Jackson, L., et al. (2008) Multi-site genetic modification of monolignol biosynthesis in alfalfa (Medicago sativa): Effects on lignin composition in specific cell types. New Phytologist, 179, 738-750.
- [9] Trabucco, G.M., Matos, D.A., Lee, S.J., et al. (2013) Functional characterization of cinnamyl alcohol dehydrogenase and caffeicacid O-methyltransferase in Brachypodium distachyon. BMC Biotechnology, 13, 61-78.
- [10] Micco, V.D. and Aronne, G. (2007) Combined histochemistry and autofluorescence for identifying lignin distribution in cell walls. Biotechnic & Histochemistry, 82, 209-216.
- [11] Xu, F., Sun, R.C., Lu, Q., et al. (2006) Comparative study of anatomy and lignin distribution in normal and tension wood of Salix gordejecii. Wood Science and Technology, 40, 358-370.
- [12] Lin, S.Y. and Dence, C.W. (1992) Methods in lignin chemistry. In: Fukuzawa, K., Ed., Ultraviolet Microscopy, Springer-Verlag, Berlin, 110-131.

NOTES
*通讯作者。