Hans Journal of Medicinal Chemistry
Vol.03 No.03(2015), Article ID:15789,9
pages
10.12677/HJMCe.2015.33005
The Development of Anti-Tumor Activity of Sulfonylurea Compounds
Jing Tian, Yu Qian, Xiaowei Chang, Junjie Ba*
College of Pharmacy, Inner Mongolia Medical University, Hohhot Inner Mongolia
Email: *bajunjie1982@sina.com
Received: Jul. 13th, 2015; accepted: Jul. 27th, 2015; published: Aug. 3rd, 2015
Copyright © 2015 by authors and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY).
http://creativecommons.org/licenses/by/4.0/



ABSTRACT
While the hypoglycemic and herbicidal activity of sulfonylurea is investigated, its anti-tumor activity has attracted special attention. Sulfonylurea compounds may be used in the medical field as a new class of promising anticancer drugs. In order to provide a reference for the application and development of anti-tumor sulfonylurea compounds, we summarize the domestic and foreign research progress of antitumor activity of the compounds.
Keywords:Sulfonylureas, Anti-Tumor, Development
磺酰脲类化合物抗肿瘤活性的研究进展
田静,钱宇,常霄巍,巴俊杰*
内蒙古医科大学药学院,内蒙古 呼和浩特
Email: *bajunjie1982@sina.com
收稿日期:2015年7月13日;录用日期:2015年7月27日;发布日期:2015年8月3日

摘 要
在进一步探讨磺酰脲类化合物除草作用和降糖活性的同时,其抗肿瘤活性早已引起了人们的特别关注。磺酰脲类化合物有可能作为一类新兴的具有前景的抗肿瘤药物应用于医药领域,本文综述了国内外对该类化合物抗肿瘤活性的研究进展,以期对磺酰脲类抗肿瘤化合物的应用发展提供参考。
关键词 :磺酰脲,抗肿瘤,研究进展

1. 引言
恶性肿瘤是世界上最可怕的疾病之一,尽管基础与临床研究领域取得了巨大的进步,使得恶性肿瘤的治愈率提高了许多,但是在发展与发达国家,癌症仍然是继心脏病之后的第二大死亡原因[1] 。治疗癌症的方法有手术治疗、放射治疗、化学治疗、生物治疗、基因治疗和中医药治疗,其中,化学治疗是最重要的方法之一[2] 。目前临床常用的抗肿瘤药有70种左右,已进入临床试验的抗肿瘤新药有400多种。抗肿瘤药物的数量虽多,但理想的药物却很少,所以寻找疗效好、毒副作用小的抗肿瘤药物有着深远的意义。
磺酰脲类化合物作为除草剂和降糖药已经广泛应用于农药和医药领域,在对磺酰脲类降糖药的作用机制的研究过程中,人们发现第二代降糖药如格列本脲等药物具有潜在的抑制肿瘤作用。
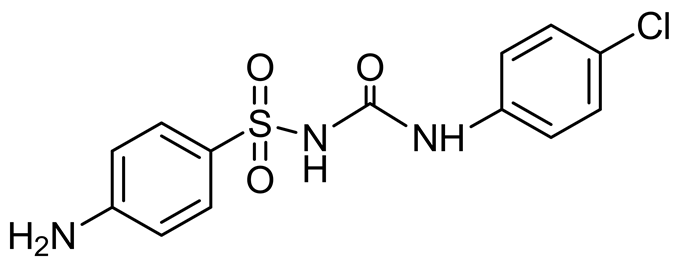
近年来,国外学者研究发现二芳基磺酰脲类化合物不论在体外还是体内都表现出很强的抗肿瘤活性,尤其是对结肠癌、卵巢癌、肺癌等实体肿瘤,并且无明显的多药耐药性[3] 。最早被报道的二芳基磺酰脲类抗肿瘤药物是磺氯苯脲(LY186641) (图1)。磺氯苯脲在临床上主要用于肺癌、乳腺癌、结肠癌、卵巢癌、胃癌以及横纹肌肉瘤等的治疗[4] -[6] 。其剂量限制以及高蛋白粘合物导致了贫血和高铁蛋白血红症,这种副反应可能是磺氯苯脲的苯胺代谢物引起的。随后,为了克服磺氯苯脲的这些严重不良反应,一些咪唑烷酮衍生物的二芳基磺酰脲类被合成,例如化合物D(图1)显示出比磺氯苯脲更高的细胞毒性,但是没有类似的副作用[7] 。至此,二芳基磺酰脲类(DSU)化合物逐渐成为了人们研制新一代抗肿瘤药物的焦点。本文就磺酰脲类化合物的抗肿瘤机制以及活性研究进展进行综述。
2. 抗肿瘤机制
2.1. 磺酰脲类降糖药物
格列本脲作为第二代磺酰脲类药物,具有很好的降糖作用。近年来,一些研究表明格列本脲对不同类型的肿瘤细胞具有抑制作用。
2.1.1. KATP通道抑制剂
越来越多的证据支持钾离子通道在癌症细胞的增殖和生存中起着调节作用。这表明该通道可能是潜在的治疗靶点。KATP通道在不同的组织(胰腺、心脏、骨骼肌和脑)和癌症细胞中表达,而格列本脲的抗肿瘤作用就与KATP通道相关,它能关闭血浆和线粒体膜中的KATP通道,引起细胞损伤和细胞凋亡[8] 。
2.1.2. 诱导活性氧(ROS)
Qian X等于2008年在胃癌细胞株MGC-803中研究格列本脲的抗肿瘤活性,发现其能诱导活性氧生成,通过激活浆液中的C-Jun NH2氨基端激酶和抑制凋亡AKT激酶能够降低线粒体膜蛋白电位,最后释放线粒体色素p450c以及凋亡诱导因子进入细胞液,从而导致肿瘤细胞凋亡[9] 。
2.1.3. TRAIL增敏剂
日本学者Suzuki Y在2012年报道称,格列本脲能够增加肿瘤细胞坏死因子诱导凋亡配体(TRAIL)的敏感性,从而导致肿瘤细胞凋亡。具体机理可能与增加等离子体膜电位的去极化,激活效应凋亡蛋白3和7,同时激活了内质网压力诱导凋亡蛋白酶12有关 [10] 。
2.2. 二芳基磺酰脲类化合物
二芳基磺酰脲类化合物作为潜在的抗肿瘤药物已经进入了临床,但是此类药物的详细作用机制目前尚不完全清楚,但是明显不同于其他抗肿瘤药物。目前研究发现可能存在多种抗癌机制,主要的有4种:一是作用于线粒体解耦联蛋白。二是与微管蛋白的位点结合,干扰微管的聚合和解聚,进而影响肿瘤细胞有丝分裂,导致细胞凋亡。三是通过JNK介导的转录激活上调RhoB。四是抑制肿瘤细胞的NADH环氧酶。
2.2.1. 作用于线粒体解偶联蛋白
Antonio Mastrolorenzo等在2000年报道了一系列对甲基苯磺酰脲的氨基酸(a)和二肽衍生物(b) (图2),在体外对白血病,非小细胞肺癌,卵巢癌,黑色素瘤,结肠癌等肿瘤细胞都具有抑制作用。其抗肿瘤机理也可能是通过线粒体解偶联线粒体氧化磷酸化来降低肿瘤细胞的ATP,进而抑制肿瘤细胞生长 [11] 。
2.2.2. 作用于微管蛋白聚合物
Hwang等在1999年报道了二芳基磺酰脲类衍生物DW2282 (图3),DW2282体内与体外都对人体肿瘤细胞都表现出很强的抑制活性。其机理是抑制微管蛋白聚合活性,作用于细胞有丝分裂G2/M期,从而诱导癌细胞凋亡 [12] 。Semi Kim等在2004年合成了一系列DW2282的衍生物,它们都是微管蛋白聚合抑制剂。通过在人类结肠癌细胞以及非小细胞性肺癌细胞中的药理实验发现,这些衍生物的抗肿瘤活性弱于或者等同于DW2282。其中,化合物1a (图3)表现出了比DW2282更强的抗肿瘤活性 [13] 。
2.2.3. 通过JNK介导的转录激活上调RhoB
Dong-Myung Kim等在2010年报道了一种新的二芳基磺酰脲衍生化合物LB2A (图4),他们通过免疫印迹、逆转录聚合酶链反应、促进剂荧光素酶等方法发现LB2A通过JNK介导的转录激活增加RhoB,

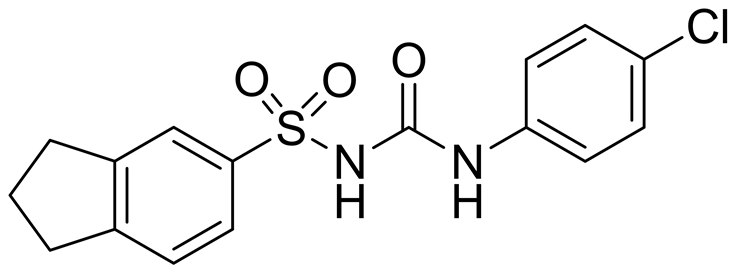 LY186641 D
LY186641 D
Figure 1. Structure of LY186641 and D
图1. LY186641和D的结构

 a b
a b
Figure 2. Structure of a and b
图2. a和b的结构
从而诱导人类结肠癌HCT-116细胞的凋亡。具体机制为LB2A减少组蛋白去乙酰化酶,增加乙酰化组蛋白H3抗体,使RhoB启动子活化,RhoB的异位表达诱导使结肠癌细胞死亡。同时在大鼠异位移植的体外实验中也进一步验证了该活性。因此LB2A可以作为结肠癌的潜在治疗化合物[14] 。
2.2.4. NADH氧化酶抑制剂
D.JamesMorre等在1995年通过人工培养宫颈癌细胞,研究二芳基磺酰脲类化合物LY181984 (图5)的活性,结果表明人宫颈癌细胞质膜表面上的34KDa结合蛋白具有NADH氧化酶活性,而LY181984则能与之结合从而抑制NADH氧化酶活性[15] 。研究表明LY181984仅能抑制肿瘤细胞血清中的NADH氧化酶,而对正常人和其他非肿瘤患者血清的NADH氧化酶无作用[16] 。并且其对细胞表面的NADH氧化酶活性是抑制还是促进与氧化还原环境有关[17] 。
此外,有研究表明,LY181984具有抑制人宫颈癌细胞的蛋白质二硫化物-硫醇交换的活性,并且该活性在还原型谷胱甘肽存在时达到最大[18] 。
Chinpal Kim等人于1997年研究发现LY181984的类似物LY237868 (图5)及其α-环糊精共轭物同样具有抑制人宫颈癌细胞NADH氧化酶的作用[19] 。
3. 抗肿瘤活性研究进展
最早对磺酰脲类化合物进行抗肿瘤活性研究的是外国学者,因为二芳基磺酰脲类化合物表现出了较好的抗肿瘤活性以及无明显的多药耐药性,所以该类化合物成为了目前的主要研究对象。国内对于磺酰脲类抗肿瘤化合物的研究甚少,鲜有报道。近年来,逐渐有学者开始关注该类化合物及其抗肿瘤活性,
 1a DW2282
1a DW2282
Figure 3. Structure of 1a and DW2282
图3. 1a和DW2282的结构
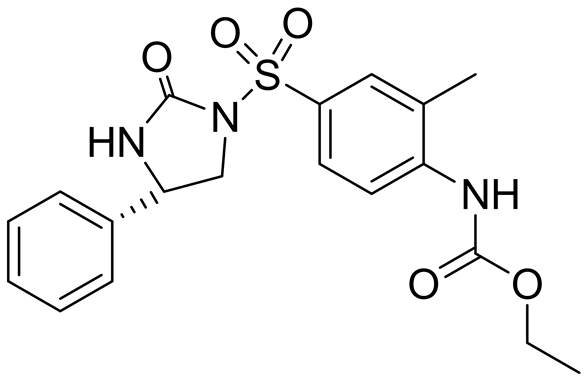
Figure 4. Structure of LB2A
图4. LB2A的结构
 LY181984 LY237868
LY181984 LY237868
Figure 5. Structure of LY181984 and LY237868
图5. LY181984和LY237868的结构
并进行了一系列结构改造,以求获得新的潜在抗肿瘤药物。
3.1. 国外
Houghton PJ等在1996年首先报道了一种新的二芳基磺酰脲类化合物LY295501 [20] (图6)。Ehlhardt WJ等在1997年进一步研究了该种化合物的抗肿瘤活性,证实了它在晚期难治性肿瘤中具有一定的抑制活性[21] 。该化合物已经进入了临床试验阶段,后期发现它具有脊髓毒性和血液毒性,但是作为最早进入临床的药物之一,它的贡献意义非凡。
Gil MJ等在1999年报道了一些N-2-吡啶基取代的二芳基磺酰脲衍生物,他们通过三维建模等研究手段发现其中的化合物6c (图7)对人结肠癌细胞(HT-29)、白血病细胞(K-562)和人肺癌细胞(HTB-54)具有很好的拮抗作用。而化合物6d和6e则对人急性淋巴细胞白血病T淋巴细胞(CCRF-CEM)具有更高的毒性[22] 。
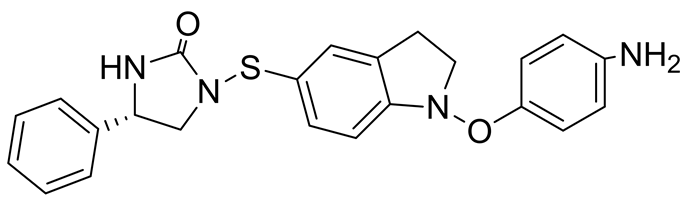
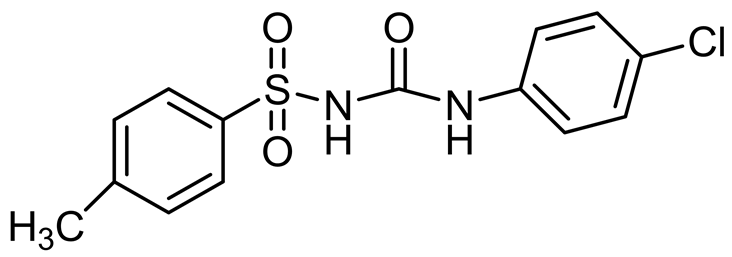
Lee CW等在2002年报道了两种具有立体构象的磺酰脲类化合物DW2282和DW2143 (图8)。其中DW2143为外消旋体混合物,DW2282为S-异构体。经过一系列的药理实验,发现DW2143对人类结肠癌细胞和肺癌细胞的生长抑制率分别为87%和67%。而DW2282则具有比DW2143更好的抗肿瘤活性和更低的毒性[23] 。
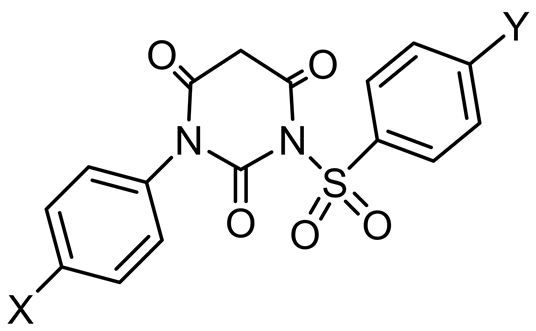
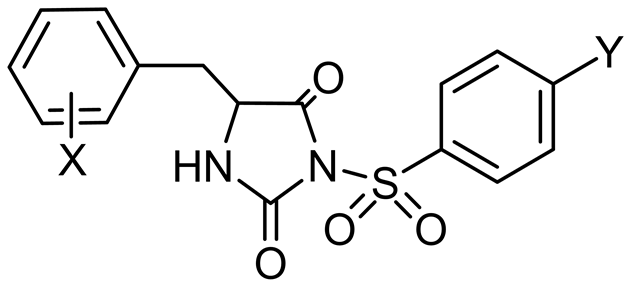
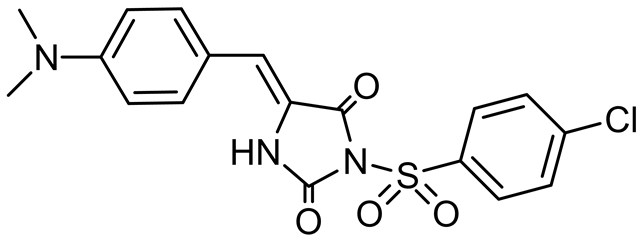
El-Deeb IM等在2010年设计合成了3a-r,6a-l,8a-l (图9)三个系列的环脲芳基磺酰脲化合物,通过对来自9种器官的60多种细胞株进行体外活性实验,证实了这三个系列的化合物分别抑制肾脏癌细胞、卵巢癌细胞和黑素瘤细胞。其中化合物3q对卵巢癌细胞IGROV1和肾癌细胞RXF393 具有很强的抑制活性,在测试浓度10 μM时对黑素瘤细胞的抑制百分率达到了199.62% [24] 。
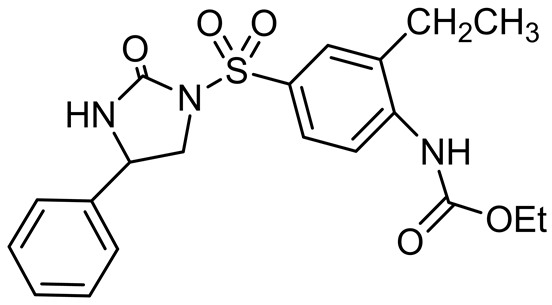
Vinay K等在2011年合成并报道了一系列咪唑啉酮基磺酰脲类衍生物,其中化合物c及其类似物d (图10)在体外表现出强有力的抑制肿瘤生长作用。化合物c具有抑制微管蛋白聚合的作用,并对一些多
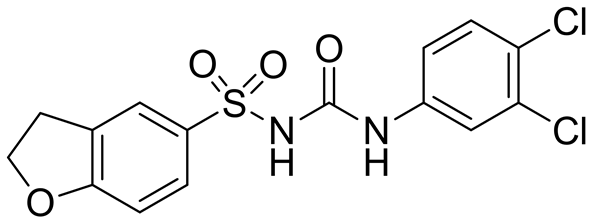
Figure 6. Structure of LY295501
图6. LY295501的结构


 6c 6d 6e
6c 6d 6e
Figure 7. Structure of 6c, 6d, 6e
图7. 6c、6d、6e的结构
 DW2143 DW2282
DW2143 DW2282
Figure 8. Structure of DW2143 and DW2282
图8. DW2143和DW2282的结构
耐药肿瘤细胞具有毒性。化合物d则能很好地抑制结肠癌(HCT-116)细胞、肺癌(A549)细胞和非小细胞肺癌(NCI-H460)细胞株 [25] 。
Pooja Rathore等在2014年设计合成了一系列新的吡唑啉取代的苯磺酰脲衍生物2a-z,对筛选的14个化合物进行人体肿瘤细胞活性测试,发现它们显示出了很好的抗恶性肿瘤细胞增生的活性。其中化合物2i、2n、2v和2x (图11)表现出广谱的抗肿瘤活性,对白血病、黑色素瘤、肺癌、结肠癌、中枢神经系统、卵巢、肾、前列腺癌和乳腺癌均有很强的抑制作用 [26] 。
Chetna Kharbanda等在2014年报道合成了一些新的含有苯硫基吡唑啉结构的苯磺酰脲化合物,筛选
 3系列 6系列
3系列 6系列
 8系列 3q
8系列 3q
Figure 9. Structure of series 3, 6, 8 and 3q
图9. 3、6、8系列和3q的结构
 c d
c d
Figure 10. Structure of c and d
图10. c和d的结构
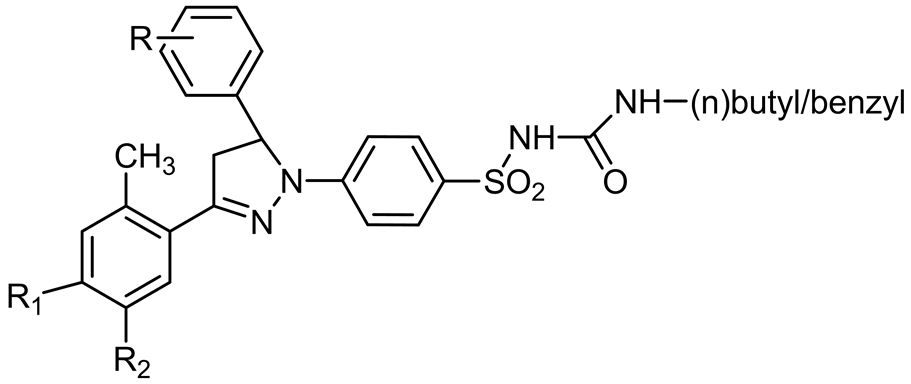 2i: R1 = H R2 = CH3 R = 3,4,5-trimethoxy; 2n: R1 = CH3 R2 = H R = 4-dimethylamino; 2v: R1 = HR2 = CH3 R = 3,4,5-trimethoxy; 2x: R1 = CH3 R2 = H R = 4-dimehtylamino
2i: R1 = H R2 = CH3 R = 3,4,5-trimethoxy; 2n: R1 = CH3 R2 = H R = 4-dimethylamino; 2v: R1 = HR2 = CH3 R = 3,4,5-trimethoxy; 2x: R1 = CH3 R2 = H R = 4-dimehtylamino
Figure 11. Structure of 2i, 2n, 2v and 2x
图11. 2i、2n、2v和2x的结构
了其中的2种(3h和3i) (图12)进行了体外活性试验,表明这两种化合物对肿瘤细胞尤其是黑素瘤细胞具有较为敏感的抑制活性[27] 。
3.2. 国内
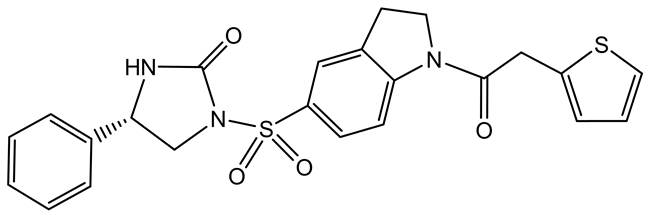
贾心语等于2013年报道合成了一系列的N′-取代苯基-2-苯并噻唑磺酰脲类化合物(图13),并以人非小细胞肺癌A-549细胞为测试细胞株,对所合成的化合物进行了初步抗肿瘤活性试验。筛选结果显示,与阳性对照顺铂(IC50 = 117 μmol∙L−1)相比较,目标化合物6b (IC50 = 135 μmol∙L−1)、6e (IC50 = 216 μmol∙L−1)和6n (IC50 = 184 μmol∙L−1)具有一定的抗肿瘤活性[28] 。其进一步的活性测试还在进行中。
钱宇等在2015年报道合成30个新型的N-取代苯基-9-烷基-3-咔唑磺酰脲类化合物(图14),并对其进行细胞周期分裂蛋白(Cdc25B)抑制活性筛选。结果表明,在用药浓度为20 ug∙mL−1时,其中12个化合物对Cdc25B具有良好的抑制活性,抑制率大于90% [29] 。
4. 结语
近20年来,我国恶性肿瘤的发生率和死亡率明显上升,在35~59岁的中年人群中,肿瘤已列居各类死因之首[30] 。寻找新颖的、高效的抗肿瘤药物势在必行。磺酰脲类化合物对各种人体实体瘤均有体外抑制作用,有望成为一类潜在的抗肿瘤药物。目前投入临床的药物有LY186641以及LY295501,但是在实
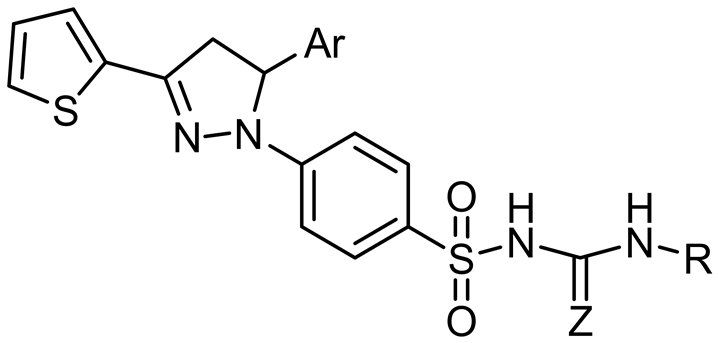 3h: Ar = 5-methylthiopenylR = p-CH3C6H5 Z=O; 3i: Ar = 5-methylthiopenylR = p-OCH3C6H5 Z=O
3h: Ar = 5-methylthiopenylR = p-CH3C6H5 Z=O; 3i: Ar = 5-methylthiopenylR = p-OCH3C6H5 Z=O
Figure 12. Structure of 3h and 3i
图12. 3h和3i的结构
 6b: R1=H R2=4-Cl; 6e: R1=3-Cl R2=4-Cl; 6n: R1=H R2=4-OCH3
6b: R1=H R2=4-Cl; 6e: R1=3-Cl R2=4-Cl; 6n: R1=H R2=4-OCH3
Figure 13. Structure of 6b、6e、6n
图13. 6b、6e、6n的结构

Figure 14. Structure of N-substituted phenyl-9-alkyl-3-carbazole sulfonyl ureas
图14. N-取代苯基-9-烷基-3-咔唑磺酰脲的结构
际应用中,发现前者具有贫血和高铁蛋白血红症等副作用,后者具有脊髓毒性和肾毒性。因此需要对该类化合物进行结构改造和修饰以合成更多活性强,毒性低的二芳基磺酰脲类类抗肿瘤药物。
磺酰脲类化合物对肿瘤的治疗作用是通过多环节、多靶点共同协调完成的。这对于从多途径发现抗肿瘤药物具有重大的意义。二芳基磺酰脲类化合物的合成和抗肿瘤活性研究正在成为抗肿瘤药物研究的热点之一。
文章引用
田 静,钱 宇,常霄巍,巴俊杰. 磺酰脲类化合物抗肿瘤活性的研究进展
The Development of Anti-Tumor Activity of Sulfonylurea Compounds[J]. 药物化学, 2015, 03(03): 29-37. http://dx.doi.org/10.12677/HJMCe.2015.33005
参考文献 (References)
- 1. Sherif, A. and Rostom, F. (2006) Synthesis and in vitro antitumor evaluation of some indeno[1,2-c]-pyrazol(in)es substituted with sulfonamide, sulfonylurea(-thiourea)pharmacophores, and some derived thiazole ring systems. Bioorganic & Medicinal Chemistry, 14, 6475-6485. http://dx.doi.org/10.1016/j.bmc.2006.06.020
- 2. 方家椿 (2006) 分子靶点和分子靶向抗肿瘤药研究进展. 北京大学报, 38, 575-578.
- 3. Grindey, G.B. (1988) Identification of diarylsulfonylureas as novel anticancer drugs. Proceedings of the American Association for Cancer Research, 29, 535-536.
- 4. Charles, W., Taylor, D., Alberts, S. and Peng, Y.-M. (1992) Antitumor activity and clinical pharmacology of sulofenur in ovarian cancer. Journal of the National Cancer Institute, 84, 1798-1802. http://dx.doi.org/10.1093/jnci/84.23.1798
- 5. Houghton, P., Sosinski, J., Thakar, J. and Houghton, J. (1991) Diarylsulfonylureas: New anticancer agents with novel activities, toxicities and mechanism of action. Proceedings of the 3rd International Congress on Neo-Adjuvant Chemotherapy, 405-408. http://dx.doi.org/10.1007/978-2-8178-0782-9_98
- 6. Houghton, P.J., Houghton, J.A., Myers, L. and Cheshire, P. (1989) Evaluation of N-(5-indanylsulfonyl)-N'-(4-chloro- phenyl)-urea against xenografts of pediatric rhabdomyosarcoma. Cancer Chemotherapy and Pharmacology, 25, 84-88. http://dx.doi.org/10.1007/BF00692344
- 7. Howbert, J.J., Grossman, C.S., Crowell, T.A., Harper, B.J.R.W. and Grindey, G.B. (1990) Novel agents effective against solid tumors: The diarylsulfonylureas. Synthesis, actrities, and analysis of quantitative structure-activity relationships. Journal of Medicinal Chemistry, 33, 2393-2407. http://dx.doi.org/10.1021/jm00171a013
- 8. Ardehali, H. and O’Rourke, B. (2005) Mitochondrial K(ATP) channels in cell survival and death. Journal of Molecular and Cellular Cardiology, 39, 7-16. http://dx.doi.org/10.1016/j.yjmcc.2004.12.003
- 9. Qian, X., Li, J., Ding, J., et al. (2008) Glibenclamide exerts an antitumor activity through reactive oxygen species-c-jun NH2-terminal kinase pathway in human gastric cancer cell line MGC-803. Biochemical Pharmacology, 76, 1705-1715. http://dx.doi.org/10.1016/j.yjmcc.2004.12.003
- 10. Suzuki, Y., Inoue, T., Murai, M., et al. (2012) Depolarization potentiates TRAIL-induced apoptosis in human melanoma cells: Role for ATP-sensitive K+ channels and endoplasmic reticulum stress. International Journal of Oncology, 41, 465-475. http://dx.doi.org/10.3892/ijo.2012.1483
- 11. Mastrolorenzo, A., Scozzafava, A. and Supuran, C.T. (2000) 4-Toluenesulfonylureido derivatives of amines, amino acids and dipeptides: A novel class of potential antitumor agents. European Journal of Pharmaceutical Sciences, 11, 325-332. http://dx.doi.org/10.1016/S0928-0987(00)00122-6
- 12. Hwang, H.S. and Moon, E.Y. (1999) Characterization of the anticancer activity of DW2282, a new anticancer agent. Anticancer Research, 19, 5087-5093.
- 13. Kim, S., Park, J.H., Koo, S.-Y., Kim, J.I., Kim, M.-H., Kim, J.E., et al. (2004) Novel diarylsulfonylurea derivatives as potent antimitotic agents. Bioorganic & Medicinal Chemistry Letters, 14, 6075-6078. http://dx.doi.org/10.1016/j.bmcl.2004.09.069
- 14. Kim, D.-M., Won, M., Chung, C.-S., Kim, S., Yim, H.J., Jung, S.-H. and Jeong, S.W. (2010) JNK-mediated transcriptional upregulation of RhoB is critical for apoptosis of HCT-116 colon cancer cells by a novel diarylsulfonylurea derivative. Apoptosis, 15, 1540-1548. http://dx.doi.org/10.1007/s10495-010-0531-7
- 15. Morré, D.J., Wu, L.Y. and Morré, D.M. (1995) The antitumor sulfonylurea N-(4-methylphenylsulfonyl)-N’-(4- chlorophenyl)urea (LY181984) inhibits NADH oxidase activity of HeLa plasma membranes. Biochimica et Biophysica Acta, 1240, 11-17. http://dx.doi.org/10.1016/0005-2736(95)00164-7
- 16. Morré, D.J. and Reust, T. (1997) A circulating form of NADH oxidase activity responsive to the antitumor sulfonylurea N-4-(methylphenylsulfonyl)-N’-(4-chlorophenyl)urea (LY181984) specific to sera from cancer patients. Journal of Bioenergetics and Biomembranes, 29, 281-289. http://dx.doi.org/10.1023/A:1022466212083
- 17. Morré, D.J., Wu, L.-Y. and Morre, D.M. (1998) Response of a cell-surface NADH oxidase to the antitumor sulfonylurea N-(4-methylphenylsulfonyl)-N’-(4-chlorophenylurea) (LY181984) modulated by redox. Biochimica et Biophysica Acta, 1369, 185-192. http://dx.doi.org/10.1016/S0005-2736(97)00202-2
- 18. Morré, D.J., Jacobs, E. and Sweeting, M. (1997) A protein disulfide-thiol interchange activity of HeLa plasma membranes inhibited by the antitumor sulfonylurea N-(4-methylphenylsulfonyl)-N’-4-chlorophenyl)urea (LY181984). Biochimica et Biophysica Acta, 1325, 117-125.
- 19. Kim, C., MacKellar, W.C., Cho, N.M., Byrn, S.R. and Morré, D.J. (1997) Impermeant antitumor sulfonylurea conjugates that inhibit plasma membrane NADH oxidase and growth of HeLa cells in culture. Identification of binding proteins from sera of cancer patients. Biochimica et Biophysica Acta, 1324, 171-181. http://dx.doi.org/10.1016/S0005-2736(96)00219-2
- 20. Houghton, P.J. and Houghton, J.A. (1996) Antitumor diarylsulfonylureas: Novel agents with unfulfilled promise. Investigational New Drugs, 14, 271-280. http://dx.doi.org/10.1007/BF00194530
- 21. Ehlhardt, W.J., Woodland, J.M., Toth, J.E., Ray, J.E. and Martin, D.L. (1997) Disposition and metabolism of the sulfonylurea oncolytic agent LY295501 in mouse, rat, and monkey. Drug Metabolism and Disposition, 25, 701-708.
- 22. Gil, M.J., Mañú, M.A., Arteaga, C., Migliaccio, M., Encío, I., González, A. and Martínez-Merino, V. (1999) Synthesis and cytotoxic activity of N-(2-pyridylsulfenyl)urea derivatives. A new class of potential antineoplastic agents. Bioorganic & Medicinal Chemistry Letters, 9, 2321-2324. http://dx.doi.org/10.1016/S0960-894X(99)00373-X
- 23. Lee, C.W., Hong, D.H., Han, S.B., Jung, S.H., Kim, H.C., Fine, R.L., Lee, S.H. and Kim, H.M. (2002) A novel stereo- selective sulfonylurea, 1-[1-(4-aminobenzoyl)-2,3-dihydro-1H-indol-6-sulfonyl]-4-phenyl-imidazolidin-2-one, has antitumor efficacy in vitro and in vivo tumor models. Biochemical Pharmacology, 64, 473-480. http://dx.doi.org/10.1016/S0006-2952(02)01105-X
- 24. El-Deeb, I.M., Bayoumi, S.M., El-Sherbeny, M.A. and Abdel-Aziz, A.A.M. (2010) Synthesis and antitumor evaluation of novel cyclic arylsulfonylureas: ADME-T and pharmacophore prediction. European Journal of Medicinal Chemistry, 45, 2516-2530. http://dx.doi.org/10.1016/j.ejmech.2010.02.038
- 25. Sharma, V.K., Lee, K.-C. and Venkateswararao, E. (2011) Structure-activity relationship study of arylsulfonylimidazolidinones as anticancer agents. Bioorganic & Medicinal Chemistry Letters, 21, 6829-6832.
- 26. Rathore, P., Yaseen, S., Ovais, S., Bashir, R., Yaseen, R., Hameed, A.D., et al. (2014) Synthesis and evaluation of some new pyrazoline substituted benzenesulfonylureas as potential antiproliferative agents. Bioorganic & Medicinal Chemistry Letters, 24, 1685-1691. http://dx.doi.org/10.1016/j.bmcl.2014.02.059
- 27. Kharbanda, C., Alam, M.S., Hamid, H., Javed, K., Shafi, S., Ali, Y., et al. (2014) Novel benzenesulfonylureas containing thiophenylpyrazoline moiety as potential antidiabetic and anticancer agents. Bioorganic & Medicinal Chemistry Letters, 24, 5298-5303. http://dx.doi.org/10.1016/j.bmcl.2014.09.044
- 28. 贾心语, 苗娜, 马丽娟, 钱宇 (2013) N’-取代苯基-2-苯并噻唑磺酰脲类化合物的合成. 中国药物化学杂志, 6, 467-472.
- 29. 钱宇, 田静, 常霄巍, 巴俊杰 (2015) 新型N-取代苯基-9-烷基-3-咔唑磺酰脲类化合物的合成及其抗肿瘤活性. 合成化学, 5, 369-375.
- 30. 杨眉, 李钰, 徐冬燕, 侯长军, 法焕宝 (2014) 靶向型药物载体在抗肿瘤治疗中的研究进展. 材料导报, 3, 60-64.