Open Journal of Fisheries Research
Vol.02 No.04(2015), Article ID:16600,8
pages
10.12677/OJFR.2015.24007
Acute Toxic Effects upon the Main Pollutants of Aquaculture Water Quality on Juvenile Larimichthys crocea
Kunhuang Han1,2
1State Key Laboratory of Large Yellow Croaker Breeding, Ningde Fufa Fisheries Company Limited, Ningde Fujian
2Fisheries College of Jimei University, Xiamen Fujian

Received: Dec. 4th, 2015; accepted: Dec. 18th, 2015; published: Dec. 24th, 2015
Copyright © 2015 by author and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY).
http://creativecommons.org/licenses/by/4.0/



ABSTRACT
The ammonia nitrogen (NH3-N) and nitrite nitrogen (NO2-N) are the main pollutants of aquaculture water quality, which have some toxic effects on the aquatic animals. This paper studies acute toxic effects of ammonia nitrogen and nitrite nitrogen upon juvenile Larimichthys crocea with total length (90 - 120 mm) in (25 ± 0.5)˚C of water temperature, with a salinity of 23, pH 8.0 ± 0.1, and dissolved oxygen (DO) more than 5.0 mg∙L−1. The NH3-N concentration gradient is 3.00 mg∙L−1, 4.75 mg∙L−1, 7.54 mg∙L−1, 11.94 mg∙L−1, 18.93 mg∙L−1 and 30.00 mg∙L−1; the NO2-N concentration gradient is 20.00 mg∙L−1, 34.37 mg∙L−1, 59.07 mg∙L−1, 101.55 mg∙L−1, 174.50 mg∙L−1, and 299.99 mg∙L−1. Results show that the half lethal concentration at 96 h (96 h-LC50) of total ammonia nitrogen (NH3-Nt) is 6.35 mg/L with the safe concentration (CS) of 0.64 mg∙L−1; 96 h-LC50 of molecular ammonia (NH3-Nm) is 0.11 mg∙L−1 with the safe concentration (CS) of 0.011 mg∙L−1; and 96 h-LC50 of nitrite nitrogen (NO2-N) is 45.73 mg∙L−1 with the CS of 4.57 mg∙L−1.
Keywords:Larimichthys crocea, Ammonia Nitrogen, Nitrite Nitrogen, Acute Toxicity

大黄鱼苗种对养殖水质主要污染物的急性毒性反应
韩坤煌1,2
1宁德市富发水产有限公司,大黄鱼育种国家重点实验室,福建 宁德
2集美大学水产学院,福建 厦门

收稿日期:2015年12月4日;录用日期:2015年12月18日;发布日期:2015年12月24日

摘 要
氨氮(NH3-N)和亚硝酸盐(NO2-N)是养殖水质的主要污染物,对养殖水产动物具有一定的毒性效应。本研究在水温(25 ± 0.5)℃,盐度23,pH值为8.0 ± 0.1,溶解氧(DO)大于5.0 mg∙L−1的条件下,研究全长90~
关键词 :大黄鱼,氨氮,亚硝酸盐,急性毒性

1. 引言
大黄鱼(Larimichthys crocea)隶属硬骨鱼纲、鲈形目、石首鱼科、黄鱼属,为温暖性近海中下层鱼类,是中国现如今养殖规模最大的海水网箱经济鱼类[1] 。
氨氮(NH3-N)和亚硝酸盐(NO2-N)是养殖水体的主要污染物 [2] ,对养殖水产动物具有一定的毒性效应,它们在养殖过程中随着养殖密度及投饵的增加而不断积累,抑制鱼类正常生长,甚至危害鱼的健康 [3] - [6] 。其毒性主要表现为对摄食和生长的抑制 [7] [8] ,对血液指标的影响 [9] - [11] ,对生理指标和组织器官的影响 [12] - [19] ,以及降低机体免疫力 [20] 等。不同的水产动物以及同种动物的不同生长阶段对水质中NH3-N和NO2-N的耐受性不同 [21] 。近年来,关于NH3-N和NO2-N对鱼类 [22] - [25] 、虾 [26] - [28] 、蟹 [29] 等不同水产动物的毒性试验研究已多有见报,而关于NH3-N和NO2-N对大黄鱼苗种的急性毒性研究却尚不多见。为此,本试验研究了总氨氮(NH3-Nt)、非离子氨(NH3-Nm)和(NO2-N)对大黄鱼幼鱼的半致死浓度(LC50)和安全浓度(CS),为大黄鱼苗种养殖的适宜水质环境调控提供科学依据。
2. 材料与方法
2.1. 试验条件与材料
试验地点位于福建官井洋大黄鱼原种场,试验时间为2012年6月,试验大黄鱼苗种全长为90~
试验用药剂为氯化铵(NH4Cl)和亚硝酸钠(NaNO2) (分析纯),均配置成10 g∙L−1的母液备用。
2.2. 试验方法
进行预试验,分别配置含NH4Cl和NaNO2不同浓度的水体,放入大黄鱼幼鱼;观察记录大黄鱼的死亡情况,经多次试验得到NH4Cl和NaNO2对大黄鱼的96 h 0%死亡质量浓度(90 h-LC0)和24 h 100%死亡质量浓度(24 h-LC100),以确定NH3-N和NO2-N毒性试验中各试验组的浓度上下限,各自以等对数浓度区间设立7个试验浓度组,包括6个浓度梯度组及1个对照组,其所选取的试验质量浓度如表1所示,每个浓度组(含对照组)设2个平行。试验开始前一天备选幼鱼停食,试验期间不投饵。试验开始时,容器中放入
2.3. 试验数据处理
使用SPSS 15.0软件进行试验数据处理,采用直线内插法求出NH3-N和NO2-N对大黄鱼幼鱼24 h、48 h、72 h和96 h的LC50及95%置信区间,并求出NH3-N和NO2-N对大黄鱼幼鱼的CS。
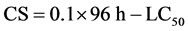 (1)
(1)
NH3-N的两种组成中,NH3-Nm对鱼体的毒害作用远高于离子氨NH3-Nl,是NH3-N中主要的毒性物质,因此计算NH3-N的LC50的同时要计算NH3-Nm的LC50,NH3-Nm浓度的计算公式 [24] 为:
 (2)
(2)
式中
 (3)
(3)
3. 试验结果
3.1. 在NH3-N急性毒性试验中的表现
在NH3-N急性毒性试验中,大黄鱼幼鱼有明显应激反应,在低浓度试验组中反应较为缓慢,在高浓度试验组中反应强烈。从NH3-N质量浓度3.00 mg∙L−1开始,幼鱼在试验开始后即表现出不安窜游、时有浮头的症状,但总体较为正常,受惊程度低;NH3-N质量浓度大于11.94 mg∙L−1试验组中,幼鱼在试验开始后即出现躁动、频繁浮头的症状,部分幼鱼有触击塑料箱的行为,6 h后部分幼鱼即活力降低,游动缓慢,并出现侧游、鳃盖微张甚至死亡。幼鱼因为受惊而产生的应激反应随时间而减缓,但由于大黄鱼极易受惊,因受惊而死亡的大黄鱼幼鱼数不可避免。
3.2. 对NH3-N的急性毒性反应结果
NH3-N对大黄鱼幼鱼的急性毒性试验结果显示,NH3-N浓度和其对大黄鱼的毒性呈正相关,和大黄鱼的死亡率呈正相关;在同一NH3-N浓度条件下,NH3-N对鱼体的作用时间与其毒性呈正相关、和大黄鱼死亡率呈正相关(表2)。经直线内插法求出NH3-Nt对大黄鱼幼鱼的24 h、48 h、72 h和96 h LC50及CS,显示结果为11.923 mg∙L−1、8.600 mg∙L−1、7.347 mg∙L−1、6.348 mg∙L−1和0.64 mg∙L−1,其相应的NH3-Nm的CS分别为0.208 mg∙L−1、0.150 mg∙L−1、0.128 mg∙L−1、0.111 mg∙L−1和0.011 mg∙L−1 (表3)。
3.3. 在NO2-N急性毒性试验中的表现
在NO2-N急性毒性试验中,大黄鱼对NO2-N的耐受性较之NH3-N大大升高,试验开始后,不同质量浓度试验组中的鱼体表现出不同程度的呼吸障碍现象,鱼体活力不同程度减弱直至死亡,中毒过程中未发现出躁动不安现象,死亡鱼体身鳃盖张大,倒翻于水面。整个试验过程中未发现因更换试验用水而引起鱼体应激死亡的情况。
Table 1. The mass concentration of NH3-N and NO2-N in this experiment (unit: mg∙L−1)
表1. NH3-N和NO2-N的试验质量浓度表(单位:mg∙L−1)
Table 2. The acute toxic effect of NH3-N on the juvenile L. crocea
表2. 氨氮对大黄鱼幼鱼毒性试验结果
Table 3. The LC50 and CS values of NH3-Nt and NH3-Nm on the juvenile L. crocea
表3. 总氨氮和非离子氨对大黄鱼幼鱼的半致死浓度和安全浓度
3.4. 对NO2-N的急性毒性反应结果
NO2-N对大黄鱼幼鱼的急性毒性试验结果显示,NO2-N浓度和其毒性呈正相关,和大黄鱼的死亡率呈正相关;在NO2-N同一浓度条件下,NO2-N对鱼体的作用时间与其毒性、大黄鱼死亡率呈正相关(表4)。经直线内插法求出NO2-N对大黄鱼的24 h、48 h、72 h和96 h LC50及CS分别为115.675 mg∙L−1、97.881 mg∙L−1、73.107 mg∙L−1、45.730 mg∙L−1和4.57 mg∙L−1 (表5)。
Table 4. The acute toxic effect of NO2-N on the juvenile L. crocea
表4. 亚硝酸盐对大黄鱼幼鱼的毒性试验结果
Table 5. The LC50 and the safe concentrations of NO2-N on the juvenile L. crocea
表5. 亚硝酸盐对大黄鱼幼鱼的半致死浓度和安全浓度
4. 讨论
4.1. NH3-N和NO2-N的毒性分析
养殖水体中的NH3-N主要以NH3-Nl和NH3-Nm两种形式存在,NH3-Nl不能进入细胞膜,无明显毒害。NO2-N对鱼体的毒性主要是由于水体中的NO2-N浓度达到一定程度后,通过鳃丝等组织进入到鱼体中并结合血红蛋白,将血红细胞中的Fe2+氧化成Fe3+,形成不具携氧功能的高铁血红蛋白,血液的载氧能力减弱,造成鱼体组织缺氧,神经麻痹,甚至窒息死亡 [19] 。NH3-Nm为不带电荷的脂溶性小分子,可透过细胞膜或结合血液中血红蛋白,引起鱼体组织中毒,对水生生物的毒性较NH3-Nl强百倍。
随着水环境中NH3-Nm浓度的上升,鱼体中的血氨含量和其他组织中的氨含量增加。NH3-Nm不但进入血淋巴对鳃细胞造成不可逆损伤,还破坏细胞膜,从而导致鱼体各组织中的细胞形态、结构和功能的异常,致使肾、肝等各组织器官出现不同程度的组织损伤 [18] 。洪美玲等 [13] 研究显示,NH3-Nm急性毒性试验中,鱼体的神经系统中毒,表现为抽搐、昏迷,并发生死亡。王志坚等 [14] 研究发现,NH3-Nm能破坏鳃上皮细胞引起窒息并渗进血液刺激糖酵解和三羧酸循环,引起鱼酸中毒和血液携氧量的降低,使水生动物呼吸代谢受阻。PARK等 [17] 研究发现在高浓度NO2-N组中鱼体体表、鳃、肝脏和肾脏己经发生病变。此外,BENLI等 [19] 指出,在高浓度的NO2-N水环境下,鱼体鳃丝基部的泌氯细胞增殖变大、胞内线粒体受损肿大,鳃丝肿大、鳃小片溶解、肝肾严重受损。
4.2. NH3-N和NO2-N对大黄鱼幼鱼的毒性比较
已有研究表明,氨氮中毒时鱼苗的反应较亚硝酸盐中毒更为剧烈。本试验中大黄鱼幼鱼在试验开始时NH3-N质量浓度3.00 mg∙L−1后即表现出不安窜游、时有浮头的症状,而在NO2-N不同质量浓度试验组中的鱼体表现出不同程度的呼吸障碍现象,活力减弱直至死亡,整个过程中未发现出躁动不安现象。试验结果显示,NH3-Nt对大黄鱼的96 h-LC50为6.348 mg∙L−1,NH3-Nm的96 h-LC50为0.111 mg∙L−1;NO2-N对大黄鱼96 h-LC50为45.730 mg∙L−1,说明了同种条件下NH3-Nm对大黄鱼种的毒性远大于NO2-N和NH3-N。这与黄颡鱼(Pelteobagrus fulvidraco) [7] 、鳜(Siniperca chuatsi)成鱼 [24] 、斜带石斑鱼(Epinephelus coioides)幼苗 [25] 、凡纳滨对虾(Litopenaeus vannamei) [26] 、沼虾(Macrobrachium tenellum)幼体 [28] 、裸项栉虾虎鱼(Ctenogobius gymnauchen)仔鱼 [30] 、白梭吻鱸(Sander lucioperca)幼体 [31] 、岩原鲤(Procypris rabaudi)幼苗 [32] 等国内外相关研究结论相符。
4.3. NH3-N和NO2-N在大黄鱼养殖过程中的重要性及调控方法
大黄鱼是我国最大规模的海水网箱养殖鱼类和8大优势出口养殖水产品之一,其2012年养殖产量近10 × 104 t,直接产值70多亿元 [33] 。然而,大黄鱼养殖仍以传统的网箱养殖为主,网箱养殖面临着很大的局限性,抗台风能力差、污染严重,其高密度养殖模式和投高蛋白饵料,产生大量的残饵和粪便沉积水底,很容易使水体产生大量的NH3-N和NO2-N,对大黄鱼健康养殖业造成极大的危害,其幼苗对NH3-N和NO2-N的敏感度更强。该试验结果表明池中大黄鱼幼鱼对NH3-N和NO2-N的毒性反应与其在水中的浓度及其作用时间呈正相关关系。JI等 [34] 认为,网箱养殖致使底层有机沉积物堆积,底层微生物活动加剧造成缺氧环境,而无氧或缺氧又促使了微生物的脱氮和硫还原反应,沉积物还原形成具有毒性的硫化氢,毒害鱼体。与此同时,随着海洋港口的建设及相关港口经济产业的发展,致使大黄鱼养殖空间严重萎缩,海区的养殖环境负荷进一步加大。因此,大黄鱼产业亟需探索养殖新模式。目前国内正积极探索发展海水鱼类室内工厂化循环水养殖技术,以谋求产业出路。而NH3-N和NO2-N作为循环水养殖技术中水质调控的关键指标,是核心技术难题。
因此,笔者认为,根据本试验所得NH3-Nt、NH3-Nm和NO2-N的CS,实时监测水质指标,可通过以下3个方向对NH3-N和NO2-N进行调控:
1) 通过硝化菌群加快硝化转化。NH3-N和NO2-N可在硝化菌和亚硝化菌的作用下,转化为硝酸盐(NO3-N),而生成的NO3-N对鱼体无明显毒性,并可被藻类等直接吸收利用。因此,可结合运用固定化技术和生物膜技术,加强微生物的硝化作用,有效降低水体中NH3-N和NO2-N的浓度指标。
2) 调节pH以降低NH3-N毒性。NH3在水体中存在电离平衡(NH3 + H2O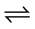 NH3∙H2O
NH3∙H2O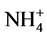
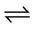 +
+ ),当pH升高时,水体中NH3-Nm浓度增大,NH3-N毒性增加。林忠婷等 [30] 研究表明,适当调低pH、升高盐度可使NH3在NH3-Nt中的比率降低,养殖环境中NO2-N的毒性降低。因此,可适度调节水中pH,以降低NH3-N和NO2-N毒性。
),当pH升高时,水体中NH3-Nm浓度增大,NH3-N毒性增加。林忠婷等 [30] 研究表明,适当调低pH、升高盐度可使NH3在NH3-Nt中的比率降低,养殖环境中NO2-N的毒性降低。因此,可适度调节水中pH,以降低NH3-N和NO2-N毒性。
3) 调节溶氧以降低NH3-N和NO2-N毒性。REMEN等 [35] 对大西洋鳕鱼(Gadus morkua)幼鱼的研究发现,高溶氧条件下NH3-Nm对大西洋鳕鱼的毒性作用降低。李波等 [36] 指出,提高水中溶氧量可使黄颡鱼对NH3-N和NO2-N的96 h-LC50大大提高,即黄颡鱼(Pelteobagrus fulvidraco)对两者的耐受性大为提高。徐勇等 [37] 对半滑舌鳎(Cynoglossuss semilaevis)鱼苗在不同溶氧量条件下对氨氮和亚硝酸盐的耐受性研究也表明,过饱和氧可使鱼苗对非离子氨和亚硝酸盐的耐受浓度提高2倍以上。因此,在水中存在大量的NH3-N和NO2-N时加大充氧量,或改用纯氧增氧,保持水中较高的溶氧量,可以降低NH3-N和NO2-N的毒性,对大黄鱼幼鱼的生长和抗病力具有重要的作用。
5. 结论
本研究利用氨氮和亚硝酸盐这两种养殖水体中主要的污染物对全长90~120 mm的大黄鱼苗种的急性毒性反应。结果表明,在水温25℃ ± 0.5℃、盐度23、pH值为8.0 ± 0.1、溶解氧(DO)大于5.0 mg∙L−1条件下,总氨氮(NH3-Nt)的96 h半致死浓度(96 h-LC50)为6.35 mg∙L−1,安全浓度(CS)为0.64 mg∙L−1;非离子氨(NH3-Nm)的96 h-LC50为0.11 mg∙L−1,CS为0.011 mg∙L−1;NO2-N的96 h-LC50为45.73 mg∙L−1,CS为4.57 mg∙L−1。本试验结果表明池中大黄鱼苗种对水中NH3-N和NO2-N的毒性反应与其浓度及其作用时间呈正相关关系。
基金项目
福建省自然科学基金项目(2015J06019),福建省科技平台建设项目(2015N2002),福建省对外合作项目(2015I1002)。
文章引用
韩坤煌. 大黄鱼苗种对养殖水质主要污染物的急性毒性反应
Acute Toxic Effects upon the Main Pollutants of Aquaculture Water Quality on Juvenile Larimichthys crocea[J]. 水产研究, 2015, 02(04): 59-66. http://dx.doi.org/10.12677/OJFR.2015.24007
参考文献 (References)
- 1. 黄伟卿, 张艺, 柯巧珍, 等. 大黄鱼选育子二代生长性状研究[J]. 南方水产科学, 2013(3): 14-19.
- 2. 桂福坤, 王萍, 吴常文. 基于氮和磷平衡的负责任养殖模式下的养殖海区规划[J]. 南方水产科学, 2011, 7(4): 69- 75.
- 3. Pinto, W., Aragão, C., Soares, F., et al. (2007) Growth Stress Response and Free Amino Acid Levels in Se-negalese sole (Solea senegalensis Kaup 1858) Chronically Exposed to Exogenous Ammonia. Aquaculture Research, 38, 1198- 1204. http://dx.doi.org/10.1111/j.1365-2109.2007.01788.x
- 4. Randall, D.J. and Tsui, T.K.N. (2002) Ammonia Toxicity in Fish. Marine Pollution Bulletin, 45, 17-23. http://dx.doi.org/10.1016/S0025-326X(02)00227-8
- 5. Lemarie, G., Dosdat, A., Coves, D., et al. (2004) Effect of Chronic Ammonia Exposure on Growth of European Seabass (Dicentrarchus labrax) Juveniles. Aquaculture, 229, 479-491. http://dx.doi.org/10.1016/S0044-8486(03)00392-2
- 6. Foss, A., Siikavuopio, S.I., Sæther, B.S., et al. (2004) Effect of Chronic Ammonia Exposure on Growth in Juvenile Atlantic Cod. Aquaculture, 237, 179-187. http://dx.doi.org/10.1016/j.aquaculture.2004.03.013
- 7. 李波. 氨氮和亚硝酸盐对黄颡鱼的毒性研究[D]: [硕士学位论文]. 武汉: 华中农业大学, 2010.
- 8. Brinkman, S.F., Woodling, J.D., Vajda, A.M., et al. (2009) Chronic Toxicity of Ammonia to Early Life Stage Rainbow trout. Transactions of the American Fisheries Society, 2, 433-440. http://dx.doi.org/10.1577/T07-224.1
- 9. 赵海涛. 氨氮对南方鲶(Silurus meridionalis Chen)幼鱼血液生理、生化及非特异性免疫指标的影响[D]: [硕士学位论文]. 重庆: 西南大学, 2006.
- 10. Jensen, F.B. (2003) Nitrite Dis-rupts Multiple Physiological Functions in Aquatic Animals. Comparative Biochemistry and Physiology Part A: Mole-cular & Integrative Physiology, 135, 9-24. http://dx.doi.org/10.1016/S1095-6433(02)00323-9
- 11. Das, P.C., Ayyappan, S., Jena, J.K., et al. (2004) Nitrite Toxicity in Cirrhinus mrigala (Ham.): Acute Toxicity and Sub-Lethal Effect on Selected Haematological Parameters. Aquaculture, 235, 633-642. http://dx.doi.org/10.1016/j.aquaculture.2004.01.020
- 12. 姜会民. 氨氮胁迫对黄河鲤幼鱼肝胰脏、肾脏抗氧化性的影响[J]. 山东大学学报: 理学版, 2012, 47(1): 17-23.
- 13. 洪美玲. 水中亚硝酸盐和氨氮对中华绒鳌蟹幼体的毒性效应及维生素E的营养调节[D]: [博士学位论文]. 上海:华东师范大学, 2007.
- 14. 王志坚, 鲁增辉, 石萍, 等. 氨氮对稀有鮈鲫胚胎及卵黄囊期仔鱼的毒性效应研究[J]. 环境科学, 2012, 33(4): 1323-1330.
- 15. 乔顺风. 水体氨氮转化形式与调控利用的研究[J]. 饲料工业, 2005, 26(12): 44-46.
- 16. 强俊, 徐跑, 何杰, 等. 氨氮与拥挤胁迫对吉富品系尼罗罗非鱼幼鱼生长和肝脏抗氧化指标的联合影响[J]. 水产学报, 2011, 35(12): 1844-1845.
- 17. Park, I.S., Lee, J., Hur, J.W., et al. (2007) Acute Toxicity and Sublethal Effects of Nitrite on Selected Hematological Parameters and Tissues in Dark-Banded Rockfish, Sebastes inermis. Journal of the World Aquaculture Society, 38, 188-199. http://dx.doi.org/10.1111/j.1749-7345.2007.00088.x
- 18. Peyghan, R. and Takamy, G.A. (2002) Histopathological, Serum Enzyme, Cholesterol and Urea Changes in Experimental Acute Toxicity of Ammonia in Common Carp Cyprinus carpio and Use of Natural Zeolite for Prevention. Aquaculture International, 10, 317-325. http://dx.doi.org/10.1023/A:1022408529458
- 19. Benli, A.C., Köksal, G. and Ozkul, A. (2008) Sublethal Am-monia Exposure of Nile Tilapia (Oreochromis niloticus L.): Effects on Gill, Liver and Kidney Histology. Chemosphere, 72, 1355-1358. http://dx.doi.org/10.1016/j.chemosphere.2008.04.037
- 20. 张晓雁, 李罗新, 危起伟, 等. (2011) 养殖密度对中华鲟行为、免疫力和养殖环境水质的影响[J]. 长江流域资源与环境, 2011(11): 1348-1354.
- 21. Emmanuelle, R.D., Blancheton, J.P. and Belaud, A. (2009) Water Quality and Rainbow Trout Performance in a Danish Model Farm Re-circulating System: Comparison with a Flow through System. Aquacultural Engineering, 40, 135-143. http://dx.doi.org/10.1016/j.aquaeng.2009.02.002
- 22. Kroupova, H., Machova, J. and Svobodova, Z. (2005) Nitrite Influence on Fish: A Review. Veterinary Medicine, 50, 461-471.
- 23. 郑乐云, 杨求华, 黄种持, 等. 循环水养殖密度和氨氮对斜带石斑鱼生长和免疫力的影响[J]. 上海海洋大学学报, 2013, 22(5): 706-712.
- 24. 郭丰红, 汪之和, 陈必文, 等. 分子氨和亚硝态氮对鳜鱼成鱼的急性毒性试验[J]. 食品科学, 2010, 30(23): 397- 400.
- 25. 郑乐云. 氨氮和亚硝酸盐对斜带石斑鱼鱼苗的急性毒性效应[J]. 海洋科学, 2012, 36(5): 28-35.
- 26. Dominic, J.S., Gregory, D.B., David, D.K., et al. (2010) Acute Toxicity of Ammonia and Nitrite to Pacific White Shrimp, Litopenaeus vannamei, at Low Salinities. Journal of the World Aquaculture Society, 42, 438-446.
- 27. Liu, C.H. and Chen, J.C. (2004) Effect of Ammonia on the Immune Response of White Shrimp Litopenaeus vannamei and Its Susceptibility to Vibrio alginolyticus. Fish & Shellfish Immunology, 16, 321-334. http://dx.doi.org/10.1016/S1050-4648(03)00113-X
- 28. Gerardo, F.L., María, C.H., Miguel, J.G., et al. (2012) Acute Toxicity of Ammonia on Macrobrachium tenellum (Smith) Larvae. Revista Internacional de Contaminación Ambiental, 28, 145-150.
- 29. 洪美玲, 陈立侨, 孙新谨, 等. 亚硝酸盐急性胁迫对中华绒螯蟹幼体相关免疫指标和应激蛋白(HSP70)表达的影响[J]. 应用与环境生物学报, 2011(5): 688-693.
- 30. 林忠婷, 李建军, 陈琳, 等. 非离子氨和亚硝酸氮对虾虎鱼仔鱼的急性毒性及安全浓度评价[J]. 中国比较医学杂志, 2011, 21(9): 45-48.
- 31. Wuertz, S., Schulze, S.G., Eberhardt, U., et al. (2013) Acute and Chronic Nitrite Toxicity in Juvenile Pike-Perch (Sander lucioperca) and Its Compensation by Chloride. Comparative Biochemistry and Physiology Part C: Toxicology & Pharmacology, 157, 352-360. http://dx.doi.org/10.1016/j.cbpc.2013.01.002
- 32. Gong, Q., Zhao, G., Wang, T., et al. (2010) Remove from Marked Records Acute Toxic Effects of Ammonia-N and Nitrite-N on Procypris rabaudi Tchang. Southwest China Journal of Agricultural Sciences, 23, 231-233.
- 33. 刘家富. 大黄鱼养殖与生物学[M]. 厦门: 厦门大学出版社, 2013.
- 34. Ji, X.L., Lin, X.T., Xu, Z.N., et al. (2000) Machenism of Mariculture Self-Pollution and Its Effects on Environment. Marine Environmental Science, 19, 66-71.
- 35. Remen, M., Imsland, A.K., Stefansson, S.O., et al. (2008) Interactive Effects of Ammonia and Oxygen on Growth and Physiological Status of Juvenile Atlantic Cod (Gadus morhua). Aquaculture, 274, 292-299. http://dx.doi.org/10.1016/j.aquaculture.2007.11.032
- 36. 李波, 樊启学, 张磊, 等. 不同溶氧水平下氨氮和亚硝酸盐对黄颡鱼的急性毒性研究[J]. 淡水渔业, 2009, 39(3): 31-35.
- 37. 徐勇, 张修峰, 曲克明, 等. 不同溶氧条件下亚硝酸盐和氨氮对半滑舌鳎的急性毒性效应[J]. 海洋水产研究, 2006, 27(5): 28-33.
