Advances in Clinical Medicine
Vol.4 No.02(2014), Article
ID:13718,6
pages
DOI:10.12677/ACM.2014.42006
Construction of Tissue Engineering Bone with Osteoactivin Gene Transfected Rabbit Bone Marrow Stromal Cells and Porous Silk Fibroin Scaffold in Vitro
Department of Stomatology, The First Affiliated Hospital of Guangzhou Medical University, Guangzhou
Email: *1549058757@qq.com, *yuanlin00@hotmail.com
Copyright © 2014 by authors and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY).
http://creativecommons.org/licenses/by/4.0/



Received: Apr. 1st, 2014; revised: May 2nd, 2014; accepted: May 11th, 2014
ABSTRACT
Objective: Rabbit bone marrow stromal cells (BMSCs) infected by a recombinant adenoviral vector carrying the osteoactivin gene (Ad-OA) were seeded into porous silk fibroin scaffold to construct tissue engineering bone in vitro. Method: Ad-OA infected RBM SC cultured in vitro and the expression of OA in these cells after infection were determined by in situ hybridization and immune ohistochemical analysis. OA productions were confirmed by western blot analysis of the supernatant collected from the cells. The changes of cellular proliferation and differentiation in the cells were observed by flowcytometry and ALP activity analysis. OA transduced cells were then seeded into porous silk fibroin scaffolds. The attachment and growth of the cells on the scaffold were examined using SEM. Results: The expression of OA was confirmed in mRNA and protein levels in the cells after infection and the presence of OA was detected in the supernatant of the cells. In addition, cellular proportion in S period and ALP activity obviously increased in the cells. SEM examination revealed extensive cellular attachment and growth on the porous silk fibroin scaffolds composite in 1 day. Conclusion: Ad-OA could infect RBMSC with high efficiency and promote cellular proliferation and osteoblast conversion. The cells after infection grew well on a porous silk fibroin scaffold. Tissue engineering bone used to regional gene therapy is constructed successfully.
Keywords:Osteoactivin, Bone Marrow Stromal Cells, Gene Therapy, Tissue Engineering Bone

骨活素基因转染的兔骨髓基质干细胞复合
多孔丝素蛋白支架体外构建组织工程骨
王 涵,杨征毅,程 峰,潘广嗣,易晓辉,孙 晋,曹依娜,袁 林*
广州医科大学附属第一医院口腔科,广州
Email: *1549058757@qq.com, *yuanlin00@hotmail.com
收稿日期:2014年4月1日;修回日期:2014年5月2日;录用日期:2014年5月11日

摘 要
目的:用腺病毒表达载体将骨活素基因转染到兔骨髓基质干细(BMSCs),复合多孔丝素蛋白支架体外构建组织工程骨。方法:用表达骨活素基因的腺病毒载体转染体外培养的兔BMSC,免疫组化、原位杂交染色和蛋白印迹方法检测细胞骨活素的表达,并通过流式细胞仪和ALP活性检测分析其对细胞增殖、分化的影响。然后将转染后细胞接种到多孔丝素蛋白支架上,扫描电镜观察细胞贴附、生长状况。结果:转染后,骨活素基因在mRNA水平和蛋白水平均有表达;S期细胞比例和ALP活性明显增高。扫描电镜见转染细胞分布均匀,伸展良好。结论骨活素基因可高效转染兔BMSC,且促进细胞增殖及成骨转化。转染后细胞在多孔丝素蛋白支架上生长良好,骨活素基因治疗的组织工程骨构建成功。
关键词
骨活素,骨髓基质干细胞,基因治疗,组织工程骨

1. 引言
创伤、炎症、先天发育畸形以及肿瘤切除导致的不同程度的颌骨缺损等都严重影响着患者的面部外形和口腔功能。自体骨移植以及同种异体骨移植是最为常用的治疗骨缺损的方法。但是它们仍存在一些问题,自体植骨的应用受限于供区骨量有限、增加手术风险及延长手术时间等。而同种异体骨移植可能会引起机体排异反应、疾病传播和骨不愈合等并发症,这也使异体骨移植的临床应用受到限制。目前,组织工程技术的开展可能会成为解决这一难题的有效方法。
骨活素(OA)是一种在成骨细胞中合成的高表达蛋白因子,其主要与成骨细胞的分化和骨基质的骨化有关,其分子中含有与细胞黏附有关的特异序列RGD(Arg-Gly-Asp),它还可能参与成骨细胞的迁移。利用骨活素对成骨细胞分化的促进作用,尝试诱导间充质干细胞向成骨细胞分化,为以干细胞治疗各种骨病提供新的途径。
蚕丝在我国产量丰富,主要成分是丝素蛋白,含量高达70%~80%。经过大量研究发现,蚕丝经过脱胶、溶解、提纯制得的再生丝素蛋白具有良好的生物相容性和生物降解性,并且无毒、无刺激,易于加工成各种形态,如膜、纤维、凝胶、三维海绵支架等。由丝素蛋白所制备的多孔丝素作为一种普适的组织工程用支架,已经在组织工程皮肤、骨和软骨重建、肌腱韧带重建、血管重建、神经重建、膀胱重建以及人工角膜等各方面表现出良好的应用潜力。
本研究中,我们通过电转将骨活素基因转入MSCs,使其表达骨活素蛋白,然后将其与多孔丝素蛋白支架体外复合,观察骨活素基因转染的MSCs在多孔丝素蛋白支架材料上的贴附生长、增殖及分化特性。
2. 材料和方法
2.1. 实验材料
2.1.1. 腺病毒载体及菌株
OA腺病毒表达载体(Ad-OA)由美国哈佛医学院分子骨科中心Oliver博士馈赠。携带B-半乳糖酐酶基因的腺病毒对照载体(Ad-Lacz)由吉林大学白求恩基础医学院病理教研室高航博士馈赠。通过感染293细胞扩增病毒,病毒噬菌斑形成试验测定滴度。
2.1.2. 支架材料
多孔丝素蛋白支架由复旦大学高分子材料科学系提供。将材料制成直径0.8 cm,长度5 mm的圆柱体,孔隙率为(96.6 ± 0.1)%,表观密度为1.355 g/cm3,孔径为(190 ± 15) μm。
2.2. 试验方法
2.2.1. BMSCs 培养及转染
抽取兔胫骨结节处骨髓液4 mL。采用密度梯度离心法联合贴壁法分离培养BMSCs,10 d时细胞长至80%汇合时吸掉原培养基,用0.25%胰蛋白酶消化,按1:2的比例传代培养。取第3代BMSCs以6 × 103/cm2的密度接种于放置有无菌盖玻片的6孔培养板中,当细胞长满50%~60%时,实验组将培养基更换为含体积分数为10%胎牛血清的DMEM培养液,以后每2 d换液1次,连续3周。第3代融合率为80%左右的细胞,更换无血清的培养液孵育4 h后吸出培养液,根据病毒滴度以感染倍数(multiplicity of infection, MOI)50、100感染BMSCs,转染后不加培养液放置培养箱中培养1 h,每15 min轻轻摇动培养瓶,1 h后换含体积分数为10%血清的正常培养液继续培养。
2.2.2. rBMSC 转染后表型检测
1) hOA表达检测:于转染后2 d,培养液经冻干浓缩后行蛋白印迹法(Western blot)检测OA分泌;2) ALP(碱性磷酸酶)活性检测:于转染后5 d,按试剂盒说明处理细胞,测定吸光值,标准曲线上读取酶活性值。未转染细胞作为空白对照;3) 流式细胞仪分析:收集Ad-OA转染、Ad-Lacz转染和未转染3组细胞,测定细胞周期;4) 统计学处理:数据采用SPSS统计软件处理,t检验和方差分析比较转染效果。
2.2.3. 复合人工骨制备
胰酶消化收集Ad-OA转染细胞,制成单细胞悬液(5 × 106/ml),均匀接种2枚多孔丝素蛋白材料块,每块材料100 uL。4 h后待细胞基本贴壁,再缓慢加入培养液1.5 ml。常规培养1 d后,2.5%戊二醛固定,水平中央剖平,扫描电镜观察。
3. 结果
3.1. BMSCs 转染后表型检测
1) 转染后2 d,Western Blot检测表明,仅Ad-OA转染组分泌OA(图1);2) ALP活性检测:转染后细胞ALP活性较对照组明显增高[转染组(32.23 ± 3.12) U/ml,对照组(20.24 ± 2.64) U/ml,P < 0.01],转染后ALP染色结果见图2、图3;3) 流式细胞仪检测:见表1,Ad-OA转染后,BMSCs的S期细胞比例增加,G1期细胞减少,说明细胞DNA的合成以及细胞的增殖活动加强。而对照病毒Ad-Lacz转染后,与空白对照组无差异(P > 0.05)。

Figure 1. The expression of OA in the transfected cell culture medium, detected by Western Blot; 1) Untransfected BMSCs; 2) Transfected by Ad-OA (MOI = 50); 3) Transfected by Ad-OA (MOI = 100); 4) Transfected by Ad-Lacz
图1. 转染后细胞培养液OA Western Blot检测结果。 1) 未转染BMSCs; 2) AdOA转染(MOI = 50); 3) Ad-OA转染(MOI = 100); 4) Ad-Lacz转染
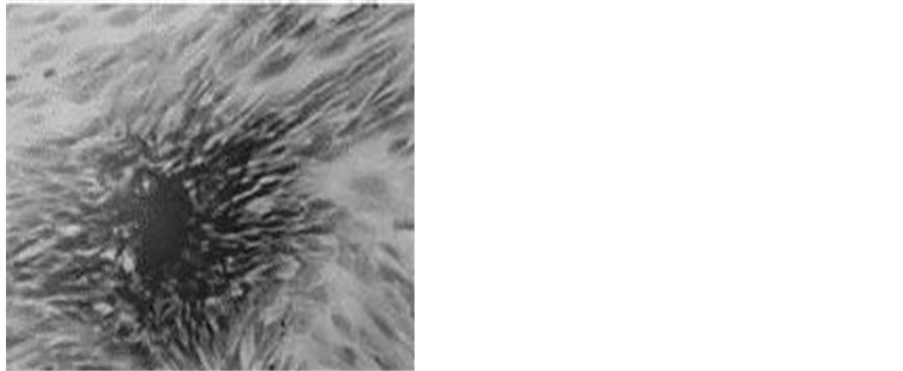
Figure 2. After 15 d BMSCs were transfected by Ad-OA, positive staining cells were generally blueblack by ALP staining (Cobalt, calcium stain × 100)
图2. Ad-OA转染BMSCs后15 d,ALP染色见细胞普遍呈蓝黑色阳性着色(钙钴染色 × 100)

Figure 3. After 15 d BMSCs were untransfected, the cells were generally negative pale coloring by ALP staining (Cobalt, Calcium stain × 100)
图3. 未转染BMSCs 15 d,ALP染色见细胞普遍呈灰白色阴性着色(钙钴染色 × 100)
3.2. 扫描电镜观察
培养1 d后,扫描电镜见载体表面平整,呈网格状,其间可见微孔。Ad-OA转染后的BMSCs在多孔丝素蛋白材料块上均匀分布,原始面与剖开面一致,细胞贴附伸展良好,呈纺锤形,有较长突起,密集处连接成片,细胞与材料表面融合紧密,不易分辨(图4)。
4. 讨论
众所周知各种原因(感染、创伤、肿瘤、先天性畸形等)引起的骨缺损是口腔外科的难题之一,虽然目前存在的各种解决方案(各种同种异种骨移植、各种支架材料的植入等),能不同程度的解决问题,但都有各自的弊端,自体植骨的应用受限于供区骨量有限、手术创伤大,增加手术风险,操作复杂及延长手术时间和术后供区及植入区的各种并发症多等,而同种异体骨移植可能会引起机体排异反应、疾病传播和骨不愈合等并发症,这也使异体骨移植的临床应用受到限制。因此应用骨组织工程修复骨缺损成为一种重要途径。组织工程应用细胞生物学和工程学的原理,将体外培养扩增后具有生物学活力及特定功能的细胞与可降解生物支架材料复合,在体内或体外再造组织或器官,用以修复或改善损伤组织或器官的结
表1. 不同组别细胞周期流式细胞仪分析结果(%) (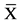 ± s, n = 6)
± s, n = 6)
*表示P < 0.01
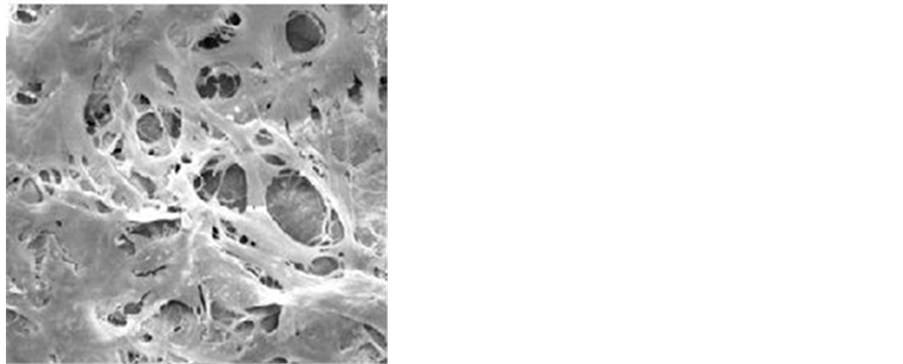
Figure 4. The BMSCs, transfected by Ad-OA, attached to the surface of porous silk fibroin materials and stretched well. The shape of BMSCs was spindle and long process. BMSCs close stuck to the materials surface and were difficult to be distinguished (scanning by electron microscopy)
图4. 扫描电镜见Ad-OA转染后的BMSCs在多孔丝素蛋白材料表面贴附伸展良好,呈纺锤形,有较长突起,细胞与材料表面融合紧密,不易分辨
构与功能,最终形成有活力的正常组织或器官,达到真正意义上的生物学重建。由于组织细胞可以在体外培养扩增,且扩增后细胞能够维持原组织细胞特有的生物学特性,这使通过取得少量活体组织来获得大量有功能的供体细胞成为可能。但是单纯细胞移植很容易流失,且无法进行塑形以适合组织缺损的大小和形状,无法达到创伤修复对结构与功能重建的基本要求。组织工程多孔支架又称为细胞外基质(ECM),它是对细胞外基质的结构和功能的仿生,要为细胞提供生存空间,使细胞获得足够的营养物质,进行气体交换,并使细胞按预制形态的三维支架生长。
骨活素(OA)是一种在成骨细胞中合成的高表达蛋白因子,其主要与成骨细胞的分化和骨基质的骨化有关,其分子中含有与细胞黏附有关的特异序RGD(Arg-Gly-Asp),它还可能参与成骨细胞的迁移。Abdelmagid等[1] 的研究结果表明骨活素对骨的形成起正调节作用。利用骨活素对成骨细胞分化的促进作用,尝试诱导间充质干细胞向成骨细胞分化,为以干细胞治疗各种骨病提供新的途径。
作为组织工程三要素之一的支架材料的开发与研究一直是人们研究的热点。理想的骨组织工程细胞外基质材料应具备: 1)良好的生物相容性和表面活性; 2) 良好的生物降解性; 3) 多孔性和高孔隙率; 4) 可塑性和一定机械强度; 5) 骨传导性和骨诱导性。本实验采用的是多孔丝素蛋白块生物可降解支架。丝素蛋白是从天然蚕丝中提取的,是去除蚕丝中主要的抗原部分后的产物。作为一种天然的纤维蛋白,其具有良好的力学性能、生物相容性和可降解性,这使其在生物医学方面的应用不断拓展。多孔支架能够为细胞的粘附和增殖提供有利的微环境,在重塑和修复组织的过程中起着至关重要的作用。很多实验证实多种细胞在丝素材料上均可攀附生长增殖,尤其发现内皮细胞在丝素材料上可良好生长,为组织工程材料血管化提供了新方法[2] [3] ;还有学者进行与胶原的比较研究,发现两种材料上细胞生长、增殖状况几乎相同;Deng等[4] 实验证明利用骨髓间充质干细胞复合丝素蛋白和壳聚糖支架修复兔膝关节软骨缺损有明显的修复效果;Wang等[5] 通过体外实验证明骨髓间充质干细胞共培养于丝素蛋白和羟基磷灰石复合材料上对节段性骨缺损修复有明显的功效;Zhang等[6] 通过体内外实验的研究的结果表明,在骨缺陷修复中丝素蛋白对于基因传递来说是一种很有前途的生物材料。
本研究采用体外基因治疗策略,利用Ad-OA转染BM-SCs后种复合到多孔丝素蛋白支架,证实OA基因可高效导入细胞且表达基因产物促进自身增殖分化,转染后细胞在支架材料上贴附生长良好,为将来应用携带OA基因的人工骨修复骨缺损奠定了实验基础。
Owen等[7] 利用RT-PCR技术研究发现,骨活素的mRNA在成骨细胞增殖期的表达量很低,但随细胞外基质的成熟而增加,在成骨细胞骨化期维持高水平表达,与标志成骨细胞分化成熟的骨钙素和碱性磷酸酶同时在细胞培养的第21 d达到高峰。Schaffner等[8] 报告在骨组织中,某些蛋白分子中的特异序列RGD与整合素结合能够调节成骨细胞的许多功能,并可导致血管形成的增加。Susan等[9] 报告RGD结构与整合素结合,可促进成骨细胞对基底膜的黏附,从而促进骨组织的再生。Abdelmagid等[10] 通过体外实验的研究结果表明,BMP-2通过Smad1信号途径来调节OA表达。同时他们的的数据还强调,OA蛋白是BMP-2影响成骨细胞分化和功能的下游介质。Rich等[11] 根据骨活素能显著引起体内、外人胶质细胞迁移的现象,推断出骨活素可能像骨黏素和BMP-2一样参与调节成骨细胞的迁移,而成骨细胞的分化和迁移在骨折修复中特别是难愈性骨折的修复中是不可缺少的。
腺病毒载体基因转移方法和表达载体选择是保证OA局部持续有效表达的关键。目前认为,采用腺病毒载体体外转染比较理想[12] ,腺病毒表达载体因具有转染效率高,目的基因高水平表达,免疫排斥反应低,安全系数高等优点。尽管腺病毒载体存在目的基因表达时间短的缺点(最长达6周),但因为骨修复是一个阶段性过程,不需要转染的目的基因长久表达,因此利用其将目的基因导入BMSCs促进骨愈合比较理想,而且不必担心持续的过度表达引起骨质增生过度,影响骨改建甚至致瘤性。但是如何克服其残存的免疫原性仍是未来的努力方向,总之,利用Ad-OA转染的BMSCs运载骨诱导蛋白是可行的,细胞可高水平表达OA并促进细胞增殖及成骨细胞标志酶ALP表达,转染后细胞在多孔丝素蛋白支架上生长良好,基因治疗的组织工程骨体外构建成功。然而其在体内究竟以何种愈合方式成骨和植入细胞最终命运如何,仍不十分清楚,我们将在以后的体内实验中研究论证。
项目基金
本课题得到广州市属高校科研计划科技类一般项目资助(编号:2012C096),广州市科技计划项目科技惠民专项资助(编号:2014Y2-00058)。
参考文献 (References)
- [1] Abdelmagid, S.M., Barbe, M.F., Rico, M.C., Salihoglu, S., et al. (2008) Osteoactivin, an anabolic factor that regulates osteoblast differentiation and function. Experimental Cell Research, 314, 2334-2351.
- [2] Chiarini, A., Petrini, P., Bozzini, S., Dal Pra, I. and Armato, U. (2003) Silk fibroin/poly(carbonate)-urethane as a substrate for cell growth: In vitro interactions with human cells. Biomaterials, 24, 789-799.
- [3] Jin, H.J., Chen, J.S., Karageorgiou, V., et al. (2004) Human bone marrow stromal cell responses on electrospun silk fibroin mats. Biomaterials, 25, 1039-1047.
- [4] Deng, J., She, R., Huang, W., Dong, Z., Mo, G. and Liu, B. (2013) A silk fibroin/chitosan scaffold in combination with bone marrow-derived mesenchymal stem cells to repair cartilage defects in the rabbit knee. Journal of Materials Science: Materials in Medicine, 24, 2037-2046.
- [5] Wang, G., Yang, H., Li, M., Lu, S., Chen, X. and Cai, X. (2010) The use of silk fibroin/hydroxyapatite composite cocultured with Rabbit Bone-Marrow Stromal cells in the healing of a segmental bone defect. The Journal of Bone & Joint Surgery, 92, 320-325.
- [6] Zhang, Y., Fan, W., Nothdurft, L., Wu, C., Zhou, Y., Crawford, R. and Xiao, Y. (2011) In vitro and in vivo evaluation of adenovirus combined silk fibroin scaffolds for bone morphogenetic protein-7 gene delivery. Tissue Engineering Part C: Methods, 17, 789-797.
- [7] Owen, T.A., Smock, S.L., Prakash, S., et al. (2003) Identification and characterization of the genes encoding human and mouse osteoactivin. Critical Reviews in Eukaryotic Gene Expression, 13, 205-220.
- [8] Schaffner, P. and Dard, M.M. (2003) Structure and function of RGD peptides involved in bone biology. Cellular and Molecular Life Sciences, 60, 119-132.
- [9] Susan, J., Mclarthy, A., Kaplan, L., et al. (2000) Functionalized silk protein biomaterials for regeneration. Proceeding in Sixth World Biomaterials Congress Transactions, Hawaii, 2000, 1206.
- [10] Abdelmagid, S.M., Barbe, M.F., Arango-Hisijara, I., Owen, T.A., Popoff, S.N. and Safadi, F.F. (2007) Osteoactivin acts as downstream mediator of BMP-2 effects on osteoblast function. Journal of Cellular Physiology, 210, 26-37.
- [11] Steinbrech, D.S., Mehrara, B.J., Rower, N.M., et al. (2000) Gene expression of TGF-beta, TRF-beta receptor and extracellular matrix proteins during membranous bone healing in rats. Plastic and Reconstructive Surgery, 105, 2028- 2038.

NOTES
*通讯作者。

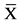 ± s, n = 6)
± s, n = 6)