Hans Journal of Food and Nutrition Science
Vol.04 No.03(2015), Article ID:15820,10
pages
10.12677/HJFNS.2015.43011
The Study of Extraction and Purification of Lactones from Bamboo Leaves
Pingping Zhang, Hanju Sun*, Qiuyan Lou, Xin Wang, Yupeng Xie, Xiao Wang, Manli Zhang
School of Biotechnology and Food Engineering, Hefei University of Technology, Hefei Anhui
*通讯作者。
Email: *sunhanjv@163.com
Received: Jul. 21st, 2015; accepted: Jul. 31st, 2015; published: Aug. 7th, 2015
Copyright © 2015 by authors and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY).
http://creativecommons.org/licenses/by/4.0/



ABSTRACT
In this article, the extraction and purification of the lactones from the bamboo leaves were studied. First, after pretreatment of bamboo leaves, the lactones were extracted with ethanol in terms of the extraction rate of lactones. Then, the optimal parameters, such as concentration of enthanol, solid-liquid ratio, temperature and time of extraction were determined in single factor experiments. Finally, the best extraction condition was optimized in an orthogonal experiment with four factors and three levels (L9 (34)). The results indicated that the optimal conditions were 40% of ethanol concentration, liquid-solid ratio 15:1, extraction temperature at 90˚C and extraction duration of 3 h. After centrifugation of the extract, the supernatant was concentrated and then subjected to purification by polyamide resins, DM301, D101, HP-20 and AB-8, respectively. Taken the static adsorption and desorption rate as evaluation indexes, the result showed that polyamide had better adsorption and desorption rate for bamboo lactone than the others, which was also favorable for the separation of lactones and flavonoids from bamboo leaves. Therefore, polyamide was chosen as the best resin. Subsequently, after concentration, the extract was subjected to the column separation, followed by elution with 20% ethanol before the effluent was collected. Finally, after lyophilization and concentration in turn, the extract was collected, in which the yield (according to the original bamboo leaves) and purity of lactones in the extract were 9.44‰ and 46.2%, respectively.
Keywords:Bamboo Leaves, Lactones, Extraction, Purification, Resin

竹叶内酯的提取及纯化工艺研究
章萍萍,孙汉巨*,娄秋艳,王鑫,谢玉鹏,王霄,张曼莉
合肥工业大学生物与食品工程学院,安徽 合肥
Email: *sunhanjv@163.com
收稿日期:2015年7月21日;录用日期:2015年7月31日;发布日期:2015年8月7日

摘 要
本文探索了竹叶内酯的提取及纯化工艺。首先,以预处理后的竹叶为原料,采用乙醇为提取剂,提取竹叶内酯。以提取率为评价指标,采用单因素试验,确定了乙醇浓度、料液比、提取温度和时间对内酯提取的影响。在此基础上,采用L9(34)正交试验,优化了竹叶内酯的提取工艺条件,其结果为:乙醇浓度40%,液料比15:1,提取温度90℃,提取时间3 h。然后,将浸提液离心,将上清液浓缩后,分别用聚酰胺、DM301、D101、HP-20和AB-8五种树脂进行纯化。以静态吸附率和解吸率为评价指标,考察树脂种类对内酯纯化的影响。结果表明:用聚酰胺纯化时,其对竹叶内酯有较好的吸附率和解吸率,且有利于内酯与黄酮的分离。所以,选择聚酰胺为最佳吸附树脂。然后,将浓缩后的提取液上柱,用20%乙醇洗脱,得到的流出液依次浓缩及冷冻干燥后,获得竹叶提取物,其内酯的得率(按原始竹叶算)和纯度分别为9.44‰和46.2%。
关键词 :竹叶,内酯,提取,纯化,树脂

1. 引言
竹叶为禾本科淡竹叶属植物,又名竹叶门冬青、迷身草、山鸡米、金竹叶等。在我国野生淡竹叶主要分布于长江流域以南和西南等地,中华淡竹叶分布于江苏、浙江、江西、福建、湖南等地。竹叶具有悠久的药用和食用历史,其亦是一味中医著名的清热解毒药 [1] 。竹叶中含有大量的黄酮、香豆素类内酯、酚酸、葸醌类化合物、活性多糖、氨基酸、叶绿素、芳香成分和锰、锌及硒等微量元素 [2] 。其内酯主要为香豆素类内酯,是由分子中的羟基和羧基发生内缩合环化产生,难溶于冷水,易溶于沸水和有机溶剂,具有芳香性和挥发性。竹叶内酯的种类和含量尚不明确。目前,检测到的竹叶内酯有莨菪苷、东莨菪内酯、伞形酮、香豆素和茴芹内酯等十余种。值得一提的是,竹叶内酯与银杏内酯相似,具有降血脂、降胆固醇和抗氧化等作用 [3] 。并且,在我国竹叶是一种比银杏叶资源量大、无毒且廉价的可再生资源,有望成为银杏叶的替代品。另外,竹叶中内酯与黄酮、多糖、氨基酸等成分可开发为天然防腐剂、抗菌杀虫剂 [4] [5] 和缓蚀剂 [6] 。
竹叶香豆素类内酯的提取主要有溶剂提取法 [7] [8] 、碱溶酸沉法、蒸馏法、超临界提取法 [9] 及超声波提取法 [10] 等方法。本文拟用乙醇提取竹叶内酯,主要从乙醇浓度、液料比、浸提温度、时间四方面对浸提工艺的影响进行了探讨,优化最佳树脂,对其进一步纯化。
2. 材料与方法
2.1. 材料、试剂与仪器
材料:竹叶(由宣城市中良枣业有限责任公司提供,采于安徽省宣城市水东镇)。
试剂:伞形花内酯(98%)及芦丁(98%)购自北京神州科创生物技术有限公司;聚酰胺树脂,AB-8、DM-301、D-101及HP-20四种大孔树脂购自长沙市大禹化工有限公司;无水乙醇、氢氧化钠、盐酸、磷酸氢二钠、柠檬酸、硝酸铝及亚硝酸钠均为分析纯;试验用水为去离子水。
仪器:HX-200高速中药粉碎机(浙江永康市溪岸五金药具厂);HH-2数显恒温水浴锅(江苏金坛市杰瑞尔电器有限公司);SC-3614低速离心机(安徽中科中佳科学仪器有限公司);DZF-6020真空烘干箱(上海三发科学仪器有限公司);SHZ-P(III) 循环水式真空泵(巩义市予华仪器有限责任公司);R-201旋转蒸发仪(上海申胜生物技术有限公司);722E紫外分光光度计(上海光谱仪器有限公司);1.6 × 60 cm层析柱(上海琪特分析仪器有限公司);BT1-200恒流泵(上海琪特分析仪器有限公司);BSZ-100自动部份收集器(上海精科实业有限公司);LGJ-12冷冻干燥器(北京松源华兴科技有限公司)。
2.2. 材料、试剂与仪器
2.2.1. 工艺流程
竹叶→预处理→浸提→离心→浓缩 乙醇←←冷凝
↓ ↓ ↑
树脂→预处理→上柱→吸附→解吸→收集→蒸发→内酯溶液→冷冻干燥→竹叶内酯成品
2.2.2. 工艺要点
1) 原料:选择新鲜、无损伤的深绿竹叶。
2) 预处理:除去竹叶末端的竹枝,然后切剪,用清水洗涤,去除杂物。在60℃条件下,真空干燥至水分含量小于5%。用粉碎机粉碎3 min,然后过60目筛,得到竹叶粉末。
3) 浸提:用乙醇提取竹叶内酯,主要考察乙醇浓度、液料比、提取温度和时间对提取的影响。分别进行单因素和正交试验,得出最佳的提取条件组合。
4) 离心:将浸提液在4000 rpm下离心15 min,取上清液。
5) 浓缩:在50℃及−0.5 MPa真空度下,用旋转蒸发仪将提取液浓缩至原体积的1/3。
6) 树脂的预处理:分别取50 g聚酰胺、DM301、D101、HP-20及AB-8五种树脂,先用去离子水洗去细小及破碎树脂,再用95%乙醇浸泡24小时,洗涤至无乙醇。然后,依次用5%盐酸及5%氢氧化钠溶液浸泡4小时(两次浸泡后均水洗至中性)。最后,用去离子水浸泡备用。
7) 上柱:将预处理好的树脂水浆液加入层析柱中,待树脂沉降下来,把过量的水通过柱底放出,保持水面高于树脂层面3 cm以上,上柱高度为柱高的2/3。
8) 吸附:用磷酸氢二钠–柠檬酸缓冲溶液,将上样液pH调至4后,加入装有树脂的层析柱中。加入量为2倍树脂体积,控制流速为2 mL/min,让内酯被充分吸附。
9) 解吸:吸附结束后,依次用3 BV去离子水和3 BV 20%乙醇洗脱,收集洗脱液。
10) 蒸发:用旋转蒸发仪,将收集的洗脱液浓缩至原体积的1/5 (蒸发出的乙醇可循环利用)。
11) 冷冻干燥:将浓缩后的洗脱液在−20℃下冻结后,再在−50℃及−0.1 MPa真空度下,干燥至水分含量 < 5%。
2.2.3. 测定方法
1) 内酯标准工作曲线的制备
以伞形花内酯为标准品,采用双波长分光光度法 [11] 。准确称取伞形花内酯标准样品20 mg,用40%乙醇溶解后,定容至25 mL,得伞形花内酯标准品溶液(0.8 mg/mL)。准确吸取2 mL上述伞形花内酯标准品溶液于试管中,用40%乙醇稀释至20 mL,得伞形花内酯标准对照液。分别取上述对照液0.1、0.5、1.0、1.5、2.0及2.5 mL于试管中,补加40%乙醇至10 mL。以40%乙醇为空白溶液,分别在325.5和385.5 nm下测定吸光度,得线性回归方程:
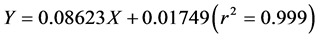 (1)
(1)
式中:Y——两吸光度的差值;
X——伞形花内酯溶液的浓度(μg/mL)。
2) 黄酮标准工作曲线的制备
以芦丁为标准品,采用硝酸铝-亚硝酸钠比色法 [12] 。准确称取芦丁标准样品20 mg,用40%乙醇溶解,定容至50 mL,得芦丁标准品溶液(0.4 mg/mL)。准确吸取0、0.1、0.5、1.0、1.5、2.0及2.5 mL上述芦丁标准溶液分别于10 mL容量瓶中。先加5% NaNO2溶液0.3 mL,放置6 min;再加10% Al(NO3)3溶液0.3 mL,放置6 min;加入4% NaOH溶液4 mL后,用40%乙醇溶液定容至刻度。摇匀,放置15 min后,在510 nm处测定吸光度,得线性回归方程:
 (2)
(2)
式中:Y——吸光度值;
X——芦丁溶液的浓度(μg/mL)。
3) 竹叶内酯提取率
浸提结束后,取离心后的上清液,稀释25倍,分别在测定波长和参比波长处测定吸光度。根据标准曲线计算出提取液的浓度,并进一步得出竹叶内酯的提取率。
 (3)
(3)
式中:Q——提取率(‰);
C——内酯浓度(mg/mL);
V——提取液的体积(mL);
M——竹叶粉的质量(g)。
4) 得率和纯度测定
准确称取100 g竹叶粉,在最佳提取条件下提取,浓缩后用pH4的磷酸氢二钠–柠檬酸缓冲溶液定容至500 mL。然后,将定容后的溶液上柱。吸附结束后,依次用3 BV去离子水和3 BV 20%乙醇洗脱,收集洗脱液,浓缩到原体积的1/5。然后,干燥至水分含量 < 5%。收集密封,称重,计算内酯的得率。
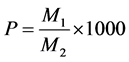 (4)
(4)
式中:P——得率(‰);
M1——纯化后内酯粉末的质量(g);
M2——竹叶粉的质量(g)。
准确称取2 mg竹叶内酯粉末,用40%乙醇溶解,定容至250 mL。用双波长分光光度法测定吸光度值,再根据标准曲线计算出内酯的浓度,进而计算出内酯的纯度。
 (5)
(5)
式中:R——纯度(%);
C——内酯的浓度(mg/mL);
V——内酯溶液的体积(mL);
M——内酯粉末的质量(g)。
2.2.4. 单因素试验
1) 乙醇浓度对内酯提取率的影响
取六个100 mL锥形瓶,均加入2 g竹叶粉和40 mL乙醇溶液(浓度分别为20%、30%、40%、50%、60%及70%),在80℃下提取2 h。提取两次,合并提取液。冷却后离心,测吸光度值,根据公式(3)计算竹叶内酯的提取率。以提取率为评价标准,考察乙醇浓度对竹叶内酯提取的影响。
2) 液料比对内酯提取率的影响
取六个100 mL锥形瓶,均加入2 g竹叶粉,分别加入40%乙醇10、20、30、40、50及60 mL,在80℃下提取2 h。提取两次,合并提取液。冷却后离心,测吸光度值,根据公式(3)计算竹叶内酯的提取率。以提取率为评价标准,考察料液比对竹叶内酯提取的影响。
3) 提取温度对竹叶内酯提取率的影响
取六个100 mL锥形瓶,均加入2 g竹叶粉和40%乙醇溶液40 mL。温度分别为50℃、60℃、70℃、80℃、90℃及100℃,提取2 h。提取两次,合并提取液。冷却后离心,测吸光度值,根据公式(3)计算竹叶内酯的提取率。以提取率为评价标准,考察提取温度对竹叶内酯提取的影响。
4) 提取时间对竹叶内酯提取率的影响
取六个100 mL锥形瓶,均加入2 g竹叶粉和40%乙醇溶液40 mL。时间分别为0.5、1.0、1.5、2.0、2.5及3.0 h,在80℃下提取两次,合并提取液。冷却后离心,测吸光度值,根据公式(3)计算竹叶内酯的提取率。以提取率为评价标准,考察提取时间对竹叶内酯提取的影响。
2.2.5. 提取条件的正交试验
为了进一步考察竹叶内酯的提取条件,在单因素的基础上,设计四因素三水平L9(34)正交试验。如表1所示,其因素和水平分别为:乙醇浓度(30%、40%及50%),液料比(10:1、15:1及20:1),提取时间(2.0、2.5及3.0 h)。以提取率为考察指标,优化各因素及水平对内酯提取的影响。
2.2.6. 树脂种类的确定
选取聚酰胺、DM301、D101、HP-20及AB-8五种树脂,对竹叶提取物进行静态吸附和解吸。初步选出对竹叶内酯吸附和解吸效果最好的树脂。然后,对初步选出的树脂进行动态解吸,进一步验证。
1) 树脂对竹叶内酯和黄酮的静态吸附
准确称取预处理好的五种树脂(聚酰胺、DM301、D101、HP-20、AB-8)各5.0 g于250 mL锥形瓶中,精密加入竹叶提取浓缩液50 mL (内酯、黄酮浓度分别为0.512及1.09 mg/mL)。放入振荡器,在25℃及110 r/min条件下,振荡24 h。充分吸附后,静置过滤,取滤液稀释50倍,分别用双波长分光光度法和硝酸铝–亚硝酸钠比色法测定内酯和黄酮的浓度。按下式计算各树脂对竹叶内酯和黄酮的吸附率(%)。
Table 1. Orthogonal test factor horizontal table
表1. 正交试验因素水平表
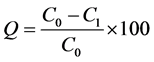 (6)
(6)
式中:Q——吸附率(%);
C0——初始浓度(mg/mL);
C1——吸附后浓度(mg/mL)。
2) 树脂对竹叶内酯和黄酮的静态解吸
取两组吸附饱和的五种树脂,分别加入20%及80%乙醇溶液解吸。放入振荡器,在25℃及110 r/min条件下,振荡24 h。静置过滤。用上述相同方法测解吸液中内酯和黄酮的浓度,按下式计算解吸率(%)。
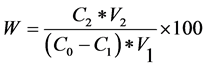 (7)
(7)
式中:W——解吸率(%);
C2——解吸液浓度(mg/mL);
V2——解吸液体积(mL);
C0——初始浓度(mg/mL);
C1——吸附后浓度(mg/mL);
V1——吸附液体积(mL)。
3) 树脂的吸附动力学测定
选择初步确定的最佳树脂用于装柱,样液中内酯和黄酮含量分别为0.512和1.09 mg/mL。上样量为2 BV,流速为2 mL/min。吸附结束后,依次用3 BV去离子水、3 BV 20%乙醇和3 BV 80%乙醇洗脱。用自动收集器收集,每隔3试管测一次内酯和黄酮的吸光度值。
2.2.7. 统计分析
本研究中,所有试验均平行三次,试验结果取三次的平均值。
3. 结果与分析
3.1. 乙醇浓度对竹叶内酯提取的影响
乙醇浓度对竹叶内酯提取的影响如图1所示。显然,随着浓度的增加,提取率不断增加;当浓度为40%时,提取率达到最大值(5.63‰);之后,尽管浓度进一步增加,提取率逐渐下降。乙醇对内酯提取的影响原因可能为:首先,根据相似相溶原理,竹叶内酯极性较小,可以大量的溶解在弱极性的乙醇溶液中;当浓度为40%时,两者的互溶效果最好,但随着浓度的进一步增大,其极性也相应的增强,内酯的溶解率减小,从而导致内酯得率的减少。故40%乙醇对竹叶内酯的提取效果最好。
3.2. 液料比对竹叶内酯提取的影响
为了考察液料比对竹叶内酯提取的影响,调节液料比为5:1~30:1,结果如图2所示。起初,提取率随着液料比的增加而快速增加,当液料比为15:1时,提取率达到最大值(5.77‰)。之后,随着液料比的增加,提取率基本保持不变。整个变化趋势可分析如下:刚开始,液料比增加时,竹叶粉末与提取溶剂的接触面增大,内酯类化合物容易渗透出来;当液料比达到15:1时,绝大部分的内酯已经溶解在乙醇溶液中了,继续增加溶剂体积,更多的醇溶性杂质会溶解出来。且过多的溶剂不仅增加了后续操作的负荷也增加了提取成本。故综合考虑,选择最佳液料比为15:1。
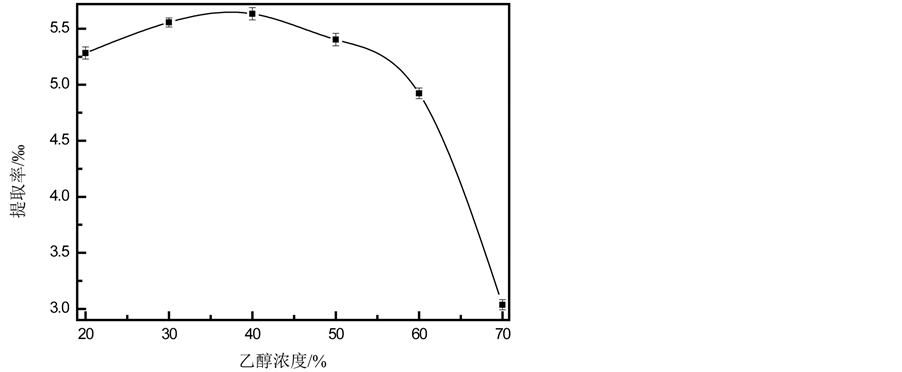
Figure 1. Effect of ethanol concentration on the extraction of lactones of bamboo leaves
图1. 乙醇浓度对竹叶内酯提取的影响

Figure 2. Effect of solid-liquid ratio on the extraction of lactones of bamboo leaves
图2. 液料比对竹叶内酯提取的影响
3.3. 提取温度对竹叶内酯提取的影响
为了考察温度对竹叶内酯提取的影响,调节温度为50℃~100℃,温度与内酯提取率的关系如图3所示。在一定范围内,竹叶内酯的提取率随着温度的增加而不断增加;大于90℃后,趋于平稳。出现这种现象可能有两方面的原因:第一,一般来说,冷提杂质少,热提效率高,温度的增加使得分子的运动加剧,溶解速度加快,更利于内酯的溶出;第二,随着温度的升高,细胞膜被破坏,内酯能够迅速地从竹叶外层细胞转移到溶液中去,更多的内酯被溶解出来。当温度为90℃时,溶液处于回流状态,当再增加温度,回流状态不变,提取率基本不再增加。且高温还会增加能耗,故选择90℃为最佳提取温度。
3.4. 提取时间对竹叶内酯提取的影响
提取时间对竹叶内酯提取的影响如图4所示。随着时间的延长,竹叶内酯的提取率逐渐增加;在2.5 h时,提取率达到最大(5.57‰)。此时,竹叶内外有效成分浓度达到平衡,提取效果最好;再延长时间,
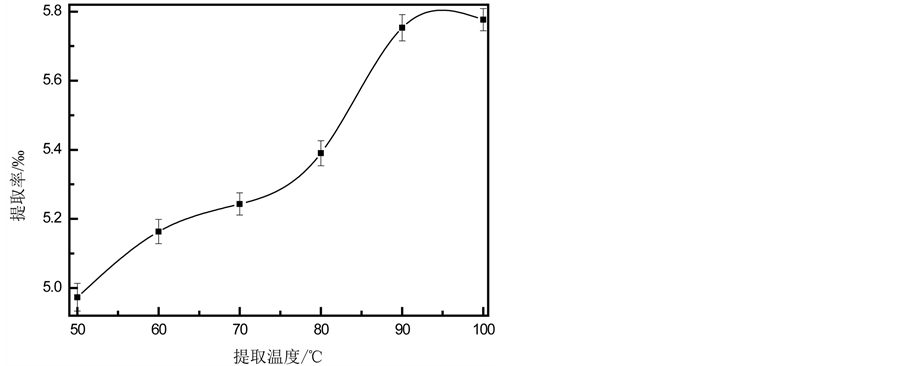
Figure 3. Effect of extraction temperature on the extraction of lactones of bamboo leaves
图3. 提取温度对竹叶内酯提取的影响

Figure 4. Effect of extraction time on the extraction of lactones of bamboo leaves
图4. 提取时间对竹叶内酯提取的影响
内酯提取效果逐渐降低。出现这种现象的原因可能是:随着时间的增加,内酯不断溶解出来,越溶越多;但是内酯具有挥发性,提取时间超过2.5 h后,蒸发量大于溶出量,使其含量降低 [13] ;且随着时间的延长,内酯暴露在空气中,容易被氧化。由此分析,提取竹叶内酯时,最佳提取时间为2.5 h。
3.5. 提取条件的正交试验
竹叶内酯提取条件的正交试验结果如表2所示。很显然,对竹叶内酯提取率的影响大小为乙醇浓度 > 提取时间 > 液料比。通过极差分析,确定了三因素的最优组合为A2B2C3,与直接分析的最优组合A2B2C3相同,故不需做验证试验,即确定最优提取条件:乙醇浓度40%,提取时间3 h,液料比15:1。
3.6. 树脂对竹叶内酯和黄酮的静态吸附以及乙醇浓度对竹叶内酯和黄酮的解吸性能
为了优化纯化竹叶内酯的树脂,分别用5种树脂对竹叶内酯进行了静态吸附试验,并分别用20%和80%乙醇溶液对其解吸,测定其解吸率,结果如表3和表4所示。很显然,这五种树脂对竹叶内酯和黄
Table 2. Orthogonal test results of extraction conditions of lactones of bamboo leaves
表2. 竹叶内酯提取条件的正交试验结果
Table 3. Adsorption rate of resin for lactones and flavonoids of bamboo leaves
表3. 树脂对竹叶内酯和黄酮的吸附率
Table 4. The effect of ethanol concentration on the desorption of lactones and flavonoids adsorbed by resin
表4. 乙醇浓度对被树脂吸附的内酯和黄酮解吸的影响
酮的吸附率相差不大,其中聚酰胺树脂和AB-8大孔树脂的吸附率最好,而用20%乙醇洗脱时,相比于其他四种树脂,聚酰胺中竹叶内酯的解吸率最大(80.5%),但对黄酮的解吸率均较低(约20%);用80%乙醇洗脱时,五种树脂中内酯和黄酮的解吸率均较高(约90%)。故可总结出:用聚酰胺树脂处理时,低浓度的乙醇可以将大部分内酯解吸出来,而只能解吸少量的黄酮。可以很好的将内酯和黄酮分离开,从而提高内酯的纯度。因此,初步选用聚酰胺树脂。
3.7. 内酯和黄酮的洗脱动力学曲线
内酯和黄酮的动态洗脱曲线分别如图5和图6所示。显而易见,内酯和黄酮的动态曲线均有两个明显的峰。当用20%乙醇洗脱时,大部分内酯和少量黄酮被洗脱下来;用80%乙醇洗脱时,剩余的少量内酯和大量黄酮被洗脱下来。故进一步验证了:聚酰胺树脂能够较好的分离竹叶中的内酯和黄酮,从而提高内酯的纯度。出现这种现象的原因可能是:聚酰胺树脂为氢键吸附树脂,而黄酮酚羟基较多,对应吸附力强,与聚酰胺结合牢固[14] 。内酯酚羟基少,吸附力较弱,故低浓度的乙醇便可将大部分内酯洗脱下来,而需高浓度的乙醇才能将大部分黄酮洗脱下来。但DM301、D101、HP-20和AB-8为大孔吸附树脂,是一种新型的非离子型高分子吸附剂,主要是由苯乙烯、二乙烯苯和甲基丙烯酸酯等物质聚合而成。其具有高分子孔穴网状结构,从而它能够借助范德华力从溶液中吸附各种有机物[15] 。故对内酯和黄酮的吸附力相当,故为了初步分离竹叶内酯和黄酮,提高内酯的纯度,选用聚酰胺树脂。
3.8. 竹叶内酯的得率和纯度
根据上述2.2.3(4)中的方法,测定竹叶提取物中内酯的得率和纯度,结果如表5所示。测得100 g竹叶得到的竹叶提取物的质量为0.944 ± 0.015,吸光度差值为0.060 ± 0.007。故根据公式(4)和(5)算得竹叶提取物中,内酯的得率和纯度分别为9.44‰和46.2%。
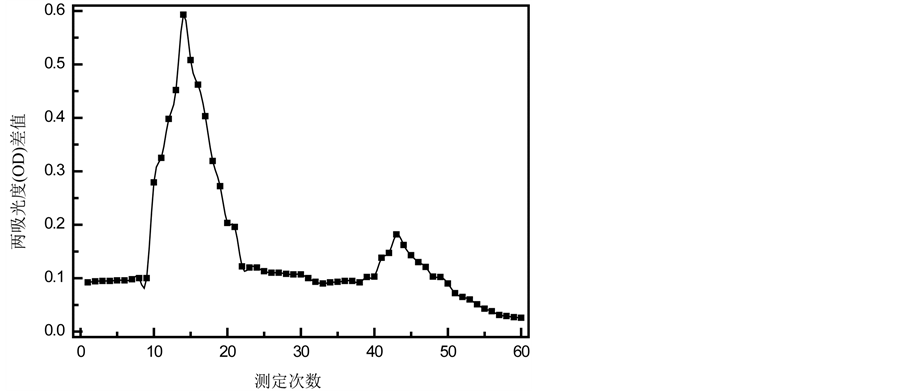
Figure 5. Dynamic elution curve of lactones of bamboo leaves
图5. 竹叶内酯的动态洗脱曲线
Table 5. The yield and purity of lactones of bamboo leaves
表5. 竹叶内酯的得率和纯度
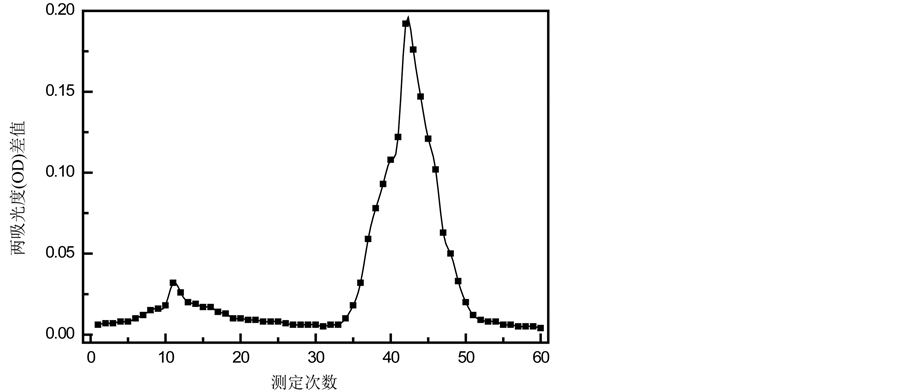
Figure 6. Dynamic elution curve of flavonoids of bamboo leaves
图6. 竹叶黄酮的动态洗脱曲线
4. 结论
本研究通过单因素与正交试验,确定了乙醇提取竹叶内酯的最佳条件,即:乙醇浓度40%,液料比15:1,提取温度90℃,时间3 h。然后,分别用聚酰胺、DM301、D101、HP-20和AB-8五种树脂对其进行纯化,结果表明聚酰胺不仅对竹叶内酯有较好的吸附率和解吸率,更有利于竹叶内酯和黄酮的分离。最后,得出的竹叶提取物中,内酯的得率和纯度分别为9.44‰和46.2%。
文章引用
章萍萍,孙汉巨,娄秋艳,王 鑫,谢玉鹏,王 霄,张曼莉, (2015) 竹叶内酯的提取及纯化工艺研究
The Study of Extraction and Purification of Lactones from Bamboo Leaves. 食品与营养科学,03,76-86. doi: 10.12677/HJFNS.2015.43011
参考文献 (References)
- 1. 胡春水, 佘祥威 (1999) 竹的药膳史及竹食品开发. 竹子研究汇刊, 18, 26-31.
- 2. 李惠珍, 陈朝洋 (1990) 天然食品防腐剂——竹叶的研究. 福建师范大学学报, 6, 74-82.
- 3. 张英, 丁霄霖 (1996) 竹叶有效成分和抗活性氧自由基效能的研究. 竹子研究汇刊, 15, 17-24.
- 4. 龚金炎, 吴晓琴, 张英 (2007) 竹提取物抗菌杀虫性能的研究进展. 竹子研究汇刊, 25, 28-31.
- 5. 姚晓宝, 刘银泉, 吴晓琴 (2004) 毛竹杭白菊粗提取对讨蚜和小菜蛾的生物活性测定. 浙江农业学报, 16, 156-158.
- 6. 刘建祥, 付惠, 陈厚琴, 等 (2011) 麻竹叶提取物在HCl介质中对Al的缓蚀作用. 安徽农业科学, 39, 8946-8947.
- 7. Wang, S.Y., Tang, F., Yue, Y.D., Yao, X., Wei, Q. and Yu, J. (2013) Simultaneous determination of 12 coumarins in bamboo leaves by HPLC. Journal of AOAC International, 96, 942-946. http://dx.doi.org/10.5740/jaoacint.12-441
- 8. 何军氏, 杨鸽华, 闫志健, 等 (2011) 祖师麻总香豆素的提取工艺研究. 海峡药学, 23, 86-88.
- 9. 张少华, 张志丽, 王立红, 等 (2013) 独活中总香豆素的超临界CO2提取工艺研究.中医药大学学报, 15, 55-57.
- 10. 闫广平 (2012) 微波辅助提取独活中香豆素类成分的工艺研究. 广东农业科学, 24, 104-107.
- 11. 韩正春 (2002) 竹叶活性成分提取纯化工艺及质量标准的研究. 硕士论文, 浙江大学, 杭州.
- 12. 谢捷, 林银双, 朱兴一, 等 (2012) 竹叶黄酮和香豆素类内酯的提取及含量比较. 林业实用技术, 20, 7-9.
- 13. 冷平生, 王天华, 苏淑钗, 等 (2001) 银杏黄酮苷和萜类内酯含量的季节变化. 植物资源与环境学报, 10, 15-18.
- 14. 胡清文 (2012) 银杏内酯的提取分离及药理作用研究. 硕士论文, 山东大学, 济南.
- 15. 谢捷, 方明春, 朱兴一, 等 (2013) 微波辅助提取竹叶内酯的工艺研究. 林产化工, 5, 61-65.
