Hans Journal of Agricultural Sciences
Vol.4 No.02(2014), Article ID:13364,9 pages
DOI:10.12677/HJAS.2014.42006
外源亚精胺、壳聚糖对盐胁迫下黄瓜幼苗 叶绿素荧光参数的影响
Dandan Lv, Xiaobo Pei *School of Horticulture, Anhui Agricultural University, Hefei
Email: *peixiaobo@ahau.edu.cn
Copyright © 2014 by authors and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY).
http://creativecommons.org/licenses/by/4.0/


Received: Feb. 18th, 2014; revised: Feb. 24th, 2014; accepted: Feb. 28th, 2014
ABSTRACT
To explore the effect of cucumber seedling photosynthesis on exogenous Spermidine (Spd) and Chitosan (CTS) under salt stress as well as their interaction effect, using Jinyou No.1 (Cucumis sativus L.) as test materials under NaCl salt stress (200 mmol/l), adopting substrate cultivation and setting 5 treatments (CK water, S1 NaCl, S2 NaCl + CTS, S3 NaCl + Spd, S4 NaCl + CTS + Spd), the effects of cucumber seedling under salt stress with exogenous CTS (150 mg/g) and Spd (150 mg/g) about seedling growth, chlorophyll content, chlorophyll fluorescence parameters (PSII photochemical efficiency) and so on were studied. Study showed that the treatments of exogenous CTS and Spd relieved cucumber seedling injure under salt stress, whatever integrated treatments or independent treatments. Exogenous CTS and Spd influenced chlorophyll fluorescence parameters of cucumber seedlings under NaCl salt stress that could improve seedlings’ photochemical efficiency. Effect of integrated treatment of Spd and CTS was greater than that of independent treatment of chlorophyll fluorescence parameters. Chlorophyll content of integrated treatments was obviously much more than that of independent treatments. All treatments enhanced cucumber seedling salt tolerance, and persistent induction more than 9 days can be optimum. With integrated treatments, increments of stem diameter, plant height, leaf area, the ground fresh weight, and underground fresh weight were much more than those of cucumber seedling under salt stress, respectively up to 27.64%, 20.59%, 26.76%, 39.24%, and 39.79%. What’s more, these increments of integrated treatments were obviously much more than those of independent treatments. Significant or extremely significant interaction of SA and CTS was observed as chlorophyll content and chlorophyll fluorescence parameters.
Keywords:Salt Stress; Cucumber Seedling; Spd; CTS; Chlorophyll Fluorescence Parameters

外源亚精胺、壳聚糖对盐胁迫下黄瓜幼苗 叶绿素荧光参数的影响
吕丹丹,裴孝伯*
安徽农业大学园艺学院,合肥
Email: *peixiaobo@ahau.edu.cn
收稿日期:2014年2月18日;修回日期:2014年2月24日;录用日期:2014年2月28日

摘 要
为探讨盐胁迫下外源壳聚糖(Chitosan, CTS)和外源亚精胺(Spermidine, Spd)处理对黄瓜幼苗光合作用的影响,以“津优1号”(Cucumis sativus L.)为试验材料,在200 mmol/l NaCl胁迫条件下,采用基质培育法,设置5组处理(CK清水,S1 Nacl,S2 NaCl、CTS,S3 NaCl、Spd,S4 NaCl,CTS,Spd),研究了150 mg/g外源壳聚糖和150 mg/g外源亚精胺对黄瓜幼苗叶绿素荧光参数(PSII光化学效率)、叶绿素含量、植株生长量等指标的影响。研究表明:在NaCl盐胁迫下,无论Spd、CTS单一处理还是共同处理下,均能缓解盐胁迫的伤害。外源Spd,CTS影响NaCl盐胁迫下黄瓜幼苗叶绿素荧光参数变化,提高植株的光化学效率,NPQ、F0在NaCl盐胁迫下均有所上升,而Fm、Fv/Fm、Y(II)、qP在处理下均有所下降。在NaCl盐胁迫下,Spd、CTS共同处理NPQ、F0的升幅均小于单一处理,Fm、Fv/Fm、Y(II)、qP的降幅均小于单一处理,Spd、CTS共同处理作用效果更显著。Spd、CTS共同处理显著提高叶绿素含量,在NaCl盐胁迫下提高量最高可达30.37%,显著高于单一处理,并且持续诱导9天以上效果较佳。CTS、Spd共同处理作用下,茎粗、株高、叶面积、地上鲜重、根鲜重比盐胁迫对照最高量提高分别可达27.64%、20.59%、26.76%、39.24%、39.79%,增长量明显高于Spd、CTS单独处理。且Spd、CTS在盐胁迫下黄瓜幼苗叶片叶绿素含量,叶绿素荧光参数均存在显著差异及极显著差异。
关键词
盐胁迫;黄瓜幼苗;亚精胺;壳聚糖;叶绿素荧光参数

1. 引言
黄瓜是设施栽培的主要蔬菜之一,由于设施栽培中有较长时间的覆盖,施肥量大,室内空气流动性差等原因,容易造成盐分积聚,引起土壤次生盐渍化,导致黄瓜的产量和品质下降,严重影响其设施生产的可持续发展。因此如何克服连作盐害是目前设施黄瓜生产中有待解决的主要问题。
连作盐害中,NaCl盐害较为严重,Na+和Cl−对植物造成的损伤是由于渗透胁迫(水分胁迫)和离子毒害而引起植物体生理功能紊乱的结果[1] -[4] 。这些原初反应直接引起叶绿体和线粒体电子传递中泄露的电子增加,活性氧(reactive oxygen species, ROS)大量产生,导致细胞内氧化损伤,引起叶绿素降解、膜结构损伤、蛋白质变性、核酸断裂、甚至细胞死亡,从而导致植物光合速率下降、能耗增加、衰老加速、生长量降低,甚至导致植株死亡[5] -[8] 。
叶绿素荧光动力学技术由于其快速和非破坏性的优点,成为研究植物光合结构功能和逆境胁迫响应的主要工具。叶绿素荧光的变化可以在一定程度上反映逆境胁迫对植物的影响。研究表明PSII对盐胁迫的敏感性随植物种类和胁迫程度的不同而不同[9] 。在蔬菜作物黄瓜上,低浓度的NaCl胁迫7 d后,幼苗叶片光合效率下降主要是由于气孔因素,而并没有抑制PSII的活性[10] -[12] ,而当NaCl浓度较大时,最大光化学效率(Fv/Fm)和光化学淬灭系数(qP)显著下降,并且还原性QA(原初电子受体质体醌A)比例增加,导致PSII反应中心放氧活性降低[13] 。有关盐胁迫对辣椒[14] 、甜瓜[15] 、玉米[16] 、番茄[17] 、梨[18] 、葡萄[10] 、四季豆[13] 等园艺植物光合作用的影响均有报道。
亚精胺(Spermidine, Spd)、壳聚糖(chitosan, CTS)是植物抗病反应和诱导植物对非生物逆境反应的抗逆信号分子,两者均能诱导植物体内抗逆性蛋白产生,提高保护酶活性,增加渗透调节物质及次生代谢产物含量,从而提高植物的抗病性、耐盐性及抗热性等[19] -[24] 。据此推断Spd、CTS 2种信号转导途径之间可能存在交叉作用。关于两者共同施用对植物抗逆性特别是盐胁迫下黄瓜幼苗叶片叶绿素荧光动力学方向的研究在国内外还未见报道。为此,本试验以“津优1号”黄瓜为材料,研究Spd与CTS共同处理对NaCl盐胁迫下黄瓜叶片光合特性的影响,以明确两者对提高盐胁迫下黄瓜叶片光合作用是否存在互作效应及可能的生理机制。
2. 材料与方法
2.1. 材料
供试黄瓜品种为“津优1号”,为盐敏感品种,天津黄瓜研究所产品。NaCl为分析纯(分子量为58.5)。CTS为Sigma公司产品,脱乙酰度 ≥ 85%,产品代码:C3646。外源亚精胺Spd为Sigma公司产品,无色液体,密度0.925 g/ml,纯度 ≥ 98%,产品代码:S2626。
2.2. 方法
2.2.1. 培养
试验于2013年4~11月在安徽农业大学实验室进行。挑选籽粒饱满、整齐一致的种子经55℃温汤浸种3 h,用纱布包好放入温度为28℃的恒温培养箱中催芽24 h。挑选发芽一致的种子,播于装有复合基质(草炭、蛭石、珍珠岩 = 3:1:1)的10 cm × 10 cm营养钵内,置于智能人工气候培养箱(ZRX-1000EC,杭州钱江仪器设备有限公司制造)内进行培养。培养箱设置4个时间段A(23℃, 6 h)、B(27℃, 4 h)、C(25℃, 6 h)和D(20℃, 8 h)以模拟温室光温环境,箱内相对湿度控制在70%左右。
2.2.2. 诱导
在预备试验的基础上,当第2片真叶初展时,挑选长势一致的幼苗,用蒸馏水(对照组CK)和CTS(150 mg/L)、Spd(150 mg/g)进行诱导处理,进行如下分区处理:S0:清水,S1:清水 + CTS,S2:清水 + Spd,S3:清水 + CTS + Spd,用注射器吸取15 ml溶液,距根际2 cm处缓慢注入进行初始诱导;3 d后用喷雾器吸取溶液均匀喷洒于叶面和叶背进行强化诱导,药液下不滴为宜。对照用等量蒸馏水代替,随机区组排列,三次重复,每处理小区30株。苗期管理过程中保持各处理小区环境一致。
2.2.3. 胁迫
强化诱导3 d后,进行盐胁迫处理。把黄瓜幼苗进行分组处理,总共5组处理:S0:清水(CK对照),S1:NaCl,S2:NaCl + CTS,S3:NaCl + Spd,S4:NaCl + CTS + Spd,在幼苗根际处,用注射器缓慢注入200 mmol/l NaCl (国药集团北京化学试剂公司,含量 ≥ 99.5%,规格:AR)溶液,每株40 ml,药液不渗出钵外为宜。
2.2.4. 测定
盐胁迫后3、6、9、12 d取第2片真叶,叶绿素含量(SPAD仪测定)的测定;盐胁迫后3、6、9、12d,将植株叶片充分暗适应20 min后,在同一叶片上用用PAM2100调制荧光仪(英国)进行测定荧光参数,包括初始荧光(F0)、最大荧光产量(Fm)、PSII最大光化学效率(Fv/Fm)、光化学量子产量(Y(II)),其它荧光参数如下:光化学猝灭系数(qP)、非光化学猝灭系数(NPQ)由仪器自动给出;盐胁迫结束后20 d,进行株高、茎粗等形态指标的测定。单株进行处理,每处理进行3次重复。
2.3. 数据处理
结果采用SAS软件中的Duncan’s新复极差法进行方差分析及显著性比较分析,图表采用软件Microsoft Excel进行绘图。
3. 结果与分析
3.1. 外源亚精胺、壳聚糖对NaCl盐胁迫下黄瓜幼苗叶绿素荧光参数的影响
3.1.1. 外源亚精胺、壳聚糖对NaCl盐胁迫下黄瓜幼苗初始荧光产量(F0)和最大荧光产量(Fm)的影响
F0为初始荧光产量,是PSII全部开放时的荧光水平,F0升高意味着PSII受到了伤害或不可逆失活。在本实验中,随着处理时间的增加,F0升高(图1),第9天,各组处理有显著性差异,在NaCl盐胁迫下,施加外源Spd、CTS明显缓解F0的升高,S2、S3、S4相比于S1,F0降幅分别为9.18%,12.32%,17.15%。外源Spd、CTS共同处理作用明显大于单一处理,其次,外源Spd的单一处理略强于外源CTS的单一处理。
Fm为最大荧光产量,是PSII反应中心处于完全关闭时的荧光产量。可反映经过PSII的电子传递情况。通常叶片经暗适应30 min后测得。在本实验中,随着盐胁迫处理时间的增加,Fm下降(图2),第9天,各组处理有明显差异,在NaCl盐胁迫下,外源Spd、CTS明显缓解Fm的下降,S2、S3、S4相比于S1,Fm升幅分别为17.01%,24.12%,42.75%。表明外源Spd、CTS共同处理作用明显大于单一处理,而Spd单一处理与CTS单一处理之间有显著性差异。
3.1.2. 外源亚精胺、壳聚糖对NaCl盐胁迫下黄瓜幼苗PSII最大光化学效率(Fv/Fm) 和实际光化学量子产量(Y(II))的影响
Fv/Fm是PSII最大光化学效率,其大小反映了PSII反应中心内初光能的转换效率(最大转换效率),胁迫条件下该参数明显下降,是反映光抑制程度的良好指标。在本试验中随着处理的时间Fv/Fm呈下降趋势(图3),其中在第9天时,各组处理明显下降,在NaCl盐胁迫下,施加外源Spd、CTS均明显缓解下降趋势,其中,Spd、CTS共同处理降幅明显低于Spd、CTS单一处理,施加外源Spd组降幅略低于施加外源CTS组,S2,S3,S4相比于S1升幅分别为18.42%,21.73%,32.59%。表明在盐胁迫下外源Spd、CTS共同处理对黄瓜幼苗Fv/Fm作用大于单一处理。
实际光化学量子产量Y(II)非胁迫条件下该参数的变化极小,不受物种和生长条件的影响,胁迫条件下该参数明显下降。在本试验中,实际光化学量子产量(Y(II))随着NaCl盐胁迫处理时间的延长呈递减趋势(图4),其中,6天后有显著变化,到第9天达到最大差异。在NaCl盐胁迫下,施加外源Spd、CTS,S2、S3、S4均有所上升,与S1相比,黄瓜幼苗的Y(II)的升幅分别为21.80%,15.70%,33.14%。表明在盐胁迫下外源Spd、CTS共同处理作用效果大于单一处理,而外源CTS单一处理作用效果大于外源Spd
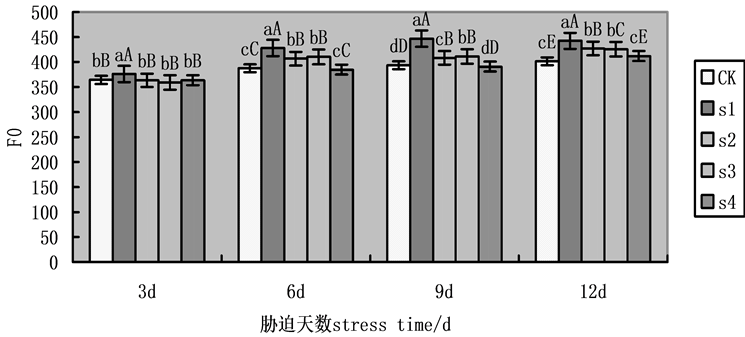
Figure 1. Effects on initial fluorescence (F0) of cucumber seedlings on exogenous Spd and CTS treatment under NaCl salt stress
图1. 外源Spd、CTS对NaCl盐胁迫下黄瓜幼苗叶片叶绿素荧光参数F0的影响

Figure 2. Effects on maximal fluorescence (Fm) of cucumber seedlings on exogenous Spd and CTS treatment under NaCl salt stress
图2. 外源Spd、CTS对NaCl盐胁迫下黄瓜幼苗叶片叶绿素荧光参数Fm的影响
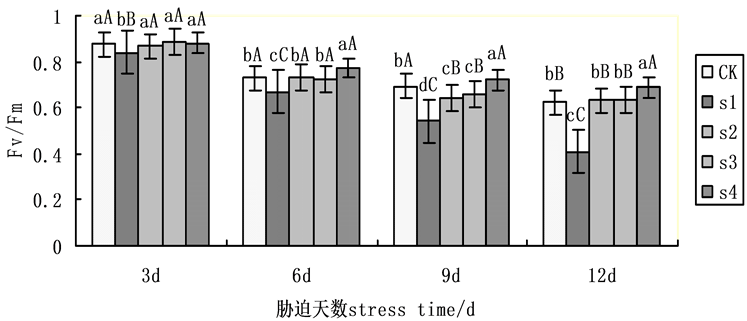
Figure 3. Effects on the maximum photochemical efficiency (Fv/Fm) of cucumber seedlings on exogenous Spd and CTS treatment under NaCl salt stress
图3. 外源Spd、CTS对盐胁迫下黄瓜幼苗叶片叶绿素荧光参数Fv/Fm的影响
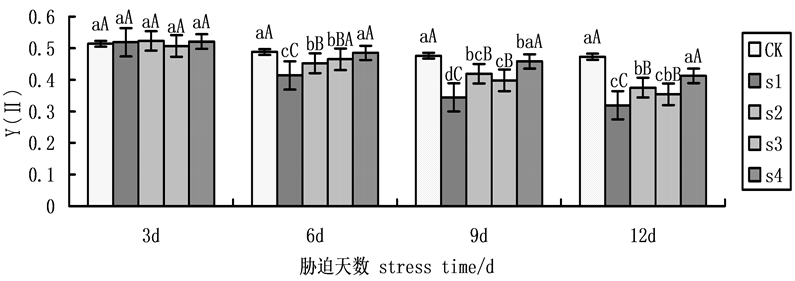
Figure 4. Effects on the actual photochemical quantum yield (Y(II)) of cucumber seedlings on exogenous Spd and CTS treatment under NaCl salt stress
图4. 外源Spd、CTS对NaCl盐胁迫下黄瓜幼苗叶片叶绿素荧光参数Y(II)的影响
单一处理。
3.1.3. 外源亚精胺、壳聚糖对NaCl盐胁迫下黄瓜幼苗光化学淬灭系数(qP) 和非光化学淬灭系数(NPQ)的影响
荧光猝灭分为光化学猝灭和非光化学猝灭两类。光化学猝灭系数反映了PsII天线色素吸收的光能用于光化学传递的份额,非光化学猝灭系数反映了PsII天线色素吸收的光能不能用于光合电子传递而以热的形式耗散掉的光能部分。本试验中,光化学淬灭系数(qP)随着NaCl盐胁迫下处理时间的延长呈现递减趋势(图5),第9天时,各组处理下降明显,在NaCl盐胁迫下,施加外源Spd、CTS,无论是单一处理还是共同处理均能缓解盐胁迫下的下降趋势,其中共同处理下与S1相比,升幅可达22.13%,而Spd、CTS单一处理下与S1相比,升幅分别为10.04%,12.30%,表明Spd、CTS共同处理明显缓解盐胁迫下qP下降趋势。
与qP相反,NPQ随胁迫时间延长而呈现上升规律(图6)。第9天时,在NaCl盐胁迫下,施加外源Spd、CTS,无论单一处理,还是共同处理均使NPQ的升幅下降,S2、S3、S4处理下与S1相比,降幅分别为19.54%、23.55%、37.99%,在NaCl盐胁迫下,S4缓解能力明显强于S2、S3,表明在NaCl盐胁迫下共同处理作用效果大于单一处理。
3.2. 外源亚精胺、壳聚糖对NaCl盐胁迫下黄瓜幼苗叶绿素含量的影响
在本实验中,叶绿素含量随着时间的处理,各组有明显变化,6天以后,变化较为明显,到第9天,各组呈现显著性差异达到最大(图7)。在NaCl盐胁迫下,施加外源Spd、CTS均能缓解盐胁迫下黄瓜叶绿素含量的下降,S2、S3、S4与盐胁迫S1相比升幅分别为19.32%,15.91%,26.80%,表明在NaCl盐胁迫下,外源Spd、CTS共同处理下叶绿素含量的增加量大于单一处理,外源CTS单一处理作用效果略高于外源Spd单一处理。
3.3. 外源亚精胺、壳聚糖对NaCl盐胁迫下黄瓜幼苗植株生长的形态指标的影响
由表1可知,在NaCl盐胁迫下,施加外源Spd、CTS后,对黄瓜幼苗的生长有一定的促进作用。在NaCl盐胁迫下,S2、S3、S4处理的茎粗、株高、叶面积、地上部鲜重及地下部鲜重较S1、对照均有所增长,其中S4增长最高,分别可达27.64%、20.59%、26.76%、39.24%、39.79%,S2,S3在茎粗,株高上无显著差异,在叶面积、地上部鲜重、地下部鲜重上有显著性差异;表明Spd、CTS共同处理效果较佳。
4. 讨论
植物活体叶绿素发出的荧光信号包含的光合信息十分丰富,因此通过叶绿素荧光参数的分析,可深入了解胁迫对植物光合机构,主要是PSII的影响以及光合机构对胁迫的适应机制。叶绿体在正常情况下吸收的光能主要通过光合电子传递、叶绿素荧光和热耗散三种途径来消耗,这三种途径间存在着此消彼长的关系。在对辣椒、甜瓜、番茄、玉米、梨和葡萄的研究表明,盐胁迫破坏叶绿体光合机构,PSII反
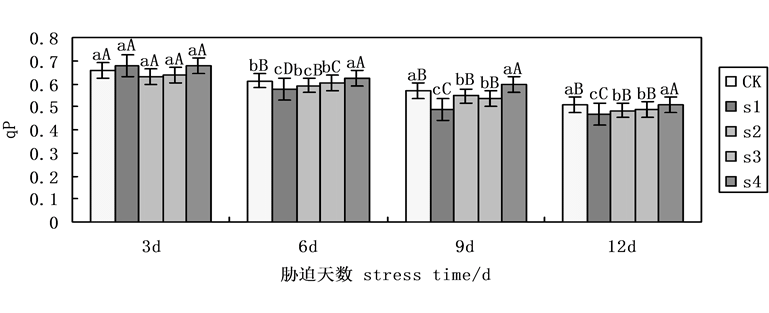
Figure 5. Effects on the photochemical quenching coefficient (qP) of cucumber seedlings on exogenous Spd and CTS treatment under NaCl salt stress
图5. 外源Spd、CTS对盐胁迫下黄瓜幼苗叶片叶绿素荧光参数qP的影响
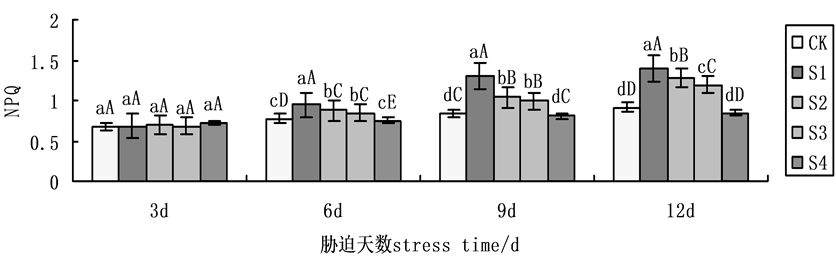
Figure 6. Effects on non-photochemical quenching coefficient (NPQ) of cucumber seedlings on exogenous Spd and CTS treatment under NaCl salt stress
图6. 外源Spd、CTS对盐胁迫下黄瓜幼苗叶片叶绿素荧光参数NPQ的影响
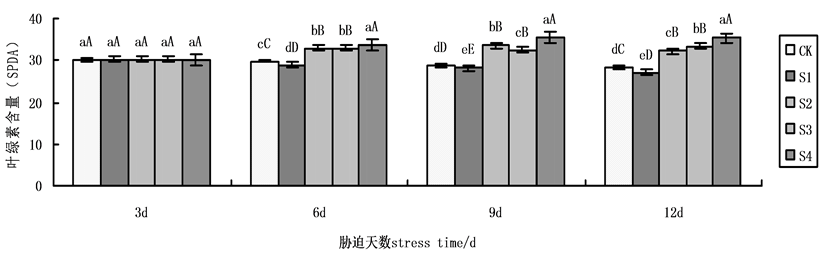
Figure 7. Effects on Chlorophyll content of cucumber seedlings on exogenous Spd and CTS treatment under NaCl salt stress
图7. 外源Spd、CTS对NaCl盐胁迫下黄瓜幼苗叶片叶绿素含量的影响
Table1. Effects on the morphology index of cucumber seedlings on exogenous Spd and CTS treatment under NaCl salt stress
表1. Spd、CTS对黄瓜盐胁迫下幼苗植株生长的影响
注:小写字母表示0.01水平,大写字母表示0.05水平。
Note: lowercase letter indicated the significant difference at P = 0. 05 level, capital letters indicates the significant difference at P = 0. 01 level.
应中心受损,抑制光合作用的原初反应,阻碍光合电子传递的过程,明显降低PSII原初光能转换效率[10] [14] -[18] 。叶绿素荧光是探测和分析植物光合功能的重要手段,为研究光系统及其电子传递过程提供了丰富的信息,是研究植物光合生理状况以及植物与逆境胁迫关系的理想探针[9] 。
本实验研究结果表明,经NaCl盐胁迫后,黄瓜幼苗叶片PSII中的初始荧光产量F0和最大荧光产量Fm均有所变化,F0上升,Fm下降,导致PSII的最大光化学效率(Fv/Fm)、实际光化学量子产量Y(II)明显下降,说明PSII已受到盐胁迫的伤害。据前人研究表明NaCl盐胁迫下,F0上升和Fm下降表明PSII反应中心失活[25] [26] 。因此推断NaCl盐胁迫使黄瓜幼苗叶片F0上升和Fm下降,说明Fv/Fm、Y(II)下降是盐胁迫导致PSII反应中心失活所致。而用Spd、CTS处理可以有效缓盐胁迫对PSII反应中心活性的伤害,增强了黄瓜幼苗的耐盐性。前人研究表明,PSII反应中心失活分为PSII反应中心可逆失活和PSII反应中心不可逆失活两种[27] -[30] 。本试验研究还发现,Spd、CTS处理后,虽然黄瓜幼苗叶片F0升高、Fm下降,但上升以及下降的幅度不同。Spd、CTS共同处理的叶片F0上升幅度较小,其次是Spd、CTS单独处理的叶片,而NaCl盐胁迫下处理上升幅度较大,同样的,共同处理下Fm下降幅度较小,其次为单一处理,NaCl对照组中Fm下降幅度最大。因此说明NaCl盐胁迫下PSII反应中心失活可能既有可逆失活又有不可逆失活,这是因为盐胁迫使叶片F0升高、Fm下降(可逆和不可逆),外源Spd、CTS处理下,NaCl盐胁迫下F0有所降低、Fm有所升高(可逆部分的变化),但并没有达到一致水平(不可逆部分没有变化)。
在黄瓜幼苗受到盐胁迫的情况下,PSII发生了明显的光抑制作用。
光化学猝灭系数qP可以表示PSII反应中心还原力的积累情况,反映了光合作用反应中心的开放程度。本实验研究得出,qP值在NaCl盐胁迫下降低,与邢庆振研究一致[10] 。这意味着在胁迫条件下黄瓜幼苗体内积累的还原力水平增加,造成光合作用反应中心的开放程度减小,表明在NaCl盐胁迫条件下黄瓜幼苗受到了明显的光抑制作用。而外源Spd、CTS处理下,盐胁迫下的黄瓜幼苗叶片qP明显上升,表明处理缓解了NaCl盐胁迫下黄瓜幼苗叶片的光抑制作用,Spd、CTS共同处理下作用效果显著大于单一处理。
NPQ代表了植物细胞的非光化学猝灭状况,反映了LHCII吸收光能的热量耗散程度。本实验研究表明,在盐胁迫期间NPQ有上升趋势,因为LHCII吸收的光能通过热能释放掉的比例加大,植物通过此途径可避免盐胁迫下有害物质的积累,减轻氧自由基的产生[9] 。NaCl盐胁迫对照下的NPQ较高,这可能是盐胁迫期间黄瓜幼苗叶片的光化学器官受到严重伤害,不能有效地把所吸收的光能用于进行光合作用,导致吸收的大部分光能以热能形式被无效地消耗掉,致使植物体内积累大量的氧自由基,损害光合器官。而外源Spd、CTS处理的NaCl盐胁迫下的黄瓜幼苗叶片NPQ有明显的下降,表明此时通过热能耗散掉的光能减少,实际光能利用效率较高,用于暗反应的比例增加。研究还发现,Spd、CTS共同处理下幼苗叶片的NPQ下降的幅度显著大于单一处理,表明共同处理下叶片实际光能利用效率大于单一处理。前人研究表明,PSII反应中心被破坏是由于LHCII(捕光色素蛋白复合体II)脱离PSII引起的[9] 。那么,NaCl盐胁迫所引起的黄瓜幼苗叶片PSII反应中心的部分被破坏是否与LHCII脱离PSII反应中心有关,有待于进一步研究。
叶绿素是光合作用的光敏化剂。叶绿素的减少降低了植物对光量子的有效吸收、传递和利用,从而降低光能转化为生物化学能的效率[31] -[33] 。在盐胁迫下,与CK对照组相比,叶绿素含量明显下降,外源Spd、CTS显著提高其叶绿素含量,且Spd、CTS共同处理下叶绿素含量的增加量显著大于SA、CTS单一处理(表1)。
植物在盐胁迫等非生物逆境胁迫条件下,最直观的表现是生物学产量的降低,初期叶片变黄以至脱落,植株生长缓慢,停滞甚至死亡。本实验研究结果表明了,盐胁迫下黄瓜幼苗生长的形态指标与CK对照组相比,明显有所下降,而外源Spd、CTS处理下,幼苗生长的形态指标均有所上升,缓解了盐胁迫下的伤害,尤其是Spd、CTS共同处理下,显著大于单一处理。
植物耐盐性的机制十分复杂,单纯从某一层面研究盐胁迫对植物造成的伤害机理是远远不够的。外源Spd、CTS对黄瓜幼苗的耐盐性的共同作用机理还需进一步研究。
基金项目
本研究受国家科技支撑计划(2008BADC0B02)资助。
参考文献 (References)
- Zapata, P.J., Serrano, M., Pretel, M.T., et al. (2004) Polyamines and ethylene changes during germination of different plant species under salinity. Plant Science, 167, 781-788.
- Vashisht, A.A. and Tuteja, N. (2006) Stress responsive DEAD-box helicases: A new pathway to engineer plant stress tolerance. Journal of Photochemistry and Photobiology B, Biology, 84, 150-160.
- Mayak, S., Tirosh, T. and Glick, B.R. (2004) Plant growth-promoting bacteria confer resistance in tomato plants to salt stress. Plant Physiology and Biochemistry, 42, 565-572.
- 史庆华, 朱祝军, Al-Aghabary, K., 等 (2004) 等渗Ca(NO3)2和NaCl胁迫对番茄光合作用的影响. 植物营养与肥料学报, 2, 188-191.
- 吴艳飞, 张雪艳, 李元, 魏文杰, 高丽红 (2008) 轮作对黄瓜连作土壤环境和产量的影响. 园艺学报, 3, 357-362.
- Agarwal, S., Sairam, R.K., Srivastava, G.C., et al. (2005) Changes in antioxidant enzymes activity and oxidative stress by abscisic acid and salicylic acid in wheat genotypes. Biologia Plantarum, 49, 5412550.
- Kaur-Sawhney, R., Tiburcio, A.F., Altabella, T., et al. (2003) Polyamines in plants: An overview. Journal of Cell and Molecular Biology, 2, 1-12.
- 李娜, 陈红, 裴孝伯 (2013) 外源亚精胺对盐胁迫下黄瓜幼苗耐盐性的影响. 热带作物学报, 7, 1-7.
- 陈建明, 俞晓平, 程家安 (2006) 叶绿素荧光动力学及其在植物抗逆生理研究中的应用. 浙江农业学报, 1, 51-55.
- 邢庆振, 郁松林, 牛雅萍, 于坤, 宋曼曼 (2011) 盐胁迫对葡萄幼苗光合及叶绿素荧光特性的影响. 干旱地区农业研究, 3, 96-100.
- 许耀照, 曾秀存, 郁继华, 颉建, 张国斌 (2007) 水杨酸对高温胁迫下黄瓜幼苗叶绿素荧光参数的影响. 西北植物学报, 2, 267-271.
- 魏国强, 朱祝军, 方学智, 李娟, 程俊 (2004) NaCl胁迫对不同品种黄瓜幼苗生长叶绿素荧光特性和活性氧代谢的影响. 中国农业科学, 11, 1754-1759.
- Bhivare, V.N. and Nimbalkar, J.D. (1974) Salt stress effects on growth and mineral nutrition of French beans. Plant and Soil, 80, 91298.
- 张帆, 郁继华, 颉建明, 冯致, 张国斌, 李雯琳 (2013) 外源ALA和Spd对低温弱光下辣椒幼苗光合作用及抗氧化系统的影响. 中国农业科学, 11, 2298-2306.
- 张永平, 杨少军, 陈绯翔, 陈幼源 (2011) NaCl胁迫对2个网纹甜瓜幼苗生长量及叶绿素荧光参数特性的影响.中国农学通报, 4, 189-193.
- 杨猛, 魏玲, 胡萌, 顾万荣, 庄文锋, 张道园, 孙继 (2012) 低温胁迫对玉米幼苗光合特性的影响. 东北农业大学学报, 1, 66-70.
- 杨风军, 李天来, 宿越, 臧忠婧 (2012) 外源水杨酸对NaCl胁迫下番茄幼苗光合特性的影响. 中国蔬菜, 22, 35-40.
- 高丽娟, 张玉星 (2012) 外源水杨酸对梨叶片叶绿素荧光特性的影响. 中国果树, 5, 29-31.
- 李军, 高新昊, 郭世荣, 张润花, 王旭 (2007) 外源亚精胺对盐胁迫下黄瓜幼苗光合作用的影响. 生态学杂志, 10, 1595-1599.
- 袁颖辉, 束胜, 袁凌云, 等 (2012) 外源精胺对盐胁迫下黄瓜幼苗生长和光合作用的影响. 江苏农业学报, 4, 835-840.
- 宋士清, 尚庆茂, 郭世荣, 张志刚 (2006) 壳聚糖对黄瓜幼苗抗盐的协同生理作用研究. 西北植物学报, 3, 435-441.
- Zhao, H., Wang, B.-C., Zhao, H.-C. and Wang, J.B. (2005) Stress stimulus induced resistance to Cladosporium cucumerinum in cucumber seeding. Colloids and Surfaces B: Biointerfaces, 44, 36-40.
- 刘桂智, 朱英波, 杜金有, 等 (2007) 壳聚糖在农业上的应用研究进展. 中国农学通报, 23, 377-381.
- Gao B., Song, J. and Liu, J.P. (2010) Effects of salt stress on photosynthesis and ion accumulation patterns of suaeda salsa under different habitats. Chinese Journal of Plant Ecology, 34, 671-677.
- 朱进 (2012) 温室不同黄瓜幼苗叶绿素荧光参数和叶绿素相对含量的变化. 长江蔬菜, 2, 36-38.
- Wang, B.C., Wang, J.B., Zhao, H.C. and Zhao, H. (2006) Stress induced plant resistance and enzyme activity varying in cucumber. Colloids and Surfaces B: Biointerfaces, 48, 138-142.
- 胡文海, 黄黎锋, 毛伟华, 周艳虹, 喻景权 (2006) 油菜素内酯对黄瓜苗期叶片光合机构调节作用的研究. 园艺学报, 4, 762-766.
- 徐向东, 孙艳, 郭晓芹, 孙波, 张坚 (2011) 高温胁迫下外源褪黑素对黄瓜幼苗光合作用及叶绿素荧光的影响. 核农学报, 1, 179-184.
- 孙艳, 徐伟君, 范爱丽 (2006) 高温强光下水杨酸对黄瓜叶片叶绿素荧光和叶黄素循环的影响. 应用生态学报, 3, 402.
- 孙艳, 樊爱丽, 徐伟君 (2005) 水杨酸和草酸对光氧化胁迫下黄瓜叶片光合机构及叶黄素循环的影响. 园艺学报, 6, 1034-1038.
- 张润花, 郭世荣, 李军 (2007) 外源腐胺对盐胁迫黄瓜幼苗生长, 光合及叶绿素荧光参数的影响. 中国园艺学会十届二次理事会暨学术研讨会论文摘要集, 南京农业大学, 2007年10月18至20日.
- 张红梅, 金海军, 丁小涛, 余纪柱 (2011) 黄瓜幼苗对热胁迫的生理反应及叶绿素荧光特性. 上海交通大学学报(农业科学版), 5, 61-66.

NOTES
*通讯作者。
