Botanical Research
Vol.3 No.03(2014), Article
ID:13541,6
pages
DOI:10.12677/BR.2014.33012
长春花生物碱代谢生物学研究进展
Haining Cheng, Zhonghua Tang*Key Laboratory of Forest Plant Ecology, Ministry of Education, Northeast Forestry University, Harbin
Email: *tangzh@nefu.edu.cn
Copyright © 2014 by authors and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY).
http://creativecommons.org/licenses/by/4.0/



Received: Feb. 19th, 2014; revised: Mar. 24th, 2014; accepted: Apr. 3rd, 2014
ABSTRACT
The alkaloids in Catharanthus roseus are noticed extensively as vinblastine and vincristine have been the important anticancer drugs recently, and the concerned studies developed rapidly. On the basis of many disciplines, metabolic biology of alkaloid is a new interdiscipline which contains many fields, and what it studied is the biosynthetic process of the alkaloids in the biosynthetic pathway. This paper attempts to give a brief review on the metabolic biology of the alkaloids in Catharanthus roseus, involving the biosynthetic pathway, regulatory factors, and biosynthesis and storage position of the alkaloids in C. roseus, and the perspective of researches on biological function also has been given.
Keywords:Catharanthus roseus, Alkaloid, Metabolic Biology, Regulatory Factor, Biosynthesis

长春花生物碱代谢生物学研究进展
成海宁,唐中华*
东北林业大学森林植物生态学教育部重点实验室,哈尔滨
Email: *tangzh@nefu.edu.cn
收稿日期:2014年2月19日;修回日期:2014年3月24日;录用日期:2014年4月3日

摘 要
随着长春碱和长春新碱日益成为近年来抗癌药物研发的重要对象,长春花生物碱受到了广泛的关注,与其相关的研究也随之得到了较快的发展。生物碱代谢生物学是在各门学科的基础上应运而生的一门跨领域的新兴交叉学科,它研究的是生物碱在代谢途径中的代谢生物学过程及其功能。本文从长春花生物碱的代谢途径、代谢控制因子,以及长春花生物碱的合成和贮存部位等方面,对长春花生物碱代谢生物学作以简要综述,对长春花生物碱的生物学功能的研究提出了展望。
关键词
长春花,生物碱,代谢生物学,调控因子,生物合成

1. 引言
代谢生物学主要是研究生命体在代谢途径中进行的生物学过程。生物碱代谢生物学研究了生物碱在植物体内受组织、发育和环境因子调控的代谢动态、代谢分子调控、信号传导、合成和贮存部位、转运途径、化学生态意义、生理作用、分解代谢等问题,是一门结合了细胞生物学、发育生物学、植物生理学、分子生物学、化学生态学等多个领域的交叉学科[1] [2] 。生物碱代谢生物学从植物体本身出发,围绕着生物碱的生物学功能探索其代谢的发生过程。生物碱代谢生物学的研究成功地为医药品及新的化合物提供了生产的理论依据和科学方法。
长春花(Catharanthus roseus)是一种重要的药用植物。目前已经从长春花中分离和鉴定出了130种以上的萜类吲哚生物碱(terpenoid indole alkaloids, TIAs),主要包括它波宁(tabersonine)、文多灵(vindoline)、长春质碱(catharanthine)和长春碱(vinblastine)等[2] [3] 。目前已知的是大多数长春花TIAs由于具有各自独特的药理作用而广泛应用于现代药学领域,二萜类生物碱——长春碱对多种癌症具有良好的治疗效果,已成为世界四大抗肿瘤原料药之一[4] 。同时,文多灵和长春质碱也是非常著名的一类降血脂类药物。鉴于在医学领域的广泛应用,长春花TIAs的生物代谢途径、调控特点及其机制的问题一直是研究植物次生代谢调控的重要内容[5] 。
2. 长春花生物碱及其合成途径
长春花TIAs类化合物的生物合成分为上游阶段和下游阶段[6] [7] 。上游阶段主要是合成TIAs的共同前体异胡豆苷(strictosidine, Str),下游阶段由该前体经过多种不同途径生成终端产物长春碱[8] 。在上游合成阶段中,异胡豆苷是以吲哚途径经多步酶促反应产生的色胺(tryptamine)和由类萜途径产生的裂环马钱子苷(secologanin)为前体经异胡豆苷合成酶(Strictosidine, STR)催化合成的[9] ;在下游合成阶段,以异胡豆苷为共同前体经过多步酶促反应生成文多灵和长春质碱,最后在新克隆和鉴定出的III型过氧化物酶(CrPrx1)的催化下耦合生成长春碱[10] -[12] 。在长春碱合成过程中,上游阶段的色氨酸脱羧酶(TDC)、异胡豆苷合成酶(STR),以及下游阶段的乙酰氧基文多灵4-脱羧酶(D4H),去乙酰文多灵4-O-转乙酰酶(DAT)及Ⅲ型过氧化物酶(CrPrx)是几种目前研究较为深入的长春碱及其前体合成关键酶[13] -[15] (图1)。
3. 长春花生物碱的代谢调控因子
植物的生长和发育过程是以细胞的增殖和分化为基础的,它不但促成了植物的形态建成,也赋予了植物在积累生物碱方面的组织细胞和发育特异性。研究表明,生物碱在植物体内代谢过程中具有严格的
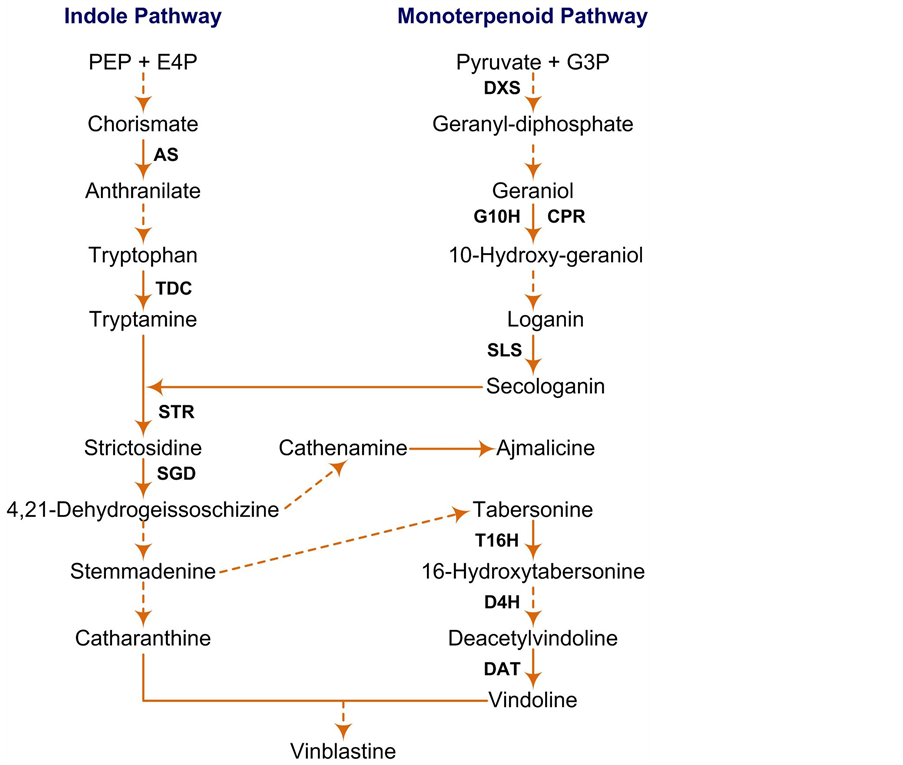
Figure 1. Terpenoids indoles alkaloid (TIAs) biosynthetic pathway in Catharanthus roseus
图1. 长春花萜类吲哚类生物碱(TIAs)生物合成途径
组织、发育和环境因子特异性,是植物化学生态和系统发育的信号分子。
3.1. 长春花生物碱代谢受组织调控
生物碱要保护植物就必须分布在植物最需要保护的地方以及积累足够高的浓度。100多年前,生物碱被发现和其他次生代谢产物一样总是以最高浓度分布在植物组织中最容易受到环境侵害的部位,比如嫩叶、芽尖及根的外表皮细胞等[16] 。单独的细胞或组织参与次生代谢产物的合成和积累成为植物的一个普遍特征。比如,蜜腺、香毛簇和其他分泌构造始于细胞表皮,它们是合成各种萜类化合物的主要场所。苯丙氨酸氨裂合酶和查尔酮合酶的表达与黄酮类化合物的生物合成有关,也局限在细胞的表皮。将能产尼古丁与不产尼古丁的烟草植物交互嫁接,说明这种生物碱主要在根部合成,经木质部转运到叶中。相似地,测定莨菪幼根中柱鞘中6β-羟基莨菪碱,揭示莨菪碱在运输到茎叶中被储存之前是在根中转变成莨菪胺[17] 。
长春花中各种生物碱的分布也具有其组织特异性。在细胞和组织中,底物和酶的积累、贮存及合成部位常常是分开的,即是以区域化进行的[6] 。细胞中各种细胞器和不同功能组织的分化均参与特异基因的表达和酶的活性调节,进而调节生物碱的合成和积累。有人认为长春花生物碱在液泡中多数以有机酸盐的形式存在,已经被证明了长春花生物碱的合成具有区室化的特征,比如乳汁管就是重要的合成生物碱的场所。研究表明,文多灵和二聚体生物碱存在于叶、茎中,而长春质碱在地下、地上部分均有分布[6] [7] [18] 。文多灵途径中,它波宁和它波宁之后的中间产物在植物体的根中也能被检测到,而在叶的乳汁管细胞中却检测不到。在文多灵途径后期阶段,几种关键的酶的表达,也显示了文多灵以及相关的几种作为中间产物的生物碱也是在特异性组织的调控下合成的[19] [20] 。
3.2. 长春花生物碱代谢受发育阶段调控
构成植物体的器官是由不同细胞类型组成的,细胞有组织地彼此联系构成了器官的特定功能。根据植物体的发育策略,每一类型的细胞都是由未分化的分生组织转化而来的。在分化的过程中通过组织中一系列复杂的信号被细胞感知的作用,来达到老幼细胞间的转化、定位以及与激素的平衡。长春花的发育过程通过其次生代谢物的积累引起细胞的分化。对幼苗和成熟的叶的研究表明植物体受到这种发育的调控[6] 。
生物碱在植物体内的积累常常是发育策略的一部分。长春花在发芽期间能够迅速地积累长春质碱、它波宁和文多灵,而在发芽后的几天后出现一个停滞期。运用RNA原位杂交和细胞免疫化学方法研究长春花的幼苗,其中几种关键酶的转录物在叶的远轴部分均有表达,但其随着叶的成熟而减少,其中d4h的mRNA可以在幼叶组织的上表皮中部分地表达,而在发育成熟的叶上表皮中却消失了,这说明由这些酶所诱导的文多灵途径中的部分生物碱受到发育阶段的调控[21] [22] 。用同样的方法研究长春花的成熟的叶,每一种关键的酶的表达与相应的幼苗相比均显著地减少,在发育中的长春花各组织中,生物碱的积累成上升趋势,这可能与幼苗的保护策略相关。St-Pierre等将长春花叶的纵切片分为基部、中部和尖端三部分,观察几种关键酶的mRNA表达,结果显示基部的表达水平最高,其次是中部,而尖端最低,这种呈梯度的表达现象说明了长春花生物碱在叶中含量呈梯度分布,而这种梯度与长春花叶的发育阶段相一致,叶基部较幼嫩而尖端相对较成熟,这个结果也证实了长春花生物碱受发育阶段的控制[6] 。文多灵生物合成早期阶段的两种酶(TDC和STR)在根尖的皮质细胞与幼叶中有所表达,而后期阶段的两种酶(D4H和DAT)主要分布在成熟叶、茎和花的乳汁管细胞和异细胞中,在根中没有表达,这说明生物碱的合成是在分生组织细胞中启动的。有数据显示,在成熟的种子中没有长春碱,而在生长4周的幼苗中却含有长春碱。随着进一步的生长,长春碱的含量也随之增加,在3个月时达到峰值,约12 μg/g DW [23] [24] 。
3.3. 长春花生物碱代谢受激素调控的研究进展
很多生物碱充当植物防御素的角色,在植物受到外来真菌攻击时会大量积累[25] ;一些组织培养细胞的细胞壁在受到外来真菌和酵母的刺激时其中的生物碱含量水平将大幅度提高,而这些生物碱的合成关键酶的转录或活性水平也在此过程被发现有很大的提高[26] 。
茉莉酸(jasmonic acid)在生物碱防御素启动过程中起着介导的作用。因为生物碱被认为是一种防御物质,那么提高内源茉莉酸的含量将诱导长春花萌发阶段体内生物碱的合成。外施甲基–茉莉酸能够明显地增加长春花幼苗中单萜吲哚生物碱的积累[27] 。研究表明,茉莉酸能够诱导单萜吲哚生物碱的合成,而不能影响长春花幼苗中长春碱的生物合成,茉莉酸是在所谓的“脂氧化途径”中产生的,并且增加了这条途径中一些酶的活性,如STR和TDC活性的增强。推测茉莉酸等小分子信号是作用于TDC和STR基因的启动子区激活基因的[28] -[30] 。茉莉酸甲酯的作用与茉莉酸相似,也可以刺激上述两种酶的活性使生物碱含量升高。水杨酸也作为一种信号分子,可使长春花幼苗的mRNA稳定,或阻止STR和TDC的mRNA合成[30] 。
乙烯(ethylene)作为一种植物激素,具有促进细胞扩大、促进果实成熟、促进器官脱落等生理作用。Vázquez-Flota认为乙烯对长春花生物碱的积累也有一定的影响,它可以使阿吗碱的含量增高,而同样的处理对长春质碱却没有影响。乙烯处理过的幼苗中,TDC活性迅速增大,48 h内它波宁却没有变化,说明乙烯的影响发生在一定的阶段:或者是色胺到它波宁的阶段,或者是形成裂环马钱子苷阶段[28] [31] -[34] 。
生长素(auxin)对长春花生物碱的合成有负调控作用,最近的研究也表明生长素能快速抑制生物碱合成酶的编码基因的表达。对无生长素培养基条件下的长春花组织培养细胞外施生长素时,其生物碱合成中的TDC和STR的基因表达会迅速受到抑制,之后去掉生长素,mRNA水平又可恢复[33] [34] 。
4. 总结与展望
生物碱作为植物次生代谢产物中的一种,被认为具有应对其环境保护植物体的功能,它是植物在长期进化过程中对生态环境适应的结果,所以许多生物碱被称为植保素。在漫长的生物进化过程中,植物在一定的环境中合成一定的生物碱使自身处于有利地位增加繁殖和存活的机会,同时,产生的生物碱伴随着该种植物也获得了发展。长春花中各种生物碱在复杂的代谢活动中的生物学功能尚不十分清楚,但现有的研究结果表明,长春花中一些生物碱的存在可能代表着一种化学防御机制,也可能与发育策略有关。为了我们更好地了解长春花生物碱代谢生物学,有关长春花生物碱的生物学功能的研究仍需继续进行,并且此方面的探索具有广阔的发展前景。
项目基金
感谢林业公益性行业科研专项经费(20120460108)、国家林业局林业科学技术推广项目([2012] 46)和东北林业大学青年拔尖人才支持计划(PYTT-1213-07)的资助。
参考文献 (References)
- Dutta, A., Batra, J., Pandey-Rai, S., Singh, D., Kumar, S. and Sen, J. (2005) Expression of terpenoid indole alkaloid biosynthetic pathway genes corresponds to accumulation of related alkaloids in Catharanthus roseus (L.) G. Don, Planta, 220, 376-383.
- Glenn, W.S., Runguphan, W. and O’Connor, S.E. (2012) Recent progress in the metabolic engineering of alkaloids in plant systems. Current Opinion in Biotechnology, 24, 354-365.
- Yang, C.Q., Fang, X., Wu, X.M., Mao, Y.B., Wang, L.J. and Chen, X.Y. (2012) Transcriptional regulation of plant secondary metabolism. Journal of Integrative Plant Biology, 54, 703-712.
- Asano, M., Harada, K., Yoshikawa, T., Bamba, T. and Hirata, K. (2010) Synthesis of anti-tumor dimeric indole alkaloids in catharanthus roseus was promoted by irradiation with near-ultraviolet light at low temperature. Bioscience, Biotechnology, and Biochemistry, 74, 386-389.
- Zhou, M.L., Shao, J.R. and Tang, Y.X. (2009) Production and metabolic engineering of terpenoid indole alkaloids in cell cultures of the medicinal plant Catharanthus roseus (L.) G. Don (Madagascar periwinkle). Biotechnology and Applied Biochemistry, 52, 313-323.
- St-Pierre, B., Vazquez-Flota, F.A. and De Luca, V. (1999) Multicellular compartmentation of catharanthus roseus alkaloid biosynthesis predicts intercellular translocation of a pathway intermediate. Plant Cell, 11, 887-900.
- Scragg, A.H. (1999) Alkaloid accumulation in Catharanthus roseus suspension cultures. Methods in Molecular Biology, 111, 393-402.
- Rischer, H., Oresic, M., Seppanen-Laakso, T., Katajamaa, M., Lammertyn, F., Ardiles-Diaz, W., Van Montagu, M.C., Inze, D., Oksman-Caldentey, K.M. and Goossens, A. (2006) Gene-to-metabolite networks for terpenoid indole alkaloid biosynthesis in Catharanthus roseus cells. Proceedings of the National Academy of Sciences of the United States of America, 103, 5614-5619.
- de Waal, A., Meijer, A.H. and Verpoorte, R. (1995) Strictosidine synthase from Catharanthus roseus: Purification and characterization of multiple forms. Biochemical Journal, 306, 571-580.
- Kumar, S., Jaggi, M., Taneja, J. and Sinha, A.K. (2011) Cloning and characterization of two new Class III peroxidase genes from Catharanthus roseus. Plant Physiology and Biochemistry, 49, 404-412.
- Jaggi, M., Kumar, S. and Sinha, A.K. (2011) Overexpression of an apoplastic peroxidase gene CrPrx in transgenic hairy root lines of Catharanthus roseus. Applied Microbiology and Biotechnology, 90, 1005-1016.
- Sottomayor, M., Lopez-Serrano, M., DiCosmo, F. and Ros Barcelo, A. (1998) Purification and characterization of alpha-3’,4’-anhydrovinblastine synthase (peroxidase-like) from Catharanthus roseus (L.) G. Don. FEBS Letters, 428, 299-303.
- Sottomayor, M., Duarte, P., Figueiredo, R. and Ros Barcelo, A. (2008) A vacuolar class III peroxidase and the metabolism of anticancer indole alkaloids in Catharanthus roseus: Can peroxidases, secondary metabolites and arabinogalactan proteins be partners in microcompartmentation of cellular reactions? Plant Signaling & Behavior, 3, 899-901.
- Costa, M.M., Hilliou, F., Duarte, P., Pereira, L.G., Almeida, I., Leech, M., Memelink, J., Barcelo, A.R. and Sottomayor, M. (2008) Molecular cloning and characterization of a vacuolar class III peroxidase involved in the metabolism of anticancer alkaloids in Catharanthus roseus. Plant Physiology, 146, 403-417.
- Kumar, S., Dutta, A., Sinha, A.K. and Sen, J. (2007) Cloning, characterization and localization of a novel basic peroxidase gene from Catharanthus roseus. FEBS Letters, 274, 1290-1303.
- Shukla, A.K., Shasany, A.K., Verma, R.K., Gupta, M.M., Mathur, A.K. and Khanuja, S.P. (2010) Influence of cellular differentiation and elicitation on intermediate and late steps of terpenoid indole alkaloid biosynthesis in Catharanthus roseus. Protoplasma, 242, 35-47.
- Oudin, A., Mahroug, S., Courdavault, V., Hervouet, N., Zelwer, C., Rodriguez-Concepcion, M., St-Pierre, B. and Burlat, V. (2007) Spatial distribution and hormonal regulation of gene products from methyl erythritol phosphate and monoterpene-secoiridoid pathways in Catharanthus roseus. Plant Molecular Biology, 65, 13-30.
- Vazquez-Flota, F., De Luca, V., Carrillo-Pech, M., Canto-Flick, A. and de Lourdes Miranda-Ham, M. (2002) Vindoline biosynthesis is transcriptionally blocked in Catharanthus roseus cell suspension cultures. Molecular Biotechnology, 22, 1-8.
- Murata, J. and De Luca, V. (2005) Localization of tabersonine 16-hydroxylase and 16-oh tabersonine-16-o-methyltransferase to leaf epidermal cells defines them as a major site of precursor biosynthesis in the vindoline pathway in Catharanthus roseus. Plant Jouenal, 44, 581-594.
- Hernandez-Dominguez, E., Campos-Tamayo, F. and Vazquez-Flota, F. (2004) Vindoline synthesis in in vitro shoot cultures of Catharanthus roseus. Biotechnology Letters, 26, 671-674.
- Makhzoum, A., Petit-Paly, G., St Pierre, B. and Bernards, M.A. (2011) Functional analysis of the dat gene promoter using transient Catharanthus roseus and stable Nicotiana tabacum transformation systems. Plant Cell Reports, 30, 1173-1182.
- Guirimand, G., Guihur, A., Poutrain, P., Hericourt, F., Mahroug, S., St-Pierre, B., Burlat, V. and Courdavault, V. (2011) Spatial organization of the vindoline biosynthetic pathway in Catharanthus roseus. Journal of Plant Physiology, 168, 549-557.
- Wang, Q., Yuan, F., Pan, Q., Li, M., Wang, G., Zhao, J. and Tang, K. (2010) Isolation and functional analysis of the Catharanthus roseus deacetylvindoline-4-o-acetyltransferase gene promoter. Plant Cell Reports, 29, 185-192.
- Murata, J., Roepke, J., Gordon, H. and De Luca, V. (2008) The leaf epidermome of Catharanthus roseus reveals its biochemical specialization. Plant Cell, 20, 524-542.
- Kaltenbach, M., Schroder, G., Schmelzer, E., Lutz, V. and Schroder, J. (1999) Flavonoid hydroxylase from Catharanthus roseus: cDNA, Heterologous expression, enzyme properties and cell-type specific expression in plants. Plant Journal, 19, 183-193.
- Mishra, S., Triptahi, V., Singh, S., Phukan, U.J., Gupta, M.M., Shanker, K. and Shukla, R.K. (2013) Wound Induced tanscriptional regulation of benzylisoquinoline pathway and characterization of wound inducible PsWRKY Transcription factor from Papaver somniferum. PLoS ONE, 8, Article ID: e52784.
- De Geyter, N., Gholami, A., Goormachtig, S. and Goossens, A. (2012) Transcriptional Machineries in jasmonate-elicited plant secondary metabolism. Trends in Plant Science, 17, 349-359.
- Vazquez-Flota, F.A. and De Luca, V. (1998) Jasmonate Modulates developmentand light-regulated alkaloid biosynthesis in Catharanthus roseus. Phytochemistry, 49, 395-402.
- Endt, D.V., Silva, M.S.E., Kijne, J.W., Pasquali, G. and Memelink, J. (2007) Identification of a Bipartite jasmonateresponsive promoter element in the Catharanthus roseus ORCA3 Transcription factor gene that interacts specifically with AT-hook DNA-binding proteins. Plant Physiology, 144, 1680-1689.
- Idrees, M., Naeem, M., Aftab, T., Khan, M.M. and Moinuddin, (2013) Salicylic acid restrains nickel toxicity, improves antioxidant defence system and enhances the production of anticancer alkaloids in Catharanthus roseus (L.). Journal of Hazardous Materials, 252-253, 367-374.
- Vazquez-Flota, F.A. and De Luca, V. (1998) Developmental and Light regulation of desacetoxyvindoline 4-hydroxylase in Catharanthus roseus (L.) G. Don. . Evidence of a multilevel regulatory mechanism. Plant Physiology, 117, 1351-1361.
- Vazquez-Flota, F.A., St-Pierre, B. and De Luca, V. (2000) Light Activation of vindoline biosynthesis does not require cytomorphogenesis in Catharanthus roseus seedlings. Phytochemistry, 55, 531-536.
- Amini, A., Glevarec, G., Andreu, F., Rideau, M. and Creche, J. (2009) Low Levels of gibberellic acid control the biosynthesis of ajmalicine in Catharanthus roseus cell suspension cultures. Planta Medica, 75, 187-191.

NOTES
*通讯作者。