Botanical Research
Vol.04 No.03(2015), Article ID:15574,10
pages
10.12677/BR.2015.43007
The Effects of Copper Stress and the Involved Role of Ethylene on the Growth and Physiological Metabolism of Catharanthus roseus
*通讯作者。
Ling Liu, Yajie Pan, Meijiao Gao, Xiaorui Guo*
Key Laboratory of Forest Plant Ecology of Northeast Forestry University, Ministry of Education, Harbin Heilongjiang
Email: *xruiguo@nefu.edu.cn
Received: Jun. 10th, 2015; accepted: Jun. 26th, 2015; published: Jun. 30th, 2015
Copyright © 2015 by authors and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY).
http://creativecommons.org/licenses/by/4.0/



ABSTRACT
Copper is the essential nutrient for the growth and development of plants. Here, a medical plant Catharanthus roseus was subjected to different concentrations of copper plus with exogenous ethylene, investigating their cooperative effects on plant growth, primary metabolism, accumulation and transportation of Cu, as well as secondary metabolisms. Our results showed that the treatment with low level of Cu decreased chlorophyll content and photosynthetic rate. In addition, large amounts of Cu was accumulated in roots and brought about obvious hurt on root growth. In this case, the plant was able to actively transfer Cu from mature tissues to young ones. When exogenous ethylene was applied, the accumulation of Cu in detected tissues was decreased, partly reducing the physiological hurt of copper stress on plant and largely promoting the Cu transport rate from mature leaves to young tissues. It was concluded that the copper stress exerted an obviously adverse effect on plant primary and secondary metabolism. An increased exogenous ethylene supply could not only alleviate the inhibitory effect of copper stress on plant growth, but enhance vinblastine accumulation in plants.
Keywords:Catharanthus roseus, Copper Stress, Ethephon, Accumulate and Transport, Secondary Metabolism

铜胁迫与外源乙烯相互作用对长春花幼苗生长和生理代谢的影响
刘灵,潘亚婕,高媚娇,郭晓瑞*
东北林业大学森林植物生态学教育部重点实验室,黑龙江 哈尔滨
Email: *xruiguo@nefu.edu.cn
收稿日期:2015年6月10日;录用日期:2015年6月26日;发布日期:2015年6月30日

摘 要
铜是植物生长发育所必需的营养元素。本文以药用植物长春花(Catharanthus roseus)为材料,从长春花在铜胁迫的逆境条件下培养入手,并且辅助以外源乙烯调控,研究其对长春花初生代谢、Cu的富集和转运以及次生代谢等方面的协同效应。当铜胁迫浓度较低时叶绿素含量减少导致光合作用减弱;根部对Cu有着较强的富集能力,并且Cu在长春花植株体内由成熟组织向幼嫩组织转运率较高,在此基础上加入外源乙烯利后,降低了植株各组织部位对铜的富集能力,降低了铜胁迫对长春花植株的胁迫伤害,促进了铜由成熟叶片向幼嫩组织的转运率。这些结果表明,铜胁迫对长春花初生和次生代谢具有显著的抑制作用,外源添加乙烯不但可以缓解铜胁迫引起的生长抑制和生理伤害,同时对长春花叶片中生物碱的合成积累具有协同促进效应。
关键词 :长春花,铜胁迫,乙烯,富集转运,次生代谢

1. 前言
对植物来说,Cu是植物生长发育必需的微量营养元素,是多酚氧化酶、细胞色素氧化酶及抗坏血酸氧化酶等多种酶类的组成成分之一 [1] ;然而过量的铜将产生重金属胁迫影响植物的形态建成和生理生化过程。在形态建成和发育上,主要表现根长降低,叶片数量减少并产生较低的生物量,同时叶片发黄,叶片脉间失绿 [2] [3] 。在生理上,重金属影响植物最直接的表现是叶绿素含量减少导致光合作用减弱 [4] 。这些生理代谢过程的变化在植物适应铜胁迫过程中可能发挥着重要的调控功能,需要进一步研究。此外,随着工业发展,重金属对土壤环境的污染日益严重,据报道农业耕地铜杀菌剂使用不当也可能污染土壤 [6] ,Cu作为重要的重金属污染物,以其毒性强,危害大,在植物体内易积累,难降解的特性逐渐吸引了国内外许多研究者的关注 [5] 。对铜的毒害机制的研究对植物正常的生理代谢及生长发育、作物产量的提高、品质的改善都有重要意义。
乙烯利(Ethephon,ET)作为植物的成熟激素是植物体内目前已知的五大类激素之一,大量的工作已证明从种子萌发到果实成熟或个体衰老整个生长发育过程中,乙烯都参与并起着重大的调节作用 [7] - [11] 。因此,研究外源激素乙烯对植物从分子到生态系统的影响成为一个热点科学问题。夹竹桃科(Apocynaceae)长春花属(Catharanthus)药用植物长春花(Catharanthus roseus (L.) G. Don)生殖能力强,不同生境下的长春花植株在生活史过程中表现出较强的可塑性和耐受性,因而是研究植物生理生态学较好的材料之一。同时长春花体内含有显著抗癌药用活性的长春碱、长春新碱等100 多种生物碱,是国际上研究和应用最多的抗癌植物药源之一,而长春花体内生物碱含量与其环境影响因子的特征紧密相连 [12] 。我们前期的研究发现,重金属胁迫能够显著促进长春花叶片中吲哚类生物碱含量的增加 [13] ,但关于Cu的作用机理尚需进一步的研究。此外,研究单一因子的作用难以全面理解由于重金属污染而产生的生物学效应,而Cu胁迫和外源乙烯协同作用对长春花生长发育以及生理代谢的影响,特别是两者同时增强对长春花中药用活性成分长春碱含量的影响尚未见报道。因此本研究以药用植物长春花作为研究对象,深入研究外源铜胁迫下长春花的初生代谢;Cu的吸收、转运;次生代谢及分子机制。系统研究乙烯调控长春花响应铜胁迫的生理生化机制,为进一步研究长春花中各项生理指标响应外源铜胁迫条件下的变化以及在此基础上外源乙烯的调控作用提供参考依据。
2. 材料与方法
2.1. 实验材料与处理
本实验选用浙江富阳长春花种植基地的优良长春花种子,为保证长春花生长环境的统一性从播种到处理都在东北林业大学森林生态学教育部重点实验室人工气候箱(ZPW-400,China)内培养,为保证长春花生长环境的统一性从播种到处理均在温室培养,试验中选取长势相同的长春花幼苗进行培养,培养条件为光照6级(day)/光照0级(night),光照时间为6:00~18:00,湿度80%,温度28℃ (day)/25℃ (night)。幼苗在长春花发芽后移栽于装有珍珠岩、下部有孔的黑色营养杯中,定期对幼苗浇灌1/2浓度的Hoagland’s营养液,并用空调调节室内温度,使之最适宜长春花生长。待长出第三对叶片开始进行外源铜和乙烯的处理。
本文通过在1/2 Hoagland营养液的基础上加入CuSO4∙5H2O (分析纯),乙烯利来处理长春花幼苗。根据预实验筛选Cu浓度定为0,200,300,400,600和800 µM∙L−1,而乙烯利的浓度选择50 µmol∙L−1,共设计6组实验,并在处理一周后分别取样并测定形态及各项生理代谢指标。
2.2. 形态参数和生物量测定方法
经胁迫处理长春花幼苗在形态上表现出生长差异。取样时每种处理随机选取三株,用直尺(精确度为1 mm)测量其株高、根长;然后用分析天平(精确度为0.0001 g)分别称量每株样品的根、茎、叶的鲜重。将称量后的样品按照处理方法不同分别放入信封中并标注,置于70℃烘箱中烘干至恒重(3 d左右),用分析天平(精确度为0.0001 g)分别称量根、茎、叶的干重。每个实验处理组各个参数分别取其平均值。
参照文献 [15] [16] 方法进行叶绿素a (Chl a)、叶绿素b (Chl b)含量的测定:用打孔器(半径为0.25 cm)避开粗大的叶脉在长春花新鲜叶片上取下10片圆形小叶片用分析天平(精确度为0.0001 g)称取并记录质量,然后置于玻璃试管中,再加入5 mL DMSO (二甲基亚砜),60℃恒温水浴条件下避光浸提实验材料2小时,收集上清液待测。以DMSO为空白对照,使用紫外可见分光光度计(Shimadzu UV-2550,Japan)分别测定提取液在480、649、665 nm的吸光值OD,然后计算叶绿素a、叶绿素b的含量。
计算公式为:

2.3. 生理代谢指标的测定
取上述烘干材料,用研钵研磨成粉末,各部位植物组织粉末各称取0.1 g,分析天平精密称定(精确至0.0001 g),加入20 mL混合酸(硝酸:高氯酸 = 4:1)到1 L大试管中,过夜放置,用20孔消化炉消解2~3 h,直至冒白烟,硝化液呈无色透明或略带黄色,冷却后,定容至25 mL容量瓶中,稀释至适合浓度,用原子吸收光谱仪测定消化过样品中金属离子浓度,再根据硝化液离子浓度,硝化液体积、叶片干物质重量换算叶片、茎、根中离子的真实含量。待计算出Cu含量后再计算植株各部位之间的转运系数 [14] 。
计算公式为:
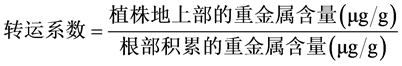
2.4. 长春花生物碱的测定
1) 长春花生物碱的提取方法
参照文献 [17] ,取70℃下烘干至恒重的长春花根、茎、叶(上部叶片、中部叶片、下部叶片)用分析天平分别称量其干重,再取根和叶两部分用研钵分别研磨成粉末,每种处理用分析天平(精确到0.0001 g)取样约0.1 g粉末于10 mL离心管中,精确称量后加入5 mL的甲醇,超声提取20 min,8000 rmp离心10 min后提取上清液。再将沉淀残渣依次加入3 mL、2 mL甲醇重复提取2次,合并上清液,在40℃条件下负压空化强化提取至干。样品以1 mL甲醇复溶,超声20 min使挂壁的提取物充分溶解于甲醇,转入2.5 mL离心管中,12,000 rmp离心10 min后提取上清液,再经0.22 µm微孔滤膜过滤后供HPLC检测。
2) 色谱条件
色谱柱:Waters 5C18-AR-Ⅱ(4.6 × 150 mm);
流动相:A相,甲醇;B相,磷酸二乙胺:990 mL超纯水 + 10 mL二乙胺(磷酸调pH至7.3~7.5);A:B = 68:32;
流速:1.0 mL/min;检测波长:220 nm;柱温:25℃;进样量:20 µL。
长春花生物碱关键酶基因的测定方法参照文献 [18] 方法用实时荧光定量PCR进行测定。
2.5. 数据处理
应用Excel和SPSS软件进行相关数据的分析和处理,并采用单因素方差分析(One-Way ANOVA)检验各处理间的差异显著性。
3. 结果
3.1. 长春花幼苗响应铜胁迫条件下的初生代谢及乙烯的调控作用
乙烯的加入影响了铜胁迫对长春花的伤害作用,由表1可见,株高在50 µM ET > CK (1.17),说明乙烯在一定程度上刺激了植株地上部分的生长,但是200 µM Cu > 200 µM Cu + 50 µM ET,说明在200 µM Cu胁迫条件上加入乙烯后反而抑制了植株地上部分的生长;根长在加入乙烯后表现为明显受到抑制;根冠比在加入乙烯处理后200 µM Cu > 200 µM Cu + 50 µM ET > CK,说明在200 µM Cu处理条件下加入乙烯后降低了植株根冠比。此外,加入乙烯后影响了铜胁迫对长春花的伤害作用,株高50 µM ET > CK (1.17)说明乙烯在一定程度上刺激了植株地上部分的生长,但是200 µM Cu > 200 µM Cu + 50 µM ET说明在200 µM Cu胁迫条件上加入乙烯后反而抑制了植株地上部分的生长;根长在加入乙烯后表现为明显受到抑制;根冠比在加入乙烯处理后200 µM Cu > 200 µM Cu + 50 µM ET > CK,说明在200 µM Cu处理条件下加入
Table 1. Regulation of ethylene on the root cap ratio of Catharanthus roseus in copper stress
表1. 乙烯对铜胁迫下长春花根冠比的调控
乙烯后降低了植株根冠比。总的来说在铜胁迫基础上加入乙烯后明显抑制了长春花的根长,但却促进了株高的生长,对于根冠比来说则表现出低促高抑的变化趋势。
植物的根系耐性指数,即加重金属处理的植株根长与对照的植株根长比值,能较好地反应植物对重金属的耐性 [19] 。由表2可见,只有400 µM Cu + 50 µM ET处理条件下长春花植株耐受系数为1.02,其余各处理条件下耐受性系数均小于1大于0.9,说明在外源铜胁迫条件下加入乙烯可以达到增加长春花植株耐受性的效果。长春花植株地上部干物质的积累能力在加入外源乙烯调控的作用下只有400 µM Cu + 50 µM ET > 400 µM Cu,其余各组处理在加入乙烯后均有所下降。
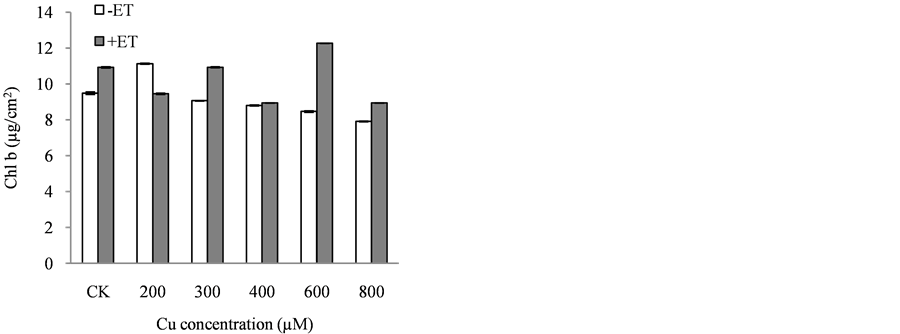
叶绿素是绿色植物进行光合作用的主要色素,叶绿素含量同光合作用的关系十分密切,其含量在一定程度上反映植物同化物质的能力。由图1可见,在铜胁迫处理条件下加入乙烯后叶绿素a、叶绿素b、总叶绿素的含量均发生不同程度的变化,除200 µM Cu > 200 µM Cu + 50 µM ET以外,其余各处理在加入乙烯后都提高了叶绿素a、叶绿素b以及总叶绿素的含量,缓解外源铜对叶片中叶绿素的降解或破坏作用。叶绿素a/b在加入乙烯后也出现不同程度的上升趋势。
3.2. 长春花幼苗响应铜胁迫条件下Cu富集、转运及乙烯的调控作用
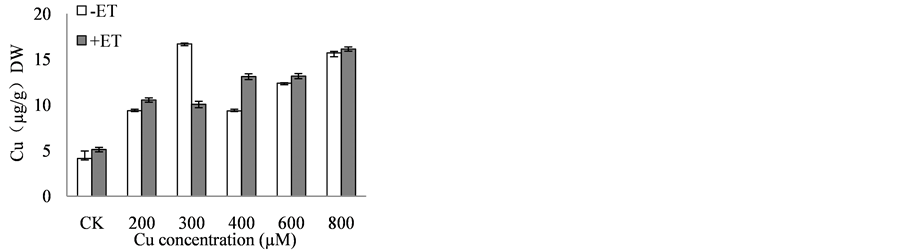
在外源铜胁迫条件下加入乙烯后长春花植株的根、茎、叶对Cu的富集能力表现各不相同,由图2可见,根部当Cu < 300 µM时加入乙烯后增加了对Cu的富集,而当Cu处理浓度高于300 µM时,加入乙烯后不同程度减少了根部对Cu的吸收;茎中除300 µM Cu + 50 µM ET降为300 µM Cu的60%,其余加入乙烯后都有略微的增加;加入外源乙烯后叶片中Cu的积累明显增加,其中800 µM Cu + 50 µM ET是800 µM Cu的1.39倍。总的来说,长春花在铜胁迫处理条件下加入乙烯后,增强了茎和叶片对Cu的积累能力,但却明显缓解了Cu对植株的根部伤害,从而减少了Cu在长春花植株体内的富集。
乙烯同时参与长春花幼苗植株根、茎、叶在铜胁迫下对Cu的转运。由图3可见,外源乙烯对长春花植株响应外源铜胁迫条件下各组织对Cu的转运率表现为:根→茎的转运率CK最高,50 µM ET < CK,200 µM Cu > 300 µM Cu > 300 µM Cu + 50 µM ET,说明在铜胁迫处理条件下加入乙烯后降低了根→茎的
Table 2. Regulation of ethylene on the survivability of Catharanthus roseus in copper stress
表2. 乙烯对铜胁迫下长春花耐受性的调控

 (a) (b)
(a) (b)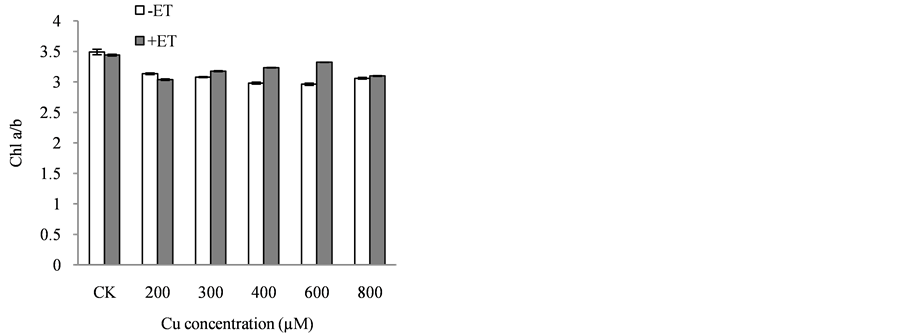
 (c) (d)
(c) (d)
Figure 1. Regulation of ethylene on the chlorophyll of Catharanthus roseus on copper stress (a) Chl a;(b) Chl b; (c) Chl a/b; (d) Chl a + b
图1. 乙烯对铜胁迫下长春花光合色素的调控。(a) 叶绿素a;(b) 叶绿素b;(c) 叶绿素a/b;(d) 总叶绿素

 (a) (b)
(a) (b) (c)
(c)
Figure 2. Regulation of ethylene on Cu accumulate of Catharanthus roseus in copper stress. (a) Content of Cu in root; (b) content of Cu in stem; (c) content of Cu in leaf
图2. 乙烯对长春花响应铜胁迫下对Cu富集的调控。(a) 根中Cu含量;(b) 茎中Cu含量;(c) 叶中Cu含量

 (a) (b)
(a) (b)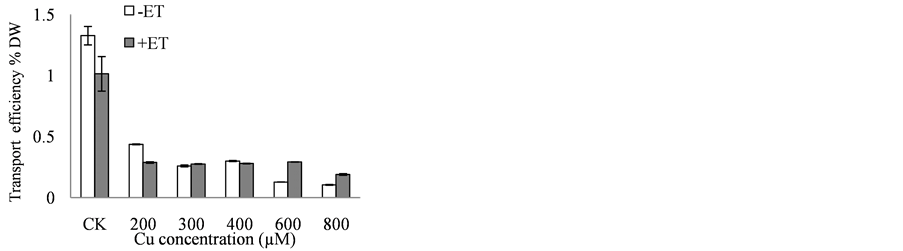 (c)
(c)
Figure 3. Cu transport of Catharanthus roseus in copper stress. (a) Transport efficiency of root to stem; (b) transport efficiency of stem to leaf; (c) transport efficiency of overground part
图3. 长春花响应外源铜条件下对Cu的转运。(a) 根→茎的转运率;(b) 茎→叶的转运率;(c) 地上部分总转运率
转运率;加入外源乙烯后茎→叶的转运能力在800 µM Cu + 50 µM ET达到最高,是CK的9.44倍,说明加入乙烯后茎→叶的转运能力整体上随着铜处理浓度的增加而逐渐增强;地上部分总转运率变化趋势与根→茎的转运率变化趋势基本相同。
3.3. 长春花幼苗响应铜胁迫条件下次生代谢的变化及乙烯的调控作用
作为药用植物长春花全株中最上部也是最幼嫩的叶片文多灵含量明显高于中部叶片和下部叶片,无论对长春花植株作何种胁迫处理,上部叶片中文多灵的含量都近乎于中部叶片和下部叶片的两倍。由图4(a)可见,在同浓度Cu胁迫条件下加入乙烯增加了上部叶片中文多灵的含量,降低了中部叶片和下部叶片中文多灵的含量。由图4(b)可知,不同胁迫处理下长春花幼苗,上部叶片中长春碱含量随着处理浓度的改变而逐步减低,中部叶片中长春碱含量在300 µM Cu、300 µM Cu + 50 µM ET处理时下降明显,下部叶片中长春碱含量有明显变化随着处理浓度的改变而逐步减低。加入外源乙烯后,上部叶片中长春碱含量无明显增加,中部叶片和下部叶片中长春碱含量在加入乙烯后呈现出相同的规律性。长春碱在长春花植株体内处于不稳定的动态平衡。由图4(c)可知,长春花响应不同胁迫条件下叶片中长春质碱含量变化显著,与叶片中文多灵含量的变化趋势基本相同,上部叶片中长春质碱的含量显著高于中部叶片和下部叶片中长春质碱的含量,并且呈现出相似的规律,长春质碱在长春花植株体内处于比较稳定的动态平衡。由图4(d)可知,不同胁迫条件下长春花叶片中生物碱含量:文多灵含量 > 长春质碱含量 > 长春碱含量,在300 µM Cu处理下,长春花叶片的文多灵和长春质碱的含量明显减低,是CK的58%、50%;而在300 µM Cu + 50 µM ET处理时长春花叶片中生物碱都明显减低。
在铜胁迫的处理基础上加入乙烯后提高了长春花文多灵合成途径中关键酶基因的表达量。如图5可见,单独施以外源ET,文多灵合成途径基因的表达水平与对照组没有显著的区别。单独施以Cu处理则与ET作用正好相反,显著的抑制了D4H和DAT的表达,但加入乙烯后基因的表达量明显升高。三个关键酶基因比较发现,T16H较为积极地响应外源胁迫,并且Cu和乙烯组合胁迫下,其表达量近似对照组的两倍。
4. 讨论
长春花因含有显著抗癌药用活性的长春碱、长春新碱等而成为国际上研究和应用最多的抗癌植物药源之一 [13] - [18] 。已有报道表明,生物碱在植物中的积累受到多种环境胁迫因子的诱导植 [19] 。关于长春花的研究目前主要集中在长春花生物碱代谢的分子调控和组织培养等方面 而对其环境调控的生理生态学方面研究较缺乏 [19] 。本研究主要从生理代谢层次上研究了重金属铜胁迫对长春花初生代谢、次生代谢等重要生理代谢物质的含量动态变化的综合影响,以及在此基础加入外源乙烯对铜胁迫条件下长春花的调控作用,围绕铜胁迫和外源乙烯双重因子对植物的影响以探讨两者综合因素对植物生长发育等多方面的影响,同时也为长春花的人工栽培提供理论指导。
实验发现,药用植物长春花对外源Cu胁迫的耐受性较好,对Cu的富集和转运力较强;而加入外源乙烯利后对长春花响应铜胁迫有一定的抑制作用,包括植株根部对Cu的耐受性、地上部干物质的积累以及Cu在植株体内的富集和转运均不同程度上受到抑制。说明乙烯利不但可以作为植物果实的催熟激素,还可以降低铜 对长春花的伤害和胁迫作用。叶绿素是绿色植物进行光合作用的主要色素,叶绿素含量同光合作用的关系十分密切,其含量在一定程度上反映植物同化物质的能力[19] 。实验表明,低浓度铜可以增加叶绿素含量,但随着铜浓度的增加,叶绿素含量逐渐降低,是铜加速了叶绿素的降解或者是破坏了叶绿素的结构。在铜胁迫处理条件下加入乙烯后提高了叶绿素a、叶绿素b、总叶绿素的含量,缓解了外源铜对叶绿素的降解或破坏作用。

 (a) (b)
(a) (b)
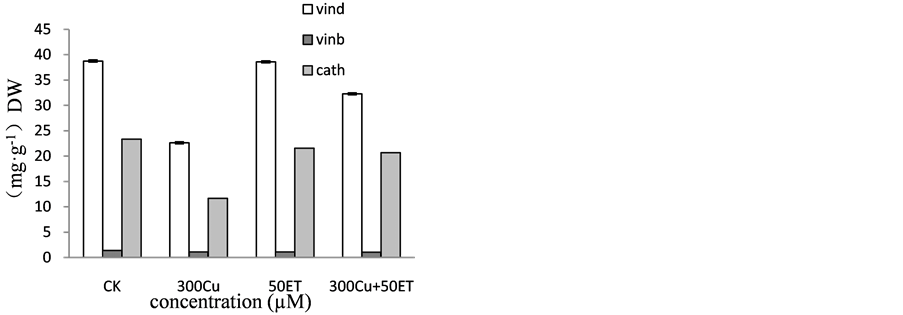 (c) (d)
(c) (d)
Figure 4. Alkaloid content changes of leaf of Catharanthus roseus in different stress. (a) Vind content (b) Vinb content (c) Cath content (d) alkaloid content
图4. 不同胁迫条件下长春花不同叶位中生物碱含量的比较。(a) 文多灵含量 (b) 长春碱含量 (c) 长春质碱 (d) 生物碱总和

Figure 5. Relative expression of alkaloid biosynthesis genes of Catharanthus roseus in different stress
图5. 不同胁迫条件下长春花生物碱合成基因相对表达量
在外源铜和乙烯处理下长春花幼苗可以促进长春花吲哚生物碱含量的提高[18] -[20] 。本研究发现Cu胁迫显著促进长春花生物碱的积累。同时增加外源乙烯进一步促进了其积累。铜和乙烯的协同效应不仅在代谢水平上有显著的促进作用,在基因表达水平上也有相似的作用。在铜胁迫的处理基础上加入乙烯后提高了长春花生物合成途径中多个关键酶基因的表达量,从而更好地促进了文多灵的合成,并且促进了文多灵和长春质碱合成长春碱,从而提高了长春花吲哚生物碱的含量,其中长春碱含量的提高最为显著。外源Cu胁迫和乙烯组合调控对长春花植株生物碱的积累具有诱导增效作用。本次研究发现:铜胁迫条件下长春花初生代谢主要表现为低促高抑的现象,即低浓度铜有利于长春花的生长,体现在植株地上部分生长旺盛,加入外源乙烯后,缓解了铜对长春花植株的伤害,主要表现在生长量有所增加,叶绿素含量增加导致光合作用增强;在铜胁迫条件下根部对Cu有着较强的富集能力,并且加入乙烯后减轻了外源铜对长春花植株的伤害;长春花植株生物碱含量变化符合一般生物碱的变化规律:幼嫩组织中含量较高,随着组织逐渐成熟,含量逐渐降低,以最大效率维持植物正常的发育和生长。外源铜和乙烯处理长春花幼苗可以促进长春花吲哚生物碱含量的提高,同时也提高了长春花生物合成途径中多个关键酶基因,从而更好地促进了文多灵的合成,并且促进了文多灵和长春质碱合成长春碱,从而提高了长春花吲哚生物碱的含量,其中长春碱含量的提高最为显著。可以看出长春花在适应铜和乙烯协同作用过程中,不仅在形态上表现出较强的可塑性和耐受性,而且在初生代谢和次生代谢方面也呈现出显著的变化,特别是铜和乙烯组合作用下促进了长春花的药用活性成分生物碱的含量大量增加。长春花培育的目的产物的增加对大规模的生产实践起到指导作用。
基金项目
国家自然科学基金项目 (31400337)。
文章引用
刘 灵,潘亚婕,高媚娇,郭晓瑞, (2015) 铜胁迫与外源乙烯相互作用对长春花幼苗生长和生理代谢的影响
The Effects of Copper Stress and the Involved Role of Ethylene on the Growth and Physiological Metabolism of Catharanthus roseus. 植物学研究,03,47-57. doi: 10.12677/BR.2015.43007
参考文献 (References)
- 1. 徐勤松, 施国新, 王学, 等 (2006) 镉、铜和锌胁迫下黑藻活性氧的产生及抗氧化酶活性的变化研究. 水生生物学报, 1, 107-112.
- 2. Vaillant, N., Monnet, F., Hitmi, A., et al. (2005) Comparative studyof responses in four Datura species to a zinc stress. Chemosphere, 59, 1005-1013.
- 3. Muschitz, A., Faugeron, C. and Morvan, H. (2009) Re-sponse of cultured tomato cells subjected to excess zinc: Role of cell wall in zinc compartmentation. Acta Physiol Plant, 31, 1197-1204.
- 4. 林春野 (1996) 重金属Cu、Cd、Zn的陆生植物毒性比较研究. 农业环境保护, 6, 266-267.
- 5. 周以富, 董亚英 (2003) 几种重金属土壤污染及其防治的研究进展. 环境科学动态, 1, 15-16.
- 6. 李元, 王焕校, 吴云树, 等 (1992) Cd、Fe及其复合污染对烟草叶片几项生理指标的影响. 生态学报, 2, 147-153.
- 7. Christoffersen, R.E., Warm, E., Laties, G.G., et al. (1982) Gene expression during fruit ripening in avo-cado. Planta, 155, 52-57.
- 8. 刘道宏 (1983) 植物叶片的衰老. 植物生理学通讯, 2, 14-19
- 9. Brady, C., McGlsson, B. and Speirss, J. (1987) In: Nevins, D.J. and Richard, A.J., Eds., Tomato Biotechnology, INFO, NY.
- 10. Van Doorn, W.G. and Stead, A.D. (1997) Abscission of flowers and floral parts. Journal of Experimental Botany, 48, 821-837.
- 11. Zarembinski, T.I. and Theologis, A. (1994) Ethylene biosynthesis and act ion: A case of conservation. Plant Molecular Biology, 26, 1579-1597.
- 12. Vázquez-Flota, F.A. and De Luca, V. (1998) Jasmonate modulates development- and light-regulated alkaloid biosynthesis in Catharanthus roseus. Phytochemistry, 49, 395-402.
- 13. 金玲, 高媚娇, 段喜华, 郭晓瑞 (2015) 锌胁迫长春花不同部位Zn 积累受外源乙烯利调控的特点. 植物研究, 1, 150-153.
- 14. Huang, Y.Z., Zhu, Y.G., Hu, Y. and Liu, Y.X. (2006) Uptake and accumulation of arsenic by different soybean varieties. Journal of Agro-Environment Science, 25, 1397-1401.
- 15. Chapelle, E.W. and Kim, M.S. (1992) Ratio analysis of reflectance spectra (RARS): An algorithm for the remote estimation of the concentration of chlorophyll A, chlorophyll B and carotenoids in soybean leaves. Remote Sensing of Environment, 39, 239-247.
- 16. Wellburn, A.R. (1994) The spectral determination of chlorophylls A and B, as well as total carotenoids, using various solvents with spectrophotometers of different resolution. Journal of Plant Physiology, 144, 307-313.
- 17. 杨蕾, 唐中华, 祖元刚 (2007) 高效液相色谱法同时测定长春花中的文多灵、长春质碱和脱水长春碱. 色谱, 4, 550-552.
- 18. Pan, Y.-J., Liu, J., Guo, X.-R., Zu, Y.-G. and Tang, Z.-H. (2015) Gene transcript profiles of the TIA biosynthetic pathway in response to ethylene and copper reveal their interactive role in modulating TIA biosynthesis in Catharanthus roseus. Protoplasma, 252, 813-824.
- 19. Deering, D.W., Rouse, J.W., Haas, R.H. and Schell, J.A. (1975) Measuring forage production of grazing units from Landsat MSS data. Environment, 23, 1169-1173.
- 20. Yang, C.-Q., Fang, X., Wu, X.-M., Mao, Y.-B., Wang, L.-J. and Chen, X.-Y. (2012) Transcriptional regulation of plant secondary metabolism. Journal of Integrative Plant Biology, 54, 703-712.
缩略词
CKcontrol对照
CATHCatharanthine长春质碱
Chl.aChlorophylla叶绿素a
Chl.bChlorophyllb叶绿素b
dDay天
DMSODimethyl sulfoxide二甲基亚砜
DWDry weight干重
DATAcetyl-CoA: 4-O-deacetylvindoline4-O-acetyl-transferase乙酰辅酶A: 脱乙酞文多灵一一乙酞转移酶
D4HDesacetoxyvindoline-4-hydroxylase 脱乙酰氧文多灵-4-羟化酶
ETEthylene乙烯利
FWFresh weight鲜重
hHour小时
HPLCHigh performance liquid chromatography高效液相色谱
MIAMonoterpene Indole Alkaloids单萜吲哚类生物碱
minMinute分钟
ODOptical density光密度
RDWRoot dry matter weight 根干物质量
RTIRoot tolerance index根系耐性指数
SDWStem dry matter weight 芽干物质量
T16HTabersonine 16-hydroxylase它波宁-16-羟化酶
PCRPolymerase chain reaction聚合酶链式反应
PnPhotosynthetic rate光合速率
VLBVinblastine长春碱
VINVindoline文多灵
CuCopper铜
