Journal of Advances in Physical Chemistry
Vol.04 No.02(2015), Article ID:15257,6
pages
10.12677/JAPC.2015.42005
Density Functional Theory Study of Thiophene Molecular Adsorb Behavior on the Metal as M = (Co,Ni,Cu,Zn)
Wei Long
School of Chemistry and Chemical Engineering, University of South China, Hengyang Hunan
Email: usclw2013@163.com
Received: Apr. 28th, 2015; accepted: May 19th, 2015; published: May 21st, 2015
Copyright © 2015 by author and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY).
http://creativecommons.org/licenses/by/4.0/



ABSTRACT
How to realize high catalytic desulfurization of thiophene cracking of transition metals is the major problem of petroleum processing. On the basis of the existing experiment, we combine Gaussian03 progress with the density functional theory (DFT) and B3LYP method to study the thiophene molecular adsorb microscopic behavior on the four kinds of transition metal as M = (Co,Ni,Cu,Zn) on Genecp basis set level. Calculation results show that: different transition metal atoms of thiophene molecular adsorption, adsorption exists different; transition metal Co and Cu adsorption is given priority to with alpha, the energy of which after the adsorption decreased 479.621 and 369.203 kJ/mol respectively; transition metal Ni adsorption is given priority to with beta, the energy of which after the adsorption decreased as high as 671.241 kJ/mol; transition metal zinc adsorption to the delta is given priority to, the energy of which after the adsorption decreased after 165.094 kJ/mol; There is another adsorb behavior as θ position exists about thiophene molecule on the transition metal Cu and Zn. The calculation of adsorption energy should consider the zero-point energy correction.
Keywords:Thiophene Cracking, Transition Metal, Density Functional, The Adsorption Behavior
噻吩与过渡金属M = (Co, Ni, Cu, Zn)吸附行为的量化研究
龙威
南华大学化学化工学院,湖南 衡阳
Email: usclw2013@163.com
收稿日期:2015年4月28日;录用日期:2015年5月19日;发布日期:2015年5月21日

摘 要
如何实现过渡金属高效催化噻吩裂解脱硫是石油加工环节的重大难题。在已有的实验基础上,我们利用Gaussian03程序,采用密度泛函理论(DFT),使用B3LYP方法在Genecp基组水平上研究了噻吩分子与四种过渡金属M = (Co, Ni, Cu, Zn)的吸附微观行为。计算结果表明:不同的过渡金属原子对噻吩分子的吸附存在着不同的吸附位,过渡金属Co与Cu吸附以α位为主,吸附后能量分别降低了479.621 kJ/mol和369.203 kJ/mol;过渡金属Ni吸附以β位为主,吸附后能量降低了高达671.241 kJ/mol;过渡金属Zn吸附以δ位为主,吸附后能量降低了165.094 kJ/mol,过渡金属Cu与Zn原子吸附噻吩分子还存在有θ位的吸附。吸附能量的计算应考虑零点能的校正。
关键词 :噻吩裂解,过渡金属,密度泛函,吸附行为

1. 引言
能源危机是全球科学研究的焦点,化石燃料的利用率提高是延续能源使用寿命的主要手段。煤作为简单易得的化石燃料,是人类长期依赖不可缺少的传统能源 [1] 。科学界对化石燃料利用率的提高及污染的控制减少一直很重视。有机含硫化合物的除去是制约煤加工的重要因素,硫化物不仅对环境会造成污染,燃料油中硫的含量也进行了严格限定在0.001% (w)以下,这对脱硫处理技术提出了极高的挑战[2] 。
煤中的含硫有机物种类较多,其中主要代表是噻吩,由于具有环状结构从而具有极高的稳定性,噻吩的开环一直认为是煤脱硫的关键性阻碍 [3] 。长期以来,众多实验报道表明过渡金属对噻吩的脱硫具有较高的活性,我国的李翔 [4] 提出噻吩在Co系催化剂作用下表现为良好的裂解脱硫性能;Bezverkhyy等 [5] 通过实验发现了过渡金属Ni对噻吩的开环有明显的促进作用,而Pawelec等 [6] 则通过实验表明Ni/FAU and Ni/ZSM-5能很好地催化噻吩发生裂解反应;Baeza等 [7] 通过实验提出噻吩能较好地分布在Cu/ZrO2催化剂上,这是噻吩裂解脱硫的首要步骤,Jose等 [8] 也对噻吩裂解的铜基催化剂进行了性能设计的优化改良;Potapenko等 [9] 对噻吩的催化裂解催化剂进行评述中提出Zn对噻吩的裂解也有明显的催化性能,而Zhang等 [10] 制备了Ni/ZnO催化剂,并通过实验发现噻吩在其上具有高活性,能够在温和条件下进行裂解。近年来关于噻吩的实验报道 [11] - [13] 还非常丰富,表明噻吩的催化裂解脱硫是科学界的热点。
噻吩在过渡金属上脱硫机理也有一定的报道,其中,2004年,郑柯文等 [14] 就用量子化学方法提出了噻吩容易在分子筛上形成带正碳离子的中间体,进而与烯烃加成发生脱硫反应生成己烯;徐坤等 [15] 利用密度泛函理论提出了噻吩在γ-Mo2N(100)表面上加氢脱硫反应的机理。最近,陈龙等 [16] 通过计算模拟提出了2-甲基噻吩与NO3反应的机理进行有力的补充,而戴凤威等 [17] 利用了量子化学方法详细地模拟计算了噻吩与O2的反应机理,提出了噻吩分子中S原子是开环的关键,提出能垒为117.06 kJ/mol,产物是丁醚。
尽管噻吩催化的实验研究非常丰富,因为不同催化剂下的效果不相同,仍无法形成统一的反应机理。归纳实验和机理研究的文献表明,过渡金属M = (Co, Ni, Cu, Zn)等均对噻吩的裂解脱硫有催化效果。这四种金属元素在元素周期表的位置非常相近,为了系统地比较他们对噻吩分子的吸附行为,我们选择了先进的量子化学研究方法进行探究,在这方面我们的研究已经有了一定的基础 [18] ,通过计算能了解四种不同的过渡金属原子对噻吩分子的具体吸附行为,可为进一步实验做科学合理的指引,具有重要的研究意义。
2. 计算方法
本文采用密度泛函理论(Density Functional Theory, DFT)中的B3LYP方法 [19] 对噻吩与过渡金属M = (Co, Ni, Cu, Zn, Mo, Sn, Pd)原子的吸附模型进行了研究。对于过渡金属原子,我们选择赝势基组lanl2dz,而其它原子我们选择6-311+G(d, p)基组,所以计算过程中使用genecp方法将基组拟合。我们使用B3LYP方法上对各反应物进行了几何构型优化及频率分析,发现所有的振动频率均为正值,说明所涉及的吸附前后的分子均是稳定的,为了能量的精确度,我们在频率分析的同时进行了零点能的校正,其校正因子取0.97,获得对应的不同的相对的能量大小数据,吸附的能量ΔEabs = (E产物 + Ezpe) − (E反应物 + Ezpe),其中E产物为发生吸附后形成稳定中间体的能量,E反应物为发生吸附前噻吩分子和过渡金属原子的能量之和,ΔE’abs为考虑零点能校正后的吸附能,ΔE为考虑零点能校正后的相对能量,以上全部工作用Gaussian 03程序 [20] 在南华大学的计算化学微型计算机上完成。在南华大学的计算化学微型计算机上完成,部分计算采用了科学计算网格ScGrid协助完成。
3. 结果与讨论
3.1. 吸附行为模型
经量化计算,噻吩分子呈明显的环状结构,部分键长(单位:Å)和键角(单位:˚)数据如图1(a)所示,分子中两侧C=C双键的长度明显比C-S键短0.369Å,而底部的C-C键长度表明为单键,C-H键长约为1.082Å,五元环上的主要原子几乎在一个平面上,但C-S-C夹角为91.5˚表明分子构型不是正五边形,所以分子具有一定的极性。图1(b)为噻吩分子的HOMO分子轨道图,而图1(c)为噻吩分子的LUMO分子轨道图,表明环上的最低占据轨道的电子云主要集中在对称的双键上,而分子的反键上主要是分子的未占据空轨道,C-C单间上也有空轨道。我们熟知过渡金属大都具有很多3d空轨道,而有些过渡金属原子的最外层轨道上单电子容易给出,考虑到S原子上有孤对电子也可以给出,我们设计了噻吩分子与过渡金属M = (Co, Ni, Cu, Zn)的吸附结合模式,如图1(d)所示的吸附模型中,α位表示过渡金属M主要进攻S原子与之成键,β位表示过渡金属M主要吸收S-C键上的电子云,γ位表示过渡金属M主要吸收右侧C=C键上的电子云,δ位表示过渡金属M主要进攻下部C-C键,可能是得到电子也可能是释放电子给C-C键的反键空轨道,θ位则表示过渡金属M是从环平面的垂直上方中心与环靠近,由于噻吩的环状结构,电子云可能出现了共轭效应,所以这也是一种过渡金属M原子进攻噻吩分子的模式。由于噻吩分子的左右对称结构,H原子上的空轨道无法与过渡金属M原子反应,所以,我们归纳过渡金属M吸附噻吩分子的模型为四种吸附位。
3.2. 过渡金属Co原子与噻吩的吸附行为
计算研究表明,过渡金属Co原子对噻吩分子的吸附仅存在α、θ位等两种模式,它的核外电子排布为3d74s2,3d轨道上有7个单电子,所以有3个轨道上仅有一个电子,所以得到1个或2个电子后仍然不稳定。过渡金属Co原子半径较大,与噻吩分子靠近时仍然受到较大的位阻效应,如图2所示,发生α位吸附时,过渡金属Co原子与S原子的间距为2.438Å,非常明显地C-S键的键长拉长了0.012Å,而C-S-C夹角基本不变;发生θ位吸附时,过渡金属Co原子在五元噻吩环的上方,距离C原子约2.072Å和2.183Å处,吸附后,噻吩中C-S-C夹角有变小至88.4˚,C-S键的键长拉长至1.785Å。
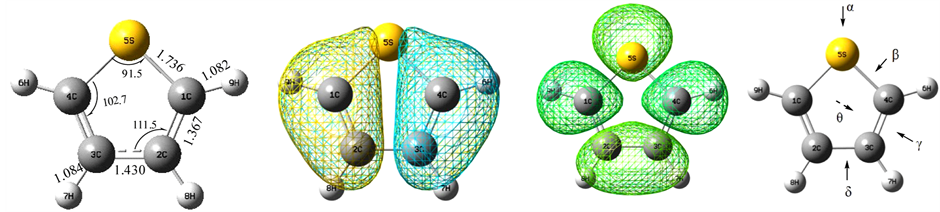 (a) (b) (c) (d)
(a) (b) (c) (d)
Figure 1. Geometric structure, molecular orbit and absorb schema of thiophene
图1. 噻吩分子的几何结构、分子轨道及吸附模式
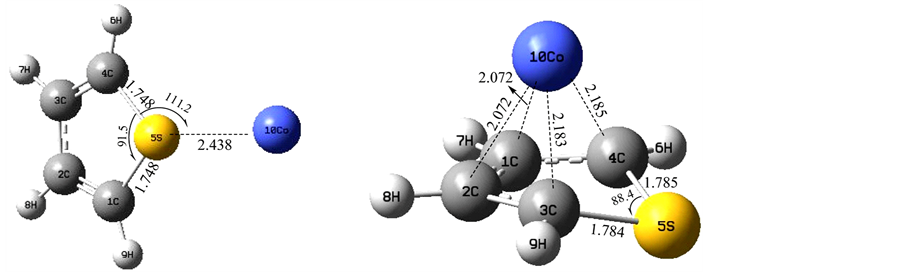
Figure 2. The two kinds of absorb schema about thiophene molecule on the metal as Co
图2. 过渡金属Co与噻吩吸附的两种模式
我们考虑了两种吸附位下的吸附能大小,将其能量数据列于表1,不难发现,吸附后产物的能量均比反应物的能量要低很多,ΔEabs为未考虑零点能校正的吸附能数据,ΔE’abs为考虑零点能校正后的吸附能数据,而ΔE为两种模式下相对的能量大小。数据表明,过渡金属Co原子在α位吸附噻吩分子形成的产物更稳定,其能量比θ位吸附位低12.335 kJ/mol,表明过渡金属Co是在α位催化噻吩分子的。
3.3. 过渡金属Ni原子与噻吩的吸附行为
计算研究表明,过渡金属Ni原子对噻吩分子的吸附存在有四种模式,即:α、β、γ、δ位,由于轨道上电子排布是3d84s2,只要填满2个电子就能稳定,故过渡金属Ni原子反应活性更高,图3的几何结构表明:过渡金属Ni原子从α和γ位吸附噻吩分子时,基本不会影响噻吩环的分子结构,而β、δ两个位置的吸附则破坏了噻吩分子的环状结构,它既能与S原子成键,也能与C原子成键,从而形成两种稳定的中间体,而由于位阻效应不存在θ位的吸附。四种吸附模式的能量数据如表2所示,β位的吸附能量降低数值最大,这可能是由于形成了一个较大的环状中间体,而此时S原子与Ni原子直接相连,有利于最大程度上吸收硫原子的孤对电子,从而降低了电子云的密度,能量最低,α位方向上发生吸附降低的能量最小。
3.4. 过渡金属Cu原子与噻吩的吸附行为
计算研究表明,过渡金属Cu原子对噻吩分子的吸附存在有三种模式,即:α、δ、θ位,由于过渡金属原子的最外层轨道上电子排布是3d104s1,只要填满1个电子就能稳定,故过渡金属Cu原子接受电子的轨道非常有限,故比Ni原子少了一种吸附模式。图4的几何结构表明:过渡金属Cu原子从α和θ位吸附噻吩分子时,基本不会影响噻吩环的分子结构,与前面不同的是α位上的过渡金属Cu原子并不是与
Table 1. The adsorb energy data about thiophene molecular on the metal as Co
表1. 过渡金属Co与噻吩的吸附能量数据
Table 2. The adsorb energy data about thiophene molecule on the metal as Ni
表2. 过渡金属Ni与噻吩的吸附能量数据
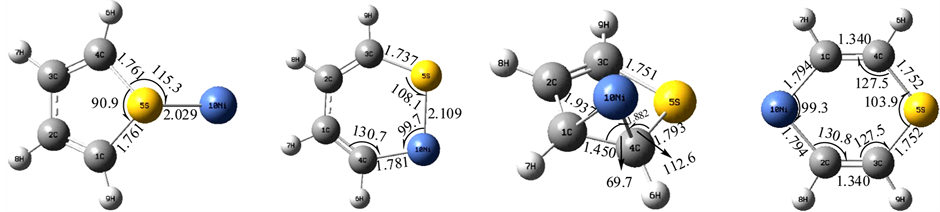
Figure 3. The four kinds of absorb schema about thiophene molecule on the metal as Ni
图3. 过渡金属Ni与噻吩吸附的四种模式
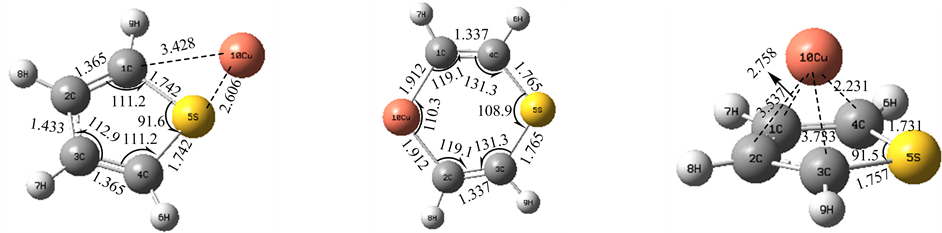
Figure 4. The three kinds of absorb schema about thiophene molecule on the metal as Cu
图4. 过渡金属Cu与噻吩吸附的三种模式
噻吩环同平面,而δ位方向的吸附则破坏了噻吩分子的环状结构,由于它无法同时接受2个电子,故不能与S原子成键,而它能与C原子成键,可能是它的d轨道电子给出,形成新的空轨道从而形成稳定的环状中间体。四种吸附模式的能量数据如表3所示,α位的吸附能量降低数值最大,θ位的能量比吸附前能量还高,说明这种吸附是不稳定的,反而需要吸收能量才能形成,而δ位吸附降低的能量较α位小,可能是由于过渡金属原子半径大导致环状结构的张力太大不稳定的缘故。
3.5. 过渡金属Zn原子与噻吩的吸附行为
计算研究表明,过渡金属Zn原子对噻吩分子的吸附存在有四种模式,即:α、γ、δ、θ位,由于轨道上电子排布是3d104s2,外层电子全排满的结构导致它只能给出电子,故过渡金属Zn原子无法形成C-Zn-S键,图5的几何结构表明:过渡金属Ni原子从α、γ、θ位吸附噻吩分子时,基本不会影响噻吩环的分子结构,而δ位方向的吸附则破坏了噻吩分子的环状结构,它插入了C-C键是由于它外层电子给出填充了原来的C-C键的反键轨道,从而形成一种稳定的中间体,而由于位阻效应θ位的吸附并不稳定。四种吸附模式的能量数据如表4所示,δ位方向的吸附能量降低数值最大,这可能是由于形成了一个较大的环状中间体的缘故,而θ位的吸附的能量降低很小是由于位阻效应大的缘故,同时它也能形成α、γ位上的吸附,表明过渡金属Zn原子存在较多位置进攻噻吩促进其裂解的可能。
4. 结论
通过对四种过渡金属M = (Co, Ni, Cu, Zn)对噻吩分子吸附模型的量化计算研究,我们发现了不同的过渡金属存在有不同的吸附模式,通过比较了各个吸附模式的能量数据大小关系,我们找到了不同金属吸附的最佳稳定吸附位,对反应机理的进一步研究具有积极的促进意义:
1) 过渡金属Co只有α和θ位吸附位,过渡金属Ni存在有α、β、γ、δ位四种吸附位,过渡金属Cu存在有α、δ、θ位三种吸附位,过渡金属Zn存在有α、γ、δ、θ位四种吸附位;
2) 过渡金属Co与Cu吸附噻吩分子的位置以α位为主,其吸附后能量分别降低了479.621 kJ/mol和369.203 kJ/mol,过渡金属Ni吸附噻吩分子的位置以β位为主,其吸附后能量降低了高达671.241 kJ/mol;过渡金属Zn吸附噻吩分子的位置以δ位为主,其吸附后能量降低了165.094 kJ/mol,其中过渡金属Cu与Zn原子吸附噻吩分子还存在有θ位的吸附。
Table 3. The adsorb energy data about thiophene molecule on the metal as Cu
表3. 过渡金属Cu与噻吩的吸附能量数据
Table 4. The adsorb energy data about thiophene molecule on the metal as Zn
表4. 过渡金属Zn与噻吩的吸附能量数据
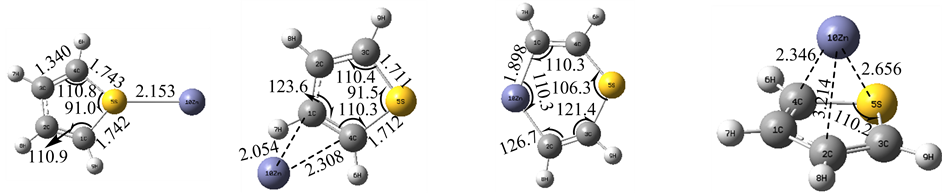
Figure 5. The four kinds of absorb schema about thiophene molecule on the metal as Zn
图5. 过渡金属Zn与噻吩吸附的四种模式
3) 吸附能计算时应考虑零点能校正的因素影响,未考虑零点能校正的吸附能量偏差较大,这是在量化计算中能量叠加中着重考虑且应消除的误差。
致谢
感谢衡阳市科技局项目(2013kJ23)的资助。本成果使用了科学计算网格ScGrid,一并表示感谢。
文章引用
龙 威, (2015) 噻吩与过渡金属M = (Co, Ni, Cu, Zn)吸附行为的量化研究
Density Functional Theory Study of Thiophene Molecular Adsorb Behavior on the Metal as M = (Co,Ni,Cu,Zn). 物理化学进展,02,31-37. doi: 10.12677/JAPC.2015.42005
参考文献 (References)
- 1. Potapenko, O.V., Doronin, V.P., Sorokina, T.P., Talsi V.P. and Likholobov, V.A. (2012) Transformations of thiophene compounds under catalytic cracking conditions. Applied Catalysis B: Environmental, 117-118, 177-184.
- 2. Biswajit, S. and Sonali, S. (2015) Influence of different hydrocarbon components in fuel on the oxidative desulfurisation of thi-ophene: Deactivation of catalyst. Fuel, 150, 679-686.
- 3. 龙威, 颜雪明 (2013)过渡金属在石油脱硫技术中的催化作用. 佛山科学技术学院学报(自然科学版), 4, 22-29.
- 4. 李翔, 王安杰, 孙仲超, 等 (2013) 全硅MCM-41担载的Ni-W催化剂上二苯并噻吩加氢脱硫反应动力学研究. 石油学报(石油加工), 4, 1-7 .
- 5. Bezverkhyy, L., Ryzhikov A., Gadacz G. and Bellat J.P. (2008) Kinetics of thiophene reactive adsorption on Ni/SiO2 and Ni/ZnO. Ca-talysis Today, 130, 199-205.
- 6. Pawelec, B., Mariscal, R., Navarro, R.M., Campos-Martin, J.M. and Fierro, J.L.G. (2004) Simultaneous 1-pentene hydroisomerisation and thiophene hydrodesulphurisation over sulphided Ni/FAU and Ni/ZSM-5 catalysts. Applied Catalysts A: General, 262, 155-166.
- 7. Baeza, P., Aguila, G., Vargas, G., Ojeda, J. and Araya, P. (2012) Adsorption of thiophene and dibenzothiophene on highly dispersed Cu/ZrO2 absorbents. Applied Ca-talysis B: Environmental, 111-112, 133-140.
- 8. Jose, N., Sengupta, S. and Basu, J.K. (2011) Optimization of oxida-tive desulfurization of thiophene using Cu/titanium silicate-1 by box-behnken desigen. Fuel, 90, 626-632.
- 9. Potapenko, O., Doronin, V.P., Sorokina, T.P., Talsi, V.P. and Likholobov, V.A. (2012) Transforma-tionsof thiophene compounds under catalytic cracking conditions. Applied Catalysis B: Environmental, 117-118, 117-118.
- 10. Zhang, J.C., Liu, Y.L., Tian, S., Chai, Y.M. and Liu, C.G. (2010) Reactive adsorption of thiophene on Ni/ZnO adsorbent:Effect of ZnO textural structure on the desulfurization activity. Journal of Natural Gas Chemistry, 19, 327-332.
- 11. Potapenko, O.V., Doronin, V.P., Sorokina, T.P., Talsi, V.P. and Likholobov, V.A. (2012) Trans-formations of thiophene compounds under catalytic cracking conditions. Applied Catalysis B: Environmental, 117-118, 177-184.
- 12. Saha, B. and Sengupta, S. (2015) Influence of different hydrocarbon components in fuel on the oxidative desulfurisation of thiophene: Deactivation of catalyst. Fuel, 150, 679-686.
- 13. Parola, V.L., Testa, M.L. and Venezia, A.M. (2012) Pd and PdAu catalysts supported over 3-MPTES grafted HMS used in the HDS of thiophene. Applied Catalysis B: Environmental, 119-120, 248-255.
- 14. 郑柯文, 高金森, 徐春明 (2004) 噻吩催化裂化脱硫机理的量子化学分析. 化工学报, 1, 87-90.
- 15. 徐坤, 冯杰, 褚绮, 张丽丽, 李文英 (2014) 噻吩在γ-Mo2N(100)表面上加氢脱硫反应的密度泛函理论研究. 物理化学学报, 11, 2063-2070.
- 16. 陈龙, 王渭娜, 卢天宇, 王文亮 (2014) 2-甲基噻吩与NO3反应机理的理论研究. 陕西师范大学学报, 4, 36-44.
- 17. 戴凤威, 邓存宝, 邓汉忠, 王雪峰, 高飞, 张勋 (2014) 噻吩结构与O2反应机理的理论研究. 煤炭学报, 4, 699- 704.
- 18. 徐文媛, 龙威, 杜瑞焕 (2011) 镍基上CH4脱氢与超临界CO2重整的量化计算. 化学通报, 8, 732-736.
- 19. Govind, N., Petersen, M., Fitzgerald, G., King-Smith, D. and Andzelm, J. (2003) A generalized synchronous transit method for transition state location. Computational Materials Science, 28, 250-258.
- 20. Malick, D.K., Petersson, G.A. and Montgomery Jr., J.A. (1998) Transition states for chemical reactions I: Geometry and classical barrier height. The Journal of Chemical Physics, 108, 5704-5713.
