International Journal of Ecology
Vol.04 No.01(2015), Article ID:14886,6
pages
10.12677/IJE.2015.41003
Isolation and Ecological Characteristics Research of Frankiaceae in Elaeagnus angustifolia L. Root Nodule
Fuqiang Song1, Lichun Niu1, Alexander V. Kurakov2*, Wei Chang1
1College of Life Science, Heilongjiang University, Harbin Heilongjiang
2Moscow Lomonosov State University, Moscow, Russia
Email: 0431sfq@163.com, *kurakov57@mail.ru
Received: Feb. 14th, 2015; accepted: Feb. 26th, 2015; published: Feb. 27th, 2015
Copyright © 2015 by authors and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY).
http://creativecommons.org/licenses/by/4.0/



ABSTRACT
We successfully introduced E. angustifoliato conduct biological repairing in soda salinization soil of Heilongjiang Province, China. Resistance of E. angustifolia has been greatly improved because of the formation of Actinomycetes nodule. In this study, Actinomycetes has been separated from E. angustifolia nodule by the method of nodules sectioning and identified by the method of molecular biology, which has obtained 2 Frankiastrains (Frankia sp1 and Frankia sp2). At the same time, we have obtained one of Micromonospora sp. and Nocardia sp. Frankia sp1 belongs to physiological type A, Frankia sp2 belongs to physiological type AB. Both of them showed strong salt tolerance, but Frankia sp2 was better than Frankia sp1. Two kinds of Frankia strain growth maximum at a pH of 7.5. The results enrich the theoretical basis of the research of E. angustifolia root nodules.
Keywords:Elaeagnus angustifolia L., Root Nodules, Salinization Stress, Frankiaceae, Stain Physiological Type

沙枣根瘤内弗兰克氏菌分离鉴定及 生态特性研究
宋福强1,牛丽纯1,Alexander V. Kurakov2*,常伟1
1黑龙江大学生命科学学院,黑龙江 哈尔滨
2莫斯科国立大学生物学,莫斯科,俄罗斯
Email: 0431sfq@163.com, *kurakov57@mail.ru
收稿日期:2015年2月14日;录用日期:2015年2月26日;发布日期:2015年2月27日

摘 要
黑龙江省苏打盐碱地在生物治理过程中成功地引种沙枣进行生物修复。由于沙枣能够形成放线菌根瘤,极大的提高了其抗逆性。本研究采用根瘤切片法对沙枣根瘤内的放线菌进行分离,并通过分子生物学手段进行鉴定,共得到两种Frankia (Frankia sp1、Frankia sp2),同时还获得了Micromonospora sp.和Nocardia sp.各一种;Frankia sp1属于生理A型,而Frankia sp2属于生理AB型;Frankia sp1和Frankia sp2均具有较强的耐盐能力,且Frankia sp2优于Frankia sp1;两种Frankia在pH值为7.5时菌株的生长量达到最大。研究结果进一步充实了沙枣根瘤研究的理论基础。
关键词 :沙枣,根瘤,盐碱胁迫,弗兰克氏菌,菌株生理类型

1. 引言
松嫩平原属于干旱-半干旱气候区,区内现有盐碱化土地373万hm2,是世界上三大片苏打盐碱地集中分布区域之一,其pH值在8.0以上,可分为NaCO3型盐土和NaHCO3型碱土及两者混合型。目前对盐碱地的生态修复是亟待解决的问题,而植被恢复则是关键[1] 。恢复植被的一个途径是通过选择耐盐碱性强的先锋植物,发挥耐盐碱植物的生物改良作用,改善土壤环境。
沙枣(Elaeagnus angustifolia L.)为胡颓子科(Elaegnaceae)胡颓子属(Elaeagnus L.)落叶乔木或小乔木落叶乔木或小乔木,在我国主要分布在西北地区和内蒙古以及华北西北部。沙枣生活力很强,具有抗旱、抗风沙、耐盐碱、耐贫瘠等特点,兼具生态、经济和药用价值,是我国北方生态脆弱地区造林绿化的一个先锋树种[2] 。目前黑龙江省已经将沙枣引入并栽植盐碱地,试验结果表明该树种能够在黑龙江省重度盐碱地上成活和很好的生长。
沙枣能够形成放线菌根瘤。非豆科植物形成的放线菌根瘤能将空气中的游离氮素固定为植物吸收利用的形式,从而提高植物的生长势及抗性[3] 。本项研究主要是对沙枣根瘤内的弗兰克氏菌分离、鉴定并了解其生理特性,旨在为进一步揭示沙枣的抗性机理及沙枣根瘤菌剂的开发奠定基础。
2. 材料与方法
2.1. 材料来源
实验材料采自黑龙江省肇东市肇岳山盐碱地(土样全盐量为2.65%,pH 9.52,速效磷13.9 mg/kg,碱解氮69.4 mg/kg,速效钾187.5 mg/kg。)栽植3年的沙枣苗木根系。在林地内随机选取10株沙枣书取样(n = 10)。将沙枣根系一侧土挖开,剪枝钳将带有根瘤的侧根剪下回实验室后,根瘤用单层纱布包好流水冲洗2 h左右,待粘土冲掉后,放入超声波清洗器清洗2 h左右,期间每隔10 min更换一次蒸馏水;待水无浑浊小颗粒时,用滤纸将根瘤表面水分吸干,处理期间尽量不要损伤根瘤。
2.2. 沙枣根瘤内弗兰克氏菌的分离与鉴定
2.2.1. 根瘤内弗兰克氏菌的分离
在超净工作台中将根瘤分成单瓣瘤,70%酒精和0.1% NaHCIO对根瘤小瓣表面灭菌,采用根瘤切片法[4] ,利用BAP固体平板培养基分离放线菌,于28℃恒温培养7 d,对培养基菌落纯化。同时用最后一次清洗样品的无菌水涂布相应空白对照培养基平板上,检验消毒情况,以判定分离所得到的菌株是否是根瘤内生菌。每处理重复10次。
2.2.2. 菌株的鉴定
采用试剂盒的方法提取菌株DNA。PCR反应引物为1429R,碱基序列为5’-AGAGTTTGATCCTGGCT- CAG-3’。反应体系为ddH2O (17.5 μL),10 × Ex Taq Buffer(含Mg2+)(2.5 μL),dNTP(1.5 μL),DNA模板(1 μL),上游引物(1 μL),下游引物(1 μL),Ex Taq酶(0.5 μL),总体积为25 μL。
PCR产物电泳后,采用琼脂糖凝胶DNA回收试剂盒回收目的基因,然后将其连接转化到大肠杆菌中;大肠杆菌菌液加甘油和LB液体培养基混匀封口,送于上海英俊生物技术有限公司进行测序,测得基因序列使用DNAMAN软件进行序列拼接,登录http://www.ncbi.nlm.nih.gov/,利用BLAST程序与GenBank中的序列进行同源性检索比对,鉴定菌株。
2.3. 弗兰克氏菌生理类型检测
根据生理类型Lechevelier方法划分[5] ,将分离纯化到鉴定的菌株分别等量接种于6种培养基中(表1),28℃暗处静置培养,并分别培养8周,每2周离心收集菌丝体,测干重,实验重复3次。
2.4. 弗兰克氏菌耐盐能力的测定
采用BAP为基础的培养基,其中分别添加浓度为1%、2%、3%、4%的NaCl,并且以不含的NaCl的BAP培养基作为对照,将其灭菌后,分别接入等量的菌株,28℃暗处静置培养1个月,离心收集菌丝体,测干重,实验重复3次。
2.5. pH值对菌株生长的影响
采用BAP为基础的培养基,使用0.1 mol/L H2SO4和NaOH调节培养基的pH值,分别制备pH值6.5、7.0、7.5和8.0的4种培养基。将4种培养基中分别接种等量的菌株,28℃暗处静置培养1个月,离心收集菌丝体测干重,实验重复3次。
3. 结果与分析
3.1. 菌株形态特征及鉴定结果
实验共分离获得4个纯菌株,代号分别为H01、H04、H05和H07。将H01、H04菌株置于光学显微镜下,观察其菌丝体形态特征(图1)。菌株具有典型的弗兰克氏菌菌丝体形态:菌丝无色素,有明显分枝,
Table 1. The composition of culture medium
表1. 培养基组成
粗细不均,具有菌丝、孢囊和泡囊等特征性结构。根据国际上公认的弗兰克氏菌属的定义,在形态特征方面的描述为:内生菌纯培养呈放线菌样,在液体培养中产生不动孢子的孢囊,有可能形成泡囊,可以初步断定该菌株属于弗兰克氏菌[6] 。
对从沙枣根瘤内分离获得菌株进行DNA提取、PCR扩增及DNA测序。将菌株测序数据在NCBI上进行同源性比对,选取同源性较高的菌种序列,对培养出的菌种进行生物信息学鉴定。从表2的结果可以看出,从沙枣根瘤中成功地分离并鉴定出3属4种放线菌,其中Frankia属有两种。
3.2. Frankia spp.生理类型检测
Lechevalier根据弗兰克氏菌能否利用吐温-80而将其分成了二个亚群:生理A型和生理B型[7] 。生理A型菌是培养基中存在吐温-80的情况下,菌株对葡萄糖的利用受到抑制;生理B型菌是培养基中存在吐温-80的情况下,菌株对葡萄糖的利用得到促进。试验结果(图2,图3)得出结论:菌株H01在无吐温-80的培养基中能够利用葡萄糖,生长量较高,但与有吐温-80存在的培养基对比发现,菌丝体的生长

Figure 1. The pictures of mycelium of actinomyces
图1. 放线菌菌丝照片
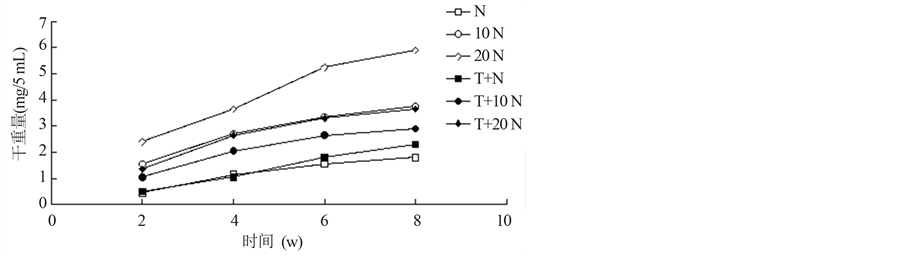
Figure 2. The increment of strains H01 under physiological detection
图2. 菌株H01生理类型在检测中的生长量
Table 2. The BLAST results of actinomyces
表2. 分离的放线菌BLAST比对结果
量明显降低,所以可将参考菌株H01划为生理A型。菌株H04在有无吐温-80的条件下均可利用葡萄糖,菌丝体的生长量也比较接近,这可以表明H04菌株的生理类型既不属A型也不属B型。根据胡传炯[8] 等对弗兰克氏菌的生理类型划分,可将菌株H04归为生理AB型。
3.3. Frankia spp.菌株耐盐能力的测定结果
试验结果图由图4可以看出,菌株H01和H04在不同浓度NaCl的培养基中均有生长,1%和2% NaCl的培养基中菌体生长与对照组(NaCL浓度为0%)几乎一样,菌株生长基本不受影响,说明菌株具有较好的耐盐能力。但从3%的NaCl浓度开始,菌丝体干重随NaCl浓度的增加而减少,菌体长势有所下降,菌丝生长状况不良,但仍有一定生长。相比较而言,H04具有耐盐能力较强。
3.4. pH值对Frankia spp.菌株生长的影响
试验结果由图5可以看出,菌株H01和H04在pH值是6.5~8.0的范围内的培养基中,菌体均有生长,其中最适宜菌体生长的pH值均在7.0~7.5左右,pH值为7.5时菌株的生长量达到最大,当pH值高于7.5时,菌体长势有所下降,菌丝生长状况不良,但仍有一定生长。pH 8.0时,菌株H01和H04耐碱能力基本相同。
4. 讨论与结论
与Frankia spp.结瘤的植物大多为乔木或者灌木,生态分布范围要大于豆科植物,固氮作用强[9] 。到目前为止放线菌结瘤植物已达到7个目8个科24个属的279个种,这八大科分别是:桦木科(Betulaceae)、

Figure 3. The increment of strains H04 under physiological detection
图3. 菌株H04生理类型在检测中的生长量
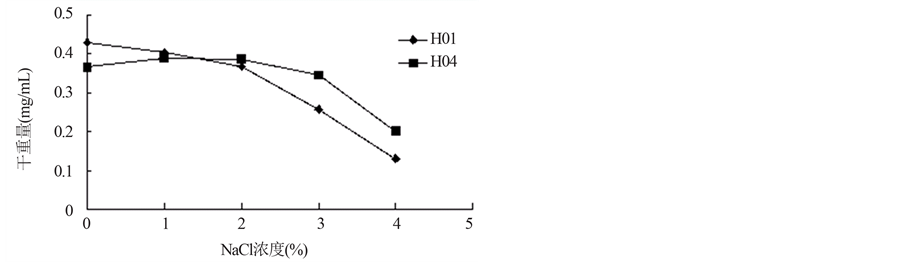
Figure 4. The influence of different contractions of NaCl on the growth of strain H01 and H04
图4. 不同浓度NaCl对菌株H01和菌株H04生长量影响
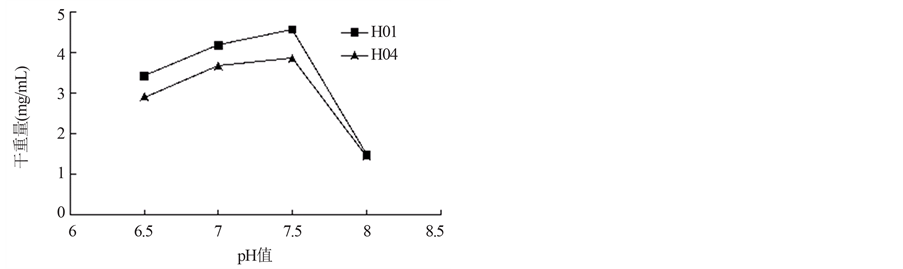
Figure 5. The influence of different pH values on the growth of strain H01 and H04
图5. 不同pH值对菌株H01和菌株H04生长量的影响
木麻黄科(Casuarinaceae)、鼠李科(Rhamnaceae)、蔷薇科(Rosaceae)、杨梅科(Myricaceae)、马桑科(Coriariaecae)、四数木科(Datiscaceae)以及胡颓子科(Elaeagnaceae) [10] 。目前这24个属的放线菌结瘤植物中仍有一大半的属还没有获得纯培养或者得到的纯培养菌种未能回接成功,因而对弗兰克氏菌的研究还是处在初步的阶段。本项研究虽然从沙枣根瘤中成功分离获得两种Frankia spp.,但这两种弗兰克氏菌是否是真正导致根瘤形成的原因,同时与另外两种非弗兰克氏菌(Micromonospora sp.、Nocardia sp.)的相互关系均有待于进一步研究。
Frankia spp.菌株H01和H04虽然来自同一种寄主,但菌体形态颜色以及液体培养基中的颜色和浑浊度均不同。经过生理类型的实验得知H01菌株为生理A型,而H04菌株为生理AB型。虽然他们生长时对pH值耐性很接近,但仍可以认为他们是不是同种的菌株。
Frankia spp.菌株H01和H04在不同浓度NaCl的培养基中均可生长,1%和2% NaCl的培养基上菌体量与对照组差异不显著,但从3%的NaCl浓度开始,菌丝体的干重随NaCl浓度的增加而减少,菌体长势有所下降,虽然菌丝生长状况不良,但仍有一定生长。说明这两株菌株的耐盐能力均较强,且H04菌株优于H01菌株。均可在6.5~8.0的范围内生存,其菌体都有一定的生长,当pH间于7.0~7.5的pH值时,菌株生长良好,但低于6.5或高于7.5时菌株的生长受到抑制,而且生长量也有所下降。试验结果可以为今后Frankia的更深入的研究奠定基础。
基金项目
黑龙江省杰出青年科学基金(JC201306);黑龙江省应用技术研究与开发计划项目(GC13B502);哈尔滨市科技创新优秀学科带头人项目(2013RFXXJ056)。
文章引用
宋福强,牛丽纯,Alexander V. Kurakov,常 伟, (2015) 沙枣根瘤内弗兰克氏菌分离鉴定及生态特性研究
Isolation and Ecological Characteristics Research of Frankiaceae in Elaeagnus angustifolia L. Root Nodule. 世界生态学,01,16-22. doi: 10.12677/IJE.2015.41003
参考文献 (References)
- 1. 孙玉芳, 牛丽纯, 宋福强 (2014) 盐碱土修复方法的研究进展. 世界生态学, 3, 30-36.
- 2. 刘正祥, 张华新, 杨秀艳等 (2014) NaCl胁迫下沙枣幼苗生长和阳离子吸收、运输与分配特性. 生态学报, 2, 326- 336.
- 3. 熊智, 张忠泽, 姜成林 (2003) 固氮放线菌Frankia与放线菌根植物共生进化的研究进展. 应用生态学报, 2, 213- 217.
- 4. Lalonde, M., Calvert, H.E. and Pine, S. (1981) Isolation and use of Frankia strains in actinorhizae formation. In: Gib- son, A.H. and Newton, W.E., Eds., Current Perspectives in Nitrogen Fixation, Australian Academy of Sciences, Can- berra, 296-299.
- 5. Lechevalier, M.P. (1994) Bacterial. International Journal of Systematic and Evolutionary Microbiology, 44, 1-8.
- 6. 郝家骐, 朱世琴, 周鸿宾 (1999) 弗兰克氏Cel517菌株固氮研究. 山西农业科学, 1, 57-59.
- 7. Caporaso, J.G. (2010) QIIME allows analysis of high-throughput community sequencing data. Nature Methods, 5, 335- 336.
- 8. 胡传炯, 周平贞 (1997) 一株马桑根瘤内生菌纯培养物的分类鉴定. 微生物学杂志, 6, 417-422.
- 9. 刘润进, 田蜜, 刘宁等 (2014) 植物根系复合共生体研究进展. 菌物研究, 1, 1-7
- 10. 洪国藩, 宋鸿遇 (1997) 固氮之光. 湖南科学技术出版社, 长沙, 134-169.
