Service Science and Management
Vol.05 No.02(2016), Article ID:17287,19
pages
10.12677/SSEM.2016.52006
Study on Optimal Control System of Ebola Disease
Guan Guan1, Jiaqian Wu2*
1Beijing University of Posts and Telecommunications, Beijing
2University of Chinese Academy of Sciences, Beijing

Received: Mar. 11th, 2016; accepted: Mar. 28th, 2016; published: Mar. 31st, 2016
Copyright © 2016 by authors and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY).
http://creativecommons.org/licenses/by/4.0/



ABSTRACT
Ebola virus is a deadly infectious disease, which seriously endangers human life and safety. Accurate prediction of the development trend of an infectious disease is of significant importance for the timely allocation and mobilization of relevant medical resources, developing reasonable strategies, as well as solving the problem of experience dependence in emergency treatment of the health sector. In order to effectively deal with the spread of the virus, this paper introduces three different methods to establish the prediction model of the Ebola virus transmission process, i.e. the probability model, the disease development course model and the system dynamics model. Through data mining of the time series variables in the disease spreading history, we can establish our predicting model based on the spreading rules of Ebola epidemic disease. Through the Ebola epidemic prediction model, we can make predictions on the future spread of the virus and simulate different control strategies under different scenarios to explore for the most effective measures. Therefore, through this research, we can provide effective technical support and suggestions for epidemic countries in Ebola disease management and to improve the public health emergency response ability. In addition, the proposed models of this paper also take some realistic factors, such as the difficulty degree of drug distribution and the medical service level in different epidemic areas into account to make improvements on the original model, which help the models to be more realistic in the simulation of the Ebola virus spreading process.
Keywords:Ebola Virus, Probability Model, Disease Development Course Model, System Dynamics Model

埃博拉病毒扩散最优控制系统研究
关关1,武佳倩2*
1北京邮电大学,北京
2中国科学院大学,北京

收稿日期:2016年3月11日;录用日期:2016年3月28日;发布日期:2016年3月31日

摘 要
埃博拉病毒是一种致命性的传染性疾病,严重危及人类的生命安全。准确预测传染病的发展趋势,对于及时配置和调集相关医疗资源、制定合理应对策略,解决卫生部门在应急处理中的经验误区有至关重要的意义。为有效控制该病毒的扩散,本文采用不同的方法建立埃博拉病毒传播预测模型,分别包括概率模型、病程发展模型和系统动力学模型。通过对该病毒的扩散历史中相关时序变量进行研究,寻找其传播规律,构建埃博拉传染病预测模型,可以对该病毒的未来传播情况做出预测,并对不同防控干预措施进行模拟仿真,检测不同措施的效果,为疫情区所在国家制定有效应对方案,健全公共卫生体系,为相关部门提高应急管理能力提供技术支撑和相关建议。此外,本文所构建的模型将一些现实影响因素,如药品配送难易程度,疫情区卫生服务水平等因素考虑在内,对模型进行改进,从而更为真实的模拟埃博拉病毒的蔓延扩散过程。
关键词 :埃博拉病毒,概率模型,病程发展模型,系统动力学模型

1. 引言
埃博拉病毒(或称埃博拉出血性发热)是一种由埃博拉病毒引起的人类和灵长类动物疾病。埃博拉病是一种致命性的病症,其致死率高达90%。这种疾病主要可以导致人类和灵长类动物(如猴子,大猩猩和黑猩猩)感染,其传播途径为,人类通过野生动物感染该病毒,并且在人与人之间进行传播。埃博拉首次出现在1976年,由于经常爆发在偏远地区,因此并没有引起太大的影响。但是最近爆发的埃博拉病毒感染却发生在西非一些人口密集的市区,并于2014年3月发现第一例感染者,随后从几内亚开始,跨越国界蔓延到塞拉利昂和利比里亚,又通过空中传播到尼日利亚,并由陆路传播到塞内加尔。这次爆发的埃博拉病毒感染事件是继1976年埃博拉被发现以来最大的一次感染事件,也是最复杂的一次,此次爆发导致病例数量快速增长而且死亡率很高 [1] ,并已引起国际社会各方的高度重视。
针对埃博拉病毒的近期较大规模爆发,各国都在研制相应的疫苗或者治疗药物以尽快遏制该病毒的蔓延。在所有应对政策中,对传染病蔓延和发展态势的预测是疫情处置当中的重要一环,研究传染病传播规律,并进行预测与风险评估,有助于在疫情发展早期为公共卫生部门制定防控策略和科学配置应急资源提供辅助决策支持,能够对应急物资调配,应急措施制定,人群疏导等政策制定提供重要指导,也为其他国家的防疫部署提供借鉴 [1] 。
由于传染病种类(如非典,甲流等)较多,近些年来传染病爆发频率逐步上升,目前与流行病预测相关的研究已经较为丰富。针对西非所爆发的埃博拉疫情,美国CDC制作出埃博拉病毒扩散仿真工具EbolaRsponse [2] 并利用该工具对埃博拉疫情的未来发展趋势进行预测,由于此工具所能考虑到的各种影响因素较少,模型较为简单,所得预测结果与实际值相比偏高 [3] 。文章接下来将对现有研究进行梳理和总结。
从研究内容上说,现有预测研究主要包括三大类型,一是对传染病的病程发展进行阶段划分并且构建模型,常见的有SIR,SIRT等;二是对传染病疫情发展规律进行研究,包括对各种病理参数进行估计,如基本再生数 [3] [4] ,潜伏期长度 [4] - [7] 及概率分布和传染期长度及概率分布 [2] [4] [8] ,发病率 [2] ,死亡率估计 [2] 等;三是对传染病爆发过程进行仿真模拟,研究人群的行为和政策措施的效果。
从预测研究的模型上进行分类,主要包括病程发展模型,时间序列模型和仿真模拟模型。其中病程发展模型已经较为成熟,从最初提出来的SIR [9] [10] 模型,到SEITR [4] 模型,后来又发展到SEIHFR [5] 模型。其中Chowell采用SEIR病程发展模型,主要引入了控制措施如对病人进行隔离等来研究该措施对感染者的接触传播率的影响 [4] 。在此基础上,Legrand将该模型进一步细化,根据埃博拉病毒的特性和传播机理将传染期的病例分为社区中的感染者(I)、医院中的感染者(H)、未入葬死尸传染源(F)这三个类型,也就是SEIHFR模型 [1] [5] ,而这种分类与西非的医疗条件和当地习俗较为切合 [1] ,并在美国CDC构建的埃博拉传播建模工具中也得到应用 [2] 。这些研究传播规律的微分方程模型 [11] - [13] 也称为仓室模型,并且已经在传染病预测研究中得到广泛应用 [4] [5] [14] 。而时间序列建模方法在传染病预测领域也有很多应用,如吴家兵等探讨了应用时间序列ARIMA模型鉴定传染病发病率预测的可行性 [15] 。魏珊采用时间序列分解法,对我国乙类法定报告传染病近八年来的发病趋势和发病季节性进行验证和探索 [16] 。
目前较为著名的埃博拉传染病预测和仿真模拟模型有美国CDC发布的疫情模拟工具EbolaResponse [2] ,其建模中也用到了前面所提到的仓室模型。此外,EpiFast [17] 和EpiSimdemics [18] 建模平台采用了Agent建模方法,并基于社会接触网络构建,并且由于ABM建模方法的特殊优势,这两个平台能够赋予模型中的个体更多现实特征。其中Agent建模方法在很多病毒扩散模型中有很多应用 [19] - [21] 。对于其他仿真模型,如系统动力学(System Dynamics)仿真在传染病模拟和预测中的应用也很多,如Mecoli等采用系统动力学模型对蚊媒疾病的传播进行模拟仿真,来研究相关疾病控制策略的有效性 [22] 。Huang等建立系统动力学模型区别不同年龄组的人群对川崎病流行病进行研究,并进而模拟医疗推进措施对该疾病发展趋势的影响 [23] 。
综合以上论述,现有研究对于传染病的病理规律和相关参数的估算研究较为充足,但是与非药物干预措施的有效性相关的研究明显不足,而且大多数研究在模型设置上比较简单,没有考虑疫情区的很多实际影响因素对疫情发展,应急物资调配等的影响。本文采用三种不同的建模方法(概率模型、病程发展模型、系统动力学模型)来对埃博拉病毒的发展态势进行模拟和预测,并根据疫情区的现实情况来对模型进行改进,以最大化模拟现实情景,从而比较不同方法和模型的优劣以及在实践中的意义。值得注意的是,传统的数值模型(包括概率模型和SIR病程模型)不能捕捉到除数据含义以外的其他属性特征,而系统动力学模型综合了数值模型和概念模型的优势,能够处理非线性多元数据及复杂的多属性混合系统,探究事物发展的内在机理,研究传染病在传播过程中与系统内各影响因素之间的作用关系。
此外,由于仿真模型能够很好的模拟不同政策措施对疫情发展的影响,可以根据现实政策环境的变化不断对模型进行修正,而系统动力学模型作为一种专门分析研究复杂反馈系统动态行为的系统科学方法,在实际应用中更为简便,而且在政策模拟中能够发挥其显著的优势。因此通过对埃博拉病毒的特定传播机理进行分析,本文建立埃博拉系统动力学仿真模型研究不同疾控措施(包括药物措施与非药物措施)对疫情发展的影响,从而为以后的研究提供参考,也为相关部门制定最优疾控策略提供技术支持。
2. 模型框架
首先,根据现有文献资料,传染性疾病的传播过程一般经过三个状态,即由最初的几例染病患者,通过接触等方式传播给其他易感人群,并且随着染病人数的增多,传染病进入爆发状态,传播速率加快,而后这些已经染病的患者经过一定的感染期长度转入移除状态(康复状态或者死亡状态),传染病进而由爆发状态转入衰减状态。本文的分析框架正是围绕着易感人群–染病人群–移除人群这一传播机理展开。
其次,从世界卫生组织官方网站可以获取埃博拉病毒扩散相关时序数据,通过对数据的整理和分析,挖掘数据的模式特征和本质特征,并综合不同的数据类型,选取合适的模型。本文通过对时序单元数据进行整合形成多元数据,从而实现了由数值模型(包括概率模型和SIR病程模型)向仿真模型(系统动力学模型)的过渡。不同模型各有其不同的优势和劣势,在实际应用中可以根据不同需要进行选择。
最后,基于所构建的不同模型,可以分别完成对埃博拉病毒扩散时序数据的预测,检验和比较不同应对措施的效果,并将成果应用到科学研究以及疾病防控实践之中,健全公共卫生体系,提高相关部门公共卫生管理能力。
通过以上分析,本文的框架图如图1所示。

Figure 1. The framework of the paper
图1. 文章框架图
3. 概率模型
3.1. 模型设计
相对于经典的SIR埃博拉病毒模型需要建立一系列复杂的方程式而言,我们寻求到一种更为简便的方法,那就是通过计算概率来解决对该病毒传播的预测问题。因此,我们首先建立一个概率模型,来寻求易感人群的感染率与疫情严重程度之间的关系;其次加入药物措施干预,研究其对疫情传播的影响。针对药物干预措施,我们考虑添加一个最优的药品配送中心,并进而将配送药品至不同区域的难易程度考虑在内。该模型的假设条件如下:
1) 一个地区中患病人群普及率与本地区的易感人群的被感染概率之间的关系满足指数函数关系。
2) 制药厂对研发投资的能力是固定的。
3) 药品生产之后都是首先送到药品配送中心,然后再由配送中心送往各个疫情区。
4) 药品配送的难易程度由一个难度系数来评估。药品配送中心与配送地点的距离越远,该难度系数就越小。该难度系数的值处于0与1之间。
5) 假设每个地区的人口总数是固定的,也就是说不考虑由出生、死亡、人口迁入与迁出等因素带来的人口数量变化。
6) 有且只有一个药品配送中心站点。
3.2. 变量
模型Ⅰ所涉及的变量如下:
1) 地区i ( )的患病人群普及率为
)的患病人群普及率为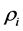 ;
;
2) 药品每周供给的总数量为C,配送到每个地区的不同药品数量为Ci;
3) 每个地区所现有的健康人群(易感人群)被感染的可能性或者感染概率为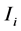 ;
;
4) 药品配送难度系数为 ,每个地区的难度系数用
,每个地区的难度系数用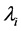 表示;
表示;
5) 不同国家的人口总数为Ai;
6) 疫情区的患病人口数量为B,不同地区的患病者人数为Bi;
7) 药品投入之后,易感人群的被感染概率为 ,不同疫情区用
,不同疫情区用 表示;
表示;
8) 由M代表药品配送中心位置,其坐标表示为(x, y);
9) 用mi代表不同疫情区,坐标表示为(xi, yi);
10) 用G代表配送中心与各疫情区的距离之和的最小值。
该模型旨在通过最优的药品配送系统来使所有地区的易感人群的感染数量P达到最小,即:
 (1)
(1)
3.3. 模型构建
从世界卫生组织官方网站获取的相关数据,我们可以拟合出一个地区易感人群被感染的概率 与该地区患病者普及率
与该地区患病者普及率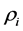 之间的关系方程,即
之间的关系方程,即 。
。
针对埃博拉病毒的药品生产出来之后,世界药品协会根据不同疫情区的疫情严重程度来配送不同数量的药品。加入药物措施干预之后,易感人群的被感染概率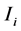 降低,这意味着易感人群中被感染者的数量
降低,这意味着易感人群中被感染者的数量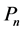 下降。假定制药厂每周可提供的药品生产总数量是C,并且所有的药品都会被分配到不同的疫情区,那么有如下关系式:
下降。假定制药厂每周可提供的药品生产总数量是C,并且所有的药品都会被分配到不同的疫情区,那么有如下关系式: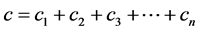
此外,送往不同疫情区的药品数量由不同疫情区的病患数量所决定,因此有:
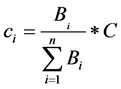 (2)
(2)
因此,我们假定抗病毒药品投入使用以后,不同疫情区易感人群的被感染概率可以表示为:
 (3)
(3)
其中不同疫情区药品配送难度系数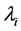 由疫情区和药品配送中心的距离决定。
由疫情区和药品配送中心的距离决定。
3.4. 结果分析
根据WHO官网数据,我们对利比里亚,塞拉利昂和几内亚这三个国家的病例数和死亡人数进行统计,并分别对易感人群的被感染概率与疫情区患病人群比例(患病人群普及率)之间的关系进行拟合,得出不同国家相应的拟合方程。其中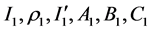 代表利比里亚国家的相关变量,
代表利比里亚国家的相关变量, 代表塞拉利昂国家的相关变量,
代表塞拉利昂国家的相关变量, 代表几内亚国家的相关变量,拟合结果如下:
代表几内亚国家的相关变量,拟合结果如下:
利比里亚: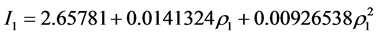 (图2)。
(图2)。
塞拉利昂: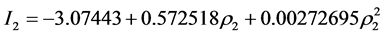 (图3)。
(图3)。
几内亚: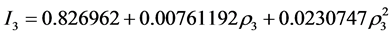 (图4)。
(图4)。
然后,我们可以根据公式(2)得出配送至这三个地区的不同药品数量:
利比里亚: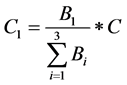 ;塞拉利昂:
;塞拉利昂: ;几内亚:
;几内亚:
据公式(3),我们可以得出这三个疫情区的易感人群被感染概率(假设不同疫情区难度系数同为1):
利比里亚: ;塞拉利昂:
;塞拉利昂: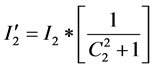 ;几内亚:
;几内亚: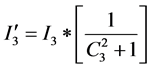
最后,我们可以根据公式(1)得到三个区域总的易感人群中被感染人数P:
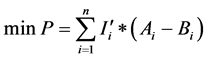 (4)
(4)
3.5. 模型改进
在3.3所介绍的基本模型中,当寻找最优配送中心地点的时候,没有考虑不同疫情区的具体情况所带来的影响,因此,在该改进模型中将会把这一重要因素考虑进来。假设:
1) 不考虑药品配送运输途中的地势地形问题,也就是说,假设在配送中心与疫情区收货地点之间的运输路线是直线。
2) 假设每个疫情区所报道的患病者人数是准确的。
3) 其他假设与3.1中基本模型的假设相同。
用 代表药品配送中心的坐标,即锚定区域的重心位置。该改进模型建立了一个囊括每个疫情区的多边形区域。根据重心算法的特征,三角形的重心位置满足三个顶点到重心的距离之和为最小。同样的,假设该模型中,多边形的所有顶点与重心的距离之和为最小。因此,在该模型中,药品配送中心的位置就是此处所建立的多边形的重心位置。
代表药品配送中心的坐标,即锚定区域的重心位置。该改进模型建立了一个囊括每个疫情区的多边形区域。根据重心算法的特征,三角形的重心位置满足三个顶点到重心的距离之和为最小。同样的,假设该模型中,多边形的所有顶点与重心的距离之和为最小。因此,在该模型中,药品配送中心的位置就是此处所建立的多边形的重心位置。
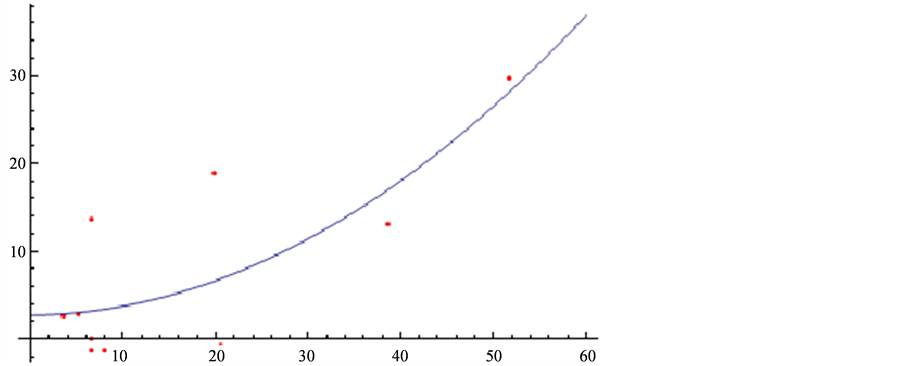
Figure 2. The probability model of Liberia
图2. 利比里亚概率模型

Figure 3. The probability model of Sierra Leone
图3. 塞拉利昂概率模型
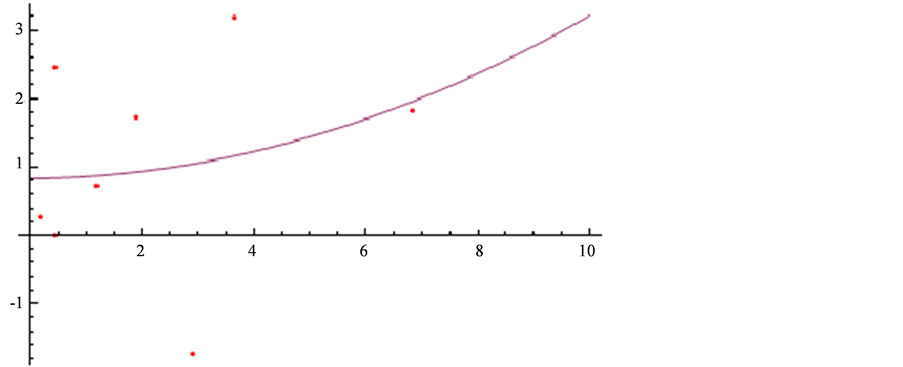
Figure 4. The probability model of Guinea
图4. 几内亚概率模型
假设该多边形具有 条边,利用基本模型与改进模型中所设置的变量,我们可以得到重心的位置为:
条边,利用基本模型与改进模型中所设置的变量,我们可以得到重心的位置为:
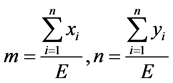 (5)
(5)
考虑到不同疫情区的具体情况,我们定义一个权重值,即:
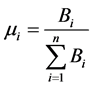 (6)
(6)
因此,我们可以获得改进模型的重心位置
 (7)
(7)
 (8)
(8)
接下来,由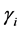 代表不同疫情区和药品配送中心的距离,由
代表不同疫情区和药品配送中心的距离,由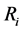 代表药品配送中心和不同疫情区的真实地理距离。因此,在基本模型中提到的不同疫情区药品配送难度系数
代表药品配送中心和不同疫情区的真实地理距离。因此,在基本模型中提到的不同疫情区药品配送难度系数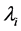 可以表示为:
可以表示为:
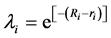 (9)
(9)
根据基本模型中的公式(3),不同疫情区的易感人群被感染概率可以表示为:
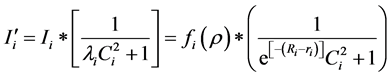 (10)
(10)
4. 病程发展模型
4.1. SIR模型
病毒的扩散过程是一个非常复杂的过程,会受到很多社会因素的限制和影响,例如,传染病患者的数量,传染速率,出生率,死亡率,疾病预防意识强弱,个体差异等等。为了简化这个问题,我们利用经典的传染病扩散模型,SIR模型来研究,该模型只需考虑易感人群(S)、染病人群数量(I)以及移除人群(R)这三个变量。该模型的假设条件如下:
假定模型中总的人口数量不变。此外,根据埃博拉病患者的特征,染病者在病毒潜伏期并不会表现出任何症状,这类人群并不能被准确识别,因此我们将这部分处于传染病潜伏期的人群归类到易感人群中,这样我们就得到下面经典的埃博拉传染病扩散模型。
4.2. 变量
该模型变量包括:易感人群S(t)、染病人群I(t)、移除人群(病愈后康复者或者死亡者)R(t)、接触传播率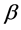 ,康复率
,康复率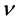 。其中接触传播率
。其中接触传播率 是由易感人群到感染者的转移速率,粗略来说就是,易感人群在与感染者的一次接触中可能患病的概率。康复率
是由易感人群到感染者的转移速率,粗略来说就是,易感人群在与感染者的一次接触中可能患病的概率。康复率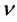 是由感染者到康复者的转移速率,如果感染者患病期限(平均传染期长度)用D表示,那么
是由感染者到康复者的转移速率,如果感染者患病期限(平均传染期长度)用D表示,那么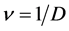 ,意思就是一个感染者在D单位时间里得到一次康复。
,意思就是一个感染者在D单位时间里得到一次康复。
4.3. 模型构建
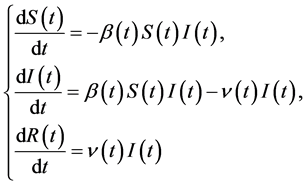 (11)
(11)
将方程组(11)转化为如下差分方程的形式:
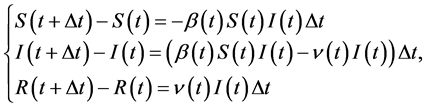 (12)
(12)
该模型由Kermack和Mckendrick二人共同于1927、1932和1933年发表的3篇运用微分方程方法研究传染病在人群中传播规律的论文构成 [11] - [13] ,该模型假定人群是均匀混合的,且疫情持续时间较短。该系统是一个非线性系统,并且不存在一个通用的解析解。然而,通过推导分析还是可以得到一些显著的结果。
4.4. 结果分析
首先由世界卫生组织官方网站获取相关数据,然后对数据进行处理:
步骤一:根据公式(12),我们对每一组数据求出每个时间点对应的接触传播率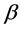 和康复速率
和康复速率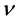 。然后我们通过一个指数方程拟合出满足
。然后我们通过一个指数方程拟合出满足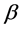 和
和 这两个参数的一般方程。
这两个参数的一般方程。
步骤二:计算出染病人群 以及死亡病例的人数。其中由于实际数据中,现阶段的康复者人数很小,大部分患者都会死亡,因此
以及死亡病例的人数。其中由于实际数据中,现阶段的康复者人数很小,大部分患者都会死亡,因此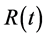 代表死亡病例人数。
代表死亡病例人数。
步骤三:搜集从2014年3月22日以来的患病者人数和死亡病例的人数。由于从该时间点开始阶段的数据及其不稳定,数据的准确性难以保证,而从真实数据趋势图(图5)可以看出从第147个数据点(即2014年8月16日)开始,数据稳定性较好,因此,我们将该时间点视为我们原始数据的起点。
采用指数方程形式对数据进行拟合,可以得到接触传播率:

其中x代表从计数点(2014年3月22日)开始的天数。通过假设检验,F = 381。将接触传播率的拟合结果曲线和真实数据进行比较,如图6所示。
同样采用指数方程形式对数据进行拟合,可以得到康复率:
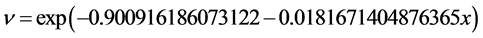
通过假设检验,F = 67。将康复率拟合结果和真实数据进行比较,得出图7。
据此,我们可以根据差分方程(12)对感染者病例数进行预测。例如,到2015年3月1日,染病人群数量达到22653,死亡病例人数(移除人群)达到9390。
同样的,根据以上介绍的思想与方法,我们可以预测几内亚,利比里亚,塞拉利昂等国家的埃博拉病毒传播情况,因为这三个国家中患病者数量非常庞大。而还有一些国家例如尼日利亚,塞内加尔,美国,西班牙,马里,英国等国家,由于感染者数量比较小,没有再出现新的感染病例,我们暂且认为这些国家的疫情处于稳定状态。
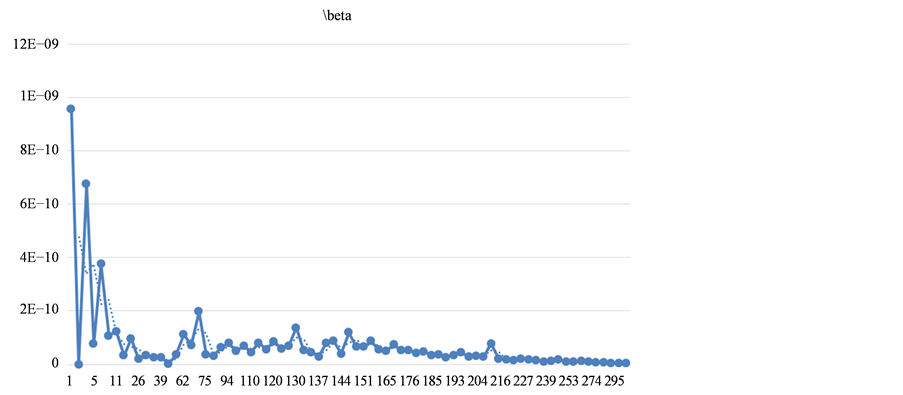
Figure 5. The fitting results of contact transmission rate
图5. 接触传播率拟合结果
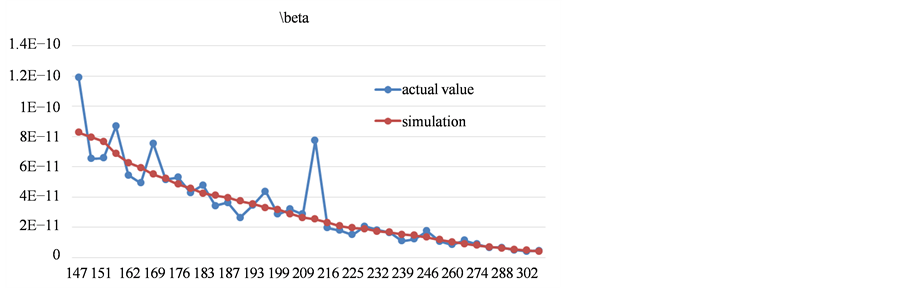
Figure 6. The comparison between fitting results and actual value of contact transmission rate
图6. 接触传播率拟合结果与实际值对比图

Figure 7. The comparison between fitting results and actual value of recovery rate
图7. 康复率拟合结果与实际值对比图
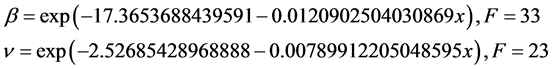
据此,我们可以依据差分方程(12)来预测几内亚感染者的人数。例如,至2015年3月1日,感染者病例达到3001,而死亡者人数达到2110。
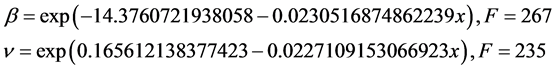
据此结果,我们可以预测利比里亚的病毒感染情况,例如,到2015年3月1日,感染者病例为8772例,死亡人数为3846例。
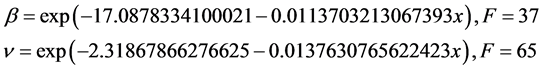
因此,可用该结果来预测塞拉利昂的病毒感染情况,例如,至2015年3月1日,感染者人数达到10,908人,而死亡病例的人数为3507人。
4.5. 改进模型:SIRT模型
在SIR模型中,模型假设总的人口数量保持不变,是一个封闭的仓室模型。而在现实情景中,疫情爆发时期依然存在着人口数量的流动,因而此处改进的模型将人口的迁入与迁出因素也考虑进来。目前,所有的国家对移居人口和感染者都采取了相对较好的隔离措施,假定移居人口不携带埃博拉病毒,得到如下的改进模型:
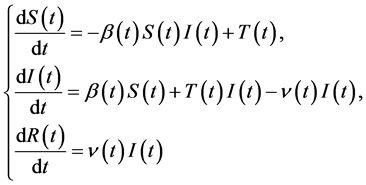
其中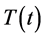 代表迁居到该国的人数。然而,当埃博拉病毒爆发之时,由于无法获知每个国家移居的人口数量,因此暂时无法模拟测算该模型。
代表迁居到该国的人数。然而,当埃博拉病毒爆发之时,由于无法获知每个国家移居的人口数量,因此暂时无法模拟测算该模型。
5. 系统动力学模型
5.1. 因果回路图
根据埃博拉病毒的传播和蔓延特征,绘制出系统的因果回路图,如图14所示。
B1:易感人群的数量越多,潜在的可以被感染的人越多,感染速率就越大;感染速率越大,越多未受感染的人成为染病的人,从而未受感染的人越少。这是一个平衡回路,它使得感染速率不会一直上升,从而使得传染病的传播具有S型增长特征,在染病人群达到峰值以后,感染速率将会下降。
R1:染病人群越多,就有越多的人可以去传染给那些还处在健康状况的易感人群,感染速率就会升高;而感染速率越高,就会使更多的人从易感人群成为染病人群。这是一个加强型回路,它在传染病开
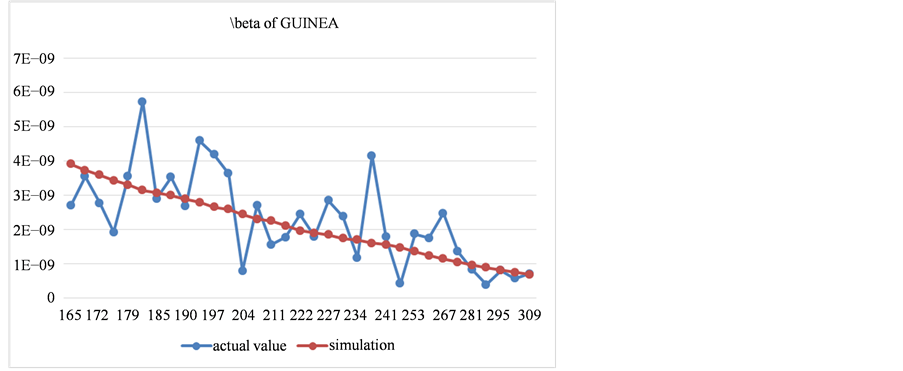
Figure 8. The comparison between fitting results and actual value of contact transmission rate in Guinea
图8. 几内亚接触传播率拟合结果与实际值对比图

Figure 9. The comparison between fitting results and actual value of recovery rate in Guinea
图9. 几内亚康复率拟合结果与实际值对比图
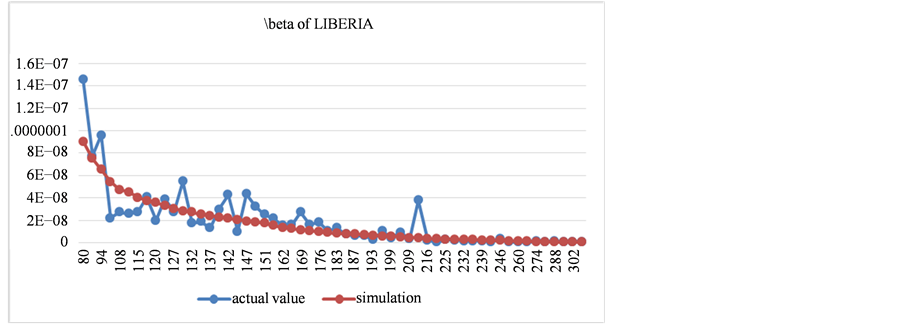
Figure 10. The comparison between fitting results and actual value of contact transmission rate in Liberia
图10. 利比里亚接触传播率拟合结果与实际值对比图

Figure 11. The comparison between fitting results and actual value of recovery rate in Liberia
图11. 利比里亚康复率拟合结果与实际值对比图

Figure 12. The comparison between fitting results and actual value of contact transmission rate in Sierra Leone
图12. 塞拉利昂接触传播率拟合结果与实际值对比图
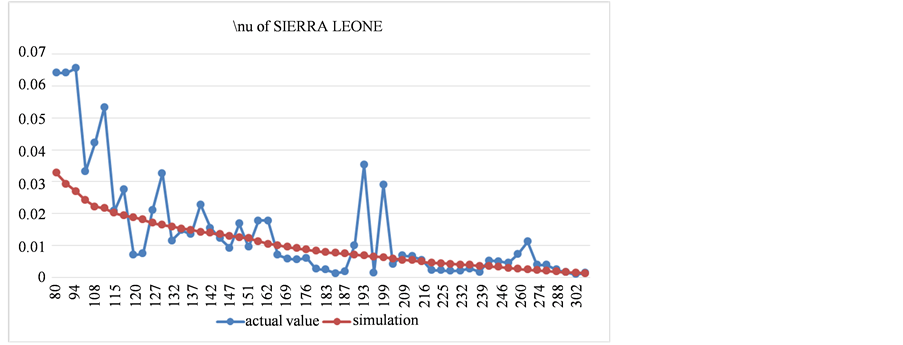
Figure 13. The comparison between fitting results and actual value of recovery rate in Sierra Leone
图13. 塞拉利昂康复率拟合结果与实际值对比图

Figure 14. Causal feedback loop diagram of Ebola virus infectious system
图14. 埃博拉病毒传播系统因果反馈回路图
始时使易受感染的人数增加越来越快,从而使得传染病的传播在初期呈现出指数增长的模式。
B2:染病人群数量越多,移除该系统的人数也就越多,由于埃博拉病毒致死率较高,移除人群主要是死亡人群;死亡的人越多,染病人群的数量就开始下降,这样使得移除速率不会一直升高。这也是一个平衡回路,它控制了染病人群的数量不会一直增加。
5.2. 系统流图
根据因果回路图绘制出系统流图。如图15所示。
埃博拉病毒爆发的初期阶段,只有小部分人患病,大部分都是健康人群,属于潜在的易感人群(S),染病人群(I)的数量虽然很少,但是由于R1加强回路的影响,大量的易感人群,通过接触等方式感染病毒,从而转为了染病人群,推动感染速率(IR)升高,导致染病人群数量急剧指数上升(图15中所侧箭头所示)。
随着染病人群的数量(I)越来越高,那些患病者经历平均传染期长度(DT)之后,成为移除人群(R),大部分埃博拉病患者会死亡,从而使得一大部分染病者转移成为死亡人群(图15中右侧箭头所示),移除速率表示为RR。
其主要方程式如下:
 (13)
(13)
 (14)
(14)
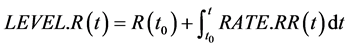 (15)
(15)
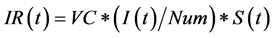 (16)
(16)
 (17)
(17)
 (18)
(18)
其中,方程(13)、(14)、(15)是三个状态变量LEVEL对速率变量RATE的积分方程,而方程(16)、(17)是速率变量的表达式,接触得病速率(VC)、人口总数(Num)以及平均感染期长度(DT)都是辅助变量。
5.3. 政策模拟
埃博拉病毒爆发之后,随着对该病的认识与研究的深入,政府及卫生部门将会采取相应的应对措施,一般来说分为药物措施和非药物措施(如隔离)。其中药物措施中又包括预防药物(如疫苗)和治疗药物。由于用于治疗的药物研发所需时限较长,且在整个传染病发展过程中属于较为被动的应对措施,因此,本文着重研究时效较短且用途较为广泛的药物应对措施——疫苗接种。

Figure 15. Flow diagram of Ebola virus infectious system
图15. 埃博拉病毒传播系统流图
5.3.1. 药物措施–接种效果模拟
通过对易感人群进行疫苗接种,感染速率能够得到很好控制,从而能够避免传染病的大规模爆发。但是该措施在具体实施过程中仍然面临着一些现实困难。由于在传染病爆发阶段,短期的疫苗需求量急剧增长,疫苗的配送(lamda)和供应(VS)难度会相应增加,同时由于每日接种能力和容量(Nma)有限,整个疫情区的医疗资源将会十分紧张,疫苗接种速率(VV)会受到限制,这些因素都将影响接种措施的实际效果。
此外,疫苗研制和应用初期,资金投入较大,对于成本较高的疫苗可以通过控制疫苗接种人群的比例,达到疾病传播控制和成本节约的双重目标。具体来说,当一个地区的已接种人群占人口总数的比例(PI)降到一定程度时,接触感染速率(VC)已经很低,从而能够大大降低感染速率,即便不对所有易感人群进行接种,传染病也能够得到有效的控制。接种措施下的系统流图如图16所示。
接种措施下的主要方程如下:
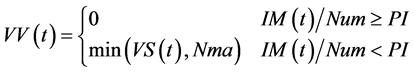 (19)
(19)
 (20)
(20)
其中方程式(19)表示,当该地区总人口接种比例超过预定的成本控制比例阀值(PI)时,已经接种的人群比例已经很高,大部分人已经不会再被感染,传染病将会无法流行起来,此时停止接种,接种速率为零,可以有效节约总的疫苗成本;而当接种比例未达到该预定阀值时,疫苗接种速率(VV)将受限于当地卫生服务能力的最高容量(Nma)和疫苗供应速率(VS)的大小。
方程式(20)表示疫苗供应速率(VS)由该地区人口占总的疫情人口的比重(w)、疫苗的总供给量(Supply)、疫苗配送难度系数(lamda)、以及该地区疫情严重程度(即染病人群比例(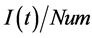 ))共同决定。
))共同决定。
通过对接种比例阀值(PI)、疫苗配送难度系数(lamda)以及每日接种最大容量(Nma)的取值进行多种情景设定,选取不同应对策略进仿真分析,可以比较不同策略的优劣和效果,有助于传染病最优控制策略的制定。其中增加疫苗购买资金投入可以提高接种比例阀值(PI);提高卫生服务能力(包括调集医务人员,增扩接种场地等)可以提高每日接种最大容量(Nma);投入资金改善医疗资源配送条件(如增派直升机空运疫苗,购买冷藏贮存设备等)可以降低疫苗配送难度系数(lamda)。
5.3.2. 非药物措施–隔离效果模拟
相对于药物控制措施来说,非药物措施如隔离具有成本低,操作简便等优点,在传染病防控管理中具有广泛应用。首先,隔离就是将具有传染性的染病患者隔离到一定的空间中,避免与外界(易感人群)接触,从而降低感染速率(IR)和染病人群(I)总数,控制传染病的大规模扩散和传播。即便如此,当传染病爆发较为迅速和突然的状况下,短期内对医疗医护人员和隔离所需空间场地(Space)、医疗工具等的需求

Figure 16. Flow diagram of Ebola virus infectious system in vaccination scenario
图16. 采用接种措施下的埃博拉病毒传播系统流图
将会急剧增长,因此在实际应用中,这些因素往往会对隔离措施的效果,即隔离速率(QR)有很大影响。从节约成本的角度考虑,通过设定每天隔离染病人群的不同比例(PQ)可以模拟出最优比例,从而达到节约成本和控制传染病传播的目标。隔离措施下的系统流图如图17所示。
隔离措施下的主要方程设定如下:
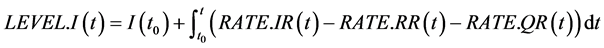 (21)
(21)
 (22)
(22)
 (23)
(23)
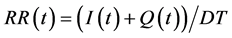 (24)
(24)
 (25)
(25)
其中,方程式(21)代表状态变量染病人群(I)对流率变量的积分,其中感染速率(IR)为流入速率变量,移除速率(RR)及隔离速率(QR)为流出速率变量。
方程(23)代表感染速率(IR)由接触得病速率(VC)及未隔离染病人群(I-Q)决定。方程(24)代表隔离措施下,移除速率由隔离染病人群(Q)和未隔离染病人群(I-Q)的总数及平均感染期长度(DT)决定。
方程(25)表示,当隔离比例已经达到预定阀值比例(PQ)时,停止隔离;否则,将继续实行隔离,隔离速率(QR)受到当地医疗条件如医务人员队伍和隔离场地的限制,因此将由每天规定比例的隔离人群和每天最高隔离人数容量(Qma)两者中的较小者决定。其中,每天隔离人数容量将会因政府资金投入和医疗资源调配能力提高而得到改善,改善状况由新增医疗资源速率(VA)代表。
通过对隔离比例阀值(PQ)、新增医疗资源速率(VA)的取值进行多种情景设定,选取不同应对策略进仿真分析,可以比较不同策略的优劣和效果,从而制定出最优的传染病传播控制系统。
6. 模型比较与评价
1) 概率模型
该模型的优势有如下三个方面:

Figure 17. Flow diagram of Ebola virus infectious system in isolation scenario
图17. 采用隔离措施下的埃博拉病毒传播系统流图
① 数据获取容易。在上文所提到的SIR模型和系统动力学模型中,诸如处于潜伏期人口的数目,移居人口的数量,接触得病速率等无法直接获取,但是在概率模型II中,我们只需要感染者数据和总的人口数目,并且各疫情流行区之间的协调也很容易搜集。
② 简捷性。相比于上文所提到的SIR模型和系统动力学模型,概率模型很容易计算和理解,不需要计算复杂的差分方程和使用仿真软件,这种模型思想简单。
该模型的缺点有以下几点:
① 模型仅仅考虑只存在一个药品配送中心的情况,没有考虑成本、药品的数量、生产的速度和很多其他因素。
② 只考虑了由患病者比例来决定疫情严重程度,实际上,在不同地区,由埃博拉病毒引发的灾难的严重程度系数应该将诸如经济环境、人口密度、受该病毒影响的区域面积等因素考虑进去。然而,如果这样考虑将很难决定准确的系数,因此我们只是简单将感染率作为系数来进行研究。
2) 病程发展模型
该模型的优势有如下四个方面:
① 该模型是基于大量数据建立的。由于拟合出来的方程,结合了很多地区的众多数据点,数据的轻微波动不会给最终结果造成显著的影响。
② 本节中的SIR模型是由传统的模型改进得到的,因此该模型具有很高的可信赖度。
③ 模型构建中所选取的数据相对比较稳定。模型舍弃了埃博拉病毒突然爆发时最初阶段的数据点。因此,我们模拟的数据结果与真实结果相比误差幅度较小。
该模型的缺点有以下几点:
① 为了简化该问题,SIR模型没有考虑一部分变量,例如总人口中出生率和死亡率(包括患病死亡和自然死亡)的影响、以及每个疫情区所在国家控制疫情传播的能力的差异。
② 模型假定药品生产速度完全满足不同疫情区对药物的需求。如果现实中药品生产速度远低于理想水平,那么我们需要更深入的优化研究。
③ 埃博拉病毒可能对新药物存在抗药性。在我们的模型中,假定药物疗效保持在稳定状态。然而,在现实中,埃博拉病毒自身的变异可能会带来更多的问题。
3) 系统动力学模型
该模型的优势有:
① 系统动力学作为一种复杂的反馈性系统,能够很好的模拟非线性,高阶次,多重反馈和时间延迟的复杂时变社会系统。
② 能够非常方便的对不同政策措施进行模拟,将众多现实因素(如医疗服务水平,疫苗供应速度,政府调配资源的能力,政府资金投入能力等)考虑在内,实现数据的多元化。
③ 可以通过表函数的形式对某些无规律性变量进行建模,因此数据更为真实。
④ 提供因果回路图、系统流图以及政策仿真流图,便于梳理逻辑,思路清晰直观。
该模型的缺点有:
① 前期梳理工作较重,需要绘制各种图形。
② 需要搜集大量数据,有些辅助变量如疫苗配送难度系数,新增医疗资源速率等数据难以获得。
③ 需要准确识别变量之间的因果关系,建立一系列的方程,工作量较大。
7. 结论
传染病的爆发和蔓延对人类的生命构成严重威胁,做好对传染病的预测,有助于在疫情发展早期为公共卫生部门制定科学合理的防控策略和优化应急资源配置提供辅助决策支持,为公共卫生决策提供重要的参考依据。本文首先对以往传染病发展趋势预测的相关研究进行梳理,总结不同方法的优势与不足,然后基于历史资料和数据,构建不同的预测模型,并根据现实情况对其进行改进,从而最大程度的模拟现实情景中埃博拉病毒的传播过程,最后对一些重要防控措施,如接种预防、调配医疗资源和隔离传染源等措施的有效性进行仿真模拟。
通过对比,本文所构建的三个模型各有优劣,其中概率模型通过寻找疾病的传播规律,建立患病人群普及率与易感人群的感染概率之间的关系,并能够利用这种关系来预测未来感染者的数量,从而决定对抗病毒药品的需求。该模型虽然简单但是不够精确。而病程发展模型历经多年的发展和改进已经非常成熟,构成了流行病学的基石,该模型是基于大量数据拟合得出,具有较高的稳定性和可信度,能够很好的模拟和预测传染病的发展过程和趋势,为流行病学提供了重要的技术参考。由于考虑到疫情区人口数量的流动问题,文章在4.5节对原有的封闭式仓室模式进行改进,并提出SIRT模型。最后,在以上两个模型的基础上,又构建了埃博拉病毒传播系统动力学模型,将众多现实影响因素考虑在内,弥补了前两个模型的很多不足之处,进而更为真实的模拟埃博拉的传播过程,并对不同干预措施的有效性进行情景仿真,寻求最优的传染病控制策略。
综上所述,本文所构建的模型能够进一步细化现有传染病模型,考虑到更多现实影响因素,从而更真实的反映埃博拉病毒的扩散过程,其中通过对不同防控干预措施的效果进行仿真,能够为相关部门提供最优控制决策支持和技术指导,而不同模型中对现实因素的考虑也能够为今后的研究提供参考。然而,现实中仍然有很多需要考虑的因素,其中规律性变量例如抗病毒药品的疗效,药品配送中心的位置和当地国家的经济环境等因素,是未来我们继续对模型进行进一步优化的努力方向。
文章引用
关 关,武佳倩. 埃博拉病毒扩散最优控制系统研究
Study on Optimal Control System of Ebola Disease[J]. 服务科学和管理, 2016, 05(02): 48-66. http://dx.doi.org/10.12677/SSEM.2016.52006
参考文献 (References)
- 1. 徐致靖, 徐展凯, 刘列, 祖正虎, 郑涛. 关于西非埃博拉疫情态势预测研究的总结分析[J]. 生物技术通讯, 2015, 26(1): 22-32.
- 2. Meltzer, M.I., Atkins, C.Y., Santibanez, S., et al. (2014) Estimating the Future Number of Cases in the Ebola Epidemic—Liberia and Sierra Leone, 2014-2015 [J]. MMWR Surveill Summ, 63, 1-14.
- 3. Butler, D. (2014) Models Overestimate Ebola Cases. Nature, 515, 1. http://dx.doi.org/10.1038/515018a
- 4. Chowell, G., Hen-gartner, N.W., Castillo-Chavez, C., et al. (2004) The Basic Reproductive Number of Ebola and the Effects of Public Health Measures: The Cases of Congo and Uganda. Journal of Theoretical Biology, 229, 119-126. http://dx.doi.org/10.1016/j.jtbi.2004.03.006
- 5. Legrand, J., Grais, R.F., Boelle, P.Y., et al. (2007) Understanding the Dynamics of Ebola Epidemics. Epidemiology and Infection, 135, 610-621. http://dx.doi.org/10.1017/S0950268806007217
- 6. Bwaka, M.A., Bonnet, M.J., Calain, P., et al. (1999) Ebola Hemorrhagic Fever in Kikwit, Democratic Republic of the Congo: Clinical Observations in 103 Patients. Journal of Infectious Diseases, 179, S1-S7. http://dx.doi.org/10.1086/514308
- 7. Ndambi, R., Akamituna, P., Bonnet, M.J., et al. (1999) Epidemiologic and Clinical Aspects of the Ebola Virus Epidemic in Mosango, Democratic Republic of the Congo, 1995. Journal of Infec-tious Diseases, 179, S8-S10. http://dx.doi.org/10.1086/514297
- 8. Rowe, A.K., Bertolli, J., Khan, A.S., et al. (1999) Clinical, Virologic, and Immunologic Follow-Up of Convalescent Ebola Hemorrhagic Fever Patients and Their Household Contacts, Kikwit, Democratic Republic of the Congo. Journal of Infectious Diseases, 179, S28-S35. http://dx.doi.org/10.1086/514318
- 9. Milner, F.A., Iannelli, M. and Feng, Z. (2002) A Two-Strain Tuberculosis Model with Age of Infection. SIAM Journal on Applied Mathematics, 62, 1634-1656. http://dx.doi.org/10.1137/S003613990038205X
- 10. Riley, S., Fraser, C., Donnelly, C.A., et al. (2003) Trans-mission Dynamics of the Etiological Agent of SARS in Hong Kong: Impact of Public Health Interventions. Science, 300, 1961-1966. http://dx.doi.org/10.1126/science.1086478
- 11. Kermack, W.O. and McKendrick, A.G. (1991) Contributions to the Mathematical Theory of Epidemics. I. 1927. Bulletin of Mathematical Biology, 53, 33-55.
- 12. Kermack, W.O. and McKendrick, A.G. (1932) Contributions to the Mathematical Theory of Epidemics. II. The Problem of Endemicity. Proceedings of the Royal Society of London, Series A, 138, 55-83. http://dx.doi.org/10.1098/rspa.1932.0171
- 13. Kermack, W.O. and McKendrick, A.G. (1933) Contributions to the Mathematical Theory of Epidemics. III. Further Studies of the Problem of Endemicity. Proceedings of the Royal Society of London. Series A, Containing Papers of a Mathematical and Physical Character, 141, 94-122. http://dx.doi.org/10.1098/rspa.1933.0106
- 14. Lekone, P.E. and Finkenstädt, B.F. (2006) Statistical Inference in a Stochastic Epidemic SEIR Model with Control Intervention: Ebola as a Case Study. Biometrics, 62, 1170-1177. http://dx.doi.org/10.1111/j.1541-0420.2006.00609.x
- 15. 吴家兵, 叶临湘, 尤尔科. ARIMA模型在传染病发病率预测中的应用[J]. 数理医药学杂志, 2007, 20(1): 90-92.
- 16. 魏珊. 我国乙类法定报告传染病的发病趋势和季节性研究[D]. 上海: 复旦大学, 2013.
- 17. Bisset, K.R., Chen, J., Feng, X., et al. (2009) EpiFast: A Fast Algorithm for Large Scale Realistic Epidemic Simulations on Distributed Memory Systems. Proceedings of the 23rd International Conference on Supercomputing, ACM, 430-439.
- 18. Barrett, C.L., Bisset, K.R., Eubank, S.G., et al. (2008) Epi-Simdemics: An Efficient Algorithm for Simulating the Spread of Infectious Disease over Large Realistic Social Networks. Proceedings of the 2008 ACM/IEEE Conference on Supercomputing, IEEE Press, 37.
- 19. 朱悦. 甲型H1N1流感病毒的主体建模防控仿真研究[D]. 北京: 首都经济贸易大学, 2010.
- 20. 许骏. 基于复杂网络的传染病突发事件应急管理研究[D]. 武汉: 华中科技大学, 2013.
- 21. 梅珊. 基于复杂Agent网络的病毒传播建模和仿真研究[D]. 长沙: 国防科学技术大学, 2010.
- 22. Mecoli, M., De Angelis, V. and Brailsford, S.C. (2013) Using System Dynamics to Evaluate Control Strategies for Mosquito-Borne Diseases Spread by Human Travel. Computers & Operations Research, 40, 2219-2228. http://dx.doi.org/10.1016/j.cor.2012.03.007
- 23. Huang, S.K., Lin, M.T., Chen, H.C., et al. (2013) Epidemiology of Kawasaki Disease: Prevalence from National Database and Future Trends Projection by System Dynamics Modeling. The Journal of Pediatrics, 163, 126-131.
*通讯作者。