Open Journal of Nature Science
Vol.05 No.02(2017), Article ID:20547,7
pages
10.12677/OJNS.2017.52016
Relationship between Polycystic Ovary Syndrome and Hyperuricemia
Ruru Sun1, Jie Shen2
1The First Clinical Medical College of Nanjing Medical University, Nanjing Jiangsu
2The First Affiliated Hospital with Nanjing Medical University Department of Endocrinology and Metabolism, The Center of Immunological Genetics and HLA Typing, Nanjing Jiangsu

Received: Apr. 27th, 2017; accepted: May 11th, 2017; published: May 18th, 2017

ABSTRACT
During the development of polycystic ovary syndrome, some patients will appear an increase in blood uric acid levels than that of the normal population. As one of the characteristic factors of metabolic syndrome, the occurrence and development of hyperuricemia is closely associated with insulin resistance, hyperandrogenemia and hyperinsulinemia in patients with PCOS. In addition, hyperuricemia has a series of effects on recent symptoms and long-term complications of PCOS. Therefore, in order to reduce the complications and improve prognosis, patients with PCOS, who are complicated by hyperuricemia, should be given good attention and symptomatic treatment.
Keywords:Polycystic Ovary Syndrome, Insulin Resistance, Metabolic Syndrome, Hyperuricemia, Complications
多囊卵巢综合征与高尿酸血症的关系
孙茹茹1,沈捷2
1南京医科大学第一临床医学院,江苏 南京
2南京医科大学第一附属医院内分泌科,移植免疫与HLA检测中心,江苏 南京
收稿日期:2017年4月27日;录用日期:2017年5月11日;发布日期:2017年5月18日

摘 要
部分多囊卵巢综合征患者在疾病过程中会出现血尿酸水平比自然人群高的情况,作为代谢综合征的特征性因素之一,高尿酸血症的发生、发展与PCOS患者的胰岛素抵抗、高胰岛素血症及高雄激素血症等密切相关,并对多囊卵巢综合征患者的近期症状及远期并发症的发生发展产生一系列影响。因此,对并发高尿酸血症的多囊卵巢综合征患者,应给予必要的关注,对症治疗,患者治疗宜个体化,以减轻和减少并发症,促进患者恢复,改善预后。
关键词 :多囊卵巢综合征,胰岛素抵抗,代谢综合征,高尿酸血症,并发症

Copyright © 2017 by authors and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY).
http://creativecommons.org/licenses/by/4.0/


1. 引言
多囊卵巢综合征(Polycystic Ovarian Syndrome, PCOS)有其独特的流行病学特点,按ESHRE/ASRM诊断标准,PCOS的主要受累群体为20~35岁的育龄妇女,它在不同国家、不同种族及不同年龄人群的发病情况和临床表现也不尽相同 [1] 。目前国外报道的PCOS患病率约为育龄妇女的5%~10% [2] ,曾有报道显示国内PCOS患病率占不孕人群的30%~40%,占不排卵性不孕的75%左右 [3] 。较之欧美人群,中国PCOS患者月经紊乱的构成比较高,而高雄激素血症和肥胖的构成比较低。
PCOS表现为妇科疾患,实质是育龄女性最常见的内分泌疾病,近期代谢改变可使女性出现月经紊乱及不育,远期则引起一系列的内分泌及代谢紊乱 [4] 。PCOS患者因存在胰岛素抵抗而成为代谢综合征(metabolic syndrome, MS)的高危人群。MS是一种代谢成分异常集聚,严重影响机体健康的代谢症候群,其基础是胰岛素抵抗(insulin resistance, IR)。IR是指胰岛素外周靶组织对内源性或外源性胰岛素的敏感性和反应性下降,导致生理剂量的胰岛素产生低于正常的生理效应,机体为克服IR会产生代偿性高胰岛素血症。IR被认为是PCOS发生、发展的重要病理机制之一,胰岛素本身也会影响糖、脂、蛋白质及核酸的代谢。高尿酸血症(hyperuricemia, HUA)是嘌呤代谢异常导致的疾病,是代谢综合征重要的组成部分。近年来,随着我国人民生活水平不断提高,其患病率相应上升。刘必成等人的研究发现中国成人中高尿酸血症的矫正患病率8.4%,并有男性(9.9%)高于女性(7.0%),城市(14.9%)高于农村(6.6%)的分布特点 [5] 。然而,在临床接诊中发现,PCOS患者高尿酸血症的发病率明显高于正常人群的平均比率,已然成为高尿酸血症的多发人群,且血尿酸水平升高会加重PCOS患者相关代谢异常症状,对PCOS发展和转归的影响也不容小觑。因此笔者将就多囊卵巢综合征和高尿酸血症之间的相互作用关系进行总结和阐述。
2. 多囊卵巢综合征患者高尿酸血症的成因
2.1. PCOS患者血尿酸水平与IR的关系
胰岛素抵抗与血尿酸水平密切相关,可能通过以下机制导致高尿酸血症:① 高水平的胰岛素可促进肾小管的Na+-H+交换。Na+重吸收增加使得尿酸的被动重吸收随之增加 [6] ;② IR状态下,肝内脂肪合成增加,嘌呤分解代谢活跃,尿酸生成相应增加 [7] ;③ IR状态下,糖酵解过程的中间代谢产物5-磷酸核糖及磷酸核糖焦磷酸增加,导致尿酸生成增多 [8] ;④ IR激活肾素–血管紧张素系统,使乳酸产生增加,通过竞争性抑制使肾小管上皮细胞,使尿酸分泌减少 [9] (见图1)。
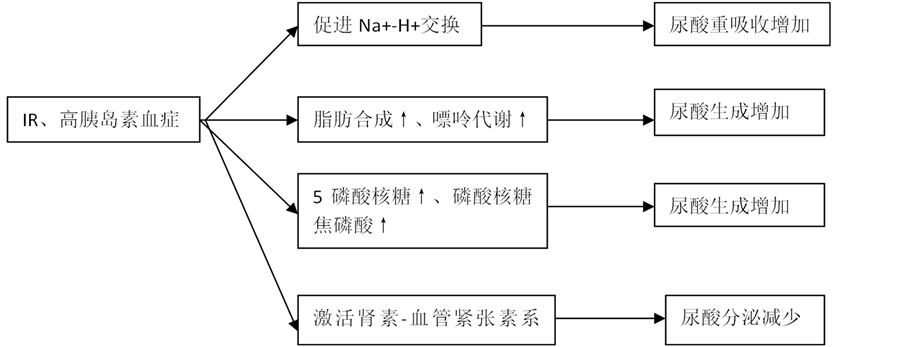
Figure 1. Causes of Hyperuricemia
图1. 高尿酸血症的成因
2.2. PCOS患者血尿酸水平与高雄激素血症的关系
PCOS患者高尿酸血症的形成与性激素水平的变化密切相关,雌激素和雄激素水平的相对平衡有助于对抗高尿酸状态。
雌激素是HUA的保护因素,它通过上调肾小管上皮细胞的人尿酸转运蛋白(hUAT)基因的表达,促进肾脏尿酸排泄,从而预防HUA的发生。同时,雌激素可使细胞磷脂膜抵抗尿酸盐结晶沉积,并且对肾脏排泄尿酸有促进作用 [10] 。雌激素还能影响脂质代谢,通过降低胆固醇和低密度脂蛋白而间接降低HUA发生的风险。
雄激素则是HUA的促进因素,它通过下调hUAT基因的表达促进肾小管对尿酸的重吸收、减少肾小管尿酸的分泌,以加速HUA的发生。同时,雄激素会使细胞器的磷脂膜对尿酸盐结晶有易感性而引起细胞反应,使尿酸盐结晶在细胞沉积而引起病损 [11] 。
2.3. PCOS患者血尿酸水平与肥胖的关系
肥胖也是PCOS患者重要特征之一,并与HUA关系密切。张长青 [12] 等人在对960例无心血管病症状的普通社区人群进行体重指数与高尿酸血症发生情况的临床研究中发现,校正混杂因素后,BMI高者发生高尿酸血症的危险是BMI低者的5.38倍,血尿酸水平与肥胖呈显著相关。分析肥胖引起高尿酸血症的机制,除考虑生活习惯及酒精摄入等环境因素外,还要考虑内脏脂肪蓄积伴随的尿酸生成过多、IR引发的肾脏尿酸排泄功能下降等因素。Matsuura [13] 等在研究肥胖类型与高尿酸血症的关系时发现,中心型肥胖以血尿酸产生过多为主要表现,而周围型肥胖则以尿酸排泄不良为主要表现。肥胖导致血尿酸水平升高的机制也主要与这两个方面有关。
一方面,当内脏脂肪过度蓄积时,门脉系统的游离脂肪酸增多,肝脏脂肪酸合成亢进,NADP-NADPH介导的由5-磷酸核糖向磷酸核糖焦磷酸进行的从头合成系统亢进,甘油三酯的合成及尿酸的产生增多;另一方面,尿酸排泄功能下降主要是因为胰岛素抵抗导致肾小管对Na+的转运发生变化,尿钠排泄增多,而与其共同转运的尿酸排泄减少,进而发生高尿酸血症 [14] 。
3. 高尿酸血症对PCOS患者的症状及并发症的影响
3.1. HUA对IR的影响
高尿酸血症与胰岛素抵抗具有相互促进的作用。相关研究发现,HUA组空腹及葡萄糖负荷后各时段的胰岛素、C肽水平高于正常尿酸组,提示HUA患者易发生高胰岛素血症和IR;HUA组腹围、体重指数、TG均高于正常尿酸组,而LDL-C低于正常尿酸者,表明HUA常与胰岛素抵抗相伴行 [15] 。
高尿酸血症加重IR与炎症反应及氧化应激有关。HUA可以引起内皮源性NO减少,导致内皮功能损伤,并能够直接作用于脂肪细胞,促使脂肪细胞发生炎症反应和氧化应激,而氧化应激和炎症反应对胰岛素抵抗具有先导作用。
3.2. HUA对糖尿病的影响
糖尿病是PCOS患者的远期并发症之一,最近的荟萃分析指出PCOS患者糖耐量损伤的风险比非PCOS患者高2.5倍,患2型糖尿病的风险高4.5倍 [16] 。而尿酸与血糖联系密切,两者的代谢均要经过糖酵解途径,其中的关键酶3-磷酸甘油醛脱氢酶受胰岛素的调控。PCOS患者的血尿酸水平升高会引起该酶活性减低,并启动多元醇通路、己糖胺通路,使糖基化终末产物形成增加,参与胰岛素抵抗形成及血管内皮损伤,最终致糖尿病及其并发症的发生;另一方面,长期高尿酸血症可使尿酸盐结晶沉积在胰岛β细胞,导致β细胞功能受损,引起糖代谢紊乱 [17] 。
3.3. HUA对血脂代谢的影响
血脂异常在PCOS患者中很普遍,它的发生与高尿酸血症有关,可能机制为:① 促进游离脂肪酸代谢途径:甘油三酯降解生成的部分游离脂肪酸再酯化进入其他组织会提高ATP的利用率,引起更多游离脂肪酸的生成和利用 [18] 。② 加强磷酸戊糖代谢过程:过多的游离脂肪酸可促进尿酸的从头合成,在5-磷酸核糖生成磷酸核糖焦磷酸的过程中,通过还原型烟酰胺腺嘌呤二核苷酸磷酸或烟酰胺腺嘌呤二核苷酸磷酸(NADPH/NADP)的共同代谢通路导致高尿酸血症;同时NADPH也是脂肪合成所需氢原子的来源,磷酸戊糖代谢的增强可促进脂肪合成的增多,引起血甘油三酯升高 [19] 。③ 降低甘油三酯分解代谢酶的活性和数量:HUA可能会减少与甘油三酯代谢相关酶的数量或降低其活性,从而引起血甘油三酯水平升高;高尿酸血症患者3-磷酸甘油醛脱氢酶的活性降低,使尿酸及甘油三酯合成增加,进而导致尿酸和甘油三酯水平明显上升;体内尿酸水平的增高导致脂蛋白脂酶活性降低,甘油三酯分解减少,使血中甘油三酯进一步升高。
3.4. HUA对CVD的影响
CVD作为PCOS的远期并发症之一 [20] ,血尿酸水平的升高在其发展过程中起了重要作用,其可能机制如下:① 损伤内皮功能。尿酸合成过程中产生的超氧阴离子可灭活内皮舒张因子NO,形成强氧化剂过氧亚硝基阴离子,黄嘌呤氧化还原酶可以干扰NO依赖的信号转导通路;② 尿酸激活血小板,促进血小板粘附、聚集,促进血栓形成;③ 增加氧化应激,促进氧化低密度脂蛋白及脂质过氧化 [21] ;④ 促增殖和促炎作用。尿酸通过有机阴离子转运体进入平滑肌细胞,改变胞内的氧化还原作用,激活MAPK、核转录因子等刺激细胞增殖,并激活单核细胞趋化蛋白21 (MCP21),使细胞因子合成增多(见图2)。
3.4.1. 对机体大血管病变的影响
HUA对动脉粥样硬化的形成有一定促进作用,可能机制为:① 血管沉积与损伤:尿酸在血液中的溶解度低,HUA易析出,沉积于血管壁,引发局部炎症,直接损伤血管内膜;② 高尿酸血症促进低密度脂蛋白氧化和脂质过氧化;③ 增加氧自由基:尿酸是嘌呤及黄嘌呤氧化酶代谢途径生成氧自由基时的终末产物,尿酸生成增多的同时,氧自由基也相应增多,从而参与血管炎症反应;④ 尿酸盐作为炎性物质,通过经典和旁路途径激活补体,刺激中性粒细胞和肥大细胞,促进血小板聚集和血栓形成,血小板释放的细胞因子使血管平滑肌增生;⑤ 高尿酸血症是MS的重要组成部分,常与高胰岛素血症和血脂紊乱相伴行,尿酸可能通过这些因素的综合作用,引起动脉粥样硬化 [22] (见图3)。
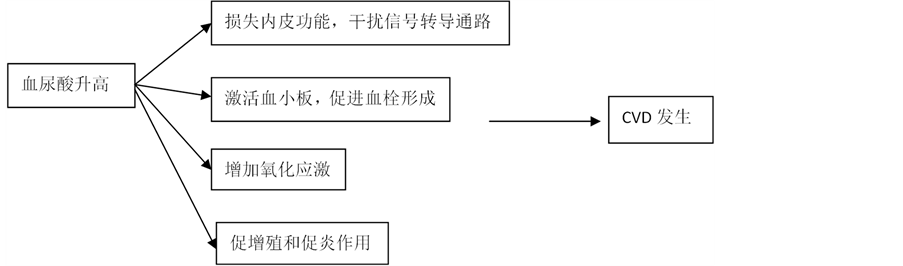
Figure 2. Mechanism of BUA
图2. 血尿酸的作用机制

Figure 3. Formation of atherosclerosis
图3. 动脉粥样硬化的形成
3.4.2. 对机体微血管病变的影响
微血管是指微小动脉与微小静脉之间,管腔直径在100 μm以下的毛细血管及微血管网。高尿酸血症引起的微血管病变主要表现为尿酸性肾病。发生高尿酸血症时大量的尿酸盐沉积于肾髓质和锥体,导致肾间质的炎症和血管损害。该种病变以肾小管功能障碍发生在前且严重,肾小球损害在后,病程较慢,晚期出现肾功能不全、氮质血症。
3.5. HUA对MS的影响
多囊卵巢综合征患者中MS的发生率为8%~47%,是同龄非PCOS妇女的2~3倍 [23] ,且随着PCOS患者血尿酸水平的升高,发生率显著升高 [24] 。同时,高尿酸血症作为MS的重要组成部分,与其它危险组分的关系十分密切,并与传统心血管疾病危险因素包括老年、高血压、2型糖尿病、高甘油三酯血症、肥胖和胰岛素抵抗等相关联。Nakagawa等 [25] 通过动物实验验证,当大鼠血清尿酸水平升高时,会出现高血压,高血糖和高甘油三酯等MS表现。
3.6. HUA对肿瘤的影响
PCOS患者相关肿瘤疾病的发病风险有所增加,尤其是雌激素依赖性肿瘤 [26] 。早在19世纪,就有人提出高尿酸环境会提高肿瘤进展、转移可能性的假设 [27] 。其后虽然鲜有关于高尿酸血症与肿瘤关系的实验室研究,但Petersson等 [28] 经过临床观察研究提出高尿酸与恶性肿瘤致死率有重大相关性的观点;Kolonel等 [29] 也提出了高尿酸血症的致癌可能性。Alexander等 [30] 进而提出,HUA患者患癌症后的病死率是一般癌症患者病死率的1.4倍。虽然,体内高尿酸环境对癌症的发生、发展的作用大小、作用机制尚未被阐释清楚,但显而易见的是,对于非癌症患者,尤其是对于癌症患者来说,改善、纠正体内高尿酸环境是极为重要的。
4. 小结
综上所述,PCOS是一种极为复杂的内分泌疾病,而高尿酸血症与多囊卵巢综合征患者的各种症状及远期并发症之间存在着相当密切的相互作用,它的发生和发展使得患者机体产生一系列神经、体液、内分泌代谢紊乱。因此,在多囊卵巢综合征患者的治疗过程中,应该密切关注有无高尿酸血症的发生,一旦发现,即给予足够重视,积极纠正代谢紊乱,改善胰岛素抵抗,这对PCOS的治疗和减轻各种并发症具有特别重要的临床意义。
致谢
诚挚感谢南京医科大学第一附属医院内分泌科、江苏省移植免疫与HLA检测中心沈捷主任在选题的过程中对我至关重要的指导和帮助。
文章引用
孙茹茹,沈 捷. 多囊卵巢综合征与高尿酸血症的关系
Relationship between Polycystic Ovary Syndrome and Hyperuricemia[J]. 自然科学, 2017, 05(02): 113-119. http://dx.doi.org/10.12677/OJNS.2017.52016
参考文献 (References)
- 1. Essah, P.A., Nestler, J.E. and Cannina, E. (2008) Difference in Dyslipidemia between American and Italian Women with Polycystic Ovary Syndrome. Journal of Endocrinological Investigation, 31, 35-41. https://doi.org/10.1007/BF03345564
- 2. Azziz, R., Woods, K.S., Reyna, R., et al. (2004) The Prevalence and Features of the Polycystic Ovary Syndrome in an Unselected Population. The Journal of Clinical Endocrinology and Metabolism, 89, 2745-2749. https://doi.org/10.1210/jc.2003-032046
- 3. Costello, M. and Eden, J.A. (2003) A Systemic Review of the Reproductive System Effects of Metformin in Patients with Polycystic Ovary Syndrome. Fertility and Sterility, 79, 1-13. https://doi.org/10.1016/S0015-0282(02)04554-5
- 4. Mastorakos, G., Lambrinoudaki, I. and Creatsas, G. (2006) Polycystic Ovary Syndrome in Adolescents: Current and Future Treatment Options. Paediatr Drugs, 8, 311-318.
- 5. Zhang, L., Wang, F., Wang, L., et al. (2012) Prevalence of Chronic Kidney Disease in China: A Cross-Sectional Survey. Lancet, 379, 815-822.
- 6. Cappuccio, F.P., Strazzullo, P., Farinaro, E., et al. (1993) Uric Acid Metabolism and Tubular Sodium Handling. Results from a Population-Based Study. JAMA, 270, 354-359.
- 7. Liou, T.L., Lin, M.W., Hsiao, L.C., et al. (2006) Is Hyperuricemia Another Facet of the Metabolic Syndrome. Journal of the Chinese Medical Association, 69, 104-109. https://doi.org/10.1016/S1726-4901(09)70186-8
- 8. Tamita, M., Murayama, T., Mizuno, S., et al. (2003) Effect of Hyperglycemia and Insulin Resistance on Serum Uric Acid. Nippon Rinsho., 61, 247-251.
- 9. Marangella, M. (2005) Uric Acid Elimination in the Urine. Pathophysiological Implications. Contributions to Nephrology, 147, 132-148.
- 10. 肖雯晖, 谢志军. 从调节生殖内分泌环境探讨中医防治高尿酸血症的思路[J]. 中华中医药杂志(原中国医药学报), 2013, 28(8): 2350-2351.
- 11. 臧路平, 刘志刚, 吴新荣. 高尿酸血症发病机制及其治疗药物研究进展[J]. 医药导报, 2011, 30(1): 69.
- 12. 张长青, 叶巍, 邢晓博, 马振亮, 刘福颂, 等. 肥胖与高尿酸血症的关系[J]. 中国分子生物学杂志, 2012, 12(5): 260-263.
- 13. Matsuura, F., Yamashita, S., Nakamura, T., et al. (1998) Effect of Visceral Fat Accumulation on Uric Acid Metabolism in Male Obese Subjects: Visceral Fat Obesity Is Linked More Closely to Overproduction of Uric Acid than Subcutaneous Fat Obesity. Metabolism, 47, 929-933. https://doi.org/10.1016/S0026-0495(98)90346-8
- 14. 疋田美穗, 王静舒. 肥胖与高尿酸血症[J]. 日本医学介绍, 2004(5): 126-128.
- 15. 张妮娅, 刘超. 2型糖尿病患者血尿酸水平与高胰岛素血症和胰岛素抵抗的关系[J]. 山东医药, 2015, 55(6): 44- 45.
- 16. Moran, L.J., Misso, M.L., Wild, R.A., et al. (2010) Impaired Glucose Tolerance, Type 2 Diabetes and Metabolic Syndrome in Polycystic Ovary Syndrome: A Systematic Review and Meta-Analysis. Human Reproduction Update, 16, 347-363.
- 17. 高丽娟, 傅晓英. 高尿酸血症与代谢综合征及其各组分关系的研究进展[J]. 新医学, 2011, 42(4): 276-278.
- 18. Gilcampos, M., Aguilera, C.M., Caete, R., et al. (2009) Uric Acid Is Associated with Features of Insulin Resistance Syndrome in Obese Children at Prepubertal Stage. Nutricion Hospitalaria, 24, 607-613.
- 19. Chen, L.Y., Zhu, W.H., Chen, Z.W., et al. (2007) Relationship between Hyperuricemia and Metabolic Syndrome. Journal of Zhejiang University—Science B, 8, 593-598. https://doi.org/10.1631/jzus.2007.B0593
- 20. Sathyapalan, T. and Atkin, S.L. (2012) Recent Advances in Cardiovascular Aspects of Polycystic Ovary Syndrome. European Journal of Endocrinology, 166, 575-583. https://doi.org/10.1530/EJE-11-0755
- 21. Patetsios, P., Song, M., Shutze, W.P., et al. (2001) Identification of Uric Acid and Xanthine Oxidase in Athemsclemtie Plaque. American Journal of Cardiology, 88, 188-191. https://doi.org/10.1016/S0002-9149(01)01621-6
- 22. Popa-Nita, O. and Naccache, P.H. (2010) Crystal-Induced Neutrophil Activation. Immunology Cell Biology, 88, 32-40.
- 23. Wild, R.A., Carmina, E., Diamanti, K.E., et al. (2010) Assessment of Cardiovascular Risk and Prevention of Cardiovascular Disease in Women with the Polycystic Ovary Syndrome: A Consensus Statement by the Androgen Excess and Polycystic Ovary Syndrome (AE-PCOS) Society. Journal of Clinical Endocrinology and Metabolism, 95, 2038-2049. https://doi.org/10.1210/jc.2009-2724
- 24. Rodrigues, S.L., Baldo, M.P., Capingana, P., et al. (2012) Gender Distribution of Serum Uric Acid and Cardiovascular Risk Factors: Population Based Study. Arquivos Brasileiros De Cardiologia, 98, 13. https://doi.org/10.1590/S0066-782X2011005000116
- 25. Nakagawa, T., Hu, H., Zharikov, S., et al. (2006) A Causal Role for Uric Acid in Fructose-Induced Metabolic Syndrome. American Journal of Physiology—Renal Physiology, 290, 625-631.
- 26. Haoula, Z., Salman, M. and Atiomo, W. (2012) Evaluating the Association between Endometrial Cancer and Polyeystic Ovary Syndrome. Human Reproduction, 27, 1327-l331. https://doi.org/10.1093/humrep/des042
- 27. King’s College Hospital (1851) Gout and Cancer (Under the Care of Dr. BUDD). The Lancet, 57, 482-483.
- 28. Petersson, B., Trell, E., Henningsen, N.C., et al. (1984) Risk Factors for Premature Death in Middle Aged Men. British Medical Journal (Clinical Research Ed.), 288, 1264-1268. https://doi.org/10.1136/bmj.288.6426.1264
- 29. Kolonel, L.N., Yoshizawa, C., Nomura, A.M., et al. (1994) Relationship of Serum Uric Acid to Cancer Occurrence in a Prospective Male Cohort. Cancer Epidemiol Biomarkers & Prevention, 3, 225-228.
- 30. Alexander, M.S., Kilian, R., Wolfgang, H., et al. (2007) Serum Uric Acid and Rick of Cancer Mortality in a Large Prospective Male Cohort. Cancer Causes & Control, 18, 1021-1029. https://doi.org/10.1007/s10552-007-9043-3