Journal of Organic Chemistry Research
Vol.03 No.03(2015), Article ID:16073,16
pages
10.12677/JOCR.2015.33017
The Research Progress about Synthesis and Biological Activities of Xanthones
Xiaopan Hao, Jun Lin*, Shengjiao Yan*
Key Laboratory of Medicinal Chemistry for Natural Resource (Ministry of Education), School of Chemical Science and Technology, Yunnan University, Kunming Yunnan
Email: *linjun@ynu.edu.cn, *yansj@ynu.edu.cn
Received: Aug. 27th, 2015; accepted: Sep. 15th, 2015; published: Sep. 23th, 2015
Copyright © 2015 by authors and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY).
http://creativecommons.org/licenses/by/4.0/



ABSTRACT
Xanthones have been found to possess wide biological activities including anti-inflammatory, analgesic, antivirus, antitumor etc. It is an important way to synthesize biologically active drugs by modification of the structure of xanthones. The skeleton structure of xanthone has been severed as the building blocks to synthesis of bioactive molecules. In this paper, the synthesis methods and the active research of xanthones were summarized in brief. The synthesis methods included metal catalyzed syntheses, biosynthesis and so on. At the same time, the paper briefly introduces the research of biological activity of xanthones, which has been reported at home and abroad for many years.
Keywords:Xanthones, Synthesis, Biological Activity

呫吨酮类化合物的合成及生物活性研究进展
郝晓盼,林军*,严胜骄*
云南大学化学科学与工程学院教育部自然资源药物化学重点实验室,云南 昆明
Email: *linjun@ynu.edu.cn, *yansj@ynu.edu.cn
收稿日期:2015年8月27日;录用日期:2015年9月15日;发布日期:2015年9月23日

摘 要
呫吨酮类化合物具有消炎、镇痛、抗病毒、抗肿瘤等广谱的生物活性。通过对呫吨酮骨架结构进行修饰是合成生物活性药物的重要方法。呫吨酮骨架成为合成具有生物活性分子的重要砌块。本文对呫吨酮母体骨架的合成方法及呫吨酮类化合物的活性研究进行了简要介绍。合成方法包括金属催化及生物合成法等,并对近年来国内外对呫吨酮类化合物生物活性的研究进行简单介绍。
关键词 :呫吨酮,合成,生物活性

1. 引言
呫吨酮又称氧杂蒽酮(xanthone),或二苯并γ-吡喃酮,分子式为C13H8O2,结构式如图式1所示[1] 。呫吨酮是一类重要的有机合成中间体[1] -[4] 。常用来合成氧杂蒽醇,该试剂作为有机分析试剂可以用来鉴定脂肪族酰胺,氨基甲酸酯以及取代的巴比士酸。呫吨酮骨架是合成呫吨染料和荧光物质的母体化合物,也是杀幼虫剂和蛾类杀卵剂的中间体,用途十分广泛。而关于呫吨酮的研究已有一个世纪之久[5] [6] 。同时,大多数的呫吨酮衍生物在其线性排列的三个环上具有酚羟基等官能团,使得该类化合物经常表现出广泛的生物和药理活性。其衍生物广泛分布在自然界中,是药用植物的有效成分之一。研究表明此类化合物具有多种药理活性,如抗疟疾、抗肿瘤、抗炎、抗氧化、抗心律不齐、抗结核、抗心肌缺血和肝保护作用等[7] -[11] 。故有科研工作者称呫吨酮骨架结构为“privileged structure”[12] 。
2. 呫吨酮类化合物的获得方法概述
从呫吨酮母核结构可以看出,其有8个可以被取代的位置,但各个部位被取代的几率并不相同,在志远属植物中,考察已知呫吨酮化合物的结构发现,5位取代基最少,4位和8位次之,而1,2,3,7位取代基最常见[13] 。通常获得呫吨酮类化合物主要有三种途径:天然产物中提取,化学合成,以及生物合成。
2.1. 从天然植物中提取
从天然植物中提取呫吨酮类化合物是最原始最直接的获取方法。自然界中得到的咕吨酮衍生物主要足从龙胆科,桑科、藤黄科、远志科和金丝桃属等科属植物以及一些真菌的代谢产物中分离得到[13] [14] 。例如,杨学东等人[13] 从远志属植物中分离鉴定出六十多种呫吨酮衍生物;赵岩等[15] 从莽吉柿果皮中分离并鉴定出几种呫吨酮;蔡幼清等从云南山竹中提取到不同类型的呫吨酮[16] ;Cui等从藤黄树干渗出的树脂中的到一些呫吨酮衍生物[17] 。2014年,Mao等人报道从獐牙菜属植物的乙醇提取液中分类里鉴定

Scheme 1. The skeleton structure of xanthones
图式1. 呫吨酮骨架结构
得到了18种呫吨酮类化合物,且部分能够降低食物中的亚硝酸盐含量[18] 。
呫吨酮类化合物虽然广泛分布于多种植物中,但是含量较低,分离提取的产率难以满足大量的研究及应用需要。故国内外的研究多从天然活性成分提供的结构出发,通过结构修饰合成其类似物并进行系统的活性研究,总结分析结构-活性关系,以此作为设计新药目标化合物的基础,这是一种是具有巨大潜力的研究开发模式。
2.2. 合成
2.2.1. 氧化法
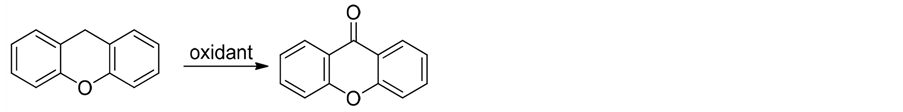
合成呫吨酮的方法中应用最广泛的是基于氧杂蒽的氧化反应(式1)。
 (1)
(1)
氧杂蒽的氧化是最简单、最常见合成呫吨酮的方法,氧化剂有KMnO4/CuSO4,过氧叔丁醇,氧气及SiO2-[CoTSPc]4−/NHPI等。该类反应最主要的缺点是由于氧杂蒽本身就是一个不易合成的化合物,因此很难获得具有分子多样性的氧杂蒽原料[19] -[22] 。
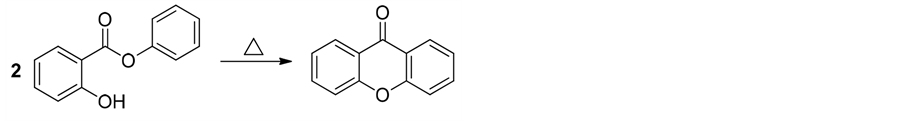
2.2.2. Fries重排反应
利用Fries 重排反应制备呫吨酮结构也是比较常规的化学合成方法。其中常见的做法是将水杨酸苯酯加热至275℃~285℃,首先生成的苯酚通过蒸馏除去,继续升温达到350℃~355℃,所得产物经精制即为氧杂蒽酮[23] (式2)。该反应的优点是条件简单,缺点为温度要求高,能耗大,而且产率低(56%)。因此,通过寻找合适的催化剂,可以达到降低反应温度,从而降低能耗,并提高产率,该方法或许可以发展成未来工业化生产方法。
 (2)
(2)
2.2.3. 醚的酰化反应
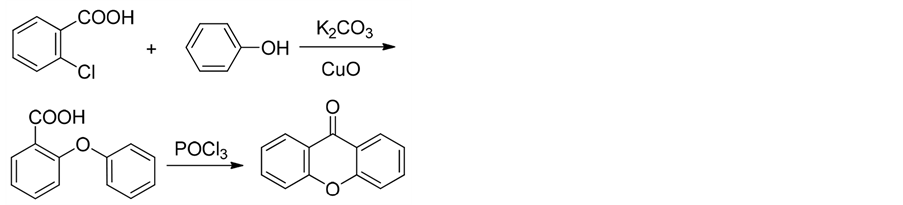
由于常规方法所存在的上述缺点,研究人员对其做了一定的改进。乌尔曼(Ullmann)缩合反应是合成呫吨酮类化合物的主要方法之一[24] [25] 。其主要的设计思路是分子间首先生成醚键再发生酰基化反应。
王纪元[26] 等就是利用乌尔曼(Ullmann)缩合反应,以2-氯苯甲酸和苯酚为原料,得到产物2-苯氧基苯甲酸后再用三氯氧磷脱水关环,合成呫吨酮,化学反应式如式3。该反应具有原料易得,反应条件温和,醚化条件得到了一定的优化等优点。缺点是具有高功能化的苯甲酮的获得较为困难。
 (3)
(3)
Gobbi等人用羧基取代芳基醚在浓硫酸作用下,通过分子内付克酰化反应合成呫吨酮类化合物(式4)。但该反应副反应较多,产率较低[27] 。
 (4)
(4)
2.2.4. 醚化成环反应
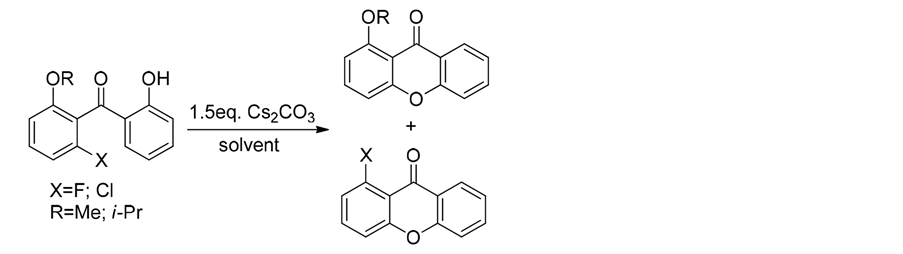
2008年Hintermann等人报道用Cs2CO3为碱进行分子内关环,合成呫吨酮[28] 。考虑到卤素原子和烷氧基具有相似的离去性能,为了提高反应的选择性,研究人员对溶剂进行了筛选,最终确定,当卤素原子为F时,离去基团为-F且与溶剂无关;当卤元素为-Cl时,溶剂效应明显,最终确定当DMPU作溶剂时,反应选择性可明显提高(式5)。
 (5)
(5)
在该反应基础上,2009年Dominguez研究小组报道了水相中醚化成环的研究[29] ,使反应条件更温和(式6)。
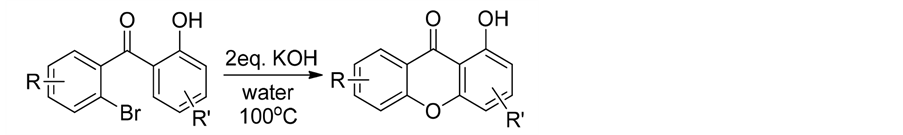 (6)
(6)
2.2.5. 金属催化合成
1) 锌催化
在金属催化合成呫吨酮类化合物也有不少报道,早在1955年就有文献报道了以水杨酸,间苯三酚为原料,在锌催化下合成呫吨酮衍生物[30] (式7)。
 (7)
(7)
覃江克等人[31] 利用该反应,氮气保护下,合成1,3-二羟基呫吨酮,经醚化,环化反应得到1-羟基呋喃并呫吨酮,再经Mannich反应合成了多个呋喃并呫吨酮衍生物(式8)。
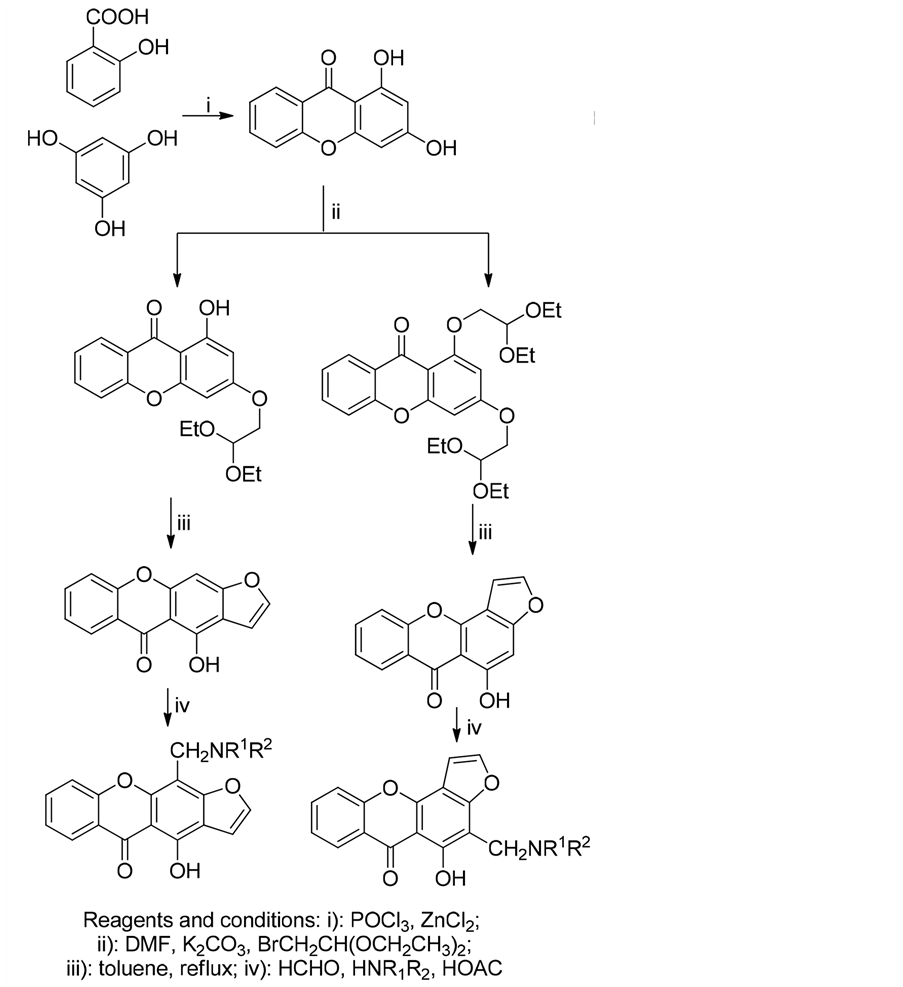 (8)
(8)
2) 钯催化
Jaysukhlal等人[32] 利用苯酚和环己烯甲酸为原料,聚磷酸催化,100℃下反应得到中间产物,继续在加热条件下,钯/碳催化脱氢得到一系列的带有烷基取代基的呫吨酮类化合物(式9)。
 (9)
(9)
其中2,5-二甲基苯酚反应后却得到6H-9H-呋喃-9-酮,原因是苯酯经过Fries重排得到邻对位产物。
Jian等人[33] 报道了用钯催化重排反应制备呫吨酮。其可能的机理是钯参与反应后所得到的中间产物在酸性条件下水解可得到呫吨酮(式10)。
 (10)
(10)
2012年,Zhang [34] 等人同样利用钯催化,通过分子间的C-H活化成功构筑呫吨酮骨架(式11)。
 (11)
(11)
此外,2014年,Xu等人[35] 以二芳醚邻位重氮盐为底物,利用钯催化,碱性条件下,经过一氧化碳羰基化、C-H活化合成了含呫吨酮骨架的一系列化合物(式12)。
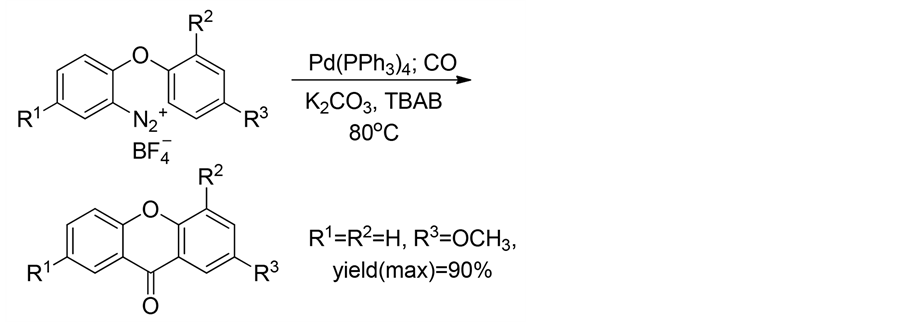 (12)
(12)
推测其可能的反应机理见下图。如下面机理图所示,初始化合物先与零价钯进行氧化加成并放出氮气得到中间体I,随后CO插入得到中间体II,接着在碳酸钾的参与下生成中间体III,最后进行还原消除得到呫吨酮骨架以及零价钯,进入下一个循环。
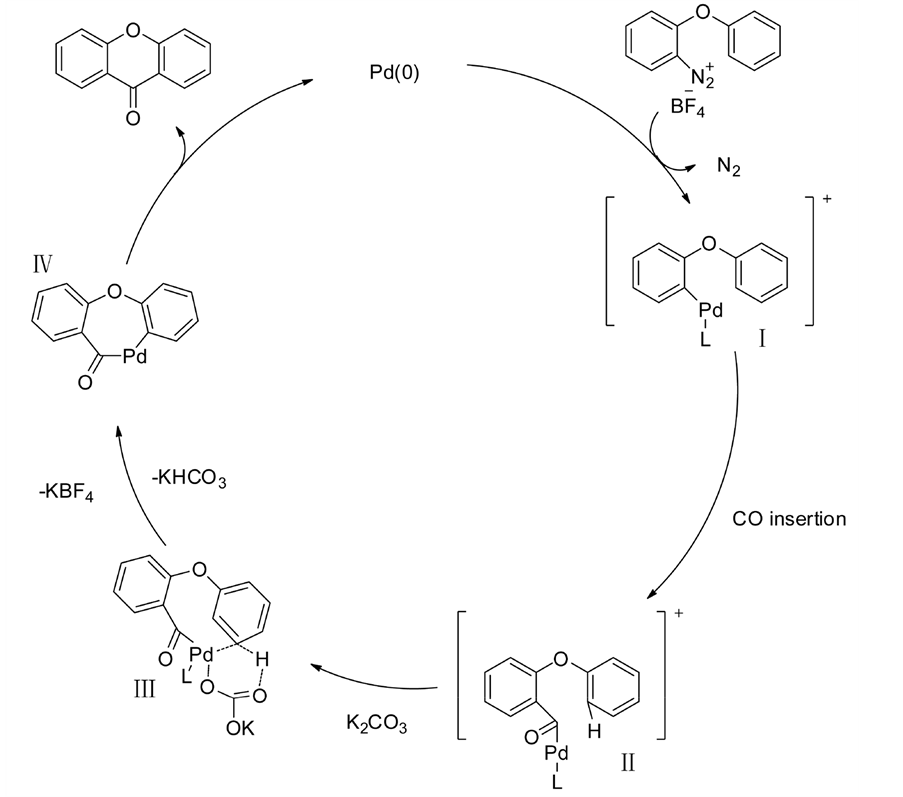
3) 铁催化
华东师范大学Li等人[36] 用1,2-二氯乙烷为溶剂,等当量氧化剂DDQ存在下,用六水合三氯化铁催化法合成呫吨酮(式13)。该反应具有普适性好,产率高等特点。
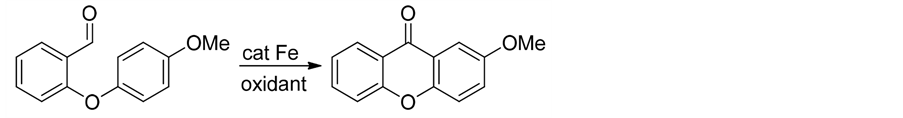 (13)
(13)
2013年,Sebastian [37] 等人在乙腈做溶剂中,TBHP存在下二茂铁催化下实现偶联反应一步合成具有呫吨酮骨架的一系列化合物(式14)。
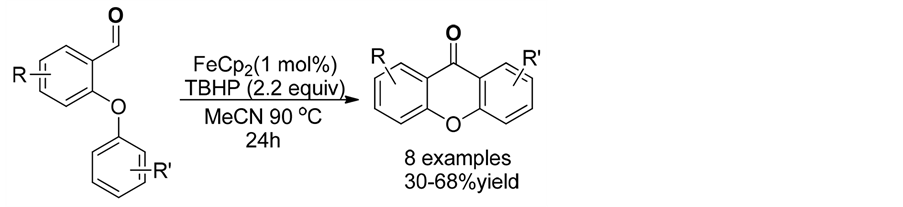 (14)
(14)
4) 铜催化
2014年,Cintia等人[38] 利用纳米级铜线圈磁材料(CuNPs),实现了分子间催化耦合,进而一步合成了多取代的呫吨酮骨架,产率51%~98% (式15)。纳米级铜线圈磁材料(CuNPs)为我们提供了向微观世界寻找更高效合成催化剂的新的合成思路和方向。
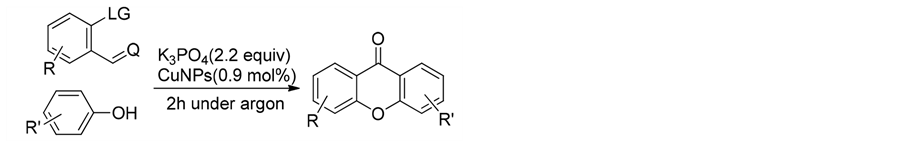 (15)
(15)
金属催化法具有合成路线简单,收率较高等优点,但当催化剂为金属钯类化合物或络合物时,存在着价格昂贵且反应结束后无法回收利用以及废液的环境污染等问题,很大程度上制约了其在生产中的推广使用。今后,可以寻找可循环使用的环境友好催化剂,如文中提到的价格便宜的金属铁化合物的催化剂,这是该方法取得突破的关键所在。
2.2.6. 芳炔与水杨醛的加成环化
芳炔作为构建杂环化合物的基本单元,近几年也被广泛应用在合成杂环反应中,2009年文献[39] 报道了氟化铯催化的芳炔与水杨醛的加成环化反应合成呫吨酮(式16)。芳炔的形成是通过邻-三甲硅基芳基三氟甲磺酸酯在氟离子作用下消去一分子三氟甲磺酸三甲酯(TMSOTf)得到。但该反应选择性并不是很好。
 (16)
(16)
2.2.7. 串联法
2010年,Hu课题组利用微波辅助,串联法,高效合成了一系列结构新颖的呫吨酮类化合物[40] 。该反应以取代色酮为原料,在二甲亚砜溶剂中,碱促进下的微波辅助的串联反应。反应只需十分钟即可高产率的合成呫吨酮类化合物(式17)。该串联反应涉及多种反应类型,如迈克尔加成,以及在温和条件下无需过渡金属催化和惰性气体保护的环加成反应。
微波手段具有反应时间短,产率高,能效高,节能环保等优点,但在扩大工业生产方面有一定的局限性。
 (17)
(17)
2.2.8. Diels-Alder反应
该反应的原料具有苯并吡喃的结构,再经Diels-Alder反应生成二苯并γ-吡喃酮衍生物。此类方不常用,但在手性合成中有一定的应用[41] [42] 。
2.2.9. 由醌类化合物制备
1979年,Wade等人[43] 从对苯醌甲酸甲酯出发,利用熔融的四氯铝酸钠盐为媒介,经过两步合成取代呫吨酮(式18)产率高达90%以上。此合成方法虽然较老,但因其产率较高,在现代合成中特别是在生物合成中有广泛的应用[44] 。
 (18)
(18)
2.2.10. 多羰基化合物的环化
这种合成方法不很常见。该方法主要是利用羰基互变为烯醇后再环化。六羰基十四羧酸通过碳负离子的加成也可环化生成呫吨酮[45] 。
2.2.11. 生物合成
2011年,Sanchez等人[46] 在纤维丝状真菌构巢曲霉中发现了两种烯化的呫吨酮,并以其为目标分子,选择包含多聚乙酰聚合酶mdpG在内的10个基因群,利用生物技术在基因水平上合成了呫吨酮类衍生物。
综上所述,从天然植物或中草药中分离提取氧杂蒽酮类化合物,虽然原料可再生,但存在分离方法复杂,产量小的问题,无法满足规模化生产需求。而且随着环境越来越严峻,植物被破化程度越来越不容乐观,有些植物甚至濒临灭绝。因此天然产物提取呫吨酮不能满足化学工业及药物工业的需求;化学合成法是目前应用最广的方法,其最大的问题在与如何优化工艺,在环境友好的基础上提高产率以及工业化;生物合成法属于比较新颖的方法,利用生物工程技术在基因水平,由相关真菌代谢合成目标呫吨酮类化合物分子,经济环保,且生物工程技术工业化生产化的可操作性比较大,因此预计该方法会是未来合成趋势。
3. 呫吨酮的生理活性
大多数呫吨酮衍生物在其线性排列的三个环上具有酚羟基官能团,常表现出广泛的生物及药理活性,如:抗菌、抗炎、抗氧化、抗心律失常、抗肿瘤等活性。同时呫吨酮还可作防癌药物保护剂、利尿剂、保肝剂及胆碱酶抑制剂等。也正因为呫吨酮衍生物在自然界的广泛存在和广泛的应用价值,才使其应用研究倍受关注。近年来,天然药物化学家从许多科属的植物中提取分离得到几百个呫吨酮类化合物并筛选出部分具有活性的先导化合物。下面简单介绍几种较为重要的生理活性。
3.1. 消炎镇痛
Librowski等[47] 报道了呫吨酮衍生物在小鼠体内的消炎镇痛作用,实验结果显示,此类药物的副作用与非甾体类消炎药并无明显差别。
在中医理论中,贯叶连翘可作为消炎药物使用,研究表明,从中提取出的一种具有高度生物活性物质-金丝桃素是一类呫吨酮衍生物。活性实验结果显示,金丝桃素可以抑制花生四烯酸和白三烯酸B的释放。而这两种物质恰好是人体可活化淋巴细胞和T细胞的细胞分裂素的前体。故研究人员推测金丝桃素是贯叶连翘消炎机制的主要作用成分[48] [49] 。
杨学东等人[13] 从远志科植物中分离得到的1,7-二羟基-2,3-二甲氧基呫吨酮具有抑制由乙酸诱发的腹部痉挛作用与剂量有关。实验结果表明,当通过腹腔注射或口服给药途径进行抗炎和抗神经性疼痛评价时,得到了明确的止痛效果。
Bumrungpert等报道了从山竹果中提取出来的呫吨酮类衍生物α-mangostin和β-mangostin能够降低以脂多糖为媒介的巨噬细胞炎症,同时也会降低脂细胞的胰岛素耐受性。推测是通过阻止一系列重要的炎性细胞因子的激活而实现消炎作用的机制[50] 。Sukma等人也报道过,从山竹果种提取出的呫吨酮类衍生物γ-mangostin,进行体外细胞测试显示,该化合物同样也能起到一定的消炎镇痛作用[51] 。
3.2. 抗真菌活性
从远志科植物中分离得到的1,7-二羟基-4-甲氧基呫吨酮和1,7-二羟基-3,5,6-三甲氧基呫吨酮具有抑制植物病原真菌的作用[13] 。其抗真菌的活性大小与两个芳环上的取代基数有关,若羟基被烷基化,则活性下降,但烷基链加长,活性会随之提高[49] 。Gopalakrishnan等人从Kielmeyera coriacea中得到的4个呫吨酮具有抗植物病原性真菌的作用[52] 。Lee等人从藤黄科山竹中得到几个呫吨酮化合物,对真菌镰孢属链格孢等均有抗菌活性,其中γ-mangostin作用最强[53] 。从藤黄属类植物未成熟的果实中提取到的呫吨酮类衍生物也具有良好的抗菌效果[54] 。
2015年,Koh等研究人员对呫吨酮类衍生物进行了氨基酸结构修饰[55] ,测试结果显示,修饰后的呫吨酮衍生物结构对多重耐药的革兰氏阳性细菌表现出非常有前途的抗菌活性。
3.3. 抗病毒活性
1,2,7-三羟基呫吨酮具有较明显抗病毒活性,但其作用效果比黄酮衍生物要差,对病毒水疱性口炎esicular stomatitis) 的抑制作用较好[56] 。
在离体和活体实验表明[48] ,金丝桃素(结构见图式2)可抑制人体免疫缺陷病毒HIV及其它一些逆转录病毒。金丝桃素体外实验对单纯疱疹病毒1型、2型,副流感病毒,牛痘病毒,疱疹口炎病毒,有抑制巨噬细胞病毒都有一定的抑制作用。
假金丝素因在金丝桃素2,3位的甲基上分别引入一个羟基,抗病毒活性下降。已有报道,人工合成的乙基金丝桃素(金丝桃素2,3位上的甲基都被乙基取代)具有比金丝桃素更高的抗病毒活性。

Scheme 2. The structure of hypericin
图式2. 金丝桃素化学结构
3.4. 利尿活性
早在1990年,Sato等人[57] 对36种呫吨酮衍生物进行研究及活性测试后发现,大部分化合物均具有较好的利尿活性。其中,以1-甲基-3,4-并呋喃甲酸基呫吨酮为首的五种呫吨酮的活性较为显著。
3.5. 抗老年痴呆
Qin等人[58] 通过对所合成的一系列1,3-二羟基呫吨酮类化合物进行活性测试,发现其中多数具有抑制乙酰胆碱酯酶和丁酰胆碱酯酶的性质。又因为这两种胆碱酯酶是诱发阿兹海默症(老年痴呆症)的主要元凶,故1,3-二羟基呫吨酮类衍生物具有一定的抗老年痴呆作用。
3.6. 肝保护作用
孙洪发[59] 等报道,从抗肝炎植物药花锚中分得到8种呫吨酮:包括花锚苷(2,3,5,7-四甲基呫吨酮),去甲基花锚苷(2,3,5-三甲基呫吨酮)呫吨酮苷,1-O-[β-D-吡喃木糖-(1-6)-β-D-吡喃葡萄糖]-2,3,5-三甲氧基呫吨酮等,药理活性实验结果表明前两种呫吨酮类化合物有明显的护肝作用,可增加核糖核酸,增加肝糖元,促进蛋白质的合成,促进肝细胞的再生,加速坏死组织的修复,是该植物抗肝炎的两种主要成分。
3.7. 抗疟疾活性
藤黄属植物早已成为传统的亚洲、非洲之抗疟疾药物。藤黄科山竹子的树皮,还是泰国的一种传统退热药。史玉俊等[60] 发现藤黄科山竹子的树皮的乙醇提取物在体外试管实验中能够有效的抑制恶性疟原虫的生长过程。并且从中提取分离得到了5个呫吨酮衍生物,体外测试活性实验显示,五种化合物都有一定的抗疟活性。蔡幼青[16] 等人从山竹中所提取到的呫吨酮类化合物经药理研究显示也具有抗疟疾作用。黄朝辉等人曾报道过2,3,4,5,6,-五羟基呫吨酮可能是通过阻止疟原虫色素的形成而发挥抗疟疾作用的[61] 。此外,国外Riscoe等人[62] 在俄勒冈州的加农海滩附近所收集到的海胆体内发现了含有抗疟疾功能的呫吨酮类化合物。研究后认为,这些呫吨酮类化合物主要通过作用于疟原虫最脆弱的地方,即消化液泡,来预防治疗疟疾的。而Lyles等人则是从可食用的藤黄属类果实中提取到了抗疟疾的呫吨酮类衍生物[63] 。
3.8. 抗肿瘤活性
多种呫吨酮衍生物被证实具有抗肿瘤细胞增殖的作用,曾有报道发现从藤黄属提取得到的呫吨酮对多种实体瘤细胞有较强的增殖抑制作用。Fouotsa等人,从藤黄属植物的幼嫩细枝中提取到了新的呫吨酮化合物,经测试,对于宫颈癌细胞株有中度的活性[64] 。Zhang等人[65] 从藤黄属植物的藤黄酸中得到一种笼状类天然产物DDO-6101,其在体外实验中表现出较强的细胞毒性。不过由于它具有较差的类药性,其在有机体内所表现的活性较差。但经过对其进行结构修饰,引入异戊二烯基之后所得到的化合物DDO-6306,则在小鼠体内表现出良好的抗肿瘤活性。
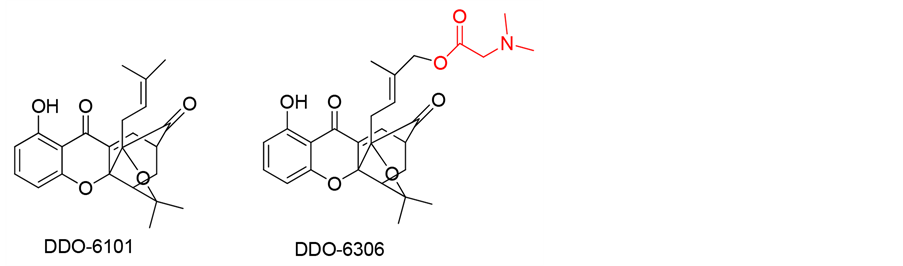
此外一些从其他植物中分μ离出的不同种呫吨酮类化合物也发现有程度不等的抗肿瘤增殖作用。最近Mah等人[66] 报道称,从两种美珊瑚属植物中提取出11种呫吨酮类化合物,经体外测试显示,部分化合物对于淋巴癌细胞,结肠癌细胞,神经母细胞瘤细胞,以及皮肤肿瘤细胞的恶性增生都有不同程度的抑制作用。
从贯叶连翘中提取到的呫吨酮类化合物金丝桃素可直接引起癌细胞程序性死亡,并伴随有细胞色素C由线粒体向细胞质释放。光活化的金丝桃素可导致细胞总ATP水平和线粒体呼吸功能显著而不可逆的下降,推测线粒体可能是金丝桃素细胞光损伤的主要攻击目标。可能的机制是金丝桃素结合到线粒体的苯并二氯杂受体上,受光激发后开启线粒体膜通道,膜可渗透性增强,释放出可引发细胞程序性死亡的细胞色素及其它线粒体因子[48] 。此外,多种呫吨酮化合物已发现有抗肿瘤活性[67] -[70] 。
现在已报道的呫吨酮化合物抗肿瘤机制包括抑制肿瘤的发生肿瘤免疫调节作用和潜在的逆转多药耐药等。此外,目前临床广泛应用的蒽醌类抗肿瘤抗生素如阿霉素、佐柔比星也具有呫吨酮衍生物类似的结构骨架。
中山大学Su等人合成呫吨酮类化合物并进行体外抗肿瘤活性的筛选和构效关系研究,发现该系列化合物对肝癌细胞HepG2的抗增殖作用明显,优于其他的实体肿瘤细胞,且具有良好的肿瘤选择性[71] 。
申瑞等人[72] 发现,具有高pKa值的含二甲胺侧链的氧杂蒽酮具有较好的DNA结合能力,同时,实验显示,其对体外肿瘤细胞的抑制作用也较有效。
3.9. 抗氧化剂
1,3,6,7-四羟基-2-葡萄糖呫吨酮是一种天然抗氧化剂,已应用在抗恶性肿瘤药物阿霉素中,消除氧自由基,减少阿霉素对人体心脏的毒副作用[73] 。
由于氧化作用会影响血管内皮生长因子,从而导致各组织血管新生。因此,具有抗氧化作用的化合物可以防止血管新生,能够起到抗血管生成作用,从山竹果的多芬粗提取液中得到的一类呫吨酮衍生物:α-mangostin就因为具有抗氧化作用以及抗血管新生的作用[74] 。
3.10. 其它生理活性
Sidahmedet等人[75] 研究了呫吨酮类衍生物α-mangostin在大鼠体内的胃保护机制。研究发现,它能够很好的降低由酒精诱发的胃部损害,并且能够抑制幽门螺杆菌的生长,进而起到胃部保护作用。
中南大学刘思好等人[76] 研究发现并报道了呫吨酮类化合物能够对心血管系统起保护作用,其可能的机制是在缺血性心脏病,动脉粥样硬化,血栓等多种心血管疾病中,呫吨酮类化合物可以通过抗氧化,抗炎,等机制保护血管内皮,从而抑制血小板聚集,最终对心血管系统起到保护作用。
Liu等人[77] 报道称藤黄属的山竹子中所提取到的G. mangostana具有改变新陈代谢紊乱,抗脂肪生成的作用,能够有望预防治疗肥胖症。
有文献报道称1,3,5,8-位和1,3,7,8-位取代类型的呫吨酮具有单胺氧化酶抑制作用,且效果很好[2] 。
综上所述,天然呫吨酮衍生物药理活性广泛。部分呫吨酮已投入临床抗肿瘤、抗氧化应用。设计合成或从植物中提取分离出含不同取代基的呫吨酮类化合物仍处在持续报道中。大多数呫吨酮衍生物具有一定的生物活性。国内外的研究经验表明,从天然活性成分提供的结构模式出发,经结构修饰、类似物合成以及系统的活性研究,总结分析活性构效关系,以此作为设计新药目标化合物的基础,是具有巨大潜力的研究开发模式。因此,以呫吨酮为母核的结构修饰及活性筛选研究是开发呫吨酮类药物及药物前提的重要方法。该方法具有很好的发掘潜力和应用前景。
基金项目
国家自然科学基金项目(No. 21362042, U1202221, 21162037, 21262042, 81160384)资助。
文章引用
郝晓盼,林 军,严胜骄. 呫吨酮类化合物的合成及生物活性研究进展
The Research Progress about Synthesis and Biological Activities of Xanthones[J]. 有机化学研究, 2015, 03(03): 122-137. http://dx.doi.org/10.12677/JOCR.2015.33017
参考文献 (References)
- 1. Ryu, H.W., Curtis-Long, M.J., Jung, S., Cho, J.K., Ryu, Y.B., Lee, W.S. and Park, K.H. (2010) Xanthones with neuramini-dase inhibitory activity from the seedcases of Garcinia mangostana. Bioorganic & Medicinal Chemistry, 18, 6258-6244. http://dx.doi.org/10.1016/j.bmc.2010.07.033
- 2. Carr, A.A., Grunwell, J.F., Sill, A.D., Meyer, D.R., Sweet, F.W., Scheve, B.J., Grisar, J.M., Fleming, R.W. and Mayer, G.D. (1976) Bis-basic-substituted polycyclic aromatic compounds. A new class of antiviral agents. 7.Bisalkamine esters of 9-oxoxanthene-2,7-dicarboxylic acid, 3,6-bis-basic ethers of xan-then-9-one, and 2,7-bis(aminoacyl)xanthen- 9-ones, xanthenes, and thioxanthenes. Journal of Medicinal Chemistry, 19, 1142-1148.
- 3. Dodean, R.A., Kelly, J.X., Peyton, D., Gard, G.L., Riscoe, M.K. and Winter, R.W. (2008) Synthesis and heme-binding correlation with antimalarial activity of 3,6-bis-(ω-N,N-diethylaminoamyloxy)-4,5-difluoroxanthone. Bioorganic & Medicinal Chemistry, 16, 1174-1183.
- 4. Kolokythas, G., Kostakis, I.K., Pouli, N., Marakos, P., Skaltsounis, A.L. and Pratsinis, H. (2002) Design and synthesis of some new pyranoxanthenone amino derivatives with cytotoxic activity. Bioorganic & Medicinal Chemistry Letters, 12, 1443-1446.
- 5. Fosse, R. (1906) On xanthone and xanthyhydrol. Competes Rendus Hebdomadaires des seances de l’Academie des sciences, 143, 749-751.
- 6. Carpenter, I., Locksley, H.D. and Scheinmann, F. (1969) Xanthones, in higher plants: biogenetic proposals and a chemotaxonomic survey. Phytochemistry, 8, 2013-2025. http://dx.doi.org/10.1016/s0031-9422(00)88089-9
- 7. Pouli, N. and Marakos, P., (2009) Fused xanthone derivatives as antiproliferative agents. Anti-Cancer Agents in Medicinal Chemistry, 9, 77-98.
- 8. Franklin, G., Conceicao, L.F., Kombrink, E. and Dias, A.C. (2009) Xanthone biosynthesis in Hypericum perforatum cells provides antioxidant and antimicrobial protection upon biotic stress. Phytochemistry, 70, 60-68.
- 9. Tanaka, N., Kashiwada, Y., Kim, S.Y., Sekiya, M., Ikeshiro, Y. and Takaishi, Y. (2009) Xanthones from hypericum chinense and their cytotoxicity evaluation. Phytochemistry, 70, 1456-1461. http://dx.doi.org/10.1016/j.phytochem.2009.08.015
- 10. Ryu, H.W., Curtis-Long, M.J., Jung, S., Jin, Y.M., Cho, J.K., Ryu, Y.B., Lee, W.S. and Park, K.H. (2010) Xanthones with neuraminidase inhibitory activity from the seedcases of Garcinia mangostana. Bioorganic & Medicinal Chemistry, 18, 6258-6244.
- 11. Carr, A.A., Grunwell, J.F., Sill, A.D., Meyer, D.R., Sweet, F.W., Scheve, B.J., Grisar, J.M., Fleming, R.W. and Mayer, G.D. (1976) Bis-basic-substituted polycyclic aromatic compounds. A new class of antiviral agents. 7. Bisalkamine esters of 9-oxoxanthene-2,7-dicarboxylic acid, 3,6-bis-basic ethers of xanthen-9-one, and 2,7-bis(aminoacyl)xanthen-9- ones, -xanthenes, and -thioxanthenes. Journal of Medicinal Chemistry, 19, 1142-1148.
- 12. Tim, W., Stefan, B. and Kye-simeon, M. (2015) Xanthone dimers: A compound family which is both common and privileged. Natural Product Reports, 32, 6-28.
- 13. 杨学东, 徐丽珍, 杨世林 (2000) 远志属植物中酮类成分及其药理研究进展. 天然产物开发与应用, 5, 88-93.
- 14. Peres, V., Nagem, T.J. and Oliveira, F.F. (2000) Tetraoxygenated naturally occurring xanthones. Phytochemistry, 55, 683-710. http://dx.doi.org/10.1016/S0031-9422(00)00303-4
- 15. 赵岩, 刘金平 (2010) 莽吉柿果皮中几种氧杂蒽酮的分离与鉴定. 吉林农业大学学报, 5, 513-517.
- 16. 蔡幼清 (1998) 云南山竹子中的抗疟成分(口山)酮. Planta Medica, 64, 64-70.
- 17. Cui, H.Y., Liu, W.Y., Lei, W. and Feng, F. (2011) Xanthone compounds isolated from Garcinia hanburyi and related analytical methods. Pharmaceutical Sciences, 35, 337-344.
- 18. Mao, S.S., Luo, C.T., Zheng, H.H., Liu, J. and Chen, H. (2014) Xanthones from Swertia mussotii plant as nitrite-scavenging agents. Natural Products Chemistry & Research, 2, 126\1-126\5.
- 19. Noureldin, N.A., Zhao, D.Y. and Lee, D.G. (1997) Heterogenous permanganate oxidations.7. The oxidation of aliphatic side chains. The Journal of Organic Chemistry, 62, 8767-8772.
- 20. Kishore, D. and Rodrigues, A.E. (2009) Liquid phase selective oxidation of diphenylmethane to benzophenone over ternary hydrotalcites with tert-butylhydroperoxidemoreless. Catalysis Communications, 10, 1212-1215.
- 21. Kotani, M., Koike, T., Yamaguchi, K. and Mizuno, N. (2006) Ruthenium hydroxide on magnetically separable heterogeneous catalyst for liquid-phase oxidation and reduction. Green Chemistry, 8, 735-741. http://dx.doi.org/10.1039/b603204d
- 22. Shaabani, A. and Rahmati, A. (2008) Aerobic oxidation of alkylarenes using a combination of N-hydroxyphthalimide and recyclable cobalt(II) tetrasulfophthalocyanine supported on silica. Catalysis Communications, 9, 1692-1697.
- 23. Holleman, A.F. (1941) Xanthone. Organic Syntheses, 1, 552-554.
- 24. 胡利红, 覃章兰 (2002) 呫吨酮类化合物的合成及生理活性. 合成化学, 4, 285-291.
- 25. 洪镰裕, 赵宏伟, 宋静 (2006) 氧杂蒽酮合成的研究进展. 化学试剂, 10, 632-634.
- 26. 王纪元, 孙学军, 王明清 (2009) Ullmann法合成氧杂蒽酮的研究. 化学世界, 7, 427-429.
- 27. Gobbi, S., Rampa, A., Bisi, A., Belluti, F., Valenti, P., Caputo, A., Zampiron, A. and Carrara, M. (2002) Synthesis and antitumor activity of new derivatives of xanthen-9-one-4-acetic acid. Journal of Medicinal Chemistry, 45, 4931-4939.
- 28. Hintermann, L., Masuo, R. and Suzuki, K. (2008) Solvent-controlled leaving-group selectivity in aromatic nucleophilic substitution. Organic Letters, 10, 4859-4862.
- 29. Barbero, N., Martin, R.S. and Dominguez, E. (2009) A con-venient approach to the xanthone scaffold by an aqueous aromatic substitution of bromo- and iodoarenes. Tetrahedron, 65, 5729-5732. http://dx.doi.org/10.1016/j.tet.2009.05.021
- 30. Grover, P.K., Shah, G.D. and Shah, R.D. (1955) Xanthones. IV. A New synthesis of hydroxyxanthones and hydroxybenzophenones. Journal of the Chemical Society, 3982-3985.
- 31. 覃江克, 韩留玉, 兰文丽, 唐煌, 苏桂发, 戴支凯, 徐庆 (2009) 呋喃并呫吨酮衍生物的合成与生物活性研究. 化学学报, 22, 2597-2606.
- 32. Jaysukhlal, R.M., Necille, V.F. and Vidyullata, C.W. (1996) Synthesis, characterization and redox properties of ruthenium(II) dithiocarbonato complexes having 2,2’-bipyridine coligands. Journal of the Chemical Society, 108, 379-398.
- 33. Jian, Z., Dawei, Y., Marino, A.C. and Richard, C.L. (2007) An aryl to imidoyl palladium migration process involving intramolecular C-H activation. Journal of the American Chemical Society, 129, 5288-5295.
- 34. Zhang, H., Shi, R.Y., Gan, P., Liu, C., Ding, A.X., Wang, Q.Y. and Lei, A.W. (2012) Palladium-catalyzed oxidative double C-H functiona-lization/carbonylation for the synthesis of xanthones. Angewandte Chemie International Edition, 51, 5204-5207. http://dx.doi.org/10.1002/anie.201201050
- 35. Xu, Y.M., Zhou, J., Zhang, C.C., Chen, K., Zhang, T., Du, Z.T. and Te-trahedron, L. (2014) Synthesis of xanthones through the palladium-catalyzed carbonylation/C-H activation sequence. Tetra-hedron Letters, 55, 6432-6434. http://dx.doi.org/10.1016/j.tetlet.2014.09.119
- 36. 李海燕(2010)铁催化的氧杂蒽酮和氮杂蒽衍生物的合成反应研究. 硕士论文, 华东师范大学, 上海.
- 37. Sebastian, W., Dirk, L. and Armido, S. (2013) Cross dehydrogenative coupling via base-promoted homolytic aromatic substitution (BHAS): Synthesis of fluorenones and xanthones. Organic Letters, 15, 928-931.
- 38. Menéndez, C.A., Nador, F., Radivoy, G. and Gerbino, D.C. (2014) One-step synthesis of xanthones catalyzed by a highly efficient copper-based magnetically recoverable nanocatalyst. Organic Letters, 16, 2846-2849.
- 39. Okuma, K., Nojima, A., Matsunaga, N. and Shioji, K. (2009) Reaction of benzyne with salicylaldehydes: General synthesis of xanthenes, xanthones, and xanthols. Organic Letters, 11, 169-171. http://dx.doi.org/10.1021/ol802597x
- 40. Xie, F.C., Chen, H. and Hu, Y.H. (2010) Efficient construction of 3C-xanthone-linked 3C-chromone scaffold by novel double michael additions and cyclizations. Organic Letters, 12, 3086-3089.
- 41. Chandra, K.G., Samita, B. and Amarendra, P. (1997) Unusual con-densation of 2-(2-dimethylaminovinyl)-1-benzopyran- 4-one with dimethyl acetylenedicarboxylate: Formation of 2,3-bis(methoxycarbonyl)xanthen-9-one. Journal of the Chemical Society, Perkin Transactions, 15, 2167-2168.
- 42. Roy, M.L., Yue, T.Y. and Cheung, K.K. (1992) A new xanthone synthesis from the Diels-Alder reaction between 2-vinylchromen-4-ones and cyclopentanone enamine. Chemical Communications, 18, 1310-1311.
- 43. Wade Jr., L.G., Acker, K.J., Earl, R.A. and Osteryoung, R.A. (1979) Cyclodehydration reactions using molten sodium tetrachloroaluminate. Journal of Organic Chemistry, 44, 3724-3725.
- 44. Ahmed, S.A., Bardshiri, E. and Simpson, T.J. (1987) A convenient synthesis of isotopically labeled anthraquinones, chrysophanol, islandicin, and emodin. Incorporation of [methyl-2H3]chrysophanol into tajixanthone in Aspergillus variecolor. Journal of the Chemical Society, Chemical Communications, 12, 883-884.
- 45. Sandifer, R.M., Bhattacharys, A.K. and Harris, T.M. (1981) Acylation of multiple anions of poly-beta-ketones by hydroxy- and alkoxybenzoates. Cyclization of the resultant tetraketones to benzophenones and xanthones. Organic Chemistry, 46, 2260-2267.
- 46. Sanchez, J.F., Entwistle, R., Hung, J.H., Yaegashi, J., Jain, S., Chiang, Y.M., Wang, C.C. and Oakley, B.R. (2011) Genome-based deletion analysis reveals the prenyl xanthone biosynthesis pathway in Aspergillus nidulans. Journal of the Chemical Society, 133, 4010-4017.
- 47. Librowski, T., Czarnecki, R., Czekaj, T. and Marona, H. (2005) New xanthone derivatives as potent anti-inflammatory agents. Medicina (Kaunas), 41, 54-58.
- 48. 梁巧丽, 高宏成 (1999) 金丝桃素的研究进展. 中草药, 9, 705-708.
- 49. 傅芃, 张川, 张卫东, 柳润辉, 徐希科 (2005) 呫吨酮类化合物的药理活性研究进展. 药学实践杂志, 1, 6-12.
- 50. Bumrungpert, A., Kalpravidh, R.W., Chuang, C.C., Overman, A., Martinez, K., Kennedy, A. and Mcintosh, M.K. (2010) Xanthones from mangosteen inhibit inflammation in human macrophages and in human adipocytes exposed to macrophage-conditioned media. Journal of Nutrition, 140, 842-847. http://dx.doi.org/10.3945/jn.109.120022
- 51. Sukma, M., Tohda, M., Suksamran, S. and Tantisira, B. (2011) γ-Mangostin increases serotonin2A/2C, muscarinic, histamine and bradykinin receptor mRNA expression. Journal of Eth-nopharmacology, 135, 450-454.
- 52. Gopalakrishnan, G., Banumathi, B. and Suresh, G. (1997) Evaluation of the antifungal activity of natural xanthones from Garcinia mangostana and their synthetic derivatives. Journal of Natural Products, 60, 519-524.
- 53. Lee, B.W., Lee, J.H., Lee, S.T., Lee, H.S., Lee, W.S., Jeong, T.S. and Park, K.H. (2005) Antioxidant and cy-totoxic activity of anthones from Cudrania tricuspidata. Bioorganic & Medicinal Chemistry Letters, 15, 5548-5552.
- 54. Auranwiwat, C., Trisuwan, K., Saiai, A., Pyne Stephen, G. and Ritthiwigrom, T. (2014) Antibacterial te-traoxygenated xanthones from the immature fruits of Garcinia cowa. Fitoterapia, 98, 179-183. http://dx.doi.org/10.1016/j.fitote.2014.08.003
- 55. Koh, J.J., Lin, S., Aung, T.T., Lim, F., Zou, H.X., Bai, Y., Li, J.G., Lin, H.F., Pang, L.M. and Koh, W.L. (2015) Amino acid modified xanthone derivatives: Novel, highly promising mem-brane-active antimicrobials for multidrug-resistant gram-positive bacterial infections. Journal of Medicinal Chemistry, 58, 739-752. http://dx.doi.org/10.1021/jm501285x
- 56. Rewcastle, G.W., Atwell, G.J., Li, Z.A., Baguley, B.C. and Denny, W.A. (1991) Potential antitumor agents. 61. Stucture-activity relationships for in vivo colon 38 activity among disubstituted 9-oxo-9H-xanthene-4-acetic acids. Journal of Medicinal Chemistry, 34, 217-222.
- 57. Sato, H., Dan, T., Onuma, E., Tanaka, H. and Koga, H. (1990) Studies on uricosuric diuretics. I. Syntheses and activities of (xanthonyloxy)acetic acids and dihy-drofuroxanthone-2-carboxylic acids. Chemical & Pharmaceutical Bulletin, 38, 1266-1277.
- 58. Qin, J., Lan, W., Liu, Z., Huang, J., Tang, H. and Wang, H. (2013) Synthesis and biological evaluation of 1, 3-dihy- droxyxanthone mannich base de-rivatives as anticholinesterase agents. Chemistry Central, 7, 78.
- 59. 孙洪发, 胡伯林, 樊淑芬, 丁经业 (1987) 花锚的三种新酮甙. 植物学报, 4, 422-428.
- 60. 常海涛, 史玉俊 (1999) 茄中的翠雀素对人纤维肉瘤HT-1080侵袭的体外抑制作用. 中草药, 6, 附5.
- 61. 黄朝辉, 曾光尧, 徐康平, 谭桂山 (2003) 呫吨酮类化合物及其药理活性. 国外医药: 植物药分册, 3, 93-100.
- 62. Riscoe, M., Kelly, J.X. and Winter, R. (2005) Xanthones as antimalarial agents: Discovery, mode of action, and optimization. Current Medicinal Chemistry, 12, 2539-2549.
- 63. Lyles, J.T., Negrin, A., Kennelly, E.J., Khan, S.I. and He, K. (2014) In vitro antiplasmodial activity of benzophenones and xanthones from edible fruits of Garcinia species. Planta Medica, 80, 676-681.
- 64. Fouotsa, H., Tatsimo, S.J.N., Neaumann, B., Michalek, C., Mbazoa, C.D., Nkengfack, A.E., Sewald, N. and Lannang, A.M. (2014) A new xanthone derivative from twigs of Garcinia nobilis. Natural Product Research, 28, 1030-1036.
- 65. Wu, Y., Hua, M.Y., Yang, L., Li, X., Bian, J.L., Jiang, F., Sun, H.P., You, Q.D. and Zhang, X.J. (2015) Xanthone with improved druglike properties and in vivo antitumor potency. Bioorganic & Medicinal Chemistry Letters, 25, 2584- 2588.
- 66. Mah, S.H., Ee, G.C.L., The, S.S., Sukari, M.A. and Pak, J. (2015) Antiproliferative xanthone derivatives from Calophyllum inophyllum and Calophyllum soulattri. Pharmaceutical Sciences, 28, 425-429.
- 67. Lin, C.N., Liou, S.J., Lee, T.H., Chuang, Y.C. and Won, S.J. (1996) Xanthone derivatives as potential anti-cancer drugs. Journal of Pharmacy and Pharmacology, 48, 539-544.
- 68. Liou, S.S., Shieh, W.L., Cheng, T.H., Won, S.J. and Lin, C.N. (1993) Gamma-pyrone compounds as potential anti-cancer drugs. Journal of Pharmacy and Pharmacology, 45, 791-794.
- 69. Rewcastle, G.W., Atwell, G.J., Baguley, B.C., Calveley, S.B. and Denny, W.A. (1989) Potential antitumor agents. 58. Synthesis and structure-activity relationships of substituted xanthenone-4-acetic acids active against the colon 38 tumor in vivo. Journal of Medicinal Chemistry, 32, 793-799.
- 70. Rewcastle, G.W., Atwell, G.J., Baguley, B.C., Boyd, M., Thomsen, L.L., Zhuang, L. and Denny, W.A. (1991) Potential antitumor agents. 63. Structure-activity relationships for side-chain analogs of the colon 38 active agent 9-oxo-9H- xanthene-4-acetic acid. Journal of Medicinal Chemistry, 34, 2864-2870.
- 71. 苏全冠 (2012) 呫吨酮类化合物抗肿瘤作用及机制研究. 博士论文, 中山大学, 广州.
- 72. Shen, R., Wang, W.H. and Yang, G.L. (2014) DNA binding property and antitumor evaluation of xanthone with dimethylamine side chain. Journal of Fluorescence, 24, 959-966.
- 73. 王道毅, 陈炼, 李忌, 李伯刚 (2000) 知母宁(Chinonin)对阿霉素的减毒增效作用. 天然产物开发与应用, 4, 8-11.
- 74. Jittiporn, K., Suwanpradid, J., Patel, C., Rojas, M., Thirawarapan, S., Suvitayavat, W., Moongkarndi, P. and Caldwell, R. (2014) Anti-angiogenic actions of the mangosteen polyphenolic xanthone derivative α-mangostin. Microvascular Research, 93, 72-79.
- 75. Sidahmed, H.M.A., Abdelwahab, S.I., Mohan, S., Abdulla, M.A., Taha, M.M.E., Hashim, N.M., Hadi, A.H.A., Vadivelu, J., Fai, M.L., Rahmani, M. and Yahayu, M. (2013) α-Mangostin from Cratoxylum arborescens (Vahl) blume demonstrates anti-ulcerogenic property: A mechanistic study. Evidence-Based Complementary and Alternative Medicine, 2013, Article ID: 450840.
- 76. 刘思好, 石端正, 范若皓, 姜德建 (2008) (口山)酮的心血管药理作用研究进展. 中国临床药理学与治疗学, 11, 1304-1308.
- 77. Liu, Q.Y., Wang, Y.T. and Lin, L.G. (2015) New insights into the anti-obesity activity of xanthones from Garcinia mangostana. Food & Function, 6, 383-393.
*通讯作者。