Hans Journal of Medicinal Chemistry
Vol.2 No.03(2014), Article ID:14025,7 pages
DOI:10.12677/HJMCe.2014.23006
Design, Synthesis and Anti-Allergic Activity Evaluation of Aryl-Acetic Acid Derivatives
1Jiangsu Key Laboratory of Drug Design and Optimization, China Pharmaceutical University, Nanjing
2Department of Medicinal Chemistry, China Pharmaceutical University, Nanjing
3Nanjing Industrial Pharmaceutical Technology Institute Co., Ltd., Nanjing
Email: *xyg@cpu.edu.cn
Copyright © 2014 by authors and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY).
http://creativecommons.org/licenses/by/4.0/



Received: Jul. 2nd, 2014; revised: Jul. 29th, 2014; accepted: Aug. 6th, 2014
Objective: To discover novel DP receptor antagonists with higher potency and less side-effect, several arylacetic acid derivatives were designed and synthesized. Method: A series of title compounds were synthesized by etherification, hydrolysis, amidation and hydrolysis on the basis of substitutional phenol, 1,2-dibromoethane and coumarate. All the target compounds were evaluated by the model of niacin-induced vasodilation. Results: 5 title compounds were synthesized. The results of biological evaluation showed that the compounds I-4 and I-5 exhibited more potency than positive drug (Laropiprant). Conclusion: The compounds I-4 and I-5 showed potent inhibitory effect on niacin-induced vasodilation and would be valuable for further investigation.
Keywords:Arylacetic Acids, Synthesis, Anti-allergic, Biological Activity

周海平1,金雨婷2,卞学国3,朱启华2*,董广平1,徐云根1,2*
1中国药科大学药物设计与优化江苏省重点实验室,南京
2中国药科大学药物化学教研室,南京
3南京医工医药有限公司,南京
Email: *xyg@cpu.edu.cn
收稿日期:2014年7月2日;修回日期:2014年7月29日;录用日期:2014年8月6日

目的:为了获得活性好、副作用小的DP受体拮抗剂,设计和合成芳基乙酸类衍生物。方法:以取代的苯酚、1,2-二溴乙烷以及香豆酸为原料,通过醚化、水解、酰胺化、水解等反应合成目标化合物,并研究其对烟酸诱导血管扩张效应的抑制活性。结果:合成了5个目标化合物,活性筛选结果表明,化合物I-4和I-5的活性优于阳性药(拉罗匹仑)。结论:化合物I-4和I-5对烟酸引起的血管扩张具有抑制作用,值得进一步研究。
芳基乙酸,合成,抗过敏,生物活性

过敏反应是机体受抗原刺激所发生组织损伤或功能紊乱的反应。前列腺素D2(PGD2)是一种重要的生物活性介质,是哮喘、过敏性鼻炎、过敏性结膜炎、过敏性皮炎等病症中促进过敏反应的关键因素之一[1] 。当PGD2作用于DP受体,会引起结膜和皮肤的血管渗透性增加,鼻腔气道阻力增加,气道收缩以及嗜酸细胞对结膜和气管的浸润[2] 。DP受体拮抗剂通过阻断DP受体,从而抑制由PGD2介导的上述过敏反应[3] -[6] 。芳基乙酸类DP受体拮抗剂是对药物吲哚美辛结构修饰过程中发现的,其中ONO-AE3- 237是代表化合物,由日本小野制药株式会社开发[7] -[10] 。并且文献报道将此类化合物的芳基环打开,可以进一步提高活性(如化合物1和2)。如图1所示。
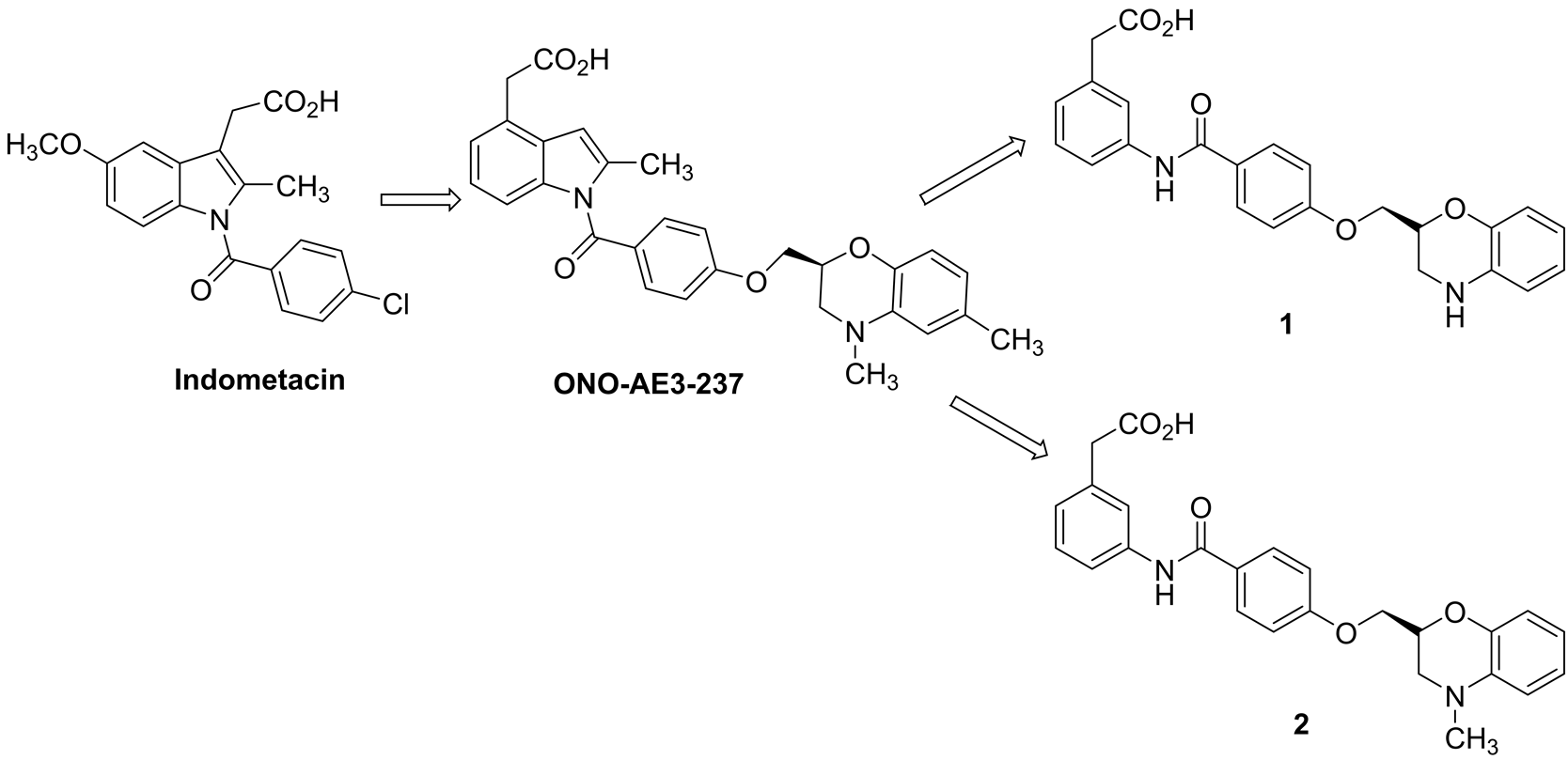
Figure 1. Structures of some arylacetic acids derivatives
图1. 部分芳基乙酸类化合物的结构
构效关系表明,此类化合物由芳基乙酸(A部分)与取代芳基(B部分)通过一个连接臂(芳基酰胺)连接而成。如图2所示:
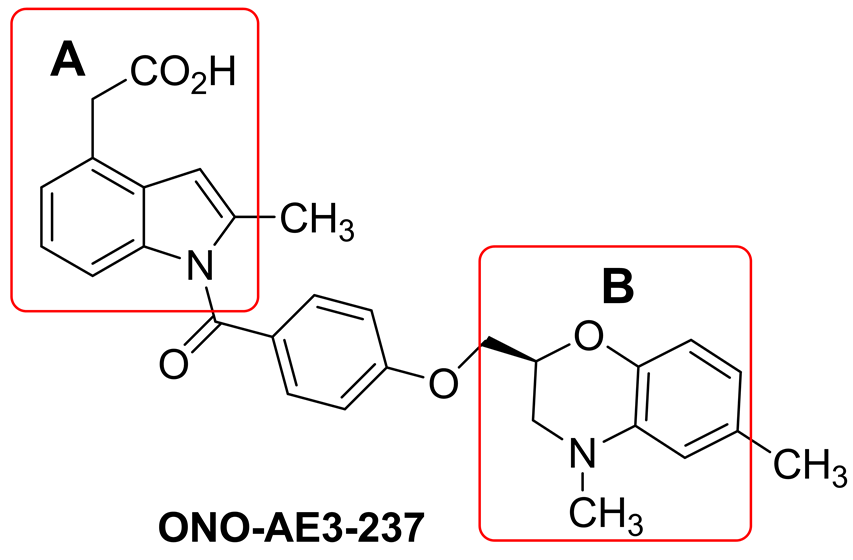
Figure 2. Structure analysis of ONO-AE3-237
图2. ONO-AE3-237的结构分析
A部分的羧基是必需基团,氨基与连接臂的羧基形成性质稳定的酰胺键,能起到固定分子骨架的作用。B部分的活性基团则是烷氧基连接的取代芳基。4-羟基肉桂酸(对香豆酸)是肉桂酸的系列衍生物,广泛存在于自然界植物中,毒性低,易于被人体代谢,用途也越来越广泛[11] [12] 。研究发现对香豆酸具有一定的抗炎抗过敏作用。为了获得活性好、副作用小的DP受体拮抗剂,本文用对香豆酸的片段替换ONO-AE3-237分子中的连接臂(4-羟基苯甲酸),A部分用苯乙酸替代,并在B部分引入一系列的取代芳基,设计合成了5个未见文献报道的化合物,并通过1H-NMR,13C-NMR和高分辨质谱进行了结构确证。同时,为了增加化合物的水溶性,将其制备成钠盐。目标化合物的结构(I-1~I-5)见表1。
表1. 目标化合物(I-1~I-5)的结构

所得到的目标化合物用烟酸诱导小鼠耳部血流加速模型进行了药理活性的筛选,结果显示I-4和I-5活性优于阳性药,目前深入的研究正在进行。期望得到副作用小,抗过敏活性好的候选化合物,为此类化合物的研究提供依据。
2.1. 主要仪器与试剂
天津市分析仪器厂RY-1型熔点仪,温度计未校正;NMR测定用BRUKER AM-300型或AM-500型核磁共振仪,内标TMS;HP 1100型质谱仪;Agilent 1100系列LC/MSD Trap SL。TLC所用硅胶板购买自烟台市化学工业研究所,型号HSGF254;柱层析硅胶为安徽良臣硅源材料有限公司(试剂级,300~400目);其他常用试剂都为市场上出售的分析纯试剂。
2.2. 实验方法
以化合物I-1的合成方法为例进行简述,化合物I-2~I-5的合成与之类似。合成路线如图3所示。

Figure 3. Synthetic route of title compounds (I-1~I-5)
图3. 目标化合物(I-1~I-5)的合成路线
反应条件:a) Br(CH2)2Br, K2CO3, CH3CN, reflux; b) 2, K2CO3, CH3CN, reflux; c) NaOH, THF, H2O,reflux; d) 1) SOCl2, CH2Cl2, DMF, 0℃ to r.t; 2)5, Et3N,THF,50℃; e) NaOH, THF, MeOH, H2O, 50℃。
3-(4-(2-苯氧基乙氧基)苯基)丙烯酸甲酯(I-1a)
在100 mL茄形瓶中,将苯酚(5 g, 0.053 mol)溶解于40 mL乙腈中,搅拌下加入1,2-二溴乙烷(9.2 mL, 0.106 mol)和碳酸钾(14.6 g, 0.106 mol),加热回流4小时后TLC检测反应完全,停止加热冷却至室温,过滤,滤饼用乙酸乙酯浸泡洗涤两次,滤液浓缩以除去残余的1,2-二溴乙烷,得到淡黄色油状物。此中间体不经提纯直接用于下一步。将上述所得的油状物加入到100 mL茄形瓶中,依次加入乙腈60 mL,碳酸钾(14.6 g, 0.106 mol)和碘化钾(0.05 g),对香豆酸甲酯(9.4 g, 0.053 mol),加热回流5小时后,TLC检测反应完全,停止加热冷却至室温,过滤,滤饼用乙腈洗涤2次,收集滤液,浓缩至50 mL左右,在冰箱中放置,析出白色固体,抽滤,烘干得11.4 g,产率72.2%,m.p.136℃~138℃。1H-NMR(300 MHz, CDCl3), δ(ppm): 7.66(1H, d, J = 15.9 Hz, =CH), 7.49(2H, d, J= 8.7 Hz, ArH), 7.28~7.34(2H, m, ArH), 6.95~7.01(5H, m, ArH), 6.33(1H, d, J = 15.9 Hz, =CH), 4.35(4H, m, OCH2), 3.80(3H, s, CO2CH3)。
3-(4-(2-苯氧基乙氧基)苯基)丙烯酸(I-1b)
将I-1a(5 g, 0.017 mol)加入到100 mL单口瓶中,依次加入THF 40 mL,水10 mL,氢氧化钠(2 g, 0.051 mol),加热回流2小时后,TLC检测反应完全。停止加热冷却至室温后浓缩,加水20 mL,用10%盐酸调pH至3,析出固体,抽滤,烘干得到白色固体4.1 g,产率84.8%,m.p.204℃~206℃。1H-NMR(300 MHz, DMSO-d6), δ(ppm): 7.66~7.68(2H, m, ArH), 7.56(1H, d, J = 16.0 Hz, =CH), 7.28~7.33(2H, m, ArH), 6.93~7.04 (5H, m, ArH), 6.40 (1H, d, J = 15.9 Hz, =CH), 4.34(4H, m, OCH2)。
2-(3-(3-(4-(2-苯氧基乙氧基)苯基)丙烯酰胺基)苯基)乙酸乙酯(I-1c)
在50 mL单口瓶中加入I-1b(0.5 g, 1.7 mmol)和15 mL CH2Cl2,冷却至0℃,滴加氯化亚砜(0.3 mL, 4.1 mmol),滴完后加入1滴DMF,在0℃搅拌10分钟后放至室温搅拌,2小时后TLC检测反应完全,将反应液浓缩后用5 mL THF稀释,制成酰氯溶液。在另一50 mL单口瓶中依次加入间氨基苯乙酸乙酯(0.3 g, 1.7 mmol),THF20 mL,三乙胺0.5 mL,冷却至0℃,滴加上述酰氯溶液,15分钟滴完,产生浑浊。缓慢加热至50℃,约3小时反应完全。停止加热冷却至室温后浓缩,加入乙酸乙酯30 mL稀释,依次用3 mol/L的NaOH(10 mL × 2),2N盐酸(10 mL × 2)和饱和食盐水洗涤(20 mL × 2),无水硫酸钠干燥,抽滤浓缩,得到白色固体0.59 g,产率75.6%,m.p.140~142℃。1H-NMR(300MHz, DMSO-d6), δ(ppm): 10.10(1H, s, CONH), 7.51~7.60(4H, m, ArH), 7.28~7.31(3H, m, ArH), 7.07(2H, d, J = 7.5 Hz, ArH), 6.97~7.00(4H, m, ArH, =CH), 6.70(1H, d, J = 15.7 Hz, =CH), 4.35(4H, d, J = 9.4 Hz, OCH2), 4.08~4.10(2H, m, CO2CH2CH3), 3.64(2H, s, ArCH2), 1.17~1.22(3H, m, CO2CH2CH3)。
2-(3-(3-(4-(2-苯氧基乙氧基)苯基)丙烯酰胺基)苯基)乙酸钠(I-1)
将I-1c(0.5 g, 1.1 mmol)加入50 mL茄形瓶中,加入THF10 mL,甲醇5 mL,以及NaOH固体(0.13 g, 3.3 mmol),加热至50℃搅拌1小时,TLC检测反应完全。停止加热冷却至室温,浓缩,得到的固体用异丙醇重结晶,得到白色固体0.43 g,产率87.2%,m.p.212℃~216℃。1H-NMR(300 MHz, CD3OD), δ(ppm): 7.66(2H, d, J = 15.9 Hz, ArH), 7.57(2H, d, J = 5.1 Hz, ArH), 7.51(1H, d, J = 15.6 Hz, =CH), 7.24~7.31(3H, m, ArH), 7.09(1H, d, J = 7.5 Hz, ArH), 6.92~7.02(5H, m, ArH), 6.66(1H, d, J = 15.6 Hz, =CH), 4.31~4.32(4H, m, OCH2), 3.50(2H, s, ArCH2). 13C-NMR(300 MHz, CD3OD), δ(ppm): 178.2, 165.1, 159.9, 158.3, 140.4, 138.3, 138.0, 128.7, 128.6, 127.7, 127.4, 124.3, 120.2, 118.2, 117.1, 114.2, 113.8, 66.2, 65.8, 44.5. HRMS (ESI) m/z: calcd. For C25H22NNaO5 (M) 440.1468 [M+H]+, found 440.1508 [M+H]+。
2.3. 活性研究
根据文献[13] -[15] 构建小鼠模型进行活性研究。方法如下:小鼠进行适应性饲养后,按照造模组(烟酸组)、阳性组每组12只以及受试组每组6只进行分组。小鼠称重后,按40 mg/kg腹腔注射3%戊巴比妥钠,待动物麻醉后,将松柏油涂于小鼠右耳,置于微循环检测仪,观察右耳血管血液流速,测定未给药前的初始血液流速并记录。阳性组腹腔注射给予10 mg/kg阳性药拉罗匹仑,受试组分别注射化合物I-1~I-5(1 mL/100 g),烟酸组不另做处理。30分钟后对各组别小鼠皮下注射给予100 mg/kg烟酸(1 mL/100 g),在2 min、4 min、6 min、8 min、10 min测定血液流速并记录,并根据所测流速计算抗烟酸抑制率,公式如下:
流速增加倍数 = 给烟酸后血液流速/初始血液流速
抗烟酸抑制率 = (烟酸组流速增加倍数 – 受试组或阳性组流速增加倍数)/烟酸组流速增加倍数 × 100%
本试验所有数据均采用SPSS软件统计,给药前后及不同给药组间比较,统计方法采用t检验。
3.1. 结构表征
化合物I-2~I-5的结构均通过1HNMR,13C NMR以及高分辨质谱得到确证。其图谱数据如下:
2-(3-(3-(4-(2-(4-氯苯氧基)乙氧基) 苯基)丙烯酰胺基)苯基)乙酸钠(I-2)
1H-NMR(300MHz, CD3OD), δ(ppm): 7.68 (1H, d, J = 8.1 Hz, ArH), 7.55~7.64(3H, m, ArH, =CH), 7.45(1H, s, ArH), 7.26~7.29(2H, m, ArH), 7.23(1H, d, J = 8.1 Hz, ArH), 7.09(1H, d, J = 7.8 Hz, ArH), 7.02(2H, d, J = 8.7 Hz, ArH), 6.95~6.98(2H, m, ArH), 6.67(1H, d, J = 15.6Hz, =CH), 4.32~4.35(4H, m, OCH2), 3.50(2H, s, ArCH2).13C-NMR(300 MHz, CD3OD), δ(ppm): 178.1, 165.1, 159.8, 157.1, 140.3, 138.4, 138.0, 128.7, 128.5, 127.6, 127.4, 125.0, 124.3, 120.1, 118.3, 117.1, 115.3, 114.2, 66.3, 66.1, 44.5. HRMS(ESI) m/z: calcd. For C25H21ClNNaO5(M) 474.1079 [M+H]+, found 474.1122 [M+H]+.
2-(3-(3-(4-(2-(3-甲氧基苯氧基)乙氧基)苯基)丙烯酰胺基)苯基)乙酸钠(I-3)
1H-NMR(300MHz, CD3OD), δ(ppm): 7.57~7.64(3H, m, ArH), 7.53(2H, d, J = 7.2 Hz, ArH), 7.15~7.26(2H, m, ArH, =CH), 7.09(1H, d, J = 7.5 Hz, ArH), 7.01(2H, d, J = 7.5 Hz, ArH), 6.67(1H, d, J = 7.5 Hz, =CH), 6.52~6.57(3H, m, ArH), 4.28~4.34(4H, m, OCH2), 3.76(3H, s, OCH3), 3.50(2H, s, ArCH2). 13C-NMR(300 MHz, CD3OD), δ(ppm): 178.2, 165.1, 160.5, 159.9, 159.5, 140.4, 138.3, 138.0, 129.1, 128.7, 127.7, 127.3, 124.3, 120.2, 118.2, 117.1, 114.2, 105.9, 105.8, 100.3, 66.2, 65.9, 53.8, 44.5. HRMS (ESI) m/z: calcd. For C26H24NNaO6 (M) 470.1574 [M+H]+, found 470.1616 [M+H]+.
2-(3-(3-(4-(2-(3-甲氧基苯氧基)乙氧基)苯基)丙烯酰胺基)苯基)乙酸钠(I-4)
1H-NMR(300 MHz, CD3OD), δ(ppm): 7.68(1H, d, J = 6.8 Hz, ArH), 7.54~7.63(3H, m, ArH, =CH), 7.45(1H, s, ArH), 7.22~7.27(1H, m, ArH), 7.09(1H, d, J = 6.3 Hz, ArH), 7.01~7.04(3H, m, ArH), 6.93~6.98(2H, m, ArH),6.90~6.92(1H, m, ArH), 6.66(1H, d, J = 13.0 Hz, =CH), 4.36(4H, s, OCH2), 3.82(3H, s, OCH3), 3.50(2H, s, ArCH2).13C-NMR(300MHz, CD3OD), δ(ppm): 178.1, 159.9, 147.7, 140.4, 138.3, 138.0, 128.7, 127.6, 127.3, 124.3, 121.3, 120.3, 120.1, 118.2, 117.1, 114.3, 114.2, 111.9, 67.5, 66.2, 54.6, 44.5. HRMS(ESI) m/z: calcd. For C26H24NNaO6 (M) 470.1574 [M+H]+, found 470.1623 [M+H]+.
2-(3-(3-(4-(2-(2,4-二氯苯氧基)乙氧基)苯基)丙烯酰胺基)苯基)乙酸钠(I-5)
1H-NMR(300MHz, CD3OD), δ(ppm): 7.65(1H, d, J = 7.0 Hz, ArH), 7.53~7.63(3H, m, ArH, =CH), 7.48(1H, s, ArH), 7.39(1H, d, J = 2.0 Hz, ArH), 7.21~7.27(2H, m, ArH), 7.09(2H, d, J = 7.3 Hz, ArH), 7.01(2H, d, J = 4.2 Hz, ArH), 6.65(1H, d, J = 7.8 Hz, =CH), 4.37(4H, s, OCH2), 3.50(2H, s, ArCH2). 13C-NMR(300 MHz, CD3OD), δ(ppm): 178.1, 165.1, 159.8, 152.9, 140.3, 138.3, 138.0, 128.9, 128.7, 127.7, 127.4, 127.0, 125.2, 124.3, 123.1, 120.1, 118.3, 117.1, 114.3, 67.6, 66.0, 44.5. HRMS(ESI) m/z: calcd. For C25H20Cl2NNaO5(M) 484.0724 [M-Na]-, found 484.072 [M-Na]-.
3.2. 生物活性
根据2.3的实验方法,以烟酸作为造模药,构建小鼠模型,用拉罗匹仑作为阳性药,研究目标化合物的抑制活性(结果见表2和表3)。
结果显示,5个化合物的抑制作用比阳性药起效速度更快。化合物I-2与烟酸造模组流速增加倍数比较有较显著差异(P < 0.05),表明此类受试物能抑制烟酸引起血流加快作用。化合物I-1,I-3,I-4,I-5与烟酸造模组流速增加倍数比较有较显著差异(P < 0.01),表明此类受试物能显著抑制烟酸引起血流加快作用。并且化合物I-4,I-5的抑制率优于阳性药,对其深入的药理实验正在进行。
Table 2. Suppression of niacin-induced vasodilation assay of the compounds (effect on blood flow velocity in the mouse ear)
表2. 目标化合物对烟酸诱导的血管扩张的抑制作用(对小鼠耳部血流速度的影响)
表3. 化合物对烟酸诱导的血管扩张的抑制率
本文以ONO-AE3-237为先导物,设计并合成了5个未见文献报道的目标化合物(I-1~I-5),其结构经1H-NMR,13C-NMR以及高分辨质谱确证,并且对5个化合物进行了活性筛选,结果表明,5个化合物对烟酸引起的血管扩张均具有一定的抑制作用,并且起效速度优于阳性药拉罗匹仑。其中,化合物I-4和I-5的抑制活性优于阳性药,值得进一步研究。
- [1] Lewis, R.A., Soter, N.A., Diamond, P.T., Austen, K.F., Oates, J.A., et al. (1982) Prostaglandin D2 generation after activation of rat and human mast cells with anti-IgE. Journal of Immunology, 129, 1627-1631.
- [2] Matsuoka, T., Hirata, M., Tanaka, H., Takahashi, Y., Murata, T., et al. (2000) Prostaglandin D2 as a mediator of allergic asthma. Science, 287, 2013-2017.
- [3] Kabashima, K. and Narumiya, S. (2003) The DP receptor, allergic inflammation and asthma. Prostaglandins, Leukotrienes and Essential Fatty Acids, 69, 187-194.
- [4] Norel, X. (2007) Prostanoid receptors in the human vascular wall. The Scientific World Journal, 7, 1359-1374.
- [5] Hammad, H., de Heer, H.J., Soullie, T., Hoogsteden, H.C., Trottein, F. and Lambrecht, B.N. (2003) Prostaglandin D2 inhibits airway dendritic cell migration and function in steady state conditions by selective activation of the D prostanoid receptor 1. Journal of Immunology, 171, 3936-3940.
- [6] Yasui, K., Asanuma, F., Hiranoa, Y., Shichijoa, M., Deguchia, M. and Arimurab, A. (2008) Contribution of prostaglandin D2 via prostanoid DP receptor to nasal hyperresponsiveness in guinea pigs repeatedly exposed to antigen. European Journal of Pharmacology, 578, 286-291.
- [7] Torisu, K., Kobayashi, K., Iwahashi, M., Nakai, Y., et al. (2004) Development of prostaglandin D2 receptor antagonist: Discovery of highly potent antagonists. Bioorganic Medicinal Chemistry, 12, 4685-4700.
- [8] Torisu, K., Kobayashi, K., Iwahashi, M., Nakai, Y., et al. (2004) Discovery of a new class of potent, selective, and orally active prostaglandin D2 receptor antagonists. Bioorganic Medicinal Chemistry, 12, 5361-5378.
- [9] Torisu, K., Kobayashi, K., Iwahashi, M., Nakai, Y., et al. (2004) Discovery of orally active prostaglandin D2 receptor antagonists. Bioorganic Medicinal Chemistry Letters, 14, 4891-4895.
- [10] Torisu, K., Kobayashi, K., Iwahashi, M., Egashira, H., et al. (2005) Development of a prostaglandin D2 receptor antagonist: Discovery of a new chemical lead. European Journal of Medicinal Chemistry, 40, 505-519.
- [11] 董颖 (2006) 白花蛇舌草的化学成分及其质量研究. 硕士论文, 首都师范大学, 北京.
- [12] 胡铮瑢, 刘玉环, 阮榕生, 彭红, 张锦胜, 刘成梅 (2009) 阿魏酸、对香豆酸碱法制备及应用研究进展. 食品科学, 21, 438-442.
- [13] Lai, E. and Tobert, J.A. (2006) Method of treating pathological blushing. Patent No. WO 2006052798 A2.
- [14] Sturino, C.F., O’Neill, G., Lachance, N., Boyd, M., et al. (2007) Discovery of a potent and selective prostaglandin D2 receptor antagonist, [(3R)-4-(4-chloro-benzyl)-7-fluoro-5-(methylsulfonyl)-1,2,3,4-tetrahydrocyclopenta[b]indol-3-yl]- aceticacid (MK-0524). Journal of Medicinal Chemistry, 50, 794-806.

*通讯作者。
