Advances in Clinical Medicine
Vol.
14
No.
01
(
2024
), Article ID:
80338
,
9
pages
10.12677/ACM.2024.141307
TACE联合靶向治疗药物治疗中晚期肝癌的 临床疗效的Meta分析
向康,戴鑫杰,李丹,吴登鼎,杨新宇,艾空,胡军*
三峡大学第一临床医学院,宜昌市中心人民医院,湖北 宜昌
收稿日期:2023年12月27日;录用日期:2024年1月21日;发布日期:2024年1月31日

摘要
分析经动脉化疗栓塞(TACE)联合靶向治疗药物索拉菲尼(Sorafenib)和单独TACE治疗中晚期肝癌的临床疗效及不良反应。方法:检索PubMed、Embase、考克兰图书馆、中国期刊全文数据库及万方数据库,收集TACE和索拉菲尼联合治疗中晚期肝癌相关的随机对照试验(Randomized Controlled Trial, RCT),检索时间跨度均从建库至2023年8月。由2位评价者按照纳入与排除标准独立筛选文献、提取资料并评价纳入研究的偏倚风险后,按照Cochrane系统评价方法完成数据提取和文献质量评估。采用RevMan 5.3软件进行Meta分析。结果:在检索分析后有7篇RCT入组,共920例患者,其中观察组为TACE联合sorafenib治疗组有464例,TACE单独治疗组为对照组有456例,这些患者的客观缓解率(ORR)在TACE+索拉菲尼组和TACE组分别为55.8%和44.5%差异有统计学意义(P = 0.0008);而且TACE + 索拉菲尼组比单独TACE治疗组有更高的1年、2年生存率;TACE + 索拉菲尼的并发症中包括厌食症、贫血、脊髓抑制、腹泻腹痛、恶心呕吐、疲惫、发热、手足口症、高血压、体重减轻等,有些学者认为在TACE + 索拉菲尼的治疗方案中,索拉菲尼的使用加重了患者的不良反应,但和TACE单独治疗组相比,在TACE + 索拉菲尼治疗组中出现的更多不良反应如手足口症和腹泻,在对症治疗后患者可以明显改善,而胃肠道反应、发热、乏力等基础不良反应的病例数与对照组并无明显差异。
关键词
中晚期肝癌,经动脉化疗栓塞,索拉菲尼,不良反应

Meta-Analysis on the Clinical Efficacy of Transcatheter Arterial Chemoembolization Combined with Targeted Therapy in the Treatment of Middle and Advanced Liver Cancer
Kang Xiang, Xinjie Dai, Dan Li, Dengding Wu, Xinyu Yang, Kong Ai, Jun Hu*
The First Clinical Medical College of China Three Gorges University, Yichang Central People’s Hospital, Yichang Hubei
Received: Dec. 27th, 2023; accepted: Jan. 21st, 2024; published: Jan. 31st, 2024

ABSTRACT
Objective: To analyze the clinical efficacy and adverse reactions of transcatheter chemoembolization (TACE) combined with Sorafenib and TACE alone in the treatment of primary liver cancer. Methods: PubMed, Embase, Cochrane Library, China Journal Full-text Database and Wanfang Database were searched to collect the Randomized Controlled trials (RCTS) related to the combination of TACE and Sorafenib in the treatment of primary liver cancer. The retrieval time span is from database construction to August 2023. Two evaluators independently screened the literature according to the inclusion and exclusion criteria, extracted the data, and evaluated the risk of bias in the included studies. Data extraction and literature quality assessment were completed according to the Cochrane systematic evaluation method. Meta-analysis was performed using RevMan 5.3 software. Results: Seven RCTS were included after retrieval analysis, including a total of 920 patients, including 464 patients in the observation group treated with TACE combined with Sorafenib, and 456 patients in the control group treated with TACE alone. The objective response rate (ORR) of these patients was 55.8% in the TACE + Sorafenib group and 44.5% in the TACE group (P = 0.0008). Moreover, the TACE + Sorafenib group had higher 1-year and 2-year survival rates than the TACE group alone. Complications of TACE + Sorafenib include anorexia, anemia, spinal cord depression, diarrhea, abdominal pain, nausea and vomiting, fatigue, fever, hand, foot and mouth disease, hypertension, weight loss, etc. Some scholars believe that in the treatment regimen of TACE + Sorafenib, the use of sorafenib worsens the adverse reactions of patients, and compared with conventional treatment alone group, in the TACE + Sorafenib treatment group, there were more adverse reactions such as hand, foot and mouth disease and diarrhea, which could be significantly improved after symptomatic treatment, while there was no obvious difference in the number of cases of gastrointestinal reaction, fever, fatigue and other basic adverse reactions from the control group.
Keywords:Middle and Advanced Liver Cancer, TACE, Sorafenib, Adverse Reaction

Copyright © 2024 by author(s) and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY 4.0).
http://creativecommons.org/licenses/by/4.0/


1. 引言
目前,中晚期肝癌是人类在消化道肿瘤中面对的困难之首 [1] ,发现时大多数已发展成为中晚期肝癌,无法耐受手术治疗,仅有15%~20%的患者有机会进行手术治疗,大部分都错过最佳治疗时间导致治疗效果不佳且预后较差。而经动脉化疗栓塞 [2] (Transcatheter arterial chemoembolization, TACE)由于其创伤小、耐受性高且效果显著,是目前中晚期肝癌患者的首选治疗,TACE使肝癌组织局部血流减慢、血量降低、血管逐渐减少,使肿瘤生长缓慢,但无法清除术后残存的肿瘤组织 [3] [4] [5] [6] 。与手术治疗相比,TACE能取得的疗效比较狭隘,因其只能栓塞局部重要的肿瘤走行血管,而无法栓塞全部的肿瘤血管,并且栓塞导致的缺血缺氧可加快肿瘤的生长和发展 [7] 。因此,在提高TACE疗效的方案中,如何在TACE治疗的同时,控制VEGF的表达就成了未来TACE治疗疗效的突破点。
针对中晚期肝癌患者,索拉菲尼(Sorafenib)是首个络氨酸激酶抑制剂,抑制肿瘤细胞的增殖 [8] 。目前,联合索拉菲尼已成为临床上部分医院的常用治疗方案,有很多研究 [6] [9] [10] [11] [12] [13] 发表,但结论有争议,本研究对TACE联合索拉菲尼和单独TACE的疗效进行分析。
2. 资料于方法
2.1. 文献检索
检索从建库2014年1月到2023年8月关于TACE联合索拉菲尼与单独TACE治疗中晚期肝癌临床疗效对照的研究。从PubMed、Embase、考克兰图书馆、万方数据库及中国知网等数据库中检索,经动脉化疗栓塞术、TACE、索拉菲尼、中晚期肝癌、肝细胞癌是中文检索词,英文检索词包括:HCC, Hepatocellular Carcinomas, Liver Cell Carcinoma Adult, Liver Cancer Adult, Adult Liver Cancer, Adult Liver Cancers, Cancer Adult Liver, Cancers Adult Liver, Liver Cancers Adult, Liver Cell Carcinoma, Carcinoma Liver Cell, Carcinomas Liver Cell, Cell Carcinoma Liver, Cell Carcinomas Liver, Liver Cell Carcinomas, Hepatocellular Carcinoma, Hepatoma, Hepatomas, randomizedcontrolledtrial [Filter], Transarterialchemoembolization, Therapeutic Chemoembolization, Chemoembolizations Therapeutic, Therapeutic Chemoembolizations, randomizedcontrolledtrial [Filter], sorafenib, Nexavar, BAY43-9006, BAY439006, BAY439006, Sorafenib N-Oxide, Sorafenib NOxide, BAY-673472, BAY-673472, BAY545-9085, BAY5459085, BAY5459085, BAY-545-9085, BAY5459085, Sorafenib Tosylate, 4-(4-(3-(4-Chloro-3-trifluoromethylphenyl)ureido)phenoxy)pyridine-2-carboxylicacidmethyamide-4-methylbenzenesulfonate, randomizedcontrolledtrial [Filter]。纳入文献语言为中文、英语。
2.2. 文献纳入标准
纳入标准:(1) 研究类型:所有引用的数据和文献均来自RCT。(2) 病例对象引用病例必须经过穿刺活检和(或)影像学证实为肝细胞肝癌,并且根据BCLC分期标准,确诊为无法接受外科手术治疗的中晚期肝细胞癌。(3) 干预措施:在各实验中TACE联合索拉菲尼治疗是实验组的治疗方式,对照组的治疗手段是单独应用TACE治疗。(4) 结局观察指标:所纳入的研究应至少采用下列一项观察指标:A) 客观缓解率(ORR = CR + PR);B) 完全有效率CR;C) 部分有效率PR;D) 6个月、1年、2年生存率;E) 治疗的不良反应。(5) 排除标准 [9] 。
A) 干预手段分组不清晰;B) 非RCT;C) 重复文章;D) 观察指标不一致;E) 试验分组不一致;F) 文献数据不完整。
2.3. 资料获取
2名研究者独立完成文献筛查和数据提取由,若对于资料和文献有分歧则一起讨论,由第3位研究者决定。对于缺乏资料数据或文件通过邮件与相应RCT作者联系。提取数据内容包括:题目、作者姓名、国籍、性别、Child-Pugh分级、并发症、发表日期、文献来源、实验组和对照组的人数、干预措施、结果指标。
2.4. 统计学分析
使用Revman (5.30版)软件进行统计分析。先用x2检验各试验结果的异质性之后再进行meta分析,若检验结果显示I2 < 50%,P > 0.05,则提示各试验同质性较好,采用固定效应模型进行荟萃分析;I2 > 50%,P < 0.05,则说明纳入研究的各实验同质性差,采用随机效应模型合并分析。最终统计指标绘制森林图,对图中优势比(CR,PR,ORR值)及其95% CI值进行统计描述及探讨。
3. 结果
3.1. 文献检索的流程和文献的一般特征
通过本文所述的检索方式阅读全文后,最终纳入研究7篇文献,见图1。所纳入的7项研究均为RCT,共920例患者,对照组和实验组分别有456和464例患者,7项研究的基本特征见表1。

Figure 1. Literature screening process
图1. 文献筛选流程
Table 1. Basic information of the included study literature cases
表1. 纳入研究文献病例的基本信息
3.2. TACE联合Sorafenib的疗效对比
选取的7篇RCT报道了TACE联合索拉菲尼与单独TACE相比的肝癌患者的客观有效率CR、临床获益率ORR和部分缓解率PR数据,异质性结果( = 27%, PORR = 0.22; = 5%, PCR = 0.39; = 22%, PPR = 0.26)显示I2 < 50%,P > 0.05,各试验同质性较好,采用固定效应模型对客观有效率、临床获益率、部分缓解率数据进行合并分析。详见图2~4。
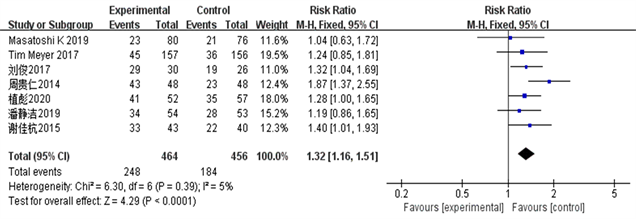
Figure 2. Objective and efficient CR forest map
图2. 客观有效率CR森林图
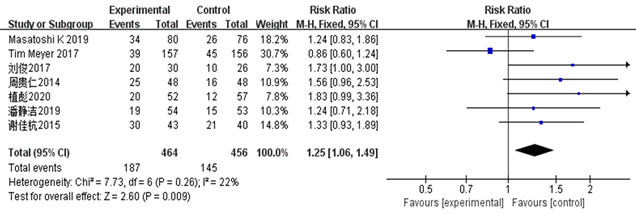
Figure 3. Partial response rate PR forest plot
图3. 部分缓解率PR森林图
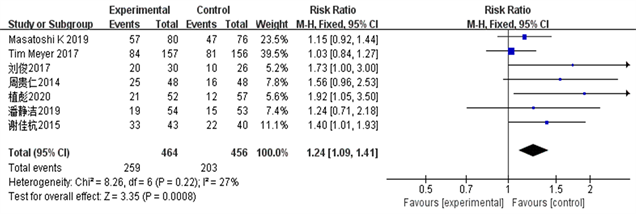
Figure 4. Clinical benefit rate ORR forest plot
图4. 临床获益率ORR森林图
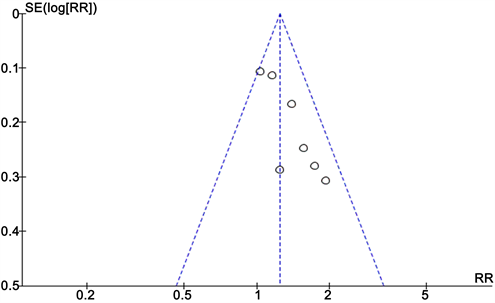
Figure 5. Clinical benefit rate funnel plot
图5. 临床获益率漏斗图
结果显示TACE联合Sorafenib靶向药物治疗中晚期肝癌的客观有效率、临床获益率和部分缓解率明显优越于单独应用TACE治疗(ORORR = 3.35, 95% CI 1.09~1.41, PORR = 0.008; ORCR = 4.29, 95% CI 1.16~1.51, PCR = 0.0001; ORPR = 2.60, 95% CI 1.06~1.49, PPR = 0.009)。该统计学结果提示TACE + Sorafenib的联合治疗效果从统计学的角度来说是优于单独TACE治疗。详见图2~5。
3.3. 两种方法生存率比较
在选取的7篇RCT中只有4篇中文文献涉及生存率的分析,因此暂不进行定量合并分析TACE联合Sorafenib的生存率,周仁贵等 [9] 研究显示两种治疗方法的一年生存率89.6%、两年生存率72.9%,均高于对照组患者对应的58.3%和35.4%,差异存在显著差异性(P < 0.05)。植彪等 [6] 研究显示1年生存期及QOL评分优于对照组(P < 0.05);刘俊等 [10] 研究显示两种治疗方法中,治疗1个月后,观察组总有效率66.7%优于对照组38.5%,两组生存率的差异有明显的统计学意义(P < 0.05),观察组中位生存时间为15.8个月,大于对照组10.8个月,两组的平均中位生存时间对比差异有统计学意义(P < 0.05)。谢佳杭等 [11] 研究显示TACE联合Sorafenib和单独TACE治疗的生存率1年、2年、3年分别为74.4%、44.2%,14.0%,对照组分别为52.5%、32.5%,10.0%,两组1年生存率差异有明显统计学意义(P < 0.05),2、3年生存率差异无统计学意义(P > 0.05)。
3.4. TACE联合Sorafenib与单独TACE治疗的不良反应对比
本研究在7篇RCT中选取了记载较详细的3篇RCT中的不良反应 [6] [13] [14] ,进行TACE联合Sorafenib治疗组与单独TACE治疗组的并发症的统计,其中主要常见的不良反应为厌食症、贫血、脊髓抑制、腹泻腹痛、恶心呕吐、疲惫、发热、手足口症、高血压、体重减轻等。各类型并发症进行分析了其异质性后,异质性无明显差异(I2 < 50%,P > 0.05,表2)。其中TACE + Sorafenib较TACE单独治疗组大多数并发症并无明显增多或改变,只有如腹泻和手足口症两种并发症较TACE单独治疗组明显增多(如表2),但手足口症和腹泻这两种并发症可以通过减少靶向药物的输入量或控制靶向药物的疗程并辅助以对症治疗后得以控制并明显改善 [15] ,患者治疗后的耐受性和接受度也较高。
Table 2. Comparison of adverse effects between TACE + Sorafenib and TACE alone (3 RCTs with comprehensive data: [9] + Tim Meyer [14] + Masatoshi K [13] , P > 0.05 and statistically significant)
表2. TACE + Sorafenib治疗组和TACE单独治疗组不良反应的对比(选取数据较全面的3篇RCT:植彪 [9] + Tim Meyer [14] + Masatoshi K [13] ,P > 0.05,并具有统计学意义)
4. 讨论
目前,肝癌是我国最常见的恶性肿瘤之一,因起病隐匿导致患者在发现时早已错过了最佳手术时间,对于丧失了手术机会的中晚期肝癌患者,主要的治疗方法为经动脉化疗栓塞术(TACE),从肝癌的生理学特性出发进行相关综合治疗 [16] [17] [18] [19] 。TACE具有创伤小、对于病变部位针对性强,在短期内疗效显著,对于患者短期的预后提升较高,但TACE术后会使肿瘤细胞和周围细胞组织缺血缺氧,促进VEGF分泌增加,使肿瘤病变部位血管再生增强,最终导致局部肿瘤复发,VEGF与肿瘤的发展和转移密切相关,最终影响了TACE治疗后的疗效 [20] [21] [22] 。与此同时,索拉菲尼作为肝癌的首选靶向治疗药物,可以通过抑制VEGFR和PDGFR阻断了肿瘤细胞和组织的血管生成,并且阻断了VEGF的增多,从原理上与TACE进行了互补 [23] [24] [25] [26] 。
为了提高TACE的疗效,本文章将研究TACE和索拉菲尼联合治疗的治疗模式和单独的TACE治疗疗效对比。结果显示,TACE和索拉菲尼的联合治疗组的客观有效率、临床获益率和局部控制率都高于TACE单独治疗组,并且有显著统计学意义(P < 0.05)。在短期和中位生存率中,实验组治疗的6个月生存率、1年生存率、2年生存率均高于单独TACE治疗组,并且差异显著(P < 0.05)。对于两者的不良反应,TACE和索拉菲尼联合治疗组中多项不良反应都与TACE单独治疗组的不良反应一致,对于手足口症和腹泻等严重并发症在减少索拉菲尼的剂量和使用对应药物后可以缓解,因此患者也能较好的耐受,因此在能够耐受并发症的情况下,TACE和索拉菲尼的联合治疗比TACE单独治疗疗效更好且预后更佳。
综上所述,TACE联合Sorafenib治疗中晚期肝癌在提高临床治疗效果以及改善中、短期生存率方面明显优于TACE单独治疗组,并且在并发症方面并没有像许多学者担心的那样严重。因此TACE联合索拉菲尼的疗法相较于TACE单独治疗是更加有效并且安全的。虽然索拉菲尼的获得性耐药性仍未解决,包括肿瘤的表观遗传调控修饰、肿瘤微环境对于索拉菲尼的运输作用、调控细胞死亡作用和肿瘤微环境对索拉菲尼的限制等以下四个方面作用,我们通过联合细胞毒性化疗药物的组合、分子靶向药物的组合、靶向PI3K/AKT/mTOR信号通路、与免疫治疗药物联合治疗这四个方面出发,寻找到针对索拉菲尼的获得性耐药性的解决方案 [27] [28] ,提高患者的疗效和预后。
本研究所用的实验数据均来自RCT,因此同质性和可信度较高,但每个实验中也存在差异,在给患者使用索拉菲尼的时间和TACE治疗时使用的辅助药物的种类和计量也不尽相同。因此在未来我们仍需要大量的病历和数据来研究和探讨TACE联合索拉菲尼治疗中晚期肝癌的临床疗效和安全性。
基金项目
本课题获湖北省卫生健康委科研项目基金资助(基金编号WJ2021M065)。
文章引用
向 康,戴鑫杰,李 丹,吴登鼎,杨新宇,艾 空,胡 军. TACE联合靶向治疗药物治疗中晚期肝癌的临床疗效的Meta分析
Meta-Analysis on the Clinical Efficacy of Transcatheter Arterial Chemoembolization Combined with Targeted Therapy in the Treatment of Middle and Advanced Liver Cancer[J]. 临床医学进展, 2024, 14(01): 2181-2189. https://doi.org/10.12677/ACM.2024.141307
参考文献
- 1. Josep, M.L., Robin, K.K., et al. (2021) Hepatocellular Carcinoma. Nature Reviews Disease Primers, 7, Article No. 7. https://doi.org/10.1038/s41572-021-00245-6
- 2. Raoul, J.L., Alejandro, F., et al. (2019) Updated Use of TACE for Hepatocellular Carcinoma Treatment: How and When to Use It Based on Clinical Evidence. Cancer Treatment Reviews, 72, 28-36. https://doi.org/10.1016/j.ctrv.2018.11.002
- 3. 徐帅帅. 肝动脉化疗栓塞术联合阿帕替尼治疗中晚期肝细胞性肝癌的疗效及安全性分析[D]: [硕士学位论文]. 合肥: 安徽医科大学, 2022. https://doi.org/10.26921/d.cnki.ganyu.2022.000415
- 4. 中国研究型医院学会互联网医院分会. 中国肿瘤微创治疗技术指南[J]. 癌症进展, 2022, 20(18): 1838-1855.
- 5. 张倩. 原发性肝癌微创介入治疗的临床对比研究[D]: [硕士学位论文]. 张家口: 河北北方学院, 2022. https://doi.org/10.27767/d.cnki.ghbbf.2022.000361
- 6. 植彪, 陈勇. TACE联合微波消融加索拉菲尼治疗中晚期原发性肝癌的临床疗效分析[J]. 四川医学, 2020, 41(10): 1058-1062.
- 7. Lin, Z.H. and Jiang, J.R. (2021) Prognostic Value of Serum HIF-1α Change following Transarterial Chemoembolization in Hepatocellular Carcinoma. Clinical and Experimental Medicine, 21, 109-120. https://doi.org/10.1007/s10238-020-00667-8
- 8. 王保江, 丛鹏. 经导管动脉化疗栓塞联合仑伐替尼治疗中晚期原发性肝癌的有效性与安全性: meta分析[J/OL].中国普外基础与临床杂志, 1-9. http://kns.cnki.net/kcms/detail/51.1505.R.20231122.1710.018.html, 2023-12-11.
- 9. 周仁贵, 周锡建, 李相勇, 等. 索拉非尼联合化疗栓塞治疗晚期原发性肝癌的疗效分析[J]. 现代生物医学进展, 2014, 14(13): 2494-2496.
- 10. 刘俊, 李灼日. 索拉菲尼联合TACE治疗肝癌术后复发的临床疗效分析[J]. 医学研究杂志, 2017, 46(12): 25-27.
- 11. 谢佳杭, 王久惠. 索拉菲尼联合TACE治疗进展期原发性肝癌疗效及并发症分析[J]. 肿瘤预防与治疗, 2015, 28(3): 152-154.
- 12. 潘静洁, 刘堂营. 肝动脉化疗栓塞术联合索拉菲尼及复方黄连素片治疗中晚期肝癌的临床观察[J]. 中医肿瘤学杂志, 2019, 1(3): 38-44.
- 13. Kudo, M., Ueshima, K., Ikeda, M., et al. (2020) Randomised, Multicentre Prospective Trial of Transarterial Che-moembolisation (TACE) plus Sorafenib as Compared with TACE Alone in Patients with Hepatocellular Carcinoma: TACTICS Trial. Gut, 69, 1492-1501. https://doi.org/10.1136/gutjnl-2019-318934
- 14. Tim, M., Richard, F., et al. (2017) Sorafenib in Combination with Transarterial Chemoembolisation in Patients with Unresectable Hepatocellular Carcinoma (TACE 2): A Randomised Placebo-Controlled, Double-Blind, Phase 3 Trial. The Lancet Gastroenterology and Hepatology, 2, 565-575. https://doi.org/10.1016/S2468-1253(17)30156-5
- 15. Wang, E.X., Xia, D.D., et al. (2019) Tumor Hypervascularity and Hand-Foot-Skin Reaction Predict Better Outcomes in Combination Treatment of TACE and Sorafenib for Intermediate Hepato-cellular Carcinoma. BMC Cancer, 19, Article No. 409. https://doi.org/10.1186/s12885-019-5570-z
- 16. 殷曰帅. TACE联合CT引导下经皮微波消融治疗肝细胞肝癌的临床研究[D]: [硕士学位论文]. 青岛: 青岛大学, 2020. https://doi.org/10.27262/d.cnki.gqdau.2020.000266
- 17. 姜香玉. 伽玛刀联合肝动脉栓塞化疗治疗原发性肝癌的疗效观察[J]. 中国医疗器械信息, 2023, 29(16): 75-77. https://doi.org/10.15971/j.cnki.cmdi.2023.16.049
- 18. 王盼. 经肝动脉化疗栓塞术联合仑伐替尼治疗不可切除肝细胞癌的疗效及安全性[D]: [硕士学位论文]. 泸州: 西南医科大学, 2023. https://doi.org/10.27215/d.cnki.glzyu.2023.000155
- 19. 尹宏祥. 术前C反应蛋白联合纤维蛋白原与前白蛋白比值评分系统在肝细胞癌患者预后中的价值研究[D]: [硕士学位论文]. 蚌埠: 蚌埠医学院, 2023. https://doi.org/10.26925/d.cnki.gbbyc.2023.000237
- 20. 杨旭丽. 肝细胞癌并门静脉癌栓预后因素分析及寡糖链检测诊断价值研究[D]: [硕士学位论文]. 南昌: 南昌大学, 2023. https://doi.org/10.27232/d.cnki.gnchu.2023.000765
- 21. 中国抗癌协会肝癌专业委员会. 中国肿瘤整合诊治指南(CACA)-肝癌部分[J]. 肿瘤综合治疗电子杂志, 2022, 8(3): 31-63.
- 22. 中华人民共和国国家卫生健康委员会. 原发性肝癌诊疗指南(2022年版) [J]. 肿瘤综合治疗电子杂志, 2022, 8(2): 16-53.
- 23. 钱旋律. NLR等炎性标志物对HBV相关不可切除原发性肝癌患者TACE治疗效果的预测价值分析[D]: [硕士学位论文]. 大连: 大连医科大学, 2022. https://doi.org/10.26994/d.cnki.gdlyu.2022.000667
- 24. 冀志祥. 西藏地区MDT下中晚期HCC患者HAIC与TACE的疗效与安全性对比[D]: [硕士学位论文]. 拉萨: 西藏大学, 2023. https://doi.org/10.27735/d.cnki.gxzdx.2023.000286
- 25. 咸晓梦. 体外模拟肿瘤微环境下索拉非尼和纳武单抗对肝癌的药效学研究[D]: [博士学位论文]. 北京: 北京协和医学院, 2023. https://doi.org/10.27648/d.cnki.gzxhu.2023.000192
- 26. 李泰平. 介入联合靶向及免疫治疗对比单独介入治疗在不可切除肝癌中的疗效分析[D]: [硕士学位论文]. 南昌: 南昌大学, 2023. https://doi.org/10.27232/d.cnki.gnchu.2023.001243
- 27. 陈大红, 李琴. 长链非编码RNA与肝细胞癌索拉非尼耐药: 分子机制与治疗靶点新进展[J]. 现代肿瘤医学, 2023, 31(24): 4633-4639.
- 28. 陈新辉. 基于生物信息学分析构建铜死亡相关索拉非尼耐药基因的HCC预后评分模型[D]: [硕士学位论文]. 广州: 南方医科大学, 2023. https://doi.org/10.27003/d.cnki.gojyu.2023.000966
NOTES
*通讯作者。
