Applied Physics
Vol.06 No.12(2016), Article ID:19401,11
pages
10.12677/APP.2016.612037
NiMo Catalyst Electrodeposited on Si Photocathodes for Enhanced Solar Water Splitting
Song Dai, Mingrong Shen
College of Physics, Optoelectronics and Energy, Jiangsu Key Laboratory of Thin Films, Collaborative Innovation Center of Suzhou Nano Science and Technology, Soochow University, Suzhou Jiangsu
Received: Dec. 8th, 2016; accepted: Dec. 25th, 2016; published: Dec. 28th, 2016
Copyright © 2016 by authors and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY).
http://creativecommons.org/licenses/by/4.0/



ABSTRACT
Recently, NiMo alloy has received lots of attention for the electrochemical catalyst in water splitting. However, fewer works studied its catalytic effect on the photoelectrochemical (PEC) reactivity when it is loaded on a photocathode. In this study, we loaded the NiMo alloy on a stable 2 nm Al2O3 protected n+p-Si photocathode using electrodeposition method to explore its PEC catalytic effect. We determined the best amount of NiMo through interrupted electrodeposition and testing of PEC properties. In KHP electrolyte with pH = 4.5 and under the 100 mW·cm−2 Xe lamp illumination, the PEC reactivity of NiMo/Al2O3/n+p-Si is close to that of Pt/Al2O3/n+p-Si. Its on-set potential is 0.5 V (vs. RHE) and photocurrent at 0 V (vs. RHE) can be up to −32 mA·cm−2. We also studied its PEC stability when different electrolytes are used which have different pH values. NiMo is very stable in alkaline electrolyte; however, it is etched quickly in acid one.
Keywords:Water Splitting, Si Photocathodes, NiMo Catalyst, Photoelectrochemical Properties

电沉积NiMo催化剂增强硅光阴极 光解水制氢的研究
戴松,沈明荣
苏州大学,苏州纳米科学与技术协同创新中心,江苏省薄膜材料重点实验室,物理与光电能源学部,江苏 苏州

收稿日期:2016年12月8日;录用日期:2016年12月25日;发布日期:2016年12月28日

摘 要
NiMo合金最近作为电解水制氢催化剂得到了较多的研究,但其担载在光解水光阴极上的催化作用则研究较少。本文以稳定性较好的2纳米Al2O3保护的单晶n+p-Si光阴极为基础,利用电沉积方法在其表面制备了NiMo催化剂,研究其光催化活性。通过多次间断电沉积及测试光阴极光电化学特性,确定了最优的NiMo量。在偏中性的邻苯二甲酸氢钾电解液中及100 mW·cm−2 Xe灯照射下,NiMo/Al2O3/n+p-Si光阴极的光电化学活性与对应的Pt/Al2O3/n+p-Si比较接近,开启电压达到0.5 V (vs. RHE),光电流在0 V (vs. RHE)处达到了−32 mA·cm−2。本文也详细研究了不同pH值电解液中光阴极的光电化学稳定性,结果显示NiMo在碱性电解液中的表现最佳,而在酸性溶液中其很快会被腐蚀。
关键词 :光解水,Si光阴极,NiMo催化剂,光电化学性能

1. 引言
使用清洁新能源替代现有的化石能源是未来的趋势,具有高能量密度、可储存、可运输、无污染等优点的氢气是一种理想的选择。早在1874法国著名小说家Jules Verne在他的科幻小说“The Mysterious Island”(神秘岛)中提到:“I believe, then, that when the deposits of coal are exhausted we shall heat and warm ourselves with water. Water will be the coal of the future (水将是未来的煤)”。在当代,美国的Jeremy Rifkin在“第三次工业革命”一书中提出了新构想,明确提到氢将是未来可再生能源的主要存储形式 [1] 。而在当前,利用集成了半导体光电极、太阳能和水/电解液的光电化学电池来制氢被看作是一种低成本、清洁、环境友好的绿色能源产生方法,从而正受到广泛重视,而高太阳光能–化学能转换效率、长时间稳定及低成本的半导体光电极是光电化学电池正被研究的重点 [2] 。
自从1972年Honda和Fujishima [3] 首次利用TiO2光分解水制氢以来,许多材料被研究用来更高效地制氢。光电化学(PEC)光解水最关键的是半导体光电极利用光能产生光生电子空穴对并分离,在半导体电极和电解液之间的界面上进行传输,并与水溶液发生析氢析氧反应。然而半导体电极表面的活性一般并不能轻易产生析氢析氧反应,需要借助析氢析氧催化剂来实现 [2] [4] 。在众多光阴极制氢催化剂中,铂金(Pt)是目前为止催化性能最好的 [5] [6] ,这是因为可以形成有理想键强度的Pt-H键,这种恰到好处的强度能够使Pt容易吸附H+,还原成氢气,同时又能轻易地释放氢气 [7] 。但由于Pt的稀缺昂贵 [8] ,一些新型的析氢催化剂材料,诸如金属硫化物 [9] [10] [11] [12] [13] ,金属磷化物 [14] [15] 以及金属碳化物 [16] [17] 等正被开发。这些材料储备丰富,其低廉的价格和高效的催化性能有望能够替代贵金属Pt。但这些材料跟Pt类似,一般仅在酸性电解液中较为稳定 [5] [18] ,而我们最终目标是能够实现无外偏压下两电极完全光分解水,这样需要析氢析氧反应在同一电解液中进行 [2] 。然而如果在酸性电解液中,析氧电极只能用贵金属诸如IrOx、RuOx等来作为催化剂。在诸多碱性电解液环境中,价格低廉、原料丰富的其他析氧催化剂如NiFeOOH效率会更加高一些 [19] [20] [21] 。因此,如果我们找到在中性或碱性电解液中高效稳定的析氢催化剂,那就为将来的两电极光解水系统打下基础。
最近有文献报道了几种Ni合金的二元或三元混合物在碱性电解液中发挥出较好的析氢催化性能 [22] [23] [24] [25] 。特别是NiMo合金仅需低于40 mA的过电压就能达到−10 mA·cm−2 [18] 。但是,近来NiMo合金主要是关于其电催化性能的研究,在光电极上作为催化剂的研究较少。2012年Lewis [26] 课题组研究了Si微米线阵列光阴极担载NiMo催化剂后的析氢特性,其开启电压达到0.46 V相对于可逆氢电位(vs. RHE),电流为9.1 mA·cm−2 (0 V vs. RHE),稳定性能表现为4000 s连续工作后约下降1 mA·cm−2;2013年Javey [27] 等人对催化剂NiMo及Pt担载在非晶硅片(amorphous-Si简记为a-Si)上的光电化学性能进行了研究,发现a-Si担载NiMo催化剂的光电化学性能与担载Pt相近,NiMo/a-Si的开启电压仅比Pt/a-Si低一点点,其饱和电流在0 V (vs. RHE)处为11 mA·cm−2。
最近,我们课题组对Si光阴极从表面的微结构、内置p-n结、MoS2和碳量子点催化剂等方面进行了较多的研究 [12] [28] [29] [30] 。本文中,我们研究了超薄Al2O3 (2纳米,nm)保护的单晶n+p-Si光阴极电沉积催化剂NiMo的PEC特性及其在不同pH值电解液中的稳定性情况,并与Pt的催化特性进行了比较。Al2O3一方面是钝化了Si表面,使其少数载流子寿命提高;另一面保护了Si表面,使得其在电沉积NiMo合金时不受影响,因此可以比较单纯地研究催化剂的作用。
2. 实验部分
2.1. 材料和方法
2.1.1. 化学试剂及溶液的配制
所用试剂:邻苯二甲酸氢钾(KHP, Energy Chemical);H2PtCl6、K2SO4为西格玛奥德里奇(上海)贸易有限公司(Sigma-Aldrich);Ni(SO3NH2)2、H3BO3、Na2MoO4、KOH均为阿法埃莎(中国)中国化学有限公司(Alfa Aesar);HClO4和NaOH均为国药集团化学试剂有限公司,分析纯。所有试剂未进一步纯化。
催化剂溶液:Pt:5 m MH2PtCl6;NiMo:1.3 M Ni(SO3NH2)2、0.5 M H3BO3和20 mM Na2MoO4的混合溶液用KOH将pH调节至pH = 4.5 [26] [31] 。
电解液:1 M HClO4;1 M NaOH;KHP (0.2 M邻苯二甲酸氢钾和0.5 M K2SO4混合溶液用KOH将pH调节至pH = 4.5) [31] 。
2.1.2. 光电极制备
本文中使用的硅片为2 nm超薄Al2O3保护的单晶n+p-Si,其规格大小为15.6 × 15.6 × 0.18 cm3,p型Si基片电阻率ρ = 1 - 3 Ω∙cm。样品表面类金字塔结构由单晶硅Si太阳能电池产线上经过标准碱性腐蚀工艺形成。烧结的Al浆通过丝网印刷的方法覆盖硅背面。表面的n+层通过磷掺杂标准工艺制备。n+p-Si光阴极样品表面2 nm的Al2O3钝化和保护层是通过原子层沉积(ALD)的方法获得的,使用的前驱体为AI(CH3)3和水,工艺的温度控制在200℃。最终样品切割成1.5 × 1.5 cm2左右。
光电极封装:直接将铜导线与单晶n+p-Si光阴极背面的Al接触,用铟镓浆涂抹以确保其形成良好的欧姆接触,并用铜胶带固定,最后用环氧树脂胶封装硅片背面及正面的边缘部分,确保硅片表面裸露面积大于0.5 × 0.5 cm2即可。
2.1.3. 催化剂NiMo及Pt电沉积方法
电沉积NiMo:将封装好的光电极浸于配置好的催化剂NiMo溶液中,在光照下(100 mW∙cm−2)用三电极系统进行电沉积 [26] ,其中工作电极为光电极,参比电极为Ag/AgCl (3 M KCl)电极,对电极为铂丝电极。电沉积时,在工作电极上外加−0.6 V (vs. Ag/AgCl),20 s~30 s为一个沉积周期。一个周期结束后将样品用去离子水洗净,接着用氮气吹干,然后在电解液KHP中测试沉积样品的光电流–电压(J-V)曲线,然后再将样品用去离子水冲洗干净,并用氮气吹干再次进行电沉积,多次循环,以得出催化剂NiMo使得光电极达到最佳光电化学性能时的最佳电沉积次数。
电沉积Pt:将催化剂NiMo溶液换成5 mM H2PtCl6即可,没有光照,电沉积时附加偏压为−0.15 V (vs. Ag/AgCl),10 s~20 s为一个沉积周期 [13] [29] [30] 。
2.1.4. 能量转化效率的计算
光电极的能量转换效率η可通过其光电流–电压(J-V)曲线数据得出 [2] ,公式如下:
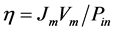 (1)
(1)
Jm和Vm表示J-V曲线上最大功率的那个点所对应的电流和电压,Pin (W·cm−2)表示入射光强密度。
2.2. 催化剂表征及光电化学测试
2.2.1. 催化剂表征
X-光电子能谱(XPS)测试仪器型号为ESCALAB 250 XiThermo。所有XPS测试均以结合能处于284.6 eV的C1s为基准。样品的表面形貌和横截面在场发射扫描电镜(SEM)上进行,SEM型号为SU8010 Hitachi,为了提高样品导电性能,避免样品表面拍摄过程积累过多负电荷影响成像质量,在拍摄SEM前我们在样品表面用离子溅射仪(BAL-TEC/SCD 005)喷金60 s。另外,在SEM测试中,我们也使用了能量色散X射线荧光光谱仪(EDAX) (TEAM Octane Plus)对材料微区成分元素种类与含量进行了分析。本实验中透射电镜(TEM)型号为TecnaiG220。
2.2.2. 光电化学测试
光电极光电化学测试在石英玻璃电解池(50 mm × 50 mm × 50 mm)中进行,在测试前,先借助光功率计(Newport Co.)将氙灯光源光强密度调节为100 mW∙cm−2,为了在实验过程中更好地将光解水所产生的H2分离硅片表面,我们在电解池中放置了一个磁力搅拌子,边测试边搅拌。光电化学测试使用电化学工作站CHI660E (上海辰华仪器有限公司),光阴极作为工作电极,Ag/AgCl电极为参比电极,铂丝电极为对电极,最后由电化学工作站测得的数据会转换成相对于可逆氢电极,公式 [29] 如下:

3. 结果与讨论
3.1. 样品SEM、EDAX及XPS表征
图1(a)和图1(b)为单晶Al2O3/n+p-Si未经任何处理的表面形貌,以便和电沉积后NiMo和Pt后的光电极表面形貌作比较。单晶Si表面经碱溶液腐蚀后,表面呈现典型的金字塔结构,且很光滑。图1(c)和图1(d)为电极表面电沉积NiMo后的表面形貌,图1(c)中比较亮的一些点并不是杂质或者其他的污染物,从图1(d)中可以发现:我们电沉积NiMo最后形成的是一层均匀的薄膜,但有一些凸起,在图1(c)中看上去是亮点。图1(e)和图1(f)为电极表面电沉积Pt后的表面形貌。结合EDAX测量,确定图1(e)中分布较为均匀的颗粒是Pt颗粒,从图1(f)中我们可以直接测量出其颗粒大小大在几百纳米,不太均匀。
为了证明图1(c)和图1(d)中的薄膜是否是NiMo,我们进行了XPS测试。图2(a)中231.4 eV和228 eV峰分别对应于Mo 3d3/2和Mo 3d5/2的谱峰,而图2(b)中870.4 eV和853 eV峰分别对应Ni 2p1/2和Ni 2p3/2的谱峰,结果与相关文献一致 [25] [32] 。这些数据表明图1(c)和图1(d)中表面生成的薄膜确为NiMo。我们在拍摄SEM过程中也进行了EDAX测试,结果更加进一步说明其为NiMo,而且EDAX定量结果显示为13.85% Mo/86.15% Ni,Mo/Ni = 0.16,与相关文献基本一致 [31] 。

Figure 1. Top-view SEM images of pure Al2O3/n+p-Si electrode (a) (b), the electrode after electrodeposited NiMo (c) (d), or after electrodeposited Pt (e) (f)
图1. 原样品Al2O3/n+p-Si (a) (b)及电沉积NiMo (c) (d)、Pt (e) (f)后的电极表面SEM图
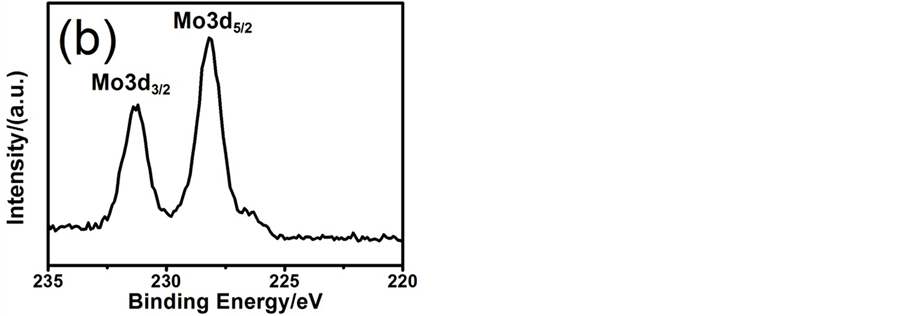
Figure 2. XPS spectra of electrodeposited NiMo: (a) Ni2p; (b) Mo3d
图2. 电沉积NiMo的XPS谱:(a) Ni2p;(b) Mo3d
3.2. 催化剂NiMo、Pt光电化学性能测试分析
我们对电沉积NiMo后的样品也进行了光电化学测试,并摸索其最佳的沉积时间。图3(a)光电化学测试是在KHP (pH = 4.5)电解液中进行的。从图3(a)中,我们可以发现NiMo电沉积的时间控制在100 s,其效果达到最好,开启电压从−0.3 V (vs. RHE)右移到0.5 V (vs. RHE),光电流在0 V (vs. RHE)处接近饱和电流−32 mA∙cm−2。我们用公式(1)计算其效率,最大效率值为3.4%,所对应的电压和电流值分别为0.22 V(vs. RHE)和−15.6 mA∙cm−2。图3(b)是100 s-NiMo/Al2O3/n+p-Si的SEM截面图,从图中标尺我们可以得出其NiMo膜的厚度约30 nm。另外我们还进行了TEM测试,从图3(b)中高分辨率透射电子显微镜插图可以看出其晶格常数为0.2 nm,属于NiMo合金(220)晶面,与相关文献一致 [25] ,更进一步证实其为NiMo。
铂金Pt是迄今为止发现的最好的光阴极催化剂。我们课题组前面也有工作研究过 [13] [29] [30] 。图4中的PEC测试也是在KHP (pH = 4.5)电解液中进行的。可以发现100 s的Pt电沉积时间,曲线最为陡峭,开启电压达到0.5 V (vs. RHE),饱和电流为−33.2 mA∙cm−2,我们也同样计算了其效率,高达8.4%,效率所对应的电压值和电流值分别为0.33 V (vs. RHE)和−25.36 mA∙cm−2。虽然催化剂Pt的效率要比催化剂NiMo要高得多,但是Pt本身的稀有珍贵属性极大地限制其应用,而且催化剂NiMo开启电压在KHP测量环境下与Pt很接近,在0 V (vs. RHE)下光电流值也较高。综合起来催化剂NiMo的表现相对于Pt还是相当可观的。
图5为Al2O3/n+p-Si、NiMo/Al2O3/n+p-Si和Pt/Al2O3/n+p-Si三种光电极在KHP (pH = 4.5)电解液中测得的交流阻抗图。通过比较不同电极的电荷转移电阻,可以更好地理解电极的PEC性能。奈奎斯特阻抗图左边高频处的半圆三个样品都一样,证明其对应于pn+结耗尽层电容。低频处的第二个半圆的弧度随着光电极表面负载催化剂的变化而变化,代表了电极表面电荷的分离和迁移速率,弧度越小表明电荷传输能力越强 [30] 。从图5中我们可以明显发现,NiMo/Al2O3/n+p-Si和Pt/Al2O3/n+p-Si第二个半圆要远远小于Al2O3/n+p-Si光电极,表明催化剂NiMo和Pt使得光电极表面的电荷分离和迁移速率发生显著改善,从而

Figure 3. The J-V curves of Al2O3/n+p-Si photocathodes electrodeposited by NiMo with different time (a) and cross sectional SEM image (b) of 100 s electrodeposited NiMo sample. The inserted figure is the high resolution TEM image of NiMo
图3. 不同时间电沉积NiMo下Al2O3/n+p-Si光阴极的J-V曲线(a)及100 s电沉积NiMo样品的SEM截面图(b),其中插图为NiMo的TEM图

Figure 4. The J-V curves of Al2O3/n+p-Si photocathodes electrodeposited by Pt with different time
图4. 不同时间电沉积Pt下Al2O3/n+p-Si光阴极的J-V曲线
也解释了为什么NiMo/Al2O3/n+p-Si和Pt/Al2O3/n+p-Si这两种光电极的PEC性能要比Al2O3/n+p-Si好得多的原因。其中Pt催化对应的半径最小,因此对应的填充因子就大,所以Pt/Al2O3/n+p-Si的效率比NiMo/Al2O3/n+p-Si高。
3.3. 催化剂NiMo在不同pH电解液中的稳定性测试
图6为NiMo/Al2O3/n+p-Si在1 M HClO4 (pH = 0)电解液中的PEC稳定性测试以及实验前后表面形貌的变化。我们可以从图6(a)中明显发现:NiMo/Al2O3/n+p-Si光电极在1 M HClO4中非常不稳定,电流呈
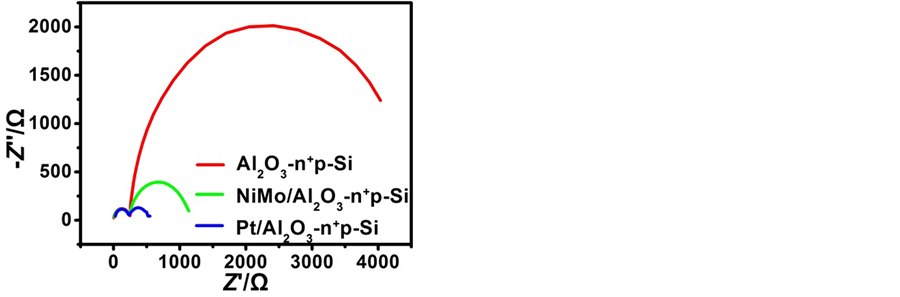
Figure 5. Nyquist impedance plots of Al2O3/n+p-Si, NiMo/Al2O3/n+p-Si and Pt/Al2O3/n+p-Si, respectively
图5. 原样品及电沉积NiMo、Pt后样品的交流阻抗图

Figure 6. Stability of 100 s electrodeposited NiMo in 1 M HClO4 (pH = 0): (a) The photocurrent at 0 V vs. RHE changing with the time; (b) The J-V curves before and after 1000 s PEC reaction; (c), (d) The surface SEM images of the sample after 1000 s PEC reaction
图6. 100 s电沉积NiMo样品在1 M HClO4 (pH = 0)中的稳定性(a)偏压0 V vs. RHE下电流–时间曲线;(b)电流–时间1000 s测试前后J-V曲线;(c) (d) 光电化学测试1000 s后样品表面SEM图
现锯齿形下降,图中的锯齿是由气泡的产生、聚集、释放所造成的。图6(b)为我们记录的该样品持续工作1000 s前后的J-V曲线,可以发现J-V曲线明显向左移动了,使得在0 V (vs.RHE)下,光电流下降了约10 mA∙cm−2。结合图3(a)的结果:NiMo沉积时间增加,J-V曲线右移,可以判断此时J-V曲线向左移动是由于NiMo减少了。这点可从1000 s连续工作后的表面SEM形貌测试得到证实(图6(c)和图6(d))。我们发现NiMo在1 M HClO4 1000 s的PEC测试时间内严重腐蚀,所以NiMo/Al2O3/n+p-Si光电极在1 M HClO4 (pH = 0)电解液中的稳定性不如人意。
图7为NiMo/Al2O3/n+p-Si在KHP (pH = 4.5)电解液中的PEC稳定性测试。很显然,图7(a)中的光电流–时间曲线相比于图6(a)稳定性大幅提升,前期的波动是由于样品与石英盒之间距离太近气泡难释放的原因,经过轻微调整后面就正常了。图7(b)为1000 s PEC连续工作前后的J-V曲线比较,变化很小,在0 V (vs. RHE)处的光电流与图7(a)基本保持一致,光电流降幅在1 mA∙cm−2内。图7(c)和图7(d)为该样品测试完后进行的SEM测试,样品表面只是少量部位腐蚀,与高氯酸中的样品相比,稳定性的表现明显要好。
图8为NiMo/Al2O3/n+p-Si在1 M NaOH (pH = 14)电解液中的稳定性的测试。虽然在碱性溶液中光电流变小了,但图8(a)的结果跟图7(a)相近,光电流降幅在1 mA∙cm−2内,令人满意。图8(b)中1000 s PEC连续工作前后的J-V曲线也是相一致的。图8(c)和图8(d)中的表面形貌也是为该样品测试完后进行的SEM测试,表面的腐蚀情况几乎没有发生,优于在HClO4和KHP中情况,样品损坏程度最低。
总之,对NiMo/Al2O3/n+p-Si光电极在三种不同pH值电解液中的PEC性能测试中,我们可以发现:催化剂NiMo的催化作用是显著的,在三种电解液中光阴极的开启电压均已达到0.5 V (vs. RHE)左右,在0 V (vs. RHE)的光电流也近乎饱和。我们也发现催化剂NiMo在强酸环境中的稳定性能欠佳,在碱性电解液中稳定性的表现最佳,这样为碱性电解液中高效稳定的析氢催化剂提供了更多的选择。

Figure 7. Stability of electrodeposited NiMo in KHP (pH = 4.5) instead of 1 M HClO4 (pH = 0) in Figure 6
图7. 电沉积NiMo在KHP (pH = 4.5)中的稳定性,其它与图6相同

Figure 8. Stability of electrodeposited NiMo in 1 M NaOH (pH = 14) instead of 1 M HClO4 (pH = 0) in Figure 6
图8. 电沉积NiMo在1 M NaOH (pH = 14)中的稳定性,其它与图6相同
4. 结论
利用电沉积的方法在Al2O3/n+p-Si光解水光阴极表面制备的催化剂NiMo可以极大地改善其PEC性能。在偏中性的KHP电解液中,开启电压达到0.5 V (vs. RHE),光电流在0 V (vs. RHE)处达到了−32 mA∙cm−2,而对应的Pt/Al2O3/n+p-Si的开启电压为0.5 V (vs. RHE),饱和电流为−33.2 mA∙cm−2。两者很接近,证明NiMo与Pt催化剂具有可比性。通过对NiMo/Al2O3/n+p-Si光电极在不同pH值电解液中的稳定性能的测试,发现NiMo/Al2O3/n+p-Si在碱性溶液中是最为稳定的,而在酸性溶液中则最不稳定。
基金项目
国家自然科学基金(51672183)、高等学校博士学科点专项科研基金资助课题(博导类) (20133201110003)资助项目。
文章引用
戴 松,沈明荣. 电沉积NiMo催化剂增强硅光阴极光解水制氢的研究
NiMo Catalyst Electrodeposited on Si Photocathodes for Enhanced Solar Water Splitting[J]. 应用物理, 2016, 06(12): 296-306. http://dx.doi.org/10.12677/APP.2016.612037
参考文献 (References)
- 1. Fan, C., Piron, D.L., Sleb, A. and Paradis, P. (1994) Study of Electrodeposited Nickel-Molybdenum, Nickel-Tungsten, Cobalt-Molybdenum, and Cobalt-Tungsten as Hydrogen Electrodes in Alkaline Water Electrolysis. Journal of the Electrochemical Society, 141, 382-387. https://doi.org/10.1149/1.2054736
- 2. Chen, W.F., Sasaki, K., Ma, C., Frenkel, A.I., Marinkovic, N., Mucherman, J.T., Zhu, Y. and Adzic, R.R. (2012) Hydrogen-Evolution Catalysts Based on Non-Noble Metal Nickel-Molybdenum Nitride Nanosheets. Angewandte Chemie International Edition, 51, 6131-6135. https://doi.org/10.1002/anie.201200699
- 3. Wang, Y., Zhang, G., Xu, W., Wan, P., Lu, Z., Li, Y. and Sun, X. (2014) A 3D Nanoporous Ni-Mo Electrocatalyst with Negligible Overpotential for Alkaline Hydrogen Evolution. ChemElectroChem, 1, 1138-1144. https://doi.org/10.1002/celc.201402089
- 4. Warren, E.L., McKone, J.R., Atwater, H.A., Gray, H.B. and Lewis, N.S. (2012) Hydrogen-Evolution Characteristics of Ni-Mo-Coated, Radial Junction, n+p-Silicon Microwire Array Photocathodes. Energy & Environmental Science, 5, 9653-9661. https://doi.org/10.1039/c2ee23192a
- 5. Lin, Y., Battaglia, C., Boccard, M., Hettick, M., Yu, Z. and Ballif, C.W., Afer, J. and Javey, A. (2013) Amorphous Si Thin Film Based Photocathodes with High Photovoltage for Efficient Hydrogen Production. Nano Letters, 13, 5615-5618. https://doi.org/10.1021/nl403265k
- 6. Fan, R., Min, J., Li, Y., Su, X., Zou, S., Wang, X. and Shen, M. (2015) N-Type Silicon Photocathodes with Al-Doped Rear P+ Emitter and Al2O3-Coated Front Surface for Efficient and Stable H2 Production. Applied Physics Letters, 106, Article ID: 213901. https://doi.org/10.1063/1.4921845
- 7. Rifkin, J. 第三次工业革命. 张体伟, 孙豫宁, 译. 北京: 中信出版社, 2012: 60-63.
- 8. Walter, M.G., Warren, E.L., McKone, J.R., Boettcher, S.W., Mi, Q., Santori, E.A. and Lewis, N.S. (2010) Solar Water Splitting Cells. Chemical Reviews, 110, 6446. https://doi.org/10.1021/cr1002326
- 9. Fan, R., Dong, W., Fang, L., Zheng, F., Su, X., Zou, S., Huang, J., Wang, X. and Shen, M. (2015) Stable and Efficient Multi-Crystalline n+p Silicon Photocathode for H2 Production with Pyramid-Like Surface Nanostructure and Thin Al2O3 Protective Layer. Applied Physics Letters, 106, Article ID: 013902. https://doi.org/10.1063/1.4905511
- 10. Chen, D., Dai, S., Su, X., Xin, Y., Zou, S., Wang, X., Kang, Z. and Shen, M. (2015) N-Doped Nanodots/np+-Si Photocathodes for Efficient Photoelectrochemical Hydrogen Generation. Chemical Communications, 51, 15340-15343. https://doi.org/10.1039/C5CC05599G
- 11. McKone, J.R., Warren, E.L., Bierman, M.J., Boettcher, S.W., Brunschwig, B.S., Lewis, N.S. and Gray, H.B. (2011) Evaluation of Pt, Ni, and Ni-Mo Electrocatalysts for Hydrogen Evolution on Crystalline Si Electrodes. Energy & Environmental Science, 4, 3573-3583. https://doi.org/10.1039/c1ee01488a
- 12. Morales-Guio, C.G., Liardet, L., Mayer, M.T., Tilley, D., Gratzel, M. and Hu, X. (2015) Photoelectrochemical Hydrogen Production in Alkaline Solutions Using Cu2O Coated with Earth-Abundant Hydrogen Evolution Catalysts. Angewandte Chemie International Edition, 54, 664-667. https://doi.org/10.1002/ange.201410569
- 13. Fujishima, A. and Honda, K. (1972) Electrochemical Photolysis of Water at a Semiconductor Electrode. Nature, 238, 37-38. https://doi.org/10.1038/238037a0
- 14. Grätzel, M. (2001) Review Article Photoelectrochemical Cells. Nature, 414, 338-344. https://doi.org/10.1038/35104607
- 15. Vesborg, P.C.K., Seger, B. and Chorkendorff, I. (2015) Recent Development in Hydrogen Evolution Reaction Catalysts and Their Practical Implementation. Journal of Physical Chemistry Letters, 6, 951-957. https://doi.org/10.1021/acs.jpclett.5b00306
- 16. Kang, D., Kim, T.W., Kubota, S.R., Cardiel, A.C., Cha, H.G. and Choi, K.S. (2015) Electrochemical Synthesis of Photoelectrodes and Catalysts for Use in Solar Water Splitting. Chemical Reviews, 115, 12839-12887. https://doi.org/10.1021/acs.chemrev.5b00498
- 17. Trasatti, S. (1972) Work Function, Electronegativity, and Electrochemical Behaviour of Metals: III. Electrolytic Hydrogen Evolution in Acid Solutions. Journal of Electroanalytical Chemistry and Interfacial Electrochemistry, 39, 163- 184. https://doi.org/10.1016/S0022-0728(72)80485-6
- 18. Kemppainen, E., Bodin, A., Sebok, B., Pedersen, T., Seger, B., Mei, B., Bae, D., Vesborg, P.C.K., Halme, J., Hansen, O., Lund, P.D. and Chorkendorff, I. (2015) Scalability and Feasibility of Photoelectrochemical H2 Evolution: The Ultimate Limit of Pt Nanoparticle as an HER Catalyst. Energy & Environmental Science, 8, 2991-2999. https://doi.org/10.1039/C5EE02188J
- 19. Merki, D., Fierro, S., Vrubel, H. and Hu, X. (2011) Amorphous Molybdenum Sulfide Films as Catalysts for Electrochemical Hydrogen Production in Water. Chemical Science, 2, 1262-1267. https://doi.org/10.1039/C1SC00117E
- 20. Merki, D., Vrubel, H., Rovelli, L., Fierro, S. and Hu, X. (2012) Fe, Co, and Ni Ions Promote the Catalytic Activity of Amorphous Molybdenum Sulfide Films for Hydrogen Evolution. Chemical Science, 3, 2515-2525. https://doi.org/10.1039/c2sc20539d
- 21. Tran, P.D., Pramana, S.S., Kale, V.S., Mai, N., Chiam, S., Batabyal, S.K., Wong, L.H., Barber, J. and Loo, J. (2012) Novel Assembly of an MoS2 Electrocatalyst onto a Silicon Nanowire Array Electrode to Construct a Photocathode Composed of Elements Abundant on the Earth for Hydrogen Generation. Chemistry: A European Journal, 18, 13994-13999. https://doi.org/10.1002/chem.201202214
- 22. Tran, P.D., Chiam, S.Y., Boix, P.P., Ren, Y., Pramana, S.S., Fize, J., Artero, V. and Barber, J. (2013) Novel Cobalt/Nickel—Tungsten-Sulfide Catalysts for Electrocatalytic Hydrogen Generation from Water. Energy & Environmental Science, 6, 2452-2459. https://doi.org/10.1039/c3ee40600h
- 23. Zhou, J., Dai, S., Dong, W., Su, X., Fang, L., Zheng, F., Wang, X., Shen, M. (2016) Efficient and Stable MoS2 Catalyst Integrated on Si Photocathodes by Photoreduction and Post-Annealing for Water Splitting. Applied Physics Letters, 108, Article ID: 213905. https://doi.org/10.1063/1.4952739
- 24. Popczun, E.J., McKone, J.R., Read, C.G., Biacchi, A.J., Wiltrout, A.M., Lewis, N.S. and Schaak, R.E. (2013) Nanostructured Nickel Phosphide as an Electrocatalyst for the Hydrogen Evolution Reaction. Journal of the American Chemical Society, 135, 9267-9270. https://doi.org/10.1021/ja403440e
- 25. Feng, L., Vrubel, H., Bensimon, M. and Hu, X. (2014) Easily-Prepared Dinickel Phosphide (Ni2P) Nanoparticles as an Efficient and Robust Electrocatalyst for Hydrogen Evolution. Physical Chemistry Chemical Physics, 16, 5917-5921. https://doi.org/10.1039/c4cp00482e
- 26. Scanlon, M.D., Bian, X., Vrubel, H., Amstutz, V., Schenk, K., Hu, X., Liu, B. and Girault, H.H. (2013) Low-Cost Industrially Available Molybdenum Boride and Carbide as “Platinum-Like” Catalysts for the Hydrogen Evolution Reaction in Biphasic Liquid Systems. Physical Chemistry Chemical Physics, 15, 2847-2857. https://doi.org/10.1039/c2cp44522k
- 27. Chen, W.F., Wang, C.H., Sasaki, K., Marinkovic, N., Xu, W., Muckerman, J.T., Zhu, Y. and Adzic, R.R. (2013) Highly Active and Durable Nanostructured Molybdenum Carbide Electrocatalysts for Hydrogen Production. Energy & Environmental Science, 6, 943-951. https://doi.org/10.1039/c2ee23891h
- 28. McCrory, C.C.L., Jung, S., Ferrer, I.M., Chatman, S.M., Peters, J.C. and Jaramillo, T.F. (2015) Benchmarking Hydrogen Evolving Reaction and Oxygen Evolving Reaction Electrocatalysts for Solar Water Splitting Devices. Journal of the American Chemical Society, 137, 4347-4357. https://doi.org/10.1021/ja510442p
- 29. McCrory, C.C.L., Jung, S., Peters, J.C. and Jaramillo, T.F. (2013) Benchmarking Heterogeneous Electrocatalysts for the Oxygen Evolution Reaction. Journal of the American Chemical Society, 135, 16977-16987. https://doi.org/10.1021/ja407115p
- 30. Nakagawa, T., Beasley, C.A. and Murray, R.W. (2009) Efficient Electro-Oxidation of Water near Its Reversible Potential by a Mesoporous IrOx Nanoparticle Film. Journal of Physical Chemistry C, 113, 12958-12961. https://doi.org/10.1021/jp9060076
- 31. Zhao, Y., Hernandez-Pagan, E.A., Vargas-Barbosa, N.M., Dysart, J.L. and Mallouk, T.E. (2011) A High Yield Synthesis of Ligand-Free Iridium Oxide Nanoparticles with High Electrocatalytic Activity. Journal of Physical Chemistry Letters, 2, 402-406. https://doi.org/10.1021/jz200051c
- 32. Raj, I.A. and Vasu, K. (1992) Transition Metal-Based Cathodes for Hydrogen Evolution in Alkaline Solution: Electrocatalysis on Nickel-Based Ternary Electrolytic Codeposits. Journal of Applied Electrochemistry, 22, 471-477. https://doi.org/10.1007/BF01077551