Hans Journal of Chemical Engineering and Technology
Vol.05 No.02(2015), Article ID:15099,6
pages
10.12677/HJCET.2015.52006
The Dispersive Liquid-Liquid Microextraction Technology in the Application of Ketamine Inspection
Peng Peng, Chaoyang Zhou, Junxiang Sang, Binbin Zhou
Jiangsu Police Institute, Nanjing Jiangsu
Email: 1377404179@qq.com
Received: Mar. 27th, 2015; accepted: Apr. 10th, 2015; published: Apr. 17th, 2015
Copyright © 2015 by authors and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY).
http://creativecommons.org/licenses/by/4.0/



ABSTRACT
By combining DLLME and GC phase, a new method for qualitative and quantitative analysis of the inspection of ketamine is presented. A mixture of 40.0 µL dichloromethane and 0.5 mL isopropyl alcohol is the extraction system. First, we quickly add the mixture to 1.0 mL pure water. Then, we centrifuge for 5 min at 6000 r/min speed in a microcentrifuge. There are 15 ± 0.5 µL precipitated phase at the bottom of the centrifuge tube. Last, we analyze 1 mL precipitated phase by gas chromatography. The linear range of the method is 1.0 - 900.0 µg/L (r = 0.9996). The detection limit of ketamine is 0.085 µg/L. The relative standard deviation of the determination is 3.5% (n = 3). The average recovery rate is 94.2% to add ketamine into the samples.
Keywords:Dispersive Liquid-Liquid Microextraction, Gas Chromatography, Ketamine
分散液相微萃取技术在氯胺酮检验中的应用
彭鹏,周朝阳,桑骏翔,周彬斌
江苏警官学院,江苏 南京
Email: 1377404179@qq.com
收稿日期:2015年3月27日;录用日期:2015年4月10日;发布日期:2015年4月17日

摘 要
本文利用分散液相微萃取技术(DLLME)与气相色谱法(GC)相结合,建立检验氯胺酮的定性定量分析的新方法。将含有40.0 µL二氯甲烷(萃取剂)的0.5 mL异丙醇(分散剂)作为萃取体系,快速注入到1.0 mL的水溶液中。分散均匀后,以6000 r/min离心5 min后得到沉于离心管底部尖端的沉淀相(15 ± 0.5 µL),取底部沉淀相1.0 µL进行气相色谱分析。方法线性范围1.0~900.0 µg/L (r = 0.9996),检出限0.085 µg/L,相对标准偏差3.5% (n = 3),加标平均回收率94.2%。
关键词 :分散液相微萃取,气相色谱,氯胺酮

1. 引言
分散液相微萃取技术[1] (dispersive liquid-liquid microextraction, DLLME)是一种集采样、萃取、净化、浓缩于一体的新型样品前处理技术[2] [3] 。其特点是用量小、灵敏度高、环境污染小等特点,又缩短了萃取时间,提高了分析效率,在药物分析领域受到广泛的亲睐。氯胺酮,俗称“K粉”,本为非巴比妥类静脉麻醉剂,用于医学麻醉。但近年来滥用和贩卖氯胺酮案件呈上升趋势,据调查发现,“K粉”俨然成为青少年吸食毒品的主要品种。本研究将分散液相微萃取技术与气相色谱联用,建立了检测氯胺酮的新方法,并对建立的方法进行了方法学考察,探讨了该方法在实际应用中的可行性和实效性,从而为科学、准确、快速检测氯胺酮提供有效依据,为公安案件的侦破提供技术支持。
2. 实验部分
2.1. 仪器与试剂
GC17A系列气相色谱仪(日本SHIMADZU公司);MINI-smart离心机(北京昊诺斯科技有限公司);XW-80A旋涡混合仪(海门市其林贝尔仪器制造有限公司)。
氯胺酮(纯度97%,公安部第二研究所);利多卡因(纯度99.8%,中国食品药品检定研究院);4-苯基丁胺(纯度 > 98.0%,上海盈东生物科技有限公司);无水乙醇、异丙醇、二氯甲烷、四氯化碳、甲醇、乙腈以上试剂均为分析纯。
2.2. 色谱条件
DB-1 (15.0 m × 0.53 mm × 1.5 µm)弹性石英毛细管色谱柱;进样口温度250℃;ECD检测器温度290℃;初始炉温100℃,以15℃/min的速率升至280℃,保持8.0 min,载气为高纯氮气,流速10.00 mL/min。
2.3. 溶液配制
2.3.1. 内标液的配制
准确称量内标物,用乙醇配制成10.0 µg/mL的内标液。选择内标物则需满足下列要求:能完全溶解于样品中,且不与待测组分发生化学作用;峰位尽可能与待测组分的峰位靠近,但能与待测组分完全分开(分离度R ≥ 1.5)的纯物质。
2.3.2. 氯胺酮系列标准溶液及其标准曲线的绘制
准确移取适量浓度均为2.0 mg/mL的氯胺酮的标准溶液于容量瓶中,用去离子水定容配制浓度分别为2.0、20.0、180.0、1000.0和1800.0 µg/mL的氯胺酮溶液,再分别加入与氯胺酮系列浓度溶液体积等量的10.0 µg/mL的内标液,经充分混合后,得到氯胺酮系列混合标准溶液。萃取后,直接进样分析,每个浓度平行测定3次,以被分析物的峰面积与内标物的峰面积比值Y对被分析物与内标物的浓度比值X做标准曲线。
2.4. 分散液相微萃取体系的研究
将1.0 mL的1.0 µg/mL的氯胺酮标准溶液置于1.5 mL带尖端底部的具塞离心管中,将含有40.0 µL二氯甲烷(萃取剂)的0.5 mL异丙醇(分散剂)快速注入到上述溶液中,轻轻振荡1 min,形成一个水/异丙醇/二氯甲烷的乳浊液体系,二氯甲烷均匀地分散在水相中,然后室温静置2.0 min。然后,将其放入离心机中于6000 r/min下离心5 min,分散在水相中的萃取剂二氯甲烷便会沉积在试管的底部,用微量进样器吸取1.0 µL沉积相,进行气相色谱分析[4] -[6] 。本研究选择不同萃取剂、不同分散剂以及其不同用量,讨论影响DLLME萃取效率的因素。
2.5. 萃取回收率计算公式
富集因子(Enrichment factor, EF)为沉淀相(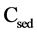 )与最初水相(
)与最初水相( )的浓度之比。
)的浓度之比。
萃取回收率(Extraction recovery, ER)按下列式计算:

其中,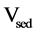 和
和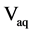 分别表示沉淀相的体积和最初水相的体积。
分别表示沉淀相的体积和最初水相的体积。
3. 结果与讨论
3.1. 内标物的选择
探讨得出氯胺酮的内标物可能是利多卡因或是4-苯基丁胺。根据实验数据我们得出利多卡因的出峰时间为8.1 min,而氯胺酮的出峰时间为7.8 min左右,虽与氯胺酮的峰位相近,可是已经有部分重叠了,因此,排除了利多卡因作为氯胺酮内标物的可能性。而在同样条件下,4-苯基丁胺的出峰时间为3.2 min左右,与氯胺酮的峰位靠近,但能完全分开并不重叠,故此我们将4-苯基丁胺确定为氯胺酮的内标物,(见图1所示)。
3.2. 影响DLLME萃取效率的因素
3.2.1. 萃取剂的种类
萃取溶剂的选择是影响萃取效率的一个关键因素。萃取剂需符合以下条件:密度大于水的密度;不溶于水或在水中溶解度低;对目标物的溶解能力大;有良好的色谱行为;与分散剂混合后在水溶液中能形成稳定的两相系统。一般来说,卤代烃的密度都比水要大,所以分别试验了二氯甲烷(1.325 g/mL)、四氯化碳(1.595 g/mL)、四氯乙烷(1.60 g/mL)做萃取溶剂时对氯胺酮的萃取能力。结果见图2,低极性的四氯化碳很难萃取目标分析物,而二氯甲烷的萃取率最高。
3.2.2. 分散剂的种类
本方法要求所选分散剂不仅在萃取溶剂中有良好的溶解性而且能与水互溶,这样可以使萃取剂在水相中分散成细小的液滴,均匀地分散在溶液中,使溶液形成一个水/异丙酮/二氯甲烷的乳浊液体系,增大萃取剂与待测物的接触面积。分别考察了异丙醇、甲醇、乙醇作分散剂时的萃取效果,结果见图3,异丙醇作为分散剂时具有较高的萃取率。
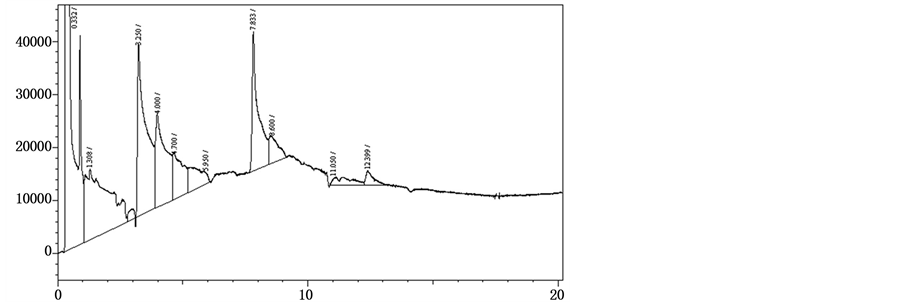
Figure 1. Chromatogram of ketamine and internal standard
图1. 氯胺酮与4-苯基丁胺对照品GC分析色谱图

Figure 2. The effect of extraction solvents on extraction efficiency
图2. 萃取剂种类对萃取效率的影响
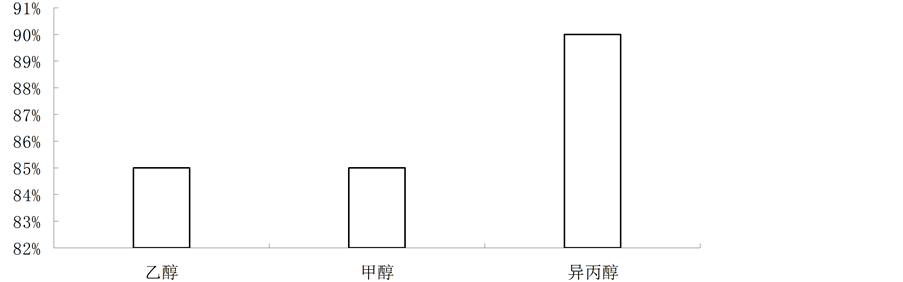
Figure 3. The effect of dispersive solvents on extraction efficiency
图3. 分散剂种类对萃取效率的影响
3.2.3. 萃取剂的用量
分别考察了0.5 mL异丙醇溶液中萃取剂二氯甲烷的用量为40.0、50.0、60.0、70.0、80.0 µL时对萃取效率的影响。随着萃取剂用量的增加,萃取回收率基本保持恒定,但萃取富集倍数呈下降趋势,见图4所示。这是因为随着所加二氯甲烷用量的增加,离心所得的有机相体积也增加,使得有机相中待测物的浓度降低,富集倍数减小。富集倍数降低则意味着方法的灵敏度也随之降低。当二氯甲烷体积为50.0 µL时,最后得到的沉淀相体积为(15 ± 0.5) µL,此时既可以保持萃取的富集倍数较高又能满足进样测定时所需的体积。所以二氯甲烷体积选择50.0 µL。
3.2.4. 分散剂的体积
分散剂的体积是影响本方法萃取效率的一个重要因素,其直接影响“水/异丙酮/二氯甲烷的乳浊液体系”的形成,导致萃取剂在水中的分散程度发生改变以致影响到萃取效率。本试验考察了0.4、0.5、0.6、0.7 mL异丙醇时方法的萃取效率,结果如图5所示。由图可知,萃取效率先是随异丙醇体积的增加而增加,在0.5 mL时达到最大值,而后又随着异丙醇体积的增加而减少。这是因为异丙醇体积较小时萃取剂没能均匀地分散在水中,不能形成良好的水/异丙酮/二氯甲烷的乳浊液体系,致使二氯甲烷的萃取效率低;当其体积较大时,会增加目标分析物在样品中的溶解度。本研究选择分散剂体积为0.5 mL。
3.2.5. 萃取时间的影响 [7] - [10]
考察了萃取时间分别是1.0,5.0,10.0和15.0 min时对萃取效率的影响,如图6所示。由图可知,DLLME能快速达到萃取平衡与萃取时间没有显著的关系。这是由于萃取剂被完全分散于样品溶液中与待测物接触面积很大,待测物可以快速地从水相转移到有机相并且能在很短的时间内在漩涡仪中达到萃取平衡。萃取时间短是分散液相微萃取一个显著的优点,本研究选取萃取时间为1.0 min。
3.3. 氯胺酮定量分析方法
在最优的实验条件下,对系列浓度的标准溶液进行萃取、测定,结果见表1。氯胺酮在1.0~900.0 µg/L的范围内均具有良好的线性关系,线性相关系数(r)为0.9996,检出限0.085 µg/L (S/N = 3)。结果表明,本方法具有很高的灵敏度和较好的精密度。

Figure 4. Effect of extraction solvent (CH2Cl2) volume on enrichment factor
图4. 萃取剂用量对富集倍数的影响
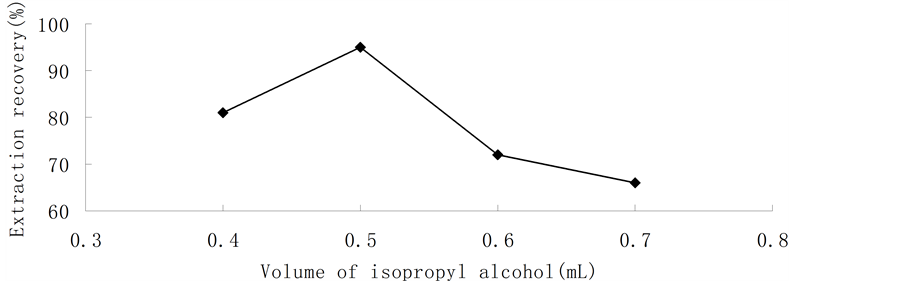
Figure 5. Effect of dispersive solvent (isopropyl alcohol) volume on extraction recovery
图5. 分散剂用量对萃取效率的影响

Figure 6. Effect of different extraction time on extraction recovery
图6. 萃取时间对氯胺酮萃取效率的影响
Table 1. Reproducibilities, linearity and limit of detections (LODs) for ketamine
表1. 氯胺酮的线性方程及其相关系数和方法的检出限
Table 2. The actual sample extraction efficiency of ketamine
表2. 实际样品中氯胺酮的萃取效率
3.4. 添加氯胺酮样品的回收率检测
在尿液中添加氯胺酮,检测分散液相微萃取体系的回收率。分别取添加浓度为5.0 µg/mL的1.0 mL氯胺酮添加尿样和空白尿样,加入4.0 mL的水稀释并混旋5 min。将含有40 µL二氯甲烷(萃取剂)的0.5 mL异丙醇(分散剂)快速注入到上述溶液中,按“1.4”方法萃取,再加入与沉淀相等体积的10.0 µg/mL内标液。平行实验3次,GC定量分析,结果见表2。结果表明,该体系的平均回收率为94.2%。
4. 结论
本实验建立了分散液相微萃取-气相色谱联用技术检测氯胺酮的新方法。研究结果表明本方法操作简单、灵敏度高、成本低、富集效率高、回收率高、集采样、萃取和浓缩于一体、所需有机溶剂用量极少,是一种环境友好的液相微萃取新技术。该技术已成功应用于尿液中氯胺酮的检验,且结果表明本方法适用法庭科学实验室中氯胺酮的检验。
致谢
作者感谢2014江苏省大学生创新项目(201410329004z)和江苏省重点学科资助。
文章引用
彭 鹏,周朝阳,桑骏翔,周彬斌, (2015) 分散液相微萃取技术在氯胺酮检验中的应用
The Dispersive Liquid-Liquid Microextraction Technology in the Application of Ketamine Inspection. 化学工程与技术,02,33-39. doi: 10.12677/HJCET.2015.52006
参考文献 (References)
- 1. Rezaee, M., Assadi, Y., Hosseini, M.M., Aghaee, E., Ahmadi, F. and Berijiani, S.J. (2006) Determination of organic compounds in water using dispersive liquid-liquid microextraction. Journal of Chromatography A, 1-2, 1-9.
- 2. 黄骏雄 (1994) 环境样品前处理技术及其进展(一). 环境化学, 1, 95-104.
- 3. Berijiani, S., Assadi, Y., Anbia, M., Mi-lani Hosseini, M.R. and Aghaee, E.J. (2006) Dispersive liquid-liquid microextraction combined with gas chromato-graphy-flame photometric detection. Very simple, rapid and sensitive method for the determination of organophosphorus pesticides in water. Journal of Chromatography A, 1123, 1-9.
- 4. Wasele, R. and Belleville, F.J. (1994) Gas chromatographic-mass spectrometric procedures used for the identification and determination of morphine, codeine and 6-monoacetylmorphine. Journal of Chromatography A, 1-2, 225-234.
- 5. 国菲, 王燕燕, 孟品佳, 张亮, 杨勇, 王继芳 (2009) 分析化学, 9, 1263-1268.
- 6. Maurer, H.H. (1992) Systematic toxicological analysis of drugs and their metabolites by gas chromatography-mass spectrometry. Journal of Chromatography A, 1-2, 3-41.
- 7. 臧晓欢, 吴秋华, 张美月, 郗国宏, 王志 (2009) 分散液相微萃取技术研究进展. 分析化学, 2, 161-168.
- 8. Xiong, C., Ruan, J., Cai, Y. and Tang, Y.J. (2009) Extraction and determination of some psychotropic drugs in urine samples using dispersive liquid-liquid microextraction followed by high-performance liquid chromatography. Journal of Pharmaceutical and Biomedical Analysis, 2, 572-578.
- 9. Liang, P. and Sang, H. (2008) Determination of trace lead in biological and water samples with dispersive liquid-liquid microextraction preconcentration. Analytical Biochemistry, 1, 21-25.
- 10. Meiwanki, M.B., Chen, W.S., Bai, H.Y., Lind, T.Y. and Fuh, M.R. (2009) Determination of 7-aminoflunitrazepam in urine by dispersive liquid-liquid microextraction with liquid chromatogra-phy-electrospray-tandem mass spectrometry. Talanta, 2, 618-622.
