Bioprocess
Vol.06 No.01(2016), Article ID:17183,11
pages
10.12677/BP.2016.61004
The Biological Identification and Optimization of Culture Condition for a Alternaria Strain Mold on Paper Relics
Yuwei Zhong1, Bo Liu2, Dacheng Duan1, Chenshu Liu3, Qijiu Li1, Songbin Ben1*
1Liaoning University of Life Sciences, Shenyang Liaoning
2Liaoning Provincial Museum, Shenyang Liaoning
3Liaoning Province Shiyan High School, Shenyang Liaoning

Received: Feb. 26th, 2016; accepted: Mar. 18th, 2016; published: Mar. 23rd, 2016
Copyright © 2016 by authors and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY).
http://creativecommons.org/licenses/by/4.0/



ABSTRACT
Objective: To isolate and identify the fungus on paper heritage as well as optimized culture conditions. Method: Through morphology (three implantation, microscopic observation microstructure) and Molecular Biology 18S rDNA ITS sequence amplification a strain on the paper relics is identified. The fungal culture condition is optimized by using single factor analysis and orthogonal test. Results: Two identified results showed that it was a strain of Alternaria mold (Alternaria eichhorniae). The optimum for its cultivation conditions is 28˚C, pH 5.5, shaking frequency 125 r/min. Conclusion: The strain is identified as a Alternaria mold (Alternaria eichhorniae) whose culture condition is easier to achieve in our laboratory, which makes basis for further analysis of components of mildew on paper artifacts and cleaning mildew with biological research, and also provides scientific basis for prevention and treatment of mold on paper artifacts.
Keywords:Mold, Microbes, Paper Relics, Culture Conditions, Optimization

纸质文物上一株交链孢霉生物学鉴定及其培养条件的优化
仲雨微1,刘博2,段大程1,刘辰澍3,李其久1,贲松彬1*
1辽宁大学生命科学院,辽宁 沈阳
2辽宁省博物馆,辽宁 沈阳
3辽宁省实验中学,辽宁 沈阳

收稿日期:2016年2月26日;录用日期:2016年3月18日;发布日期:2016年3月23日

摘 要
目的:对带有“霉斑”的纸质文物上的霉菌进行分离鉴定并优化其培养条件。方法:通过形态学观察(三点植入法、镜下显微结构观察法)与分子生物学18S rDNA ITS序列扩增相结合对纸质文物上霉菌进行鉴定,采用单因素分析及正交试验对霉菌培养条件进行优化。结果:两种方法的鉴定结果均显示该菌株为链格孢霉菌(Alternaria eichhorniae),其培养最佳条件为28℃,pH 5.5,摇床震荡频率125 r/min。结论:确定该菌为链格孢霉菌(Alternaria eichhorniae),其培养条件实验室较易达到,为下一步纸制文物上的霉斑成份分析及生物法清洗霉斑的研究奠定基础,并为纸质文物上霉菌防治提供科学依据。
关键词 :霉菌,微生物,纸质文物,培养条件,优化

1. 引言
我国古代造纸主要原料是植物纤维,其化学组成为纤维素、半纤维素、木质素,少量蛋白质和脂质成分等,这些常成为霉菌微生物营养基,因此极易受到微生物的侵蚀。“霉斑”即是古代纸质文物受到微生物污染及侵蚀后产生的最主要的结果。其不仅损害文物质地的机械强度而且影响观瞻效果,更有可能导致文物面貌全非、破坏殆尽。但关于“霉斑”成份研究目前国内外鲜有报道,所以本文对纸质文物上霉斑处的霉菌进行分离纯化培养及鉴定,并对其培养条件进行优化。目的是更好地了解污染纸质文物的霉菌的特性,为下一步对纸制文物上霉斑模拟、霉斑成份分析、以及霉斑生物法清洗的研究奠定基础,同时为霉菌防治和文物保护提供科学依据。
2. 材料与方法
2.1. 材料
2.1.1. 文物样本
带有“霉斑”晚清书法作品裱件(表面菌丝体已经处理)。
2.1.2. 仪器设备
台式恒温振荡器、电热恒温培养箱DNP-9082型、DYY-2稳压稳流电泳仪、立式压力蒸汽灭菌器 、PCR仪、可见分光光度计(比色杯)、PH计、高速冷冻离心机。
2.1.3. 培养基
马铃薯葡萄糖培养基(PDA):马铃薯洗净去皮,200 g切成小块,加适量水,煮沸半小时后,用8层纱布过补滤,在滤液中加入10 g琼脂粉,20 g葡萄糖,最后补足1000 mL水分,分装,灭菌,备用。
其中液体培养基和固体培养基成份和配方相同,只是不加琼脂粉。
2.1.4. 引物
用真菌通用ITS1和ITS4引物扩增18S-rDNA基因片段,其中上游引物为ITS1:5’-TCC GTA GGT GAA CCT GCG G-3’,下游引物为ITS4:5’-TCC TCC GCT TAT TGA TAT GC-3’,由上海生物工程有限公司合成。
2.2. 污染霉菌复苏及分离纯化
将文物裱件边上带有“霉斑”部分用紫外局部照射30 min,用已灭菌棉签轻轻擦拭霉斑处放入倒有马铃薯培养基的培养皿中,28℃恒温培养,待菌落长出后,进行划线纯化,反复多次后得到五种纯菌落。将纯化后的菌株,保存在含液体石蜡的PDA斜面试管中(4℃冰箱中保存)。选取一种菌株进行鉴定。
2.3. 三点植入观察法
用已灭菌的接种环蘸取少量上述已纯化好的菌种孢子,在固体马铃薯培养基上点成三角形三个点。然后将培养皿倒置在28℃恒温培养箱中培养,培养3~7天后拍照观察并记录菌落特征。
2.4. 插片观察
将无菌盖片以45˚左右的角度并排插入平板培养基中,插入深度为盖片的三分之一左右。用无菌接种环挑取霉菌的孢子悬液,接种于盖片与琼脂培养基的交界线上。在28℃下培养3天左右,显微镜下观察并拍照。
结合菌落特征、镜下结构观察及记录结果,查找真菌鉴定手册和相关的文献资料,依据菌种菌落形态、大小、颜色、生长速率、培养基颜色变化以及菌丝体和孢子的形态特征,进行鉴定。
2.5. 霉菌DNA提取
霉菌基因组DNA的提取采用简化CTAB法快速微量提取丝状真菌DNA方法 [1] 。
2.6. 18S rDNA序列扩增
将上述提取DNA作为模板,以ITS1和ITS4为引物,进行PCR扩增。PCR扩增体系见表1,PCR反应条件为:95℃预变性3 min,95℃变性45 s,55℃退火30 s,72℃延伸45 s,重复变性到延伸步骤28循环,72℃延伸10 min,PCR产物进行1%琼脂糖凝胶电泳检测后拿到上海生物工程有限公司测序。
Table 1. PCR amplification reaction system (50 μl)
表1. PCR扩增反应体系(50 μl)
2.7. 进化树构建
将测序结果输入GenBank中进行同源序列搜索,利用CustalX软件对扩增的ITS序列进行对比。然后用MEGA5.0软件构建Neighbor-Joining分子系统进化树,并进行1000次Bootstrap统计学检验。
2.8. 培养条件优化——单因素试验
将已纯化菌落的孢子接种到PDA液体培养基中,28℃,125 r/min,摇床培养过夜,次日扩大培养。未接种的马铃薯液体培养基作对照,测定570 nm波长处不同培养条件下每4小时菌液平均OD值,每种条件设5个平行实验组。
2.8.1. 温度因素
接种量为0.5 mL,pH为6.5,摇床频率为125 r/min,温度分别为25℃、28℃、30℃、32℃,具体操作步骤如上文所述。
2.8.2. PH因素
接种量为0.5 mL,摇床频率为125 r/min,温度为28℃,pH分别为5.5、6.0、6.5、7.0、7.5。具体操作步骤如上文所述。
2.8.3. 震荡频率因素
接种量为0.5 mL,温度为28℃,pH 6.5,摇床频率分别为100 r/min、125 r/min、150 r/min、175 r/min。
2.9. 正交试验
根据单因素试验结果,确定选取采用3因素4水平的L16(4^5)正交表进行正交试验 [2] - [4] 。试验因素见表2,所做的16组实验中,每组实验都每隔4小时测一次值,求其8~36 h内OD值的平均值作为菌体生长的速率标志。根据正交试验极差分析得出该菌的最适培养条件。
3. 结果
3.1. 菌落特征及镜检结果
该菌株在PDA固体培养基上气生菌丝发达,生长迅速,培养2天时,菌落直径较小,颜色呈灰黄色,且边缘长有一圈白色菌丝,6天后直径达到2.5 cm,菌落呈黑色或墨绿色的绒状或带粉状,伴随培养时间延长,边缘白色菌丝消失最终为全黑色。
镜检特征,菌丝灰色至黑色,扩散较快,形状呈倒棒状,中褐色,具横隔,分生孢子常数个成链。具体见图1,据以上结果结合手册及文献初步鉴定为交链孢霉目,黑霉科,半知菌纲,交链孢霉属 [5] [6] 。
Table 2. The test level of factors
表2. 试验因素水平表

Figure 1. Colony shape of Alternaria on PDA and microscopic morphology (×400)
图1. PDA培养基上的Alternaria的形态及显微结构图(×400)
3.2. PCR扩增结果
以提取的霉菌DNA为模板进行PCR扩增后琼脂糖凝胶电泳检验结果,由图2可知,电泳检测该DNA片断大小为550 bp左古。
经上海生物工程有限公司测序,其ITS序列为556 bp,所得序列为: CCGTAGGTGAACCTGCGGAGGGATCATTACACAAATATGAAGGCGGGCTGGAACCTCTCGGGGTTACAGCCTTGCTGAATTATTCACCCTTGTCTTTTGCGTACTTCTTGTTTCCTTGGTGGGTTCGCCCACCACTAGGACAAACATAAACCTTTTGTAATTGCAATCAGCGTCAGTAACAAATTAATAATTACAACTTTCAACAACGGATCTCTTGGTTCTGGCATCGATGAAGAACGCAGCGAAATGCGATAAGTAGTGTGAATTGCAGAATTCAGTGAATCATCGAATCTTTGAACGCACATTGCGCCCTTTGGTATTCCAAAGGGCATGCCTGTTCGAGCGTCATTTGTACCCTCAAGCTTTGCTTGGTGTTGGGCGTCTTGTCTCTAGCTTTGCTGGAGACTCGCCTTAAAGTAATTGGCAGCCGGCCTACTGGTTTCGGAGCGCAGCACAAGTCGCACTCTCTATCAGCAAAGGTCTAGCATCCATTAAGCCTTTTTTTCAACTTTTGACCTCGGATCAGGTAGGGATACCCGCTGAACTTAAGCATATC。
将所得基因序列提交到NCBI数据库中获得登陆号为(Acession number) KT031402,进行同源序列搜索,利用CustalX软件对扩增的ITS序列进行对比。最后用MEGA5.0软件构建进化树,并进行统计学检验,所建系统发育树如图3所示。结果表明该菌种与Alternaria eichhorniae (KC146356)聚于同一分支中,其同源性达到97%,结合形态特征,镜检结果和基于18S rRNA基因序列分析结果,可将该菌株确定至属的水平,即确定该霉菌为交链孢霉属。
3.3. 培养条件的优化结果
分别将温度、pH、摇床震荡频率做为变量,在其它因素相同的培养条件下,用570 nm波长的分光光度计测定每4 h五组菌液的平均OD值。
3.3.1. 不同温度对霉菌生长的影响
在pH为6.5,摇床频率为125 r/min,温度分别为25℃、28℃、30℃、32℃条件下,霉菌40 h内5组平行实验的平均OD值及相应的生长曲线分别见表3,图4。
温度是影响霉菌生长与存活的显著因素之一,从图中可能明显看出,28℃与32℃前期生长状况相同,但12 h之后28℃明显较32℃生长较快。其而30℃前期生长最慢,24 h后呈上升趋势较明显,综合来看,8 h到36 h,28℃生长状况较好。

Figure 2. The electrophoresis of Alternaria’ PCR
图2. PCR扩增电泳图
 注:括号内为GenBank登录号;分支点上的数字为自展值百分比;线段0.005为核苷酸替换率。 Note: Numbers in parentheses represent the sequences’ accession number in GenBank. The number at each branch point is the percentage supported by bootstrap. Bar: 0.005 substitutions per nucleotide position.
注:括号内为GenBank登录号;分支点上的数字为自展值百分比;线段0.005为核苷酸替换率。 Note: Numbers in parentheses represent the sequences’ accession number in GenBank. The number at each branch point is the percentage supported by bootstrap. Bar: 0.005 substitutions per nucleotide position.
Figure 3. The construction of Phylogenetic tree
图3. 系统发育树构建
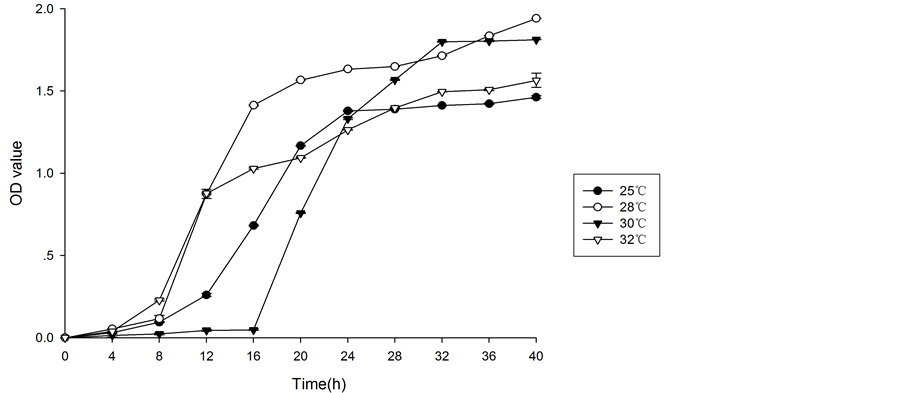
Figure 4. The effect of different temperature on the OD of Alternaria
图4. 霉菌在不同温度下的生长曲线
Table 3. The OD of Alternaria under different temperatures
表3. 霉菌在不同温度下的OD值
3.3.2. 不同PH对霉菌生长的影响
在温度为28℃,摇床频率为125 r/min,培养基pH分别为5.5、6.0、6.5、7.0、7.5条件下,霉菌40 h内的OD值及相应的生长曲线分别见表4,图5。
众所周知培养基pH可引起细胞膜电荷的变化,进而影响微生物对营养物质的吸收,影响代谢过程中酶的活性,改变营养物质的可给性和有害物质的毒性。介质的pH不仅影响微生物的生长,甚至影响微生物的形态。为了得到更好的菌斑形态,对菌的PH进行优化是非常有必要的。从图5可见,pH在6.0时最有利于菌体生长,而5.5生长状态也较好,其它三种条件都不利于霉菌的生长。
3.3.3. 不同震荡频率对霉菌生长的影响
在温度为28℃,pH为5.5,摇床震荡频率分别为100 r/min、125 r/min、150 r/min、175 r/min条件下,霉菌40 h内的OD值相应的生长曲线分别见表5和图6。
震荡频率主要是通过与增加瓶内气液接触面积、增加液体的湍动程度、增加泡在液体中的停留时间(即增加接触时间)来增加培养瓶内溶解氧的浓度 [7] [8] 。氧的溶解度对菌体的分散程度,营养物质的吸收都产生很大的影响,与此同时,对微生物的生长代谢,产物活性都有很大关系。因而对震荡频率的控制也很重要。
从图6可以看出最有利菌的生长的震荡频率为125 r/min,其次为150 r/min。
3.3.4. 正交试验结果
根据单因素结果,进行L16(4^5)正交试验,正交试验结果是以8 h到36 h之间的OD值的平均值作为菌种生长的速率。
由表6均值极差分析可知,三种因素均对OD值产生显著影响。其中温度影响最大,其次为摇床震荡频率、酸度值。温度最优水平为28℃,pH最优水平为5.5,摇床震荡频率最优水平为125 r/min,最佳组合方法为,温度28℃,pH5.5,摇床震荡频率125 r/min。从图7正交试验效应曲线图知最佳组合是温度为28℃,pH5.5,摇床震荡频率125 r/min,与正交试验结果相符合。
Table 4. The OD of Alternariaunder different pH
表4. 霉菌在不同pH下的OD值
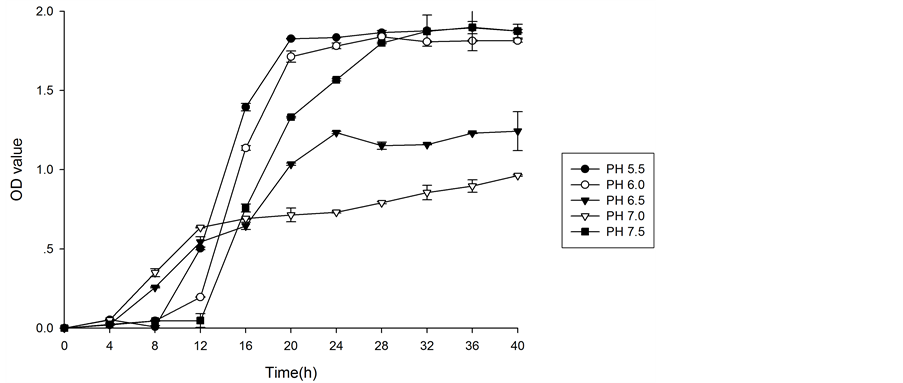
Figure 5. The effect of different pH on the OD of Alternaria
图5. 霉菌在不同PH条件下的生长曲线
Table 5. The OD of Alternaria under different rotations
表5. 霉菌在不同摇床震荡频率下的OD值

Figure 6. The effect of different rotation rates on the OD of Alternaria
图6. 霉菌在不同震荡频率下的生长曲线图
Table 6. The orthogonal experiment intuitive results analysis
表6. 正交试验直观结果分析表

Figure 7. Orthogonal experiment effect graph
图7. 正交试验效应曲线图
4. 讨论
我国历史悠久,孕育了巨大的文化底蕴。书画等纸质文物作为文化的载体以实物的形态留存并传承下来,在传承过程中不可避免地产生霉斑。霉斑是一种微生物危害,它分解纸张植物纤维作为自身生长所需养分,并代谢产生甲酸、乙酸乳酸等有机酸,造成纸张局部酸性增强、脆性提高,同时,孢子和菌落及其分泌物会在纸质文物上形成附着力较强的黄、红、绿、青、褐、黑等色斑,极不易去除,不但影响文物的原貌和信息的识读性,还大大降低了其历史与艺术价值,如何处理纸质文物的霉斑已成为文保工作的热点领域。
据不完全统计,现在仅有微生物总数的不到1%的已知的细菌,已知的真菌不到微生物总数的5%,这表明还有成千上万的微生物种类有待进一步确认和开发 [9] 。不同的菌群会产生不同的次级代谢产物,因此,需要对文物上的菌株进行分离鉴定,确定其种属。我们对晚清纸质文物上“霉斑”菌株进行生物复苏、分离,并对其中一株菌进行鉴定,除了简单的形态鉴定外,引进18srDNA分子生物学技术,提高了鉴定的准确性。结果确定其为一株链格孢霉菌株(Acession numberKT031402),与Alternaria eichhorniae (KC146356)聚于同一分支中,与Alternaria daucifolii (KC584193)亲缘关系较近,一种广泛存在于纸质文物上的菌株,可以作为“霉斑”的模拟、“霉斑”成份分析的研究对象。对此菌株培养条件进行优化,确定28℃,pH5.5,摇床震荡频率125 r/min为最佳培养条件。该数据不仅为“霉斑”的模拟、成分分析以及清洗等后续工作提供了有利的科学依据,而且在以后文物保护过程中,针对其特性,除了药物防杀外,还可采取避免适宜温度与pH范围的环境进行物理防治,这样能尽量地减少霉菌类生物对文物的损害,延缓文物褪变,延长文物寿命,尽可能保存其科学、历史、艺术等价值。
基金项目
国家自然基金项目(31371085);辽宁省教育厅资助项目(
文章引用
仲雨微,刘博,段大程,刘辰澍,李其久,贲松彬. 纸质文物上一株交链孢霉生物学鉴定及其培养条件的优化
The Biological Identification and Optimization of Culture Condition for a Alternaria Strain Mold on Paper Relics[J]. 生物过程, 2016, 06(01): 24-34. http://dx.doi.org/10.12677/BP.2016.61004
参考文献 (References)
- 1. 易润华, 朱西儒, 周而勋. 简化 CTAB 法快速微量提取丝状真菌DNA [J]. 湛江海洋大学学报, 2003, 23(6): 72-73.
- 2. 陆鸿. 正交试验设计[J]. 河南预防医学杂志, 1999, 10(2): 124-126.
- 3. 刘瑞江, 张业旺, 闻崇炜, 汤建. 正交试验设计和分析方法研究[J]. 实验技术与管理, 2010, 27(9): 52-55.
- 4. 开泰, 长兴. 正交与均匀试验设计[M]. 科学出版社, 2001.
- 5. 魏景超. 真菌鉴定手册[M]. 上海: 上海科学技术出版社, 1979.
- 6. Barnett, H.L. and Hunter, B.B. (1972) Illustrated Genera of Imperfect Fungi. Illustrated Genera of Imperfect Fungi. 3rd Edi-tion.
- 7. Wang, Y.-H. and Zhang, X. (2007) Influence of Agitation and Aeration on Growth and Antibiotic Production by Xenorhabdus nematophila. World Journal of Microbiology and Biotechnology, 23, 221-227. http://dx.doi.org/10.1007/s11274-006-9217-2
- 8. 洪文荣, 刘致新. 暗霉素产生菌 F-211 发酵工艺完善的研究[J]. 中国药科大学学报, 2000, 31(1): 61-65.
- 9. Aly, A.H., Debbab, A., Kjer, J. and Proksch, P. (2010) Fungal Endo-phytes from Higher Plants: A Prolific Source of Phytochemicals and Other Bioactive Natural Products. Fungal Diversity, 41, 1-16. http://dx.doi.org/10.1007/s13225-010-0034-4
*通讯作者。
