Open Journal of Nature Science
Vol.03 No.03(2015), Article ID:15925,11
pages
10.12677/OJNS.2015.33010
Mechanisem of Action of PICKCa Adjuvant and Its Therapeutic Vaccines
Haixiang Lin*, Yi Zhang
Beijing Yishengxingye Science and Technology Co. Ltd., Beijing
Email: *haixianglin510@sina.com
Received: Jul. 27th, 2015; accepted: Aug. 14th, 2015; published Aug. 21st, 2015
Copyright © 2015 by authors and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY).
http://creativecommons.org/licenses/by/4.0/



ABSTRACT
PICKCa, a safe vaccine adjuvant for human use, is a complex of poly IC-kanamycin-Cacl2. It is the ligand of pattern recognition receptors of TLR3, NOD and RIG-1. PICKCa vaccines can activate innate pathways in vivo to produce cytokines including IFN-α, IFN-β, IFN-γ, IL-2, IL-12p40, IL-6, TNF-α, promote macrophage function, stimulate antigen-presenting cells to produce co-stimulators of CD40, CD80, CD86, activate cell-mediated immunity and humoral immunity. Due to PICKCa adjuvant enhancing productions of IFN, IL-2, IL-12, the adjuvant may make prophylactic vaccines from main humoral immunity to possess strong cell-mediated immunity as therapeutic vaccines. In 3 independent assays of post-explosure immunizations of mice and beagle dogs, PICKCa rabies vaccine was much better than commercial adjuvant-free rabies vaccines, the protective rate was 70% - 100% and 20% - 30% respectively, and the statistical analyses were significantly different (P < 0.05 - 0.01). PICKCa rabies vaccine and PICKCa hepatitis B vaccine are ongoing in phase-1 clinical trials in Singapore.
Keywords:PICKCa Adjuvant, Therapeutic Vaccines, Mechanisem of Action

皮卡佐剂及其治疗性疫苗作用机理
林海祥*,张 译
北京依生兴业科技有限公司,北京
Email: *haixianglin510@sina.com
收稿日期:2015年7月27日;录用日期:2015年8月14日;发布日期:2015年8月21日

摘 要
皮卡是人用安全的疫苗佐剂,是双链聚肌苷酸聚胞苷酸及微量卡那霉素和氯化钙的复合物。该佐剂是三种模式识别受体TLR3、NOD和RIG-1的配体。皮卡佐剂疫苗与受体结合后在体内活化非特异免疫,包括巨噬细胞吞噬功能,促进干扰素(IFN)、白细胞介素-2(IL-2)、-6、-12、肿瘤坏死因子(TNF)等细胞因子的产生,促进产生共刺激因子CD40、CD80、CD86,促进抗原呈递细胞的提呈、活化T淋巴细胞,促进特异性的细胞免疫和体液免疫应答,促进免疫细胞的增殖。皮卡佐剂不仅提高疫苗的免疫原性,更由于促进干扰素、白细胞介素-2、-12的产生,使从主要产生体液免疫的预防性疫苗转变成具有强烈细胞免疫的治疗性疫苗。在三次独立的先感染后免疫的暴露后小白鼠和比格犬的试验中,在没有接种抗血清情况下,国内外市售人用狂犬病疫苗保护率仅为20%~30%,而皮卡狂犬病疫苗可高达70%~100%,统计学分析具有显著的差异(P < 0.05~0.01)。皮卡狂犬病治疗性疫苗和皮卡乙肝治疗性疫苗正在新加坡进行1期临床研究。
关键词 :皮卡佐剂,治疗性疫苗,作用机理

1. 引言
治疗性疫苗主要用于肿瘤和病毒感染的治疗,在抗肿瘤和抗感染的免疫反应中,细胞免疫的激活是至关重要的因素。选用适合的佐剂以增强免疫原性,并使免疫应答偏向细胞免疫(此即免疫反应类型的转换)是治疗性疫苗能否成功的重要途径。我们经过30年的研究包括其他国内外机构在狂犬病疫苗[1] 、乙肝疫苗[2] 、结核菌苗(待发表资料)、流感疫苗[3] -[5] 等独立研究结果显示皮卡佐剂疫苗显著地促进了非特异性和特异性免疫,特别是细胞免疫,与预防性疫苗不同,是具有治疗作用的疫苗。如表1所示皮卡狂犬病疫苗更具有治疗性疫苗特性。
人体抗感染免疫首先是非特异性免疫停止感染的发生和继续,随后是特异性免疫清除或治愈感染。Bruce, A.B.和Hoffmann, J.A.发现TLRs膜式识别受体可以与微生物基本成分结合活化非特异免疫[6] [7] ,Steinman, R.M.发现树突状细胞活化T淋巴细胞启动特异性免疫[8] 而共享2011年诺贝尔生理学和医学奖。这些发现明确了皮卡佐剂及其疫苗成为治疗性疫苗的机理。
皮卡佐剂是三类膜式识别受体(pattern recognition receptor PRR)的配体[9] [10] [23] ,如图1 [11] 所示,第一类是Toll-受体系统(Toll-like receptors, TLRs)中的TLR3,可直接识别dsRNA或其类似物皮卡,这是先天性免疫的受体,识别后激活B细胞的核内因子(nuclear factor k of activated B cell, NF-κB),促进炎症因子和1型干扰素(IFN1)表达。第二类是核苷酸结合寡核苷酸域(nucleotide-binding oligomerization domain, NOD)蛋白家族,是先天性免疫系统另一类重要受体,其羧基端为皮卡配体结合域,氨基端是信号传递位点,也可以激活NF-κB。第三类是RNA螺旋酶。视黄酸诱导基因I (retinoic acid inducible gene I, RIG-I),RIG-I能够识别病毒dsRNA组分,活化NF-κB,激活干扰素调节因子3 (interferon regulatory factors 3, IRF-3),启动免疫和炎性基因,释放炎性因子和1型干扰素[9] [12] 。由大部分病毒繁殖过程中产生的dsRNA和其类似物皮卡与这些PRRs结合后启动依赖和非依赖髓样分化88 (myeloid differentiation88, My88)信号传导或者通过含有诱生干扰素β接头蛋白的Toll样白细胞介素1受体域(Toll IL-1 receotor domain containing adaptor-inducing interferon β, TRIF)路径,快速引起NF-κB产生,促进分泌细胞因子,再通过抗原提呈细
Table 1. Comparison of PICKCa with rabies therapeutic vaccine and prophylactic
表1. 皮卡狂犬病疫苗与治疗性和预防性疫苗的异同
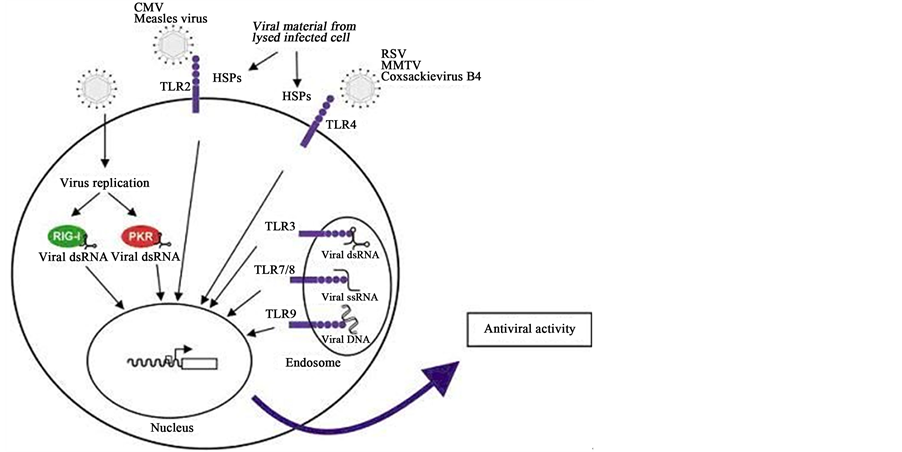
Figure 1. Participated PRR and its ligands in a host infected viruses
图1. 机体识别病毒感染过程中参与的模式识别受体及其配体
胞(antigen present cells, APC)活化T细胞,产生类炎性因子和IFN1。IFN诱导的dsRNA激活的蛋白激酶R (protein kinase regulated by double-stranded RNA, PKR)是dsRNA的细胞内受体,识别dsRNA后,PKR聚合且自动磷酸化。PKR的底物主要是真核细胞启动因子2α,故PKR能抑制mRNA翻译成蛋白而减弱受染细胞病毒蛋白的合成,及至抑制病毒复制。如图1所示,dsRNA类似物皮卡佐剂的优点是可以被多种受体识别,促进抗原交叉提呈,通过信号传导通路,促进细胞毒T细胞的增殖[13] [14] ,交叉提呈还可以促进IFN1产生[15] [24] ,调节随后的特异性免疫反应,增强机体抗击病毒的能力,发挥很强的佐剂效果,是优秀的疫苗佐剂[16] 。
下列各项国内外实验结果验证了皮卡佐剂及其疫苗显著促进机体免疫的各个过程,特别是细胞免疫,明确了其具有治疗作用的机理。
2. 皮卡是多种PRRs的配体
图2这一组试验结果是皮卡佐剂在TLR3基因缺失与不缺失小鼠中的抗流感病毒反应[4] 。图2(a)是用一种质粒表达系统(A plasmid expression system)测定出皮卡不仅可以被TLR3识别也可以被黑色瘤分化相关基因5 (MDA5)及RIG-1识别,MDA5是胞浆内核酸受体,识别ds RNA,与RIG-1相似,激活NF-κB,促进IFN1产生。图2(b)是对TLR3基因缺失和不缺失小鼠鼻内滴注皮卡佐剂或PBS,100微克/只,24
小时后取肺匀浆,采用试剂盒ELISA方法测定和分析各种细胞因子,结果表明与对照组比较,皮卡能显著地上调细胞因子表达水平。图2(c)和图2(d)是先鼻腔感染50TCID50 H7N1流感病毒然后再用皮卡治疗,结果表明皮卡佐剂对TLR3基因缺失与不缺失小鼠与只给PBS对照组小白鼠比较在鼻腔(图2(c))和肺(图2(d))都能显著抑制病毒的繁殖(P < 0.05)。
3. 皮卡和皮卡疫苗活化巨噬细胞功能[1]
皮卡佐剂和皮卡狂犬病疫苗被PRRs识别后活化了巨噬细胞吞噬抗原等一系列功能。活化的单核巨噬细胞能够非特异防御,吞噬各种抗原,在不产生免疫反应情况下将抗原降解以达清除的目的;将加工后的抗原提呈给T细胞,当CD4+辅助T细胞识别巨噬细胞表面的抗原时,生成的γ干扰素又进一步激活巨噬细胞,上调MHCII类分子的表达,有效地杀伤病原体;同时分泌IFN、肿瘤坏死因子(TNF)、IL-6、IL-12,这是使机体在抗病毒感染中转向细胞免疫的原始动力[17] 。表2结果表明皮卡佐剂和皮卡狂犬病疫苗与单纯疫苗和生理盐水比较能显著促进巨噬细胞的功能。
4. 皮卡疫苗促进干扰素的分泌[1]
I型干扰素主要由IFN-α,IFN-β组成,由单核巨噬细胞产生;II型IFN-γ只能由NK细胞、激活的T淋巴细胞产生。I型与II型IFN都具有抗病毒作用,是有效抵抗病毒入侵的多功能细胞因子。表3结果表明市售疫苗不能产生干扰素,只有皮卡疫苗能在疫苗注射后几个小时就能产生非特异性干扰素,证明


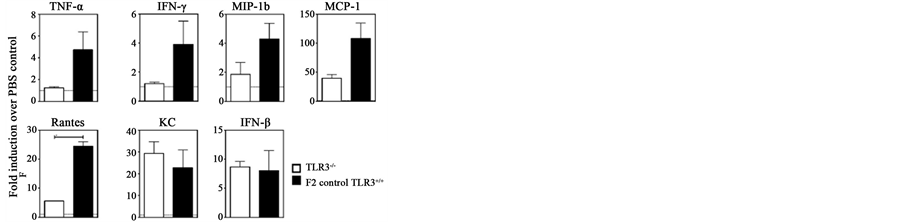
 (a) (b) (c) (d)(a) 用质粒表达系统测定皮卡佐剂对多种PRRs的识别;(b) 皮卡对TLR3基因缺失和不缺失小鼠产生细胞因子的影响。TNFα,IFNγ,MIP-1b (巨噬细胞炎性蛋白1b),MCP-1(单核细胞趋化蛋白-1),Rantes (趋化因子),KC (肝巨噬细胞),IFN-β;(c) (d) 皮卡佐剂对TLR3基因缺失与不缺失小鼠在鼻腔(NT)和肺(Lungs)对流感病毒繁殖的影响
(a) (b) (c) (d)(a) 用质粒表达系统测定皮卡佐剂对多种PRRs的识别;(b) 皮卡对TLR3基因缺失和不缺失小鼠产生细胞因子的影响。TNFα,IFNγ,MIP-1b (巨噬细胞炎性蛋白1b),MCP-1(单核细胞趋化蛋白-1),Rantes (趋化因子),KC (肝巨噬细胞),IFN-β;(c) (d) 皮卡佐剂对TLR3基因缺失与不缺失小鼠在鼻腔(NT)和肺(Lungs)对流感病毒繁殖的影响
Figure 2. The anti-influ responses stimulated by PICKCa in mice of dispensableTLR3-gene
图2. 在TLR3基因缺失与不缺失小鼠中皮卡佐剂的抗流感病毒反应
Table 2. Phagocytic function of macrophages of mice immunized with rabies vaccine using PICKCa adjuvant [percentage of phagocytosis, (phagocytosis index)]
表2. 巨噬细胞吞噬功能(吞噬百分数和吞噬指数)测定*
*0天组免疫一次,3天组免疫二次,7天组免疫三次,14天组免疫四次。检测时,于免疫后2小时注射鸡红血球,4小时后取腹腔巨噬细胞检测。吞噬百分数:吞噬了红血球的巨噬细胞百分数。吞噬指数(括号内数字):每个巨噬细胞吞噬红血球个数的平均数。
皮卡佐剂激活巨噬细胞和NK细胞,早期启动和活化机体非特异性免疫,产生向细胞免疫方向发展的细胞因子,在决定免疫方向上发挥了关键作用 [18] 。TLR3识别dsRNA或皮卡疫苗后能诱导很强IFN1的产生和共刺激分子的表达有助于建立局部的抗病毒状态,限制病毒在感染部位的复制,结合上述促进巨噬细胞功能,这在3度咬伤狂犬病防治中有类似于被动抗体的作用。
5. 皮卡(PIKA®)佐剂激活机体树突状细胞(dendritic cells, DC)上调共刺激分子
初始T细胞的活化需要两个信号共同刺激,第一信号来自抗原,提供方式是抗原-MHC与T细胞受体的相互作用和结合,该信号确保免疫应答的特异性;第二信号是共刺激分子信号,是存在APC表面,能与Th细胞共刺激分子受体结合,以确保免疫应答在需要的时候发生,其中最具特征的是CD80和CD86,CD40。图3是用皮卡佐剂与小白鼠骨髓分化的树突状细胞(BMDCs)作用后平均荧光强度(Mean Fluorescence Intensity MFI) CD80从59.82%~90.66%、CD86从11.70%~38.66%、CD40从16.98%~58.62% [2] ,显著地上调共刺激分子产生。
6. PIKA®佐剂体内诱导产生细胞因子
(1) 激活Th细胞,提高IL-2的滴度 [1]
用PBS、2.75 mg灭活纯化狂犬病疫苗(IPRV)和2.75 mg IPRV与75 mg皮卡复合,皮下免疫C3H小鼠,
Table 3. IFN level induced in immunized mice with various rabies vccines
表3. 皮卡佐剂疫苗和单纯疫苗对小白鼠干扰素的诱导
0天注射疫苗1次,3天注射第2次,7天组注射第3次,每次注射后两小时取血用细胞病变法(CPE)测定干扰素。
 方法:C57BL/6小鼠BMDC细胞体外与PIKA共同孵育18小时。FACS检测CD80+,CD86+和CD40+细胞的平均荧光强度。
方法:C57BL/6小鼠BMDC细胞体外与PIKA共同孵育18小时。FACS检测CD80+,CD86+和CD40+细胞的平均荧光强度。
Figure 3. Up-regulation of co-stimulatory molecules of dendritic cells activated by PICKCa adjuvant
图3. PIKA®佐剂激活机体DC上调共刺激分子产生
一周后取出脾细胞,并用培养液和不同剂量的IPRV于体外刺激,24小时后收获上清液掺入3H胸腺嘧啶同位素,6小时后,将细胞收集在纤维滤纸膜上,80℃烘干,在计数仪上测定CMP数。
从表4可以看到皮卡IPRV组IL-2的产量显著高于单纯IPRV组及PBS组,说明皮卡与IPRV复合后能够在体内刺激T淋巴细胞增强细胞免疫。T细胞活化引起细胞分裂(大量增殖,达到整体功能所需的数量水平)和分化(使T细胞具有分泌细胞因子或细胞杀伤的功能)。淋巴因子的分泌是T细胞活化的主要表现形式。不同的抗原刺激可使初始T细胞分泌不同种类的细胞因子,从而产生不同的效应,而IL-2是初始Th1细胞产生的最重要的细胞因子。
(2) 皮卡佐剂促进细胞因子的产生
每只小鼠500微克PIKA佐剂经腹腔注射,不同时间取血分离血清,用相应特异ELISA方法检测IFN-γ、IL-12p40、IL-6、TNF-α等细胞因子的产生。表明PIKA佐剂可诱导细胞因子IFN-γ、IL-12p40、IL-6、TNF-α的产生,但产生的时间点不同,其中TNF-α到达高峰时间为1小时,IL-12p40、IL-6为2小时,IFN-γ为5小时,见图4 [2] 。
Table 4. IL-2 production of C3H Mice immunized with IPRV or PIKA-IPRV
表4. 用IPRV或皮卡IPRV免疫C3H小鼠诱生IL-2的测定
 Balb/C mice administered intra-peritoneal injection of PICKCa 0.5 mg followed by the collection of blood samples at 0, 1, 2 and 5 hours. Blood serum then tested by ELISA for the detection of cytokines.
Balb/C mice administered intra-peritoneal injection of PICKCa 0.5 mg followed by the collection of blood samples at 0, 1, 2 and 5 hours. Blood serum then tested by ELISA for the detection of cytokines.
Figure 4. Cytokines levels enhanced by PICKCa adjuvant in vivo
图4. 皮卡佐剂促进体内细胞因子的产生
Th1类细胞因子主要包括IL-2、IL-12、IFN、TNF等,由NK和T细胞产生的IFN-γ以及巨噬细胞产生的IFNα IL-12p40。皮卡佐剂促进产生内源性IFN、IL-12使T0向Th1细胞免疫转化。Th2类细胞因子主要包括IL-4 、IL-5、IL-6、IL-10。上述结果表明皮卡佐剂狂犬病疫苗既有促进Th1类细胞因子产生又有促进Th2类细胞因子产生,既促进了细胞免疫又促进了体液免疫。
7. 皮卡疫苗对体液免疫的促进作用 [1]
(1) 降低ED50抗原量的比较
用一批灭活纯化狂犬病疫苗(IPRV)分别加不同剂量的皮卡和铝佐剂按照NIH狂犬病疫苗效力测定方法,于0,7天免疫,第14天用狂犬病攻击毒株(CVS)病毒脑内攻击,观察死亡率,计算ED50。
表5结果显示皮卡IPRV与未加皮卡的IPRV相比减少ED50抗原量5~10倍,而铝佐剂IPRV仅减少1倍左右,见表5。
(2) 提高IgG和中和抗体效价 [1]
用IPRV、皮卡IPRV和Al2O3 IPRV皮下免疫OF1小白鼠(注射量IPRV 1.67 mg/只,皮卡75 mg/只,Al2O3 75 mg/只),按0、3、7、14、30天免疫5次,其间不同天数从小白鼠眼眶静脉采血,分离血清,灭活后用ELISA方法检测IgG抗体,用RFFIT方法检测中和抗体。
结果表明皮卡IPRV能明显促进小白鼠狂犬病抗体的提高,具有抗体产生早,滴度高,维持时间长的特点,而铝佐剂IPRV在免疫后4天和7天的早期抗体水平反而下降,14天后才有所升高,见图5。
Table 5. Stimulated effects of PIKA and aluminium adjuvant to inactived and purified rabies vaccine (IPRV) with NIH test
表5. 用NIH方法比较皮卡佐剂和铝佐剂对IPRV效价的促进作用

Figure 5. Neutralizing antibody levels of mice immunized with various rabies vaccines
图5. 皮卡狂犬病疫苗、铝佐剂疫苗与单纯疫苗产生中和抗体产生的比较
上述两项试验表明皮卡佐剂提高了疫苗的免疫原性,促进了体液免疫。
8. 皮卡佐剂刺激脾细胞及其B细胞、NK细胞的活化增殖及免疫记忆
(1) 增殖B细胞和NK细胞[2]
通过细胞亚群分析,PIKA佐剂在体内外直接诱导细胞因子的产生,促进B细胞和NK细胞的活化和增殖,见图6。取小白鼠脾细胞与皮卡250微克/毫升一起37℃孵育3天,收获细胞洗后与相应抗体粘附,以CD25为标志物,通过流式细胞仪测定其活性和百分数,与对照组比较使CD19 B细胞从3.25~25.46,Ly49 NK细胞从5.40~37.40,均显著增殖了B细胞和NK细胞。NK细胞是机体非特异免疫细胞,能直接杀伤肿瘤和病毒感染的靶细胞,能合成和分泌IFN-、TNF等多种细胞因子,B细胞增殖提高体液免疫水平。位于机体抵抗肿瘤和病毒感染的第一道防线并且是连接天然免疫和获得性免疫的桥梁[11] 。
(2) 促进免疫淋巴细胞(脾细胞)的增殖[19]
在检测皮卡IPRV对IL-2的促进作用时,于显微镜下还观察到对脾细胞具有明显的增殖作用。我们用3H胸腺嘧啶掺入法测量这种现象,表6结果表明皮卡疫苗可显著地促进淋巴细胞增殖。
9. 皮卡佐剂狂犬病疫苗促进人体免疫记忆细胞产生IFN-γ
图7结果为对志愿人体免疫皮卡狂犬病疫苗2.5年后,取外周血分离单核细胞,用狂犬病抗原体外
Table 6. Proliferation of splenocytes from mice immunized with IPRV or PIKA-IPRV and stimulated in Vera with IPRV or PIKA
表6. 皮卡IPRV或IPRV免疫小鼠和体外刺激后对脾细胞增殖作用的比较

Figure 6. Generation of B and NK cells stimulated by PICKC adjuvant
图6. 皮卡佐剂促进B细胞和NK细胞增殖
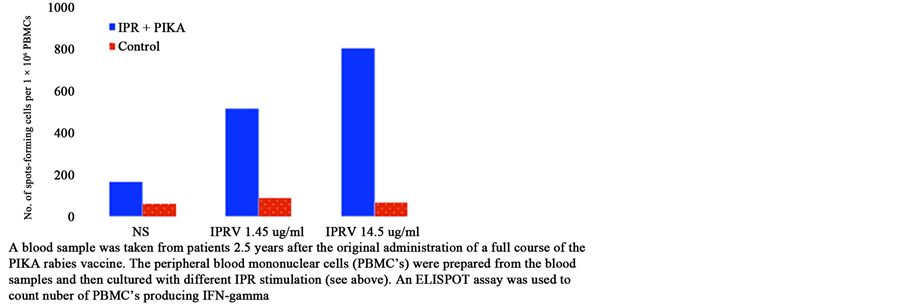
Figure 7. IFN-γSPF in PBMCs of volunteers immunized with rabies vaccine
图7. 皮卡佐剂狂犬病疫苗促进人体免疫记忆细胞产生IFN-γ SPF数量
刺激,以ELISPOT方法检测,结果可见到具有细胞免疫的IFN-γ显著增加(待发表资料)。
机体完整的抗感染免疫反应是随着抗原的清除,大多数活化T细胞死于细胞凋亡,以维持自身稳定的基础状态,少数T细胞分化为长寿命的记忆细胞,在再次抗原刺激时发挥快速的免疫应答作用。检测表明皮卡疫苗不仅激发试验动物也能激发对人体的免疫促进作用,也符合上述作用机理,这是很有意义的结果。
图7结果可见到皮卡狂犬病疫苗免疫志愿者2.5年后用ELISPOT方法检测外周血单核细胞IFN-γ,与未注射狂犬病疫苗正常人比较经相应抗原刺激后IFN-γ显著增加。表明皮卡狂犬病疫苗对人体也有很好的免疫记忆反应。
上述试验结果表明皮卡佐剂疫苗被多种膜式受体识别后,显著地促进了机体的非特异和特异性免疫反应。皮卡佐剂疫苗是如何转变免疫类型促进由主要起预防作用的体液免疫向细胞免疫转换而具有治疗作用呢?机体的T淋巴细胞分为Th0、Th1、Th2。皮卡疫苗与膜式识别受体结合后,活化巨噬细胞产生后产生IFN-α,IL-2、IL-12,活化NK细胞产生IFNr,而使T细胞向Th0、Th1分化,这是皮卡疫苗使单纯疫苗从主要诱生体液免疫向细胞免疫转化具有治疗作用的主要原因 [18] 。TH1介导细胞免疫,特别有利于清除细胞内感染,如表1所示这也是成为治疗性疫苗和预防性疫苗最主要的区别。临床上可以观察到肿瘤患者中IFN和IL-2减少,IL-10上升,表明肿瘤在生长,有Th1向Th2转化倾向。
DC联接外周和淋巴组织也是联接非特异性免疫和特异性免疫的桥梁。当PPRs和dsRNA发生作用,使DC成熟。成熟的DC表达MHC和共刺激分子CD40、CD80等,到淋巴结后,活化的DC产生细胞因子并活化初始T淋巴细胞,产生以细胞免疫为主的特异性免疫反应 [20] 。
在法国巴斯德研究所、武汉生研所和军科院兽研所应用小白鼠和Beagle犬三次暴露后实验即先皮下或肌肉感染狂犬病野毒株病毒,然后再用狂犬病疫苗免疫,结果均显示皮卡狂犬病疫苗具有极其良好的保护效果,即在没有联合应用抗血清情况下,国内外市售人用狂犬病疫苗保护率仅为20%~30%,而皮卡狂犬病疫苗可高达70%~100%。统计学分析有极其显著的差异(待发表资料)。这些机体的显著效果是上述细胞和亚细胞水平效果的总结。另外,皮卡乙肝疫苗,皮卡流感疫苗、皮卡结核病疫苗(与美国国际结核病疫苗基金会 AERAS协作)都取得符合上述免疫机理的结果,其中皮卡狂犬病疫苗、皮卡乙肝疫苗已在新加坡取得临床研究批件,已经开始了人体临床研究。
关于皮卡佐剂疫苗安全性 [21] :
皮卡(PICKCa)是聚肌苷酸(PI)、聚胞苷酸(PC)、卡那霉素(K)、氯化钙(Ca)的复合物,国内商品名称为聚肌胞注射液,这是我国独有的具有国家标准的人用注射药品 [22] 。1981年,经国家批准用于临床,很多厂家投入生产,产量达每年几千万支。浙江万马药业有限公司自1984年开始销售聚肌胞注射液,临床使用未发现严重的不良反应。该公司1999年销售1432.02万支,2000年销售1764.47万支,2001年销售1320.88万支。
关于皮卡疫苗我们已申请并已获得临床研究的有皮卡狂犬病疫苗、皮卡乙肝疫苗,其中的疫苗也都是具有国家标准批准生产的疫苗。皮卡佐剂与疫苗复合后不仅符合甚至高于两个国家标准的要求,这是由于皮卡佐剂提高了疫苗免疫原性,使疫苗用量较单纯疫苗少,如皮卡狂犬病疫苗蛋白含量由原来的120 μg改为80 μg,硫柳汞含量由原来的应不高于0.10 mg/ml改为0.02~0.08 mg/ml,效力测定由原来的≥2.5 IU/ml改为≥4.0 IU/ml等。并增加了本疫苗特有的皮卡含量、皮卡相对分子质量以及诱导细胞免疫的检定。同时也不增加疫苗中原有的一些物质(如残留小牛血清)可能产生的不良反应。这两个疫苗都通过了临床前研究的各项检定,包括急性、慢性、重复毒性和猴体安全评价。
病毒感染仍然使人类面临重大威胁:HIV已成为死亡的第四大因素;新病毒性疾病的出现:Sars,禽流感和最新在国际流行国内也检出的中东呼吸综合征(MERS);某些地域性病毒病在全球播散:拉萨热、艾博拉;旧病毒病重新播散:麻疹;致癌病毒:EB病毒、人乳头瘤病毒、性疱疹病毒、乙肝病毒等。面对这些疾病人们缺乏根本有效的对应办法。如对SARS和MERS,只能采取对症治疗,对密切接触者采取隔离措施;乙肝疫苗只能用于预防,对病毒携带者和患者无效;即使潜伏期很长的狂犬病而且认为有效的狂犬病疫苗对咬伤患者也不是足够的,须联合应用抗狂犬病免疫球蛋白。皮卡疫苗作用机理已基本清楚,既提高疫苗免疫原性又改变免疫类型具有强烈的细胞免疫而可防可治,是解决人类当前很多难题的新途径!
自从证实ds RNA是多种膜式受体的配体,是优秀的疫苗佐剂,已引起极大关注,成为热门研究课题[23] -[26] 。然而单纯PIC易被人及灵长目动物血清中的核酸酶水解而难以在机体内发挥效用[27] ,Levy等研制出PICLC,即PIC与聚赖氨酸(PolyL-lysine,相对分子质量27,000)和羧甲基纤维素CMC,相对分子质量700 000)的结合物,使相对分子质量增大了许多,可以抵抗酶水解,在人和灵长目动物中诱生出较PIC高得多的干扰素[28] [29] ,但PICLC毒副作用严重,可以引起发烧(100%),肌痛(50%),低血压(50%),白细胞明显下降等,难于应用于人体[30] 。幸运的是将PICKCa作为疫苗佐剂是我们的首创,已在35个国家和地区获得发明专利,以致美国AERAS比较若干佐剂后来华寻求皮卡专利使用权。我们应该应用皮卡佐剂加紧抗病毒、抗肿瘤疫苗的研究,希望能引起国家和社会的重视和支持,使有可能为国分忧、为患者解除病痛的具有中国自主知识产权的皮卡疫苗早日问世。
文章引用
林海祥,张译. 皮卡佐剂及其治疗性疫苗作用机理
Mechanisem of Action of PICKCa Adjuvant and Its Therapeutic Vaccines[J]. 自然科学, 2015, 03(03): 70-80. http://dx.doi.org/10.12677/OJNS.2015.33010
参考文献 (References)
- 1. 林海祥, 俞永新 (2010) 皮卡佐剂狂犬病疫苗的有效性. 中国生物制品学杂志, 9, 1028-1031.
- 2. Shen, E., Li, L., Li, L., et al. (2007) PIKA as an adjuvant enhances specific humoral and cellular immune responses following the vaccination of mice with HBsAg plus PIKA. Cellular & Molecular Immunology, 4, 113-120.
- 3. Lau, Y.F., Tang, L.-H., Ooi, E.-E. and Subbarao, K. (2010) Activation of the innate immune system provides broad- spectrum protection against influenza A viruses with pandemic potential in mice. Virology, 406, 80-87. http://dx.doi.org/10.1016/j.virol.2010.07.008
- 4. Lau, Y.-F., Tang, L.-H. and Ooi, E.-E. (2009) A TLR3 ligand that exhibits potent inhibition of influenza virus replication and has strong adjuvant activity has the potential for dual applications in an influenza pandemic. Vaccine, 27, 1354-1364. http://dx.doi.org/10.1016/j.vaccine.2008.12.048
- 5. Tang, L.H., Lim, J.H., Kuah, L.F. and Lau, Y.F. (2014) Compete protection against lethal challenge of novel H7N9 virus with heterologous inactevated H7 vaccine in mice. Vaccine, 32, 5375-5378. http://dx.doi.org/10.1016/j.vaccine.2014.07.087
- 6. Beutler, B.A. (2009) TLRs and innate immunity. Blood, 113, 1399-1407.
- 7. Hoffmann, J.A. (1995) Innate immunity of insects. Current Opinion in Immunology, 7, 4-10. http://dx.doi.org/10.1016/0952-7915(95)80022-0
- 8. Steunman, R.M. and Cohn, Z.A. (1973) Identification of novel cell type in peripheral lymphoid organs of mice 1. Morphology quantitation, tissue distribution. Journal of Experimental Medicine, 137, 1142-1162. http://dx.doi.org/10.1084/jem.137.5.1142
- 9. Alexopoulou, L., Holt, A.C., Meldzitov, R. and Flavell, R.A. (2001) Reconition of double-strainded RNA and activation of NF-kappaB by Toll-like receptoor3. Nature, 413, 732-738. http://dx.doi.org/10.1038/35099560
- 10. Stowell, N.C., Seideman, J., Raymond, H.A., et al. (2009) Long-term activation of TLR3 by poly(IC) induces inflammation ang impairs lung faction in mice. Respiratory Research, 10, 43. http://dx.doi.org/10.1186/1465-9921-10-43
- 11. 谢青, 晏春根 (2006) 模式识别受体与病毒感染. In: 2006年慢性乙型肝炎治疗进展研讨会资料汇编, 慢性乙型肝炎治疗进展研讨会, 广州, 37-41.
- 12. Kwai, T. and Akira, S. (2006) TLR signaling. Cell Death and Differentiation, 13, 816-825. http://dx.doi.org/10.1038/sj.cdd.4401850
- 13. Schulz, O., Diebold, S.S., Chen, M., Näslund, T.I., Nolte, M.A., Alexopoulou, L., et al. (2005) Toll-like receptor 3 promotes cross-priming to virus-infected cells. Nature, 433, 887-892. http://dx.doi.org/10.1038/nature03326
- 14. Schroder, M. and Bowie, A.G. (2005) TLR3 in antiviral immunity: Key player or bystander? Trends in Immunology, 26, 462-468.
- 15. Le, B.A., Etchart, N., Rossmann, C., Ashton, M., Hou, S., Gewert, D., et al. (2003) Cross-priming of CD8+ T cells stimulated by virus-induced type 1 interferon. Nature Immunology, 4, 1009-1015.
- 16. Ishii, K.J. and Akira, S. (2007) Toll or toll-free adjuvant path toward the optimal vaccine development. Journal of Clinical Immunology, 27, 363-371. http://dx.doi.org/10.1007/s10875-007-9087-x
- 17. 崔立宝, 唐朝克 (2012) PPARs调控巨噬细胞的活化与功能. 生命科学, 2, 156-160.
- 18. Romagnani, S. (1992) Induction of Th1 and Th2 response: A key role for the “nature” immune response? Immunology, 13, 379-381.
- 19. Lin, H.X., Gontier, C., Saron, M.-F. and Perrin, P. (1993) A new immunostimulatory complex (PICKCa) in experimental rabies: Antiviral and adjuvant effects. Archives of Virology, 131, 307-319. http://dx.doi.org/10.1007/BF01378634
- 20. Rajendran, M., Kiruthika, S. and Sathyva, S. (2014) Toll gate: An emerging therapeutic target. Journal of Indian Society of Periodontology, 18, 686-692. http://dx.doi.org/10.4103/0972-124X.147398
- 21. 林海祥, 俞永新 (2010) 皮卡佐剂狂犬病疫苗的安全性. 中国生物制品学杂志, 1, 98-100.
- 22. 聚肌胞注射液国家药品标准. WS1-XG-050-2000.
- 23. Pulko, V., Liu, X., Krco, C.J., Harris, K.J., Frigola, X., Kwon, E.D. and Dong, H. (2009) TLR3-stimulated dendritic cells up-regulate B7-H1 expression and influence the magnitude of CD8 T cell responses to tumor vaccination. The Journal of Immunology, 183, 3634-3641. http://dx.doi.org/10.4049/jimmunol.0900974
- 24. Carrie, A.J., van der Most, R.G., Broomfield, S.A., Prosser, A.C., Tovey, M.G. and Robinson, B.W.S. (2008) Targeting the effector site with IFN-αβ-inducing TLR ligands reactivates tu-mor-resident CD8 T cell responses to eradicate established solid tumors. The Journal of Immunology, 180, 1535-1544. http://dx.doi.org/10.4049/jimmunol.180.3.1535
- 25. Salem, M.L., Kadima, A.N., Cole, D.J., et al. (2005) Defining the antigen-specific T-cell response to vaccination and poly(I:C)/TLR3 signaling: Evidence of enhanced primary and memory CD8 T-cell responses and antitumor immunity. The Journal of Immunology, 28, 220-228. http://dx.doi.org/10.1097/01.cji.0000156828.75196.0d
- 26. Celis, E. (2007) Toll-like receptor ligands energize peptide vaccines through multiple paths. Cancer Research, 67, 7945-7947. http://dx.doi.org/10.1158/0008-5472.CAN-07-1652
- 27. McFarling, D.E., Bever, C.T., Salazar, A.M. and Levy, H.B. (1985) A preliminary trial of poly(I,C)-LC in multiple sclerosis. Journal of Biological Response Modifiers, 4, 544-548.
- 28. Levy, H.B., Baer, G., Baron, S., Buckler, C.E., Gibbs, C.J., Iadarola, M.J., et al. (1975) A modified polyriboinosinic- polyribocytidylic acid complex that induces interferon in primates. Journal of Infectious Diseases, 132, 434-439.
- 29. Zhu, X.M., Nishimura, F., Sasaki, K., Fujita, M., Dusak, J.E., Eguchi, J., et al. (2007) Toll like receptor-3 ligand poly- ICLC promotes the efficacy of peripheral vaccinations with tumor antigen-derived peptide epitopes in murine CNS tumor models. Journal of Translational Medicine, 5, 10. http://dx.doi.org/10.1186/1479-5876-5-10
- 30. 侯云德, 吴淑华, 编 (1981) 干扰素. 人民卫生出版社, 北京, 108-111.
